JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
골수 유래 대식세포의 분리, 배양, 분극 및 해당작용 특성화를 위한 포괄적인 고효율 프로토콜
요약
이 프로토콜은 살아있는 골수 유래 대식세포(BMDM)의 해당작용 대사 상태의 분리, 배양, 분극 및 측정을 위한 상세하고 포괄적인 방법을 제공합니다. 이 백서는 실시간으로 BMDM의 워크플로우 및 해당작용 평가를 위한 사실적인 시각적 그림과 함께 단계별 지침을 제공합니다.
초록
대식세포는 가장 중요한 항원 제시 세포 중 하나입니다. 대식세포의 많은 부분 집합은 고유한 대사 신호로 확인되었습니다. 대식세포는 일반적으로 M1 유사(염증성) 및 M2 유사(항염증성) 아형으로 분류됩니다. M1 유사 대식세포는 LPS 및/또는 INF-γ, IL-12 및 IL-2와 같은 전염증성 사이토카인에 의해 활성화되는 전염증성 대식세포입니다. M1과 유사한 편광 대식세포는 다양한 박테리아와 바이러스에 대한 숙주의 방어를 매개하여 다양한 질병에 관여합니다. 이는 염증성 질환에서 LPS에 의해 유발된 M1 유사 대식세포와 그 대사 상태를 연구하는 데 매우 중요합니다. M2 유사 대식세포는 항염증성 대식세포로 간주되며, 항염증성 사이토카인과 자극제에 의해 활성화됩니다. 전염증성 상태에서 대식세포는 해당작용 기능에서 해당작용이 증가한 것으로 나타납니다. 해당작용은 세포외 플럭스(XF) 분석기를 사용하여 해당과정, 해당작용 용량, 해당작용 예비력, 보상적 해당작용 또는 비해당계열 산성화의 맥락에서 활발하게 조사되었습니다.
이 논문은 골수 유래 대식세포(BMDM)가 에너지를 호흡하고, 소비하고, 생산할 때 따라하기 쉬운 단계를 통해 해당작용 상태를 실시간으로 평가하는 방법을 보여줍니다. 이 프로토콜에서 해당작용의 특정 억제제 및 활성화제를 사용하여 세포의 해당작용 대사 과정에 대한 체계적이고 완전한 관점을 얻고 보다 정확하고 현실적인 결과를 제공하는 방법을 보여줍니다. 여러 해당작용 표현형을 측정할 수 있도록 BMDM의 분극 평가를 위한 쉽고 민감한 DNA 기반 정규화 방법을 제공합니다. BMDM의 표현형 및 대사 상태의 배양, 활성화/분극 및 식별은 다양한 유형의 질병을 조사하는 데 도움이 될 수 있는 중요한 기술입니다.
이 논문에서는 LPS 및 IL4를 사용하여 나이브 M0 대식세포를 M1 유사 및 M2 유사 대식세포로 편광하고, 세포외 플럭스 분석과 해당작용 활성제 및 억제제를 사용하여 시간이 지남에 따라 BMDM의 포괄적인 해당세포 매개변수 세트를 측정했습니다.
서문
대식세포는 M1과 유사한 선천면역 체계에서 가장 중요한 세포 중 하나입니다. 그들은 감염병, 식균작용, 항원 제시 및 염증 조절2를 제거하는 데 관여합니다. 또한, 대식세포는 대식세포가 방출하는 다양한 사이토카인을 통해 다른 면역 세포를 조절하는 데 필요합니다3. 대식세포 표현형에는 큰 스펙트럼이 있습니다4. 대식세포가 노출되는 신호에 따라 대식세포는 서로 다른 염증 및 대사 상태로 양극화됩니다5. 대식세포는 대식세포가 어떤 조직에 있느냐에 따라 다양한 질병에서 대사 변화를 일으킨다6. 편광 대식세포는 해당작용 대사, 지질 대사, 아미노산 대사 및 미토콘드리아 산화 인산화(OXPHOS)를 재프로그래밍하거나 전환할 수 있는 능력이 있습니다7,8. 고전적으로 활성화된 M1 유사 대식세포와 대안적으로 활성화된 M2 유사 대식세포는 대식세포의 가장 많이 연구된 두 가지 표현형입니다3. 활성화되지 않은 정지 대식세포는 M0 대식세포라고 합니다. M1 유사 표현형을 향한 M0 대식세포의 분극은 박테리아 지질다당류(LPS)9를 함유한 미접촉 BMDM의 자극에 의해 유도될 수 있습니다. PI3K-AKT-mTOR-HIF1a 신호전달 경로는 염증성 사이토카인, 인터페론 감마(IFN γ) 또는 종양 괴사 인자(TNF)가 있는 대식세포에서 활성화될 수 있습니다10. M1 유사 대식세포는 해당작용 대사 수치가 증가하고, 산화적 인산화(OXPHOS) 수치가 감소하며, 감염성 및 염증성 질환에 관여하는 염증성 사이토카인(cytokine)을 생성한다8. 다른 한편으로는, M2-유사 표현형을 향한 분극은 JAK-STAT, PPAR 및 AMPK 경로를 통한 인터류킨 (IL)-4 또는 (IL)-13 및 TGFβ pathays11,12에 의해 유도될 수 있습니다.
M1 유사 대식세포와 대조적으로, M2 유사 대식세포는 해당과정이 감소하고 OXPHOS가 증가하며 항기생충 및 조직 복구 활동에 관여합니다 8,13. BMDM은 골수 줄기 세포에서 유래한 대식세포 연구에 널리 사용되는 시스템입니다. 해당과정(glycolysis)과 OXPHOS는 세포에서 두 가지 주요 에너지 생산 경로입니다14. 미시환경에 따라 BMDM은 이러한 경로 중 하나를 사용하도록 선택할 수 있습니다. 어떤 경우에는 한 경로에서 다른 경로로 전환하거나 두 경로를 모두 사용한다14. 이 연구에서는 활성화된 전염증성 대식세포의 해당작용 대사에 초점을 맞췄습니다. 세포질의 포도당이 피루브산으로 전환된 다음 젖산으로 전환될 때, 세포는 M1 유사 세포로 둘러싸인 배지에서 산성화 속도를 높이는 배지에서 양성자를 생성합니다5. 세포 배지의 산성화 속도를 측정하기 위해 세포 외 플럭스 분석기를 사용했습니다. 결과는 ECAR(Extracellular Acidification Rate) 또는 Proton Efflux Rate로 보고됩니다.
편광 대식세포에서 해당과정 수준에 접근하기 위한 최적화되고 빠르고 쉬운 방법은 해당작용 표현형, 대사 산물 변화, 분극 대식세포에 대한 억제제/활성제 및 약물의 효과를 결정하는 데 필수적입니다. 이 원고에 설명된 방법은 특정 해당과정 인자(해당과정, 해당과정 용량, 해당과정 예비력 및 비해당과정 산성화)에 대한 정보와 해당과정 대사의 대사 재프로그래밍에 대한 정보를 제공하도록 최적화되었습니다. 이 연구에서 사용된 억제제(2DG)는 해당과정 경로를 명시적으로 표적으로 합니다.
이 최적화된 프로토콜은 공개된 프로토콜16, 제조업체의 사용자 가이드의 해당작용 분석에 대한 세포 외 플럭스 분석 및 제조업체의 R&D 과학자와의 직접 커뮤니케이션의 조합을 기반으로 수정 및 개선되었습니다.
프로토콜
쥐는 AAALAC(Assessment and Accreditation of Laboratory Animal Care) 및 AALAS(American Association for Laboratory Animal Science) 지침에 따라 Texas A&M University 기관 동물 관리 및 사용 위원회(IACUC)에서 승인한 프로토콜에 따라 인도적으로 희생되었습니다.
1. 생쥐 골수 채취 및 BMDM 배양
- 생쥐(생후 6-10주령 C57Bl/6 생쥐가 이 프로토콜에 포함됨)를 희생하고 복부에 눕히고 피부와 복막층을 자르고 다리를 부드럽게 떼어냅니다.
알림: CO2 가스 노출을 사용하여 마우스를 안락사시킵니다. - 뼈가 잘리지 않도록 주의하면서 양쪽 뒷다리를 엉덩이 아래로 분리하십시오.
- 얼음 위에 다리 전체를 50mL 원뿔형 튜브(나중에 쉽게 잡을 수 있도록 발이 위를 향함)에 넣고 마우스에서 두 다리를 채취합니다.
2. 대퇴골 노출
참고: 생물 안전 작업대에서 다음 단계를 수행하십시오.
- 각 다리에서 경골을 잘라내어 대퇴골을 적출하고 가위와 실험지로 대퇴골을 둘러싼 조직을 최대한 많이 제거합니다.
- 채취하여 "세척한" 대퇴골을 조직 배양(TC) 배지 또는 PBS로 적신 실험용 종이 조각이 들어 있는 10cm 플레이트에 넣습니다. 얼음 위에 올려 놓으십시오.
- 플러싱 단계로 진행하기 전에 대퇴골을 계속 채취하고 모든 대퇴골에서 조직을 제거합니다(그림 1A).
3. 골수 세척
- 대퇴골에서 골수를 씻어내려면 TC 배지로 채워진 3mL 주사기 또는 23G 바늘이 있는 PBS를 사용합니다. 골수를 노출시키기 전에 주사기를 채우십시오.
- 가위를 사용하여 양쪽 골단에서 대퇴골의 맨 끝을 잘라 골수를 노출시킵니다.
- 바늘 끝을 대퇴골에 삽입하고 골수를 10cm 접시에 담아 부드럽게 씻어냅니다.
- 대퇴골 전체에 바늘을 대고 뼈 색이 하얗게 변할 때까지 세척합니다. 일반적으로 대부분의 골수는 2-3mL의 배지로 씻어낼 수 있습니다.
- 접시에 있는 모든 대퇴골과 수영장 골수를 씻어냅니다. 바늘을 사용하여 눈에 보이는 덩어리를 부수십시오. 50mL 원뿔형 튜브에 골수를 변형시킵니다(그림 1A).
4. 적혈구 용해
- 골수를 190 x g에서 10분 동안 돌립니다. 상층액을 흡인합니다.
- 피펫을 사용하여 4mL의 ACK 용해 완충액에 펠릿을 재현탁합니다. RBC 용해 버퍼가 실온에서 5분 동안 작동하도록 합니다.
- 2-메르캅토에탄올, 겐타마이신, 스트렙토마이신 및 10% FCS가 보충된 4mL의 TC 배지 RPMI-C 10%(RPMI 1640-GlutaMAX)를 골수 현탁액에 첨가하고 1300 x g에서 10분 동안 회전합니다.
- 다시 변형시켜 RBC 파편을 제거하고 계산을 위해 소량의 RPMI-C 10%로 다시 현탁합니다.
- 셀 카운터로 셀 수를 계산합니다(그림 1B). Vi-Cell Counter는 현탁액에 있는 세포의 수와 생존력을 측정하는 데 사용되었습니다.
5. 도금과 문화
- RPMI-C 10% + 10 ng/mL M-CSF(Macrophage Colony Stimulating Factor, 단핵구/대식세포 증식, 분화 및 생존의 필수 조절자) 10 mL를 원하는 만큼 10 cm 플레이트에 첨가합니다.
- 각 10cm 플레이트에 1 x 106 세포가 포함되도록 계수된 세포를 적절한 부피로 추가합니다. 플레이트를 37°C 인큐베이터(day 0으로 정의)에 넣습니다.
- 3일째에 신선한 RPMI-C 10% + 10ng/mL M-CSF 5mL를 각 플레이트에 부드럽게 첨가합니다.
참고: 7일째에는 BMDM을 테스트할 준비가 되어야 합니다(그림 1C).
6. 접시에서 수확
- 광학 현미경을 사용하여 대부분의 세포가 플레이트에 부착되었는지 확인합니다.
- 미디어를 부드럽게 흡입합니다. 그런 다음 PBS 3mL를 넣고 플레이트를 부드럽게 휘젓습니다. 이 웰을 흡인하여 남아 있지 않은 세포를 제거합니다.
- 플레이트에 7-10mL의 차가운 PBS를 추가하고, P1000 피펫을 사용하여 플레이트 바닥을 세척하고, 남은 모든 세포를 수집 튜브로 채취합니다.
참고: 대식세포는 매우 단단히 부착되어 튜브 내부에 부착되므로 튜브를 얼음 위에 보관하십시오. 세포가 차갑게 유지되면 단단히 부착되지 않을 것입니다. - 실험을 위한 원심분리기, 계수 및 플레이트형 세포(그림 1D). 유세포분석을 사용하여 결과 세포는 CD11b 및 F4/80에 대해 >95% 양성이어야 합니다. (대식세포 편광은 CD38, TNF-a 및 MCP-1의 M1 유사 마커와 CD206의 M2 유사 마커로 염색하여 측정했습니다.
참고: 생물 안전 캐비닛에서 6.1-6.3단계를 수행하고 벤치탑에서 6.4단계를 수행합니다. 절차 전반에 걸쳐 무균 기술을 유지하십시오.
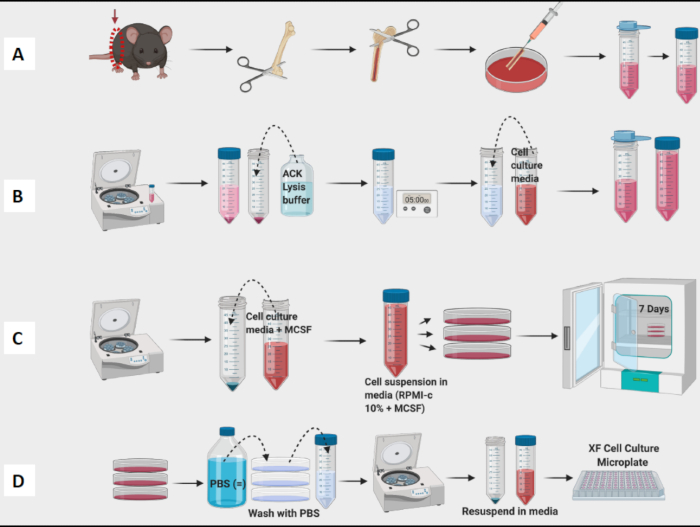
그림 1: BM 유래 대식세포의 마우스 골수 배양의 그래픽 워크플로우. (A) 다리 적출, 대퇴골 노출 및 골수 플러시; (B) 적혈구 용해; (C) 도금 및 배양 (D) 플레이트에서 세포 수확. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 대사 플럭스 분석기 분석 전날: 해당작용 시험을 위한 세포의 파종 및 분극
- 기기를 켜서 대사 플럭스 분석기를 37°C로 예열합니다.
- Calibrant Solution 200μL를 추가하여 카트리지를 수화하고 non-CO2 incubator에서 밤새 카트리지를 배양합니다(그림 2A). non-CO2 인큐베이터의 습도는 카트리지 수화에 중요하지 않습니다.
- 실험 한 시간 전에 접시를 위아래로 몇 번 담그면 기포를 제거하는 데 도움이 됩니다.
- 테스트 지침에 따라 기본 해당작용 스트레스 테스트-급성 주입에서 소프트웨어의 플레이트 맵을 설계합니다.
- 소프트웨어 아이콘을 클릭한 다음 해당과정 스트레스-급성 주사 테스트를 클릭합니다. group definition(그룹 정의) 아이콘에서 그룹 이름을 생성합니다.
- 18분 동안 5번의 측정 주기와 4번의 주입이 있습니다. 포트 A의 주입을 포도당으로, 포트 B를 올리고마이신으로, 포트 C를 로테논 및 안티마이신 A(Rot/AA)로, 포트 D를 2DG로 변경합니다.
- 플레이트의 4개 가장자리(A1, A12, H1 및 H12; 대사 플럭스 분석기 마이크로플레이트에서 배지만 추가하고 세포는 추가하지 않음)을 최종 부피 100μL까지 추가합니다. 일반적으로 이 분석을 수행하려면 최소 40k 세포가 필요합니다.
- 세포의 가장자리 효과를 피하기 위해 세포를 실온에서 45분 동안 방치합니다. 가장자리 효과는 플레이트 주변의 매체가 부분적으로 증발하여 부피 및 농도 변화를 일으키고 세포 생존력을 감소시키는 경우입니다.
- 10ng/mL LPS를 추가하여 나이브 대식세포를 M1 유사 세포로 편광하고 20ng/ml의 IL-4를 추가하여 M2 유사 세포로 편광합니다. 조건당 최소 3-6개의 웰을 사용합니다(그림 2B).
- 현미경으로 세포를 확인하고 플레이트를 37°C 및 5% CO24 시간 동안 24°C의 인큐베이터에 넣습니다.
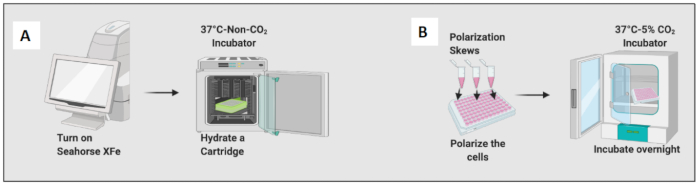
그림 2: 세포의 seeding 및 polarization에 대한 그래픽 데모. (A) 세포외 플럭스 분석기 설정 및 카트리지 수화; (B) 세포의 분극 및 하룻밤 배양. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 분석 당일: XF 배지 및 화합물 제제
- 100mL의 XF RPMI(pH 7.4) 분석 배지를 2mM 글루타민으로 보체합니다.
- 0.2μm 진공 필터 시스템을 사용하여 매체를 필터 멸균합니다.
- 분석 매체를 37°C 수조에 20분 동안 놓습니다.
- 37 °C, 5% CO2 인큐베이터에서 도금된 셀을 제거합니다. 분석 배지로 세포를 두 번 세척하고 이전 배지를 분석 배지로 최종 부피 180μL까지 교체합니다.
- 현미경을 사용하여 모든 웰에 합류 세포가 있는지 확인하고 파이펫팅으로 인한 긁힌 자국이 있는 웰을 표시합니다. 흠집이 있는 경우 분석하기 전에 해당 플레이트를 제거하십시오.
- 세포 함유 플레이트를 non-CO2 incubator에 45분 동안 배치합니다(그림 3A).
- 화합물 및 분석 매체를 사용하여 포도당(100mM), 올리고마이신(100μM), Rot/AA(50μM) 및 2DG(500mM)의 원액을 만듭니다(표 1).
- 분석 매체를 사용하여 각 화합물을 10배 주입 혼합물로 만듭니다(표 2).
| 주입 주식 (키트에 제공됨) | 전체 분석 매체 추가(mL) | 최종 재고 농도(μM) |
| 포도당 | 3 | 100케이 |
| 올리고마이신 | 0.72 | 100 |
| 2-DG | 3 | 100케이 |
표 1. 사출 원료
| 카트리지의 포트 | 재고 솔루션 | 재고 수량 추가 | 어세이 배지 추가 | 주사의 최종 농도(10x) | 이 볼륨을 지정된 포트(μL)에 추가합니다. | 각 웰에 주입 후 최종 농도 |
| A | 포도당(100mM) | 3000 μL + 0 μL | 100 밀리미터미터 | 20 | 10 밀리미터미터 | |
| B | 올리고마이신(100μM) | 300 μL + 2700 μL | 10 μM | 22 | 1.0 μm | |
| C | 로테논/안티마이신 A(50μM) | 300 μL + 2700 μL | 5 μM | 25 | 0.5 μM의 | |
| D | 2-DG(500mM) | 300 μL + 0 μL | 500 밀리미터미터 | 28 | 50 밀리미터. | |
표 2. 최종 주입 농도
9. 분석 당일: 편광 대식세포에 대한 급성 해당작용 검사 실행
- 소프트웨어에서 저장된 해당과정 응력 분석(급성 주사) 템플릿을 엽니다. 기본 급성 당-스트레스 검사는 각 주입 전에 3분 동안 혼합 및 측정합니다.
- 템플릿과 분석 세부 정보를 확인하고 준비가 되면 Run(실행)을 클릭하고 기본 분석의 지침을 따릅니다. 그러나 모든 매개 변수를 사용자 정의 할 수 있습니다.
- 비 CO2 인큐베이터에서 센서 카트리지를 제거하고 뚜껑을 제거한 다음 카트리지 플레이트의 A1 웰이 기계 삽입 패널의 왼쪽 상단 모서리에 떨어지도록 기기에 삽입합니다. 일반적으로 교정에는 20분에서 45분 정도 걸립니다.
- 보정이 완료되면 장치는 교정 용액이 들어 있는 플레이트를 배출하고 센서 카트리지를 고정합니다. 플레이트가 들어 있는 캘리브런트를 제거합니다.
- non-CO2 인큐베이터에서 셀 플레이트를 제거하고 플레이트 뚜껑을 제거한 다음 기계에 삽입합니다. Run(실행)을 클릭합니다(그림 3B).
- 분석이 완료되면 기계가 셀 플레이트와 센서 카트리지를 배출합니다.
- 플레이트에서 매체를 제거하고 추가 정규화를 위해 -20 °C에서 동결합니다.
- 세포를 정규화하기 위해 상용 세포 증식 분석 키트(예: CyQUANT)를 사용하십시오.
- 1mL의 Compound B 또는 용해 완충액을 19mL의 뉴클레아제가 없는 증류수에 첨가합니다.
- 위에서 언급한 용액에 100μL의 Compound A 또는 GR working solution을 첨가합니다.
- 플레이트의 세포가 해동되었는지 확인한 다음 각 웰에 200μL의 용액을 추가합니다.
- 실온(RT)에서 5분 동안 배양합니다.
- 플레이트 리더를 사용하여 480nm 여기 및 520nm 방출 파장에서 형광을 측정합니다.
- 소프트웨어의 정규화 패널에서 셀을 정규화합니다.
- 나이브 대식세포 세포 수를 기반으로 세포를 정규화합니다(그림 3C). 나이브 대식세포의 평균을 1로 간주하고(각 웰의 세포 수를 나이브 대식세포의 평균 세포 수로 나눔) 모든 대식세포에 적용합니다.
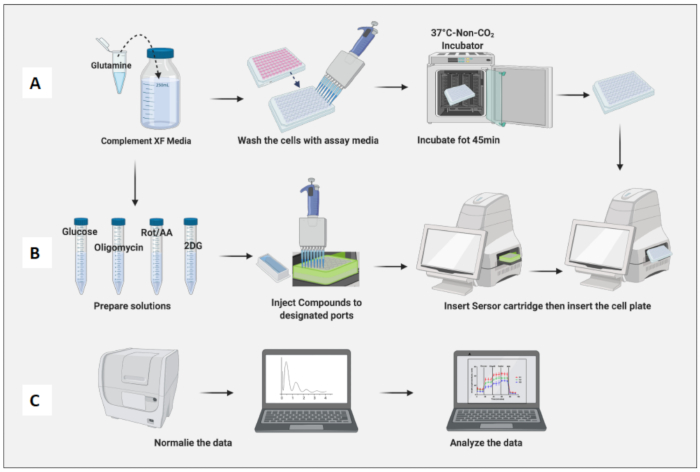
그림 3: 분석 당일: 배지 및 화합물 준비 및 분석 실행. (A) 분석을 위한 세포 준비; (B) 화합물 준비, 보정 및 분석 실행; (C) 정규화 및 데이터 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
해당과정(glycolysis)과 미토콘드리아 산화적 인산화(mitochondrial oxidative phosphorylation)는 세포의 두 가지 주요 ATP 생산 경로입니다(그림 4A). 일부 세포는 에너지 수요를 충족하기 위해 이 두 경로 사이를 전환할 수 있는 능력이 있습니다. 세포질에서 포도당이 피루브산으로 전환되는 것을 해당작용(glycolysis)이라고 합니다. 피루브?...
토론
앞서 언급했듯이 세포외 플럭스 분석기는 미토콘드리아 OXPHOS 활성의 지표인 OCR(산소 소비율)과 해당작용의 지표인 ECAR(세포외 산성화율)을 측정하여 세포의 두 가지 주요 에너지 생산 경로에 대한 실시간 정보를 제공할 수 있습니다. 대식세포는 미세환경에 따라 두 경로를 모두 사용할 수 있습니다. 또한 에너지 생산 경로를 전환할 수 있습니다17,18
공개
저자는 공개할 내용이 없습니다.
감사의 말
편집 지원에 대해 Joanna Rocha 씨에게 감사드립니다. 이 연구는 미국 국립보건원(NIH)의 R01DK118334(Sun 박사와 Alaniz 박사에게) 및 NIH) R01A11064Z(Jayaraman 박사와 Alaniz 박사에게)의 일부 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
참고문헌
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유