このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
骨髄由来マクロファージの単離、培養、分極、および解糖特性評価のための包括的で高効率なプロトコール
要約
このプロトコルは、生きた骨髄由来マクロファージ(BMDM)の解糖代謝状態の単離、培養、分極、および測定のための詳細かつ包括的な方法を提供します。このホワイトペーパーでは、BMDMのワークフローと解糖評価をリアルタイムで行うための現実的な視覚的イラストを使用して、ステップバイステップの説明を提供します。
要約
マクロファージは、最も重要な抗原提示細胞の一つです。マクロファージの多くのサブセットは、独自の代謝シグネチャーで同定されています。マクロファージは、一般的にM1様(炎症性)およびM2様(抗炎症性)のサブタイプに分類されます。M1様マクロファージは、LPSおよび/またはINF-γ、IL-12、IL-2などの炎症誘発性サイトカインによって活性化される炎症誘発性マクロファージです。M1様分極マクロファージは、さまざまな細菌やウイルスに対する宿主の防御を媒介することにより、さまざまな病気に関与しています。これは、LPS誘導性M1様マクロファージとその炎症性疾患における代謝状態を研究するために非常に重要です。M2様マクロファージは、抗炎症性サイトカインおよび刺激物質によって活性化される抗炎症性マクロファージと考えられています。炎症誘発性状態では、マクロファージは解糖機能において解糖系の増加を示します。解糖機能は、解糖、解糖能、解糖リザーブ、代償性解糖、または細胞外フラックス(XF)分析装置を使用した非解糖酸性化の文脈で積極的に研究されてきました。
この論文では、骨髄由来マクロファージ(BMDM)が呼吸し、エネルギーを消費し、生成しているときに、わかりやすい手順で解糖状態をリアルタイムで評価する方法を示します。このプロトコルでは、解糖系の特異的阻害剤および活性化剤を使用して、細胞内の解糖代謝過程の全身的かつ完全なビューを取得し、より正確で現実的な結果を提供する方法を示します。複数の解糖表現型を測定できるようにするために、BMDMの分極評価のための簡単で高感度なDNAベースの正規化法を提供します。BMDMの培養、活性化/分極、表現型と代謝状態の同定は、さまざまな種類の疾患の調査に役立つ重要な技術です。
この論文では、ナイーブなM0マクロファージをLPSおよびIL4でそれぞれM1様マクロファージおよびM2様マクロファージに分極し、細胞外フラックス分析と解糖活性化剤および阻害剤を使用して、BMDMの解糖パラメータの包括的なセットをリアルタイムおよび経時的に測定しました。
概要
マクロファージは、自然免疫系M1様の最も重要な細胞の1つです。彼らは感染症の除去、食作用、抗原提示、および炎症調節に関与しています2。さらに、マクロファージは、放出するさまざまなサイトカインを介して他の免疫細胞を調節する必要があります3。マクロファージの表現型には大きなスペクトルがあります4。マクロファージがさらされるシグナルに応じて、マクロファージはさまざまな炎症状態と代謝状態に向かって分極します5。マクロファージは、マクロファージがどの組織に存在するかによって、さまざまな疾患で代謝変化を示します6。分極されたマクロファージは、解糖代謝、脂質代謝、アミノ酸代謝、およびミトコンドリア酸化的リン酸化(OXPHOS)7,8を再プログラムまたは切り替える能力を持っています。古典的に活性化されたM1様マクロファージと代替的に活性化されたM2様マクロファージは、マクロファージ3の最も研究された表現型の2つです。非活性化静止マクロファージは、M0マクロファージと呼ばれます。M0マクロファージのM1様表現型への分極は、細菌性リポ多糖(LPS)9によるナイーブBMDMの刺激によって誘導され得る。PI3K-AKT-mTOR-HIF1aシグナル伝達経路は、炎症性サイトカイン、インターフェロン-γ(IFN γ)または腫瘍壊死因子(TNF)の存在下でマクロファージで活性化できます10。M1様マクロファージは、解糖代謝のレベルが上昇し、酸化的リン酸化(OXPHOS)のレベルが低下し、感染性疾患や炎症性疾患に関与する炎症性サイトカインを産生します8。一方、M2様表現型への分極は、インターロイキン(IL)-4によってJAK-STAT、PPAR、およびAMPK経路を介して、または(IL)-13およびTGFβ経路11,12によって誘導され得る。
M1様マクロファージとは対照的に、M2様マクロファージは解糖系を減少させ、OXPHOSを増加させ、抗寄生虫および組織修復活性に関与している8,13。BMDMは、骨髄幹細胞に由来するマクロファージの研究に広く使用されているシステムです。解糖系とOXPHOSは、細胞内の2つの主要なエネルギー生産経路である14。BMDMは、その微小環境に基づいて、これらの経路のいずれかを使用することを選択できます。場合によっては、一方から他方に切り替えるか、または両方の経路を使用します14。本研究では、活性化炎症誘発性マクロファージにおける解糖代謝に着目しました。細胞質内のグルコースがピルビン酸に変換され、次に乳酸に変換されると、細胞は培地内でプロトンを生成し、M1様細胞の周囲の培地で酸性化速度の上昇を引き起こします5。細胞外フラックス分析装置を使用して、細胞培地の酸性化速度を測定しました。結果は、細胞外酸性化率(ECAR)または陽子排出率として報告されます。
分極性マクロファージの解糖系レベルにアクセスするための最適化された迅速かつ簡単な方法は、解糖の表現型、代謝物の変化、および分極性マクロファージに対する阻害剤/活性化剤および薬物の影響を決定するために不可欠です。この原稿で説明されている方法は、特定の解糖因子(解糖、解糖能、解糖予備、および非解糖酸性化)に関する情報、および解糖代謝の代謝リプログラミングに関する情報を提供するように最適化されています。この研究で使用された阻害剤 (2DG) は、解糖経路を明示的に標的としています。
この最適化されたプロトコルは、公開されたプロトコル16、メーカーのユーザーガイドの解糖アッセイの細胞外フラックス分析、およびメーカーのR&D科学者との直接のコミュニケーションの組み合わせに基づいて変更および改善されています。
プロトコル
マウスは、Assessment and Accreditation of Laboratory Animal Care(AAALAC)およびAmerican Association for Laboratory Animal Science(AALAS)のガイドラインに従って、テキサスA&M大学の動物施設管理および使用委員会(IACUC)によって承認されたプロトコルを使用して、人道的に犠牲にされました。
1. マウスの骨髄採取とBMDMの培養
- 犠牲マウス(このプロトコルにはC57Bl/6匹のマウスが6-10週齢)を生け贄に置き、腹側に置き、皮膚と腹膜層を切断し、脚をそっと剥がします。
注意: マウスを安楽死させるには、CO2 ガス曝露を使用してください。 - 骨を切らないように注意しながら、両後ろ足を腰から下に分けます。
- 氷の上の空の50mLコニカルチューブ(足を上に向けて、後で引き出すのが簡単なように)に脚全体を置き、マウスから両脚を採取します。
2.大腿骨の露出
注意: バイオセーフティキャビネットで次の手順を実行します。
- 各脚から脛骨を切り取って大腿骨を採取し、はさみと実験紙で大腿骨の周囲の組織をできるだけ多く取り除きます。
- 採取した大腿骨を、組織培養(TC)培地またはPBSで飽和させた実験紙を含む10cmプレートに入れます。それらを氷の上に置きます。
- 大腿骨の採取を続け、すべての大腿骨から組織を採取してから、フラッシング段階に進みます(図1A)。
3.骨髄フラッシュ
- 大腿骨から骨髄を洗い流すには、TC培地またはPBSを充填した3mLシリンジと23G針を使用します。骨髄を露出させる前にシリンジを満たします。
- はさみを使用して、両方の骨端で大腿骨の一番端を切って骨髄を露出させます。
- 大腿骨に針先を挿入し、骨髄を10cmの皿にやさしく洗い流します。
- 大腿骨の全長に針を通し、骨の色が白くなるまで洗い流します。通常、ほとんどの骨髄は2〜3mLの培地で洗い流すことができます。
- すべての大腿骨を洗い流し、皿の中の骨髄をプールします。針を使用して、目に見える塊を分割します。骨髄を50 mLのコニカルチューブに濾します(図1A)。
4. RBC溶解
- 骨髄を190 x gで10分間スピンします。上清を吸引します。
- ペレットをピペットで4 mLのACK溶解バッファーに再懸濁します。RBC溶解バッファーを室温で5分間作動させます。
- 2-メルカプトエタノール、ゲンタマイシン、ストレプトマイシン、および10% FCSを添加したTC培地RPMI-C 10%(RPMI 1640 -GlutaMAX)4 mLを骨髄懸濁液に加え、1300 x gで10分間遠心します。
- 再度濾してRBCの破片を取り除き、カウントのために少量のRPMI-C 10%に再懸濁します。
- セルカウンターでセルをカウントします(図1B)。Vi-Cell Counterを使用して、懸濁液中の細胞の数と生存率を決定しました。
5. 盛り付けと培養
- 10 mLのRPMI-C 10% + 10 ng/mL M-CSF(Macrophage Colony Stimulating Factor、単球/マクロファージの増殖、分化、生存の必須調節因子)を必要な数の10 cmプレートに加えます。
- 各10cmプレートに1 x 106 個のセルが含まれるように、適切な量のカウントセルを追加します。プレートを37°Cのインキュベーター(0日目と定義)に入れます。
- 3日目に、各プレートに5 mLの新鮮なRPMI-C 10% + 10 ng/mlのM-CSFを静かに加えます。
注:7日目には、BMDMはテストの準備ができているはずです(図1C)。
6.プレートから収穫する
- 光学顕微鏡を用いて、ほとんどの細胞がプレートに付着していることを確認します。
- メディアをやさしく吸引します。次に、3 mLのPBSを加え、プレートを静かに回転させます。このウェルを吸引して、残っている非接着性細胞を除去します。
- 7〜10 mLの冷たいPBSをプレートに加え、P1000ピペットを使用してプレートの底を洗浄し、残りのすべての細胞をコレクションチューブに回収します。
注:マクロファージは非常にしっかりと付着し、チューブの内側に付着するため、チューブを氷上に保管してください。細胞が冷たく保たれていれば、細胞の接着性は低下します。 - 実験用の細胞を遠心分離、カウント、およびプレート化します(図1D)。フローサイトメトリーを使用すると、得られた細胞はCD11bおよびF4/80に対して>95%陽性であるはずです。(マクロファージの分極は、CD38、TNF-a、およびMCP-1のM1様マーカーとCD206のM2様マーカーで染色することにより決定しました。
注意: バイオセーフティキャビネットで手順6.1〜6.3を実行し、ベンチトップで手順6.4を実行します。手順全体を通して無菌技術を維持します。
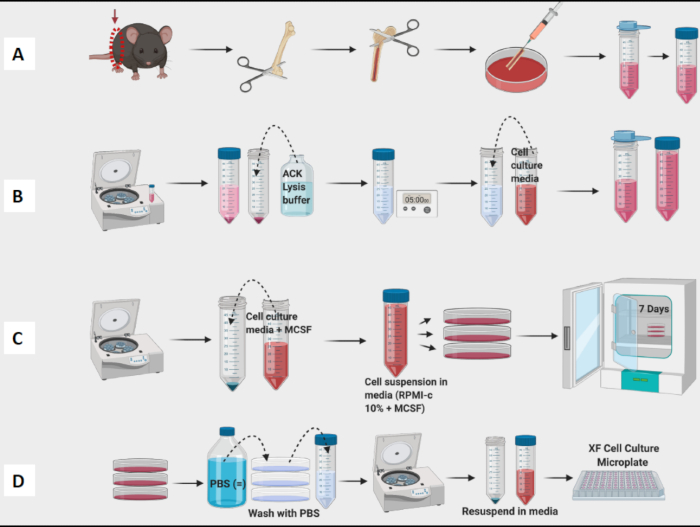
図1:BM由来マクロファージのマウス骨髄培養のグラフィカルワークフロー(A)脚の採取、大腿骨の曝露、および骨髄のフラッシュ;(B)RBCリシス;(C)メッキと文化;(D)プレートからの細胞回収。この図の拡大版を表示するには、ここをクリックしてください。
7.代謝フラックスアナライザーアッセイの前日:解糖試験のための細胞の播種と分極
- メタボリックフラックスアナライザーの電源を入れて、メタボリックフラックスアナライザーを37°Cにウォームアップします。
- 200 μLのCalibrant溶液を加えてカートリッジを水和し、カートリッジを非CO2 インキュベーターで一晩インキュベートします(図2A)。非CO2 インキュベーターの湿度は、カートリッジの水分補給には重要ではありません。
- 実験の1時間前に、プレートを数回上下に沈めると、気泡を取り除くのに役立ちます。
- デフォルトの解糖ストレス試験-急性注射のソフトウェアでプレートマップを設計し、テストの指示に従ってください。
- ソフトウェアのアイコンをクリックし、[ 解糖ストレス-急性注射テスト]をクリックします。グループ定義アイコンで、グループ名を生成します。
- 測定サイクルは5回、所要時間は18分で、4回の注入があります。ポートAをグルコースに、ポートBをオリゴマイシンに、ポートCをロテノンとアンチマイシンA(Rot/AA)に、ポートDを2DGに変更します。
- RPMI-C 10%培地で細胞を再懸濁し、プレートの4つの端(A1、A12、H1、H12;Metabolic Flux Analyzerマイクロプレートに培地のみ、細胞は加えません)を最終容量100 μLまで加えます。通常、このアッセイを行うには最低40k個の細胞が必要です。
- 細胞のエッジ効果を避けるために、細胞を室温で45分間放置します。エッジ効果とは、プレートの周囲にある培地が部分的に蒸発し、体積と濃度が変化し、細胞の生存率が低下することです。
- 10 ng/mL LPSを添加してナイーブマクロファージをM1様細胞に分極させ、20 ng/mLのIL-4を添加してM2様細胞に分極させます。条件ごとに少なくとも3〜6ウェルを使用します(図2B)。
- 顕微鏡で細胞をチェックし、プレートを37°C、5%CO2 のインキュベーターに24時間置きます。
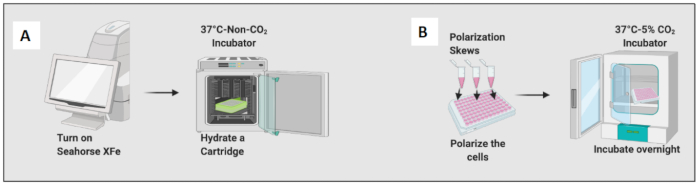
図2:細胞の播種と分極のグラフィカルなデモンストレーション。 (A)細胞外フラックスアナライザーのセットアップとカートリッジの水分補給。 (B) 細胞の分極と一晩のインキュベーション。 この図の拡大版を表示するには、ここをクリックしてください。
8. アッセイ当日:XF培地および化合物の調製
- 100 mL の XF RPMI (pH 7.4) アッセイ培地を 2 mM グルタミンで補体します。
- 0.2 μm真空フィルターシステムを使用して、メディアをフィルター滅菌します。
- アッセイ培地を37°Cのウォーターバスに20分間置きます。
- 37°C、5%CO2 インキュベーターから播種した細胞を取り出します。アッセイ培地で細胞を2回洗浄し、前の培地をアッセイ培地と交換して最終容量180μLにします。
- 顕微鏡を使用して、すべてのウェルにコンフルエントセルがあることを確認し、ピペッティングによる傷のあるウェルに印を付けます。傷がある場合は、そのプレートを取り外してから分析してください。
- 細胞含有プレートを非CO2 インキュベーターに45分間配置します(図3A)。
- 化合物とアッセイ培地を使用して、グルコース(100 mM)、オリゴマイシン(100 μM)、Rot/AA(50 μM)、2DG(500 mM)のストック溶液を作製します(表1)。
- アッセイ培地を使用して、各化合物の10倍注射混合物を調製します(表2)。
| インジェクションストック(キットに付属) | Complete assay 培地(mL)を添加します。 | 最終ストック濃度(μM) |
| グルコース | 3 | 100キロメートル競走 |
| オリゴマイシン | 0.72 | 100 |
| 2-DGの | 3 | 100キロメートル競走 |
テーブル 1.インジェクションストック
| カートリッジのポート | ストックソリューション | ストックボリュームを追加 | アッセイ培地の添加 | 注射剤の最終濃度 (10x) | この容量を指定ポートに追加(μL) | 各ウェルへの注入後の最終濃度 |
| ある | グルコース(100 mM) | 3000 μL + 0 μL | 100 mM | 20 | 10 mM | |
| B | オリゴマイシン (100 μM) | 300 μL + 2700 μL | 10 μM | 22 | 1.0 μM | |
| C | ロテノン/アンチマイシンA(50μM) | 300 μL + 2700 μL | 5 μM | 25 | 0.5 μM | |
| D | 2-DG (500 mM) | 300 μL + 0 μL | 500 mM | 28 | 50 mM | |
テーブル2.最終注入濃度
9. アッセイ当日:分極マクロファージの急性解糖試験の実施
- 保存した解糖ストレスアッセイ(急性注射)テンプレートをソフトウェアから開きます。デフォルトの急性糖質ストレステストでは、各注入前に3分間の混合と測定が行われます。
- テンプレートとアッセイの詳細を確認し、準備ができたら、Runをクリックしてデフォルトのアッセイの指示に従います。ただし、すべてのパラメーターをカスタマイズできます。
- 非CO2 インキュベーターからセンサーカートリッジを取り外し、蓋を取り外し、カートリッジプレートのA1ウェルがマシンの挿入パネルの左上隅に落ちるように装置に挿入します。通常、キャリブレーションには20〜45分かかります。
- キャリブレーションが完了すると、デバイスはキャリブラント溶液を含むプレートを排出し、センサーカートリッジを保持します。プレートが入っているキャリブラントを取り外します。
- 非CO2 インキュベーターから細胞プレートを取り外し、プレートの蓋を取り外して、マシンに挿入します。[Run](実行)をクリックします(図3B)。
- アッセイが完了すると、マシンはセルプレートとセンサーカートリッジを排出します。
- プレートから培地を取り出し、-20°Cで凍結してさらに標準化します。
- 市販の細胞増殖アッセイキット(CyQUANTなど)を使用して、細胞を標準化します。
- 1 mLのコンパウンドBまたは溶解バッファーを19 mLのヌクレアーゼフリー蒸留水に加えます。
- 上記の溶液に100 μLのコンパウンドAまたはGRワーキング溶液を加えます。
- プレート内の細胞が解凍されていることを確認してから、各ウェルに200μLの溶液を加えます。
- 室温(RT)で5分間インキュベートします。
- プレートリーダーを使用して、480 nmの励起波長と520 nmの発光波長の蛍光を測定します。
- ソフトウェアの正規化パネルでセルを正規化します。
- ナイーブマクロファージの細胞数に基づいて細胞を正規化します(図3C)。ナイーブマクロファージの平均を1とし(各ウェルの細胞数をナイーブマクロファージの平均細胞数で割ることにより)、それらをすべてのマクロファージに適用します。
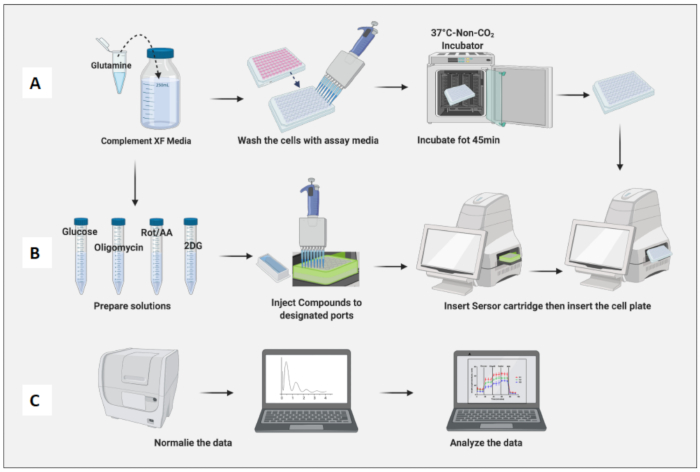
図3:アッセイの日:培地および化合物の調製とアッセイの実行(A)アッセイのための細胞調製;(B)化合物の調製、キャリブレーション、およびアッセイの実行。(C)正規化とデータ分析。この図の拡大版を表示するには、ここをクリックしてください。
結果
解糖とミトコンドリアの酸化的リン酸化は、細胞内の2つの主要なATP産生経路です(図4A)。一部の細胞は、エネルギー需要を満たすためにこれら2つの経路を切り替える能力を持っています。細胞質内でのグルコースからピルビン酸への変換は、解糖系と呼ばれます。ピルビン酸には2つの運命があります。それは乳酸に変?...
ディスカッション
先述の通り、細胞外フラックス分析装置は、ミトコンドリアのOXPHOS活性の指標であるOCR(酸素消費率)と解糖の指標であるECAR(細胞外酸性化率)を測定することで、細胞の2つの主要なエネルギー産生経路に関する情報をリアルタイムに提供できます。マクロファージは、微小環境に応じて、両方の経路を使用できます。彼らはまた、エネルギー生産経路を切...
開示事項
著者は何も開示していません。
謝辞
編集協力してくださったJoanna Rochaさんに感謝します。この研究は、国立衛生研究所(NIH)のR01DK118334(Sun博士とAlaniz博士)および(NIH)R01A11064Z(Jayaraman博士とAlaniz博士)によって部分的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
参考文献
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved