Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Комплексный высокоэффективный протокол для выделения, культивирования, поляризации и гликолитической характеристики макрофагов, полученных из костного мозга
В этой статье
Резюме
Этот протокол содержит подробные и всесторонние методы выделения, культивирования, поляризации и измерения гликолитического метаболического состояния живых макрофагов, полученных из костного мозга (МПДМ). В этом документе представлены пошаговые инструкции с реалистичными визуальными иллюстрациями для рабочего процесса и гликолитической оценки BMDM в режиме реального времени.
Аннотация
Макрофаги являются одними из наиболее важных антигенпрезентирующих клеток. Многие подмножества макрофагов были идентифицированы с уникальными метаболическими сигнатурами. Макрофаги обычно классифицируются как М1-подобные (воспалительные) и М2-подобные (противовоспалительные) подтипы. М1-подобные макрофаги являются провоспалительными макрофагами, которые активируются ЛПС и/или провоспалительными цитокинами, такими как INF-γ, IL-12 и IL-2. М1-подобные поляризованные макрофаги участвуют в различных заболеваниях, опосредуя защиту хозяина от различных бактерий и вирусов. Это очень важно для изучения индуцированных ЛПС М1-подобных макрофагов и их метаболических состояний при воспалительных заболеваниях. М2-подобные макрофаги считаются противовоспалительными макрофагами, активируемыми противовоспалительными цитокинами и стимуляторами. В провоспалительном состоянии макрофаги демонстрируют повышенный гликолиз в гликолитической функции. Гликолитическая функция активно исследовалась в контексте гликолиза, гликолитической емкости, гликолитического резерва, компенсаторного гликолиза или негликолитического подкисления с использованием анализаторов внеклеточного потока (XF).
В этой статье показано, как оценить гликолитические состояния в режиме реального времени с помощью простых шагов, когда макрофаги, полученные из костного мозга (МПДМ), дышат, потребляют и производят энергию. Используя специфические ингибиторы и активаторы гликолиза в этом протоколе, мы показываем, как получить системное и полное представление о гликолитических метаболических процессах в клетках и обеспечить более точные и реалистичные результаты. Чтобы иметь возможность измерять несколько гликолитических фенотипов, мы предлагаем простой, чувствительный, основанный на ДНК метод нормализации для поляризационной оценки МПДМ. Культивирование, активация/поляризация и идентификация фенотипа и метаболического состояния МПК являются важнейшими методами, которые могут помочь в исследовании многих различных типов заболеваний.
В этой статье мы поляризовали наивные макрофаги M0 на М1-подобные и М2-подобные макрофаги с ЛПС и ИЛ4 соответственно и измерили полный набор гликолитических параметров в МПДМ в реальном времени и в лонгитюдном течении, используя анализ внеклеточного потока и гликолитические активаторы и ингибиторы.
Введение
Макрофаги являются одними из наиболее важных клеток врожденной иммунной системы M1-подобной. Они участвуют в устранении инфекционных заболеваний, фагоцитозе, презентации антигенов и регуляции воспаления2. Кроме того, макрофаги необходимы для регуляции других иммунных клеток с помощью различных цитокинов, которые они выделяют3. Существует большой спектр фенотипов макрофагов4. В зависимости от сигналов, которым подвергаются макрофаги, они поляризуются в сторону различных воспалительных и метаболических состояний5. Макрофаги проявляют метаболические изменения при различных заболеваниях, в зависимости от того, в какой ткани находятся макрофаги6. Поляризованные макрофаги обладают способностью перепрограммировать или переключать свой гликолитический метаболизм, липидный обмен, метаболизм аминокислот и митохондриальное окислительное фосфорилирование (OXPHOS)7,8. Классически активированные М1-подобные макрофаги и альтернативно активированные М2-подобные макрофаги являются двумя наиболее изученными фенотипами макрофагов3. Неактивированные покоящиеся макрофаги называются макрофагами M0. Поляризация М0-макрофагов в сторону М1-подобного фенотипа может быть индуцирована стимуляцией наивных МПДМ бактериальным липополисахаридом (ЛПС)9. Сигнальный путь PI3K-AKT-mTOR-HIF1a может быть активирован в макрофагах в присутствии воспалительных цитокинов, интерферона-гамма (ИФН γ,) или фактора некроза опухоли (TNF)10. М1-подобные макрофаги имеют повышенный уровень метаболизма гликолиза, сниженный уровень окислительного фосфорилирования (OXPHOS), продукцию воспалительных цитокинов, участвующих в инфекционных и воспалительных заболеваниях8. С другой стороны, поляризация в сторону М2-подобного фенотипа может быть индуцирована интерлейкином (IL)-4 через пути JAK-STAT, PPAR и AMPK или (IL)-13 и TGFβ pathays11,12.
В отличие от М1-подобных макрофагов, М2-подобные макрофаги имеют пониженный гликолиз и повышенный OXPHOS, а также участвуют в антипаразитарной и тканевой репарирующей активности 8,13. МПДМ являются широко используемой системой для изучения макрофагов, полученных из стволовых клеток костного мозга. Гликолиз и OXPHOS являются двумя ведущими путями производства энергии в клетках14. В зависимости от микроокружения BMDM могут использовать любой из этих путей; В некоторых случаях переключайтесь с одного на другой или используйте оба пути14. В этом исследовании мы сосредоточились на метаболизме гликолиза в активированных провоспалительных макрофагах. Когда глюкоза в цитоплазме превращается в пируват, а затем в лактат, клетки вырабатывают в этой среде протоны, которые вызывают повышение скорости подкисления в окружающей среде М1-подобныхклеток. Для измерения скорости подкисления клеточных сред использовался анализатор внеклеточного потока. Результаты представлены в виде скорости внеклеточного закисления (ECAR) или скорости оттока протонов.
Оптимизированный, быстрый и простой метод доступа к уровням гликолиза в поляризованных макрофагах необходим для определения гликолитического фенотипа, изменений метаболитов и влияния ингибиторов/активаторов и лекарств на поляризованные макрофаги. Метод, описанный в данной рукописи, был оптимизирован для получения информации о конкретных факторах гликолиза (гликолиз, гликолитическая емкость, гликолитический резерв и негликолитическое подкисление), а также о метаболическом перепрограммировании гликолитического метаболизма. Ингибитор (2DG), который использовался в этом исследовании, явно нацелен на путь гликолиза.
Этот оптимизированный протокол был модифицирован и усовершенствован на основе комбинации опубликованного протокола16, анализа внеклеточного потока гликолитических анализов из руководств пользователя производителя и прямого общения с учеными производителя в области исследований и разработок.
протокол
Мыши были гуманно принесены в жертву в соответствии с рекомендациями Оценки и аккредитации ухода за лабораторными животными (AAALAC) и Американской ассоциации науки о лабораторных животных (AALAS) и с использованием протоколов, одобренных Комитетом по уходу и использованию животных Техасского университета A&M (IACUC).
1. Мыши, сбор костного мозга и культивирование МПДМ
- Принесите в жертву мышь (в возрасте 6-10 недель C57Bl/6 мышей входили в этот протокол) и положите ее на вентральную сторону, разрежьте кожу и брюшинный слой и аккуратно снимите с лапок.
ПРИМЕЧАНИЕ: Используйте воздействие газа CO2 для усыпления мыши. - Отделите обе задние ноги от бедра вниз, стараясь не порезать кость.
- Поместите всю ногу в пустую коническую трубку объемом 50 мл (ногами вверх, чтобы их было удобно вытащить позже) на лед и продолжайте собирать обе ноги с мыши.
2. Обнажение бедренной кости
ПРИМЕЧАНИЕ: Выполните следующие действия в шкафу биобезопасности.
- Соберите бедренную кость, отрезав большеберцовую кость с каждой ноги и удалив как можно больше ткани вокруг бедренной кости с помощью ножниц и лабораторной бумаги.
- Заготовленные, «очищенные» бедренные кости поместите в 10-сантиметровую пластину, содержащую лист лабораторной бумаги, пропитанный питательной средой (ТК) или ПБС. Выложите их на лед.
- Продолжайте забор бедренных костей и удаляйте ткани со всех бедренных костей, прежде чем перейти к этапу промывки (Рисунок 1A).
3. Промывка костного мозга
- Чтобы промыть костный мозг из бедренной кости, используйте шприц объемом 3 мл, наполненный средой TC или PBS с иглой 23G. Наполните шприц перед тем, как обнажить костный мозг.
- С помощью ножниц обнажите костный мозг, разрезав самый конец бедренной кости на обоих эпифизах.
- Вставьте кончик иглы в бедренную кость и аккуратно промойте костный мозг в посуду диаметром 10 см.
- Проведите иглой по всей длине бедренной кости и промывайте до тех пор, пока цвет кости не станет белым. Как правило, большую часть костного мозга можно промыть с помощью 2-3 мл среды.
- Промойте все бедренные кости и бассейн костного мозга в чашке. С помощью иглы разбейте все видимые комки. Процедите костный мозг в коническую пробирку объемом 50 мл (рис. 1A).
4. Лизис эритроцитов
- Отжим костный мозг при 190 x g в течение 10 минут. Аспирируйте надосадочную жидкость.
- Ресуспендируйте гранулу в 4 мл буфера для лизиса ACK с помощью пипетки. Дайте буферу для лизиса эритроцитов подействовать в течение 5 минут при комнатной температуре.
- Добавьте 4 мл среды ТК RPMI-C 10% (RPMI 1640-GlutaMAX) с добавлением 2-меркаптоэтанола, гентамицина, стрептомицина и 10% FCS в суспензию костного мозга и отвертите при 1300 x g в течение 10 мин.
- Еще раз процедите, чтобы удалить мусор эритроцитов, и снова суспендируйте в небольшом объеме RPMI-C 10% для подсчета.
- Подсчитайте ячейки с помощью счетчика ячеек (рисунок 1B). Для определения количества и жизнеспособности клеток в суспензии использовали счетчик Vi-клеток.
5. Сервировка и культура
- Добавьте 10 мл RPMI-C 10% + 10 нг/мл m-CSF (макрофагальный колониестимулирующий фактор, важный регулятор пролиферации, дифференцировки и выживаемости моноцитов/макрофагов) в любое количество 10-сантиметровых пластин.
- Прибавьте соответствующий объем подсчитанных ячеек так, чтобы каждая пластина длиной 10 см содержала 1 x 106 ячеек. Поместите планшеты в инкубатор с температурой 37 °C (определяется как день 0).
- На 3-й день аккуратно добавьте 5 мл свежего RPMI-C 10% + 10 нг/мл M-CSF в каждую тарелку.
ПРИМЕЧАНИЕ: На 7-й день БМДМ должны быть готовы к испытаниям (Рисунок 1C).
6. Сбор урожая с тарелок
- Используйте световой микроскоп, чтобы подтвердить, что большинство клеток прилипли к пластинам.
- Аккуратно аспирируйте среду. Затем добавьте 3 мл PBS и аккуратно перемешайте пластину. Хорошо аспирируйте его, чтобы удалить все оставшиеся неадгезивные клетки.
- Добавьте в планшет 7-10 мл холодного PBS, с помощью пипетки P1000 промойте дно пластин и соберите все оставшиеся клетки в пробирку для сбора.
ПРИМЕЧАНИЕ: Держите пробирки на льду, так как макрофаги очень плотно прилегают и прилипают к внутренней части пробирки. Если бы клетки оставались холодными, они были бы менее плотно прилегающими. - Центрифуга, счетные и планшетные ячейки для экспериментов (рис. 1D). С помощью проточной цитометрии полученные клетки должны быть на >95% положительными к CD11b и F4/80. (поляризацию макрофагов определяли путем окрашивания М1-подобными маркерами CD38, TNF-a и MCP-1 и М2-подобным маркером CD206.
ПРИМЕЧАНИЕ: Выполните шаги 6.1-6.3 в шкафу биобезопасности и выполните шаг 6.4 на столе. Придерживайтесь асептических техник на протяжении всей процедуры.
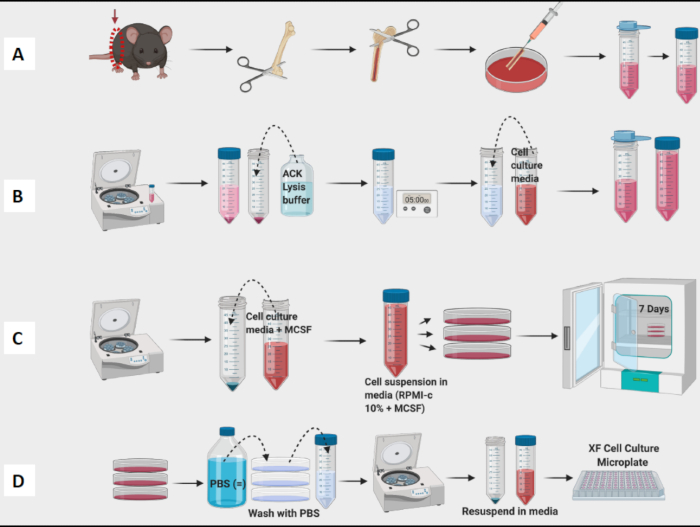
Рисунок 1: Графический процесс культивирования костного мозга мышей из макрофагов, полученных из BM. (A) Забор ножки, обнажение бедренной кости и промывка костного мозга; (b) лизис эритроцитов; (В) Сервировка и культура; (D) Забор клеток из планшетов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. За день до анализа метаболического потока: посев и поляризация клеток для гликолитического теста
- Нагрейте анализатор метаболических потоков до 37 °C, включив прибор.
- Увлажните картридж, добавив 200 μL раствора Calibrant, и инкубируйте картридж в инкубаторе безCO2 на ночь (рис. 2A). Влажность в инкубаторе без CO2 не имеет значения для гидратации картриджа.
- За час до эксперимента опустите пластину несколько раз вверх и вниз, что поможет удалить пузырьки воздуха.
- Разработайте карту планшета в программном обеспечении в стандартном стресс-тесте гликолиза - острой инъекции, следуя инструкциям теста.
- Нажмите на значок программного обеспечения, а затем нажмите на Гликолиз стресс-острый инъекционный тест. На значке определения группы сгенерируйте имена групп.
- Существует пять циклов измерения продолжительностью 18 минут и четыре инъекции. Измените инъекцию порта А на глюкозу, порта В на олигомицин, порта С на ротенон и антимицин А (Rot/AA), а порт D на 2DG.
- Повторно суспендировать клетки в RPMI-C в 10% среде и затравке 50k клеток на лунку, за исключением четырех краев планшета (A1, A12, H1 и H12; Добавьте только среды, без клеток) в микропланшет анализатора метаболического потока до конечного объема 100 μл. Обычно для проведения этого анализа требуется минимум 40 тыс. клеток.
- Дайте клеткам постоять при комнатной температуре в течение 45 минут, чтобы избежать краевого эффекта клеток. Краевой эффект возникает, когда среда по периметру пластины частично испаряется, что вызывает изменения объема и концентрации и снижает жизнеспособность клеток.
- Добавьте 10 нг/мл ЛПС, чтобы поляризовать наивные макрофаги в сторону М1-подобных клеток, и добавьте 20 нг/мл IL-4, чтобы поляризовать их в сторону М2-подобных клеток. Используйте не менее 3–6 скважин для каждого условия (Рисунок 2B).
- Проверьте клетки под микроскопом и поместите планшет в инкубатор при температуре 37 °C и 5%CO2 на 24 часа.
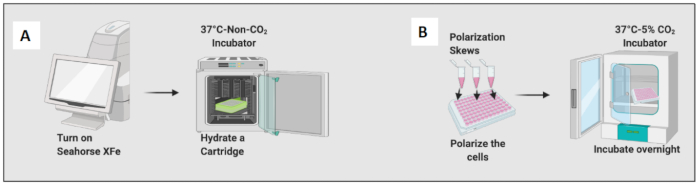
Рисунок 2: Графическая демонстрация затравки и поляризации ячеек. (A) Настройка анализатора внеклеточного потока и гидратация картриджа; (Б) Поляризация клеток и ночная инкубация. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
8. День проведения анализа: XF Medium и комбинированный препарат
- Дополните 100 мл среды для анализа XF RPMI (pH 7,4) 2 мМ глутамина.
- Фильтруйте и стерилизуйте фильтрующий материал с помощью вакуумной фильтрующей системы 0,2 мкм.
- Поместите пробирный материал на водяную баню при температуре 37°C на 20 минут.
- Извлеките металлизированные клетки из инкубатора с температурой 37 °C, 5% CO2 . Дважды промыть ячейки пробирной средой и заменить предыдущую среду на пробирную среду до конечного объема 180 μл.
- С помощью микроскопа убедитесь, что во всех лунках есть сливающиеся клетки, и отметьте все лунки, на которых есть царапины от пипетирования. Если есть царапины, снимите эту пластину перед анализом.
- Поместите камеру, содержащую клетки, в инкубатор без CO2 на 45 минут (рисунок 3A).
- Использование соединений и тестовых сред для получения исходных растворов глюкозы (100 мМ), олигомицина (100 мкМ), Rot/AA (50 мкМ) и 2DG (500 мМ) (Таблица 1).
- Сделайте 10-кратное инъекционное введение смеси каждого соединения с использованием пробирного материала (Таблица 2).
| Инъекционные приклады (предоставляются в комплектах) | Добавить Полная пробирная среда (мл) | Конечная концентрация запаса (μM) |
| Глюкоза | 3 | 100 тыс. |
| Олигомицин | 0.72 | 100 |
| 2-ДГ | 3 | 100 тыс. |
Таблица 1. Инъекционные заготовки
| Порты на картридже | Стоковые решения | Добавить объем складских запасов | Добавить пробирный материал | Конечная концентрация инъекций (10x) | Добавьте этот объем к указанному порту (μL) | Конечная концентрация после закачки в каждую скважину |
| A | Глюкоза (100 мМ) | 3000 мкл + 0 мкл | 100 мМ | 20 | 10 мМ | |
| B | Олигомицин (100 мкМ) | 300 мкл + 2700 мкл | 10 μМ | 22 | 1,0 мкМ | |
| C | Ротенон/антимицин А (50 мкМ) | 300 мкл + 2700 мкл | 5 мкМ | 25 | 0,5 мкМ | |
| D | 2-ДГ (500 мМ) | 300 мкл + 0 мкл | 500 мМ | 28 | 50 мМ | |
Таблица 2. Концентрации при окончательном впрыске
9. День проведения анализа: Проведение острого гликолитического теста на поляризованных макрофагах
- Откройте сохраненный шаблон анализа напряжения гликолиза (острая инъекция) из программного обеспечения. Стандартный тест на острый гликостресс-тест включает 3 минуты смешивания и измерения перед каждой инъекцией.
- Проверьте шаблон и детали анализа, а когда будете готовы, нажмите «Выполнить» и следуйте инструкциям анализа по умолчанию. Тем не менее, все параметры можно настроить.
- Извлеките картридж датчика из инкубатора, не содержащего CO2 , снимите крышку и вставьте прибор таким образом, чтобы отверстие A1 пластины картриджа попадало в верхний левый угол панели вставки машины. Обычно калибровка занимает от 20 до 45 минут.
- После завершения калибровки устройство извлечет пластину, содержащую раствор калибра, и будет удерживать картридж датчика. Снимите калибр, в котором находится пластина.
- Извлеките клеточную пластину из инкубатора, не содержащего CO2 , снимите крышку пластины и вставьте ее в машину. Нажмите кнопку "Выполнить" (рисунок 3B).
- Когда анализ будет завершен, машина извлечет клеточную пластину и картридж датчика.
- Снимите носитель с плиты и заморозьте его при температуре -20 °C для дальнейшей нормализации.
- Используйте коммерческий набор для анализа пролиферации клеток (например, CyQUANT) для нормализации клеток.
- Добавьте 1 мл соединения B или буфера для лизиса в 19 мл дистиллированной воды, не содержащей нуклеаз.
- Добавьте в указанный раствор 100 μл рабочего раствора Соединения А или GR.
- Убедитесь, что ячейки в планшете размораживаются, а затем добавьте по 200 мкл раствора в каждую лунку.
- Инкубировать в течение 5 минут при комнатной температуре (RT).
- Измерьте флуоресценцию на длинах волн возбуждения 480 нм и длинах волн излучения 520 нм с помощью считывателя пластин.
- Нормализуйте ячейки на панели нормализации программного обеспечения.
- Нормализация клеток на основе наивного количества клеток макрофагов (рисунок 3C). Примите среднее значение наивных макрофагов как 1 (разделив число клеток каждой лунки на среднее число клеток наивных макрофагов) и примените его ко всем макрофагам.
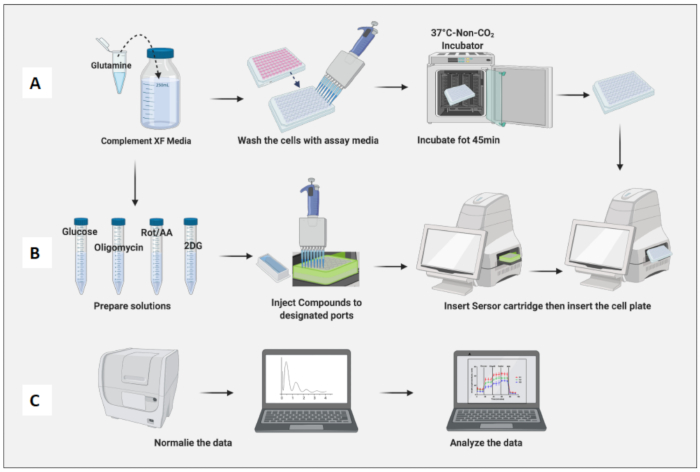
Рисунок 3: День проведения анализа: приготовление сред и соединений и проведение анализа. (A) Подготовка клеток к анализу; (В) Приготовление соединений, калибровка и проведение анализа; (C) Нормализация и анализ данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Гликолиз и митохондриальное окислительное фосфорилирование являются двумя основными путями производства АТФ в клетках (рисунок 4A). Некоторые клетки обладают способностью переключаться между этими двумя путями для удовлетворения с...
Обсуждение
Как упоминалось ранее, анализатор внеклеточного потока может предоставлять информацию в режиме реального времени о двух основных энергетических путях клеток, измеряя OCR (скорость потребления кислорода), показатель активности митохондриального OXPHOS, и ECAR (скорость вн?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим г-жу Джоанну Роча за помощь в редактировании. Работа была частично поддержана Национальными институтами здравоохранения (NIH) R01DK118334 (докторам Сану и Аланизу) и (NIH) R01A11064Z (докторам Джаяраману и Аланизу).
Материалы
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
Ссылки
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены