A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי החלבונים המחייבים של ליגנדים קטנים עם הפעולה הרדיאלית הרדיאלית הדיפרנציאלית של ליגנד אסאי (DRaCALA)
In This Article
Summary
הפעולה הרדיאלית הרדיאלית של Ligand Assay (DRaCALA) יכולה לשמש לזיהוי חלבונים קטנים מחייבים ליגנד של אורגניזם באמצעות ספריית ORFeome.
Abstract
בעשור האחרון חלה התקדמות עצומה בהבנת מולקולות איתות קטנות בפיזיולוגיה חיידקית. בפרט, חלבוני היעד של מספר שליחים משניים שמקורם בנוקלאוטידים (NSMs) זוהו ונחקרו באופן שיטתי באורגניזמים לדוגמה. הישגים אלה נובעים בעיקר מהתפתחות של מספר טכניקות חדשות, כולל טכניקת תרכובת הלכידה והפעולה הרדיאלית הרדיאלית הדיפרנציאלית של ליגנד אסאי (DRaCALA), אשר שימשו לזיהוי שיטתי של חלבוני יעד של מולקולות קטנות אלה. מאמר זה מתאר את השימוש ב- NSMs, גואנוסין פנטה וטטרפוספטים (p)ppGpp, כדוגמה והדגמת וידאו של טכניקת DRaCALA. באמצעות DRaCALA, 9 מתוך 20 ידוע ו -12 חלבוני יעד חדשים של (p)ppGpp זוהו באורגניזם המודל, Escherichia coli K-12, מדגים את כוחו של מבחנים אלה. באופן עקרוני, DRaCALA יכול לשמש לחקר ליגנדים קטנים שניתן לתייג על ידי איזוטופים רדיואקטיביים או צבעים פלואורסצנטיים. הצעדים הקריטיים, היתרונות והחסרונות של DRaCALA נדונים כאן ליישום נוסף של טכניקה זו.
Introduction
חיידקים משתמשים במספר מולקולות איתות קטנות כדי להסתגל לסביבות המשתנות כל הזמן1,2. לדוגמה, יצרני הרכב, לקטוניםN-acylhomoserine ואוליגופפטידים מותאמים שלהם, לתווך את התקשורת הבין תאית בין חיידקים כדי לתאם את התנהגות האוכלוסייה, תופעה המכונה מניין חישה2. קבוצה נוספת של מולקולות איתות קטנות היא ה- NSMs, כולל המונופוספט אדנוסין מחזורי הנחקר הנחקר (cAMP), די-AMP מחזורי, מונופוספט די-גואנוסין מחזורי (di-GMP מחזורי), וגואנוסין פנטה וטטרה פוספטים (p)ppGpp1. חיידקים מייצרים NSMs אלה כתגובה למגוון של תנאי לחץ שונים. לאחר הייצור, מולקולות אלה נקשרות לחלבוני היעד שלהן ומווסתות מספר מסלולים פיזיולוגיים ומטבוליים שונים כדי להתמודד עם הלחצים שנתקלו ולשפר את הישרדות החיידקים. לכן, זיהוי חלבוני היעד הוא תנאי מוקדם בלתי נמנע לפענוח הפונקציות המולקולריות של מולקולות קטנות אלה.
העשור האחרון היה עד לפריחה של ידע על מולקולות איתות קטנות אלה, בעיקר בשל מספר חידושים טכניים שחשפו את חלבוני היעד של מולקולות קטנות אלה. אלה כוללים את טכניקת תרכובת לכידה3,4,5, ואת הפעולה נימי רדיאלי דיפרנציאלי של ליגנד אסאי (DRaCALA)6 כדי לדון במאמר זה.
הומצא על ידי וינסנט לי ושותפיו לעבודה בשנת 20116,DRaCALA פורס את היכולת של קרום ניטרוצלולוז לבודד דיפרנציאלי ללא ליגנדים הקשורים לחלבון. מולקולות כגון חלבונים אינן יכולות לפזר על קרום ניטרוצלולוז, בעוד ליגנדים קטנים, כגון NSMs, מסוגלים. על ידי ערבוב ה- NSM (למשל,ppGpp) עם החלבון שייבדק וזיהוים על הממברנה, ניתן לצפות לשני תרחישים (איור 1):אם (p)ppGpp נקשר לחלבון, ה- radiolabeled (p)ppGpp יישמר במרכז המקום על ידי החלבון ולא יפזר כלפי חוץ, וייתן נקודה קטנה ואינטנסיבית (כלומר. אות רדיואקטיבי חזק) תחת זרחן. עם זאת, אם (p)pppp אינו נקשר לחלבון, הוא יפזר בחופשיות כלפי חוץ כדי לייצר נקודה גדולה עם אות רדיואקטיבי ברקע אחיד.
יתר על כן, DRaCALA יכול לזהות את האינטראקציה בין מולקולה קטנה וחלבון לא מנוצל בתא שלם ליסייט אם החלבון קיים בכמות מספקת. פשטות זו מאפשרת שימוש ב- DRaCALA בזיהוי מהיר של מטרות חלבון באמצעות ספריית ביטוי ORFeome. ואכן, חלבוני היעד של cAMP7, די-AMPמחזורי 8, די-GMP מחזורי9,10, ו (p)ppGpp11,12,13 זוהו באופן שיטתי באמצעות DRaCALA. מאמר וידאו זה משתמש (p)ppGpp כדוגמה כדי להדגים ולתאר את השלבים והשיקולים הקריטיים בביצוע הקרנת DRaCALA מוצלחת. הערה, תיאור יסודי יותר של DRaCALA14 מומלץ מאוד לקרוא בשילוב עם מאמר זה לפני ביצוע DRaCALA.
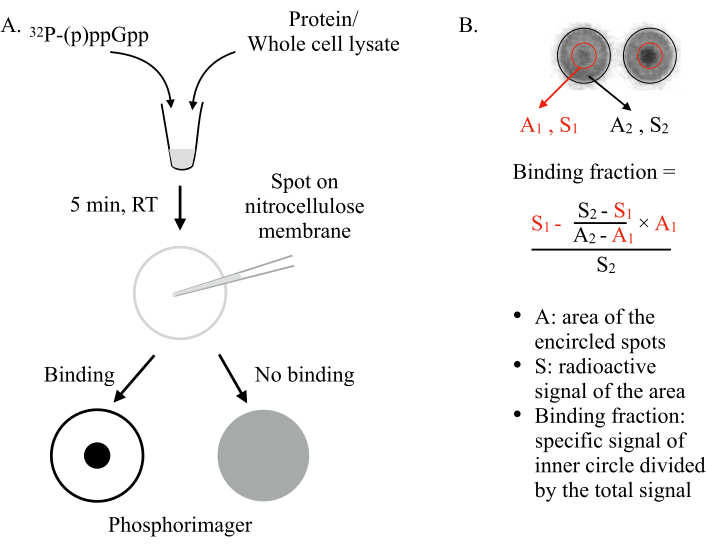
איור 1: העיקרון של DRaCALA. (א)סכמטי של תפילת DRaCALA. עיין בטקסט לקבלת פרטים. (B)כימות וחישוב של שבר האיגוד. עיין בטקסט לקבלת פרטים. בקצרה, כתמי DRaCALA ינותחו על ידי ציור שני עיגולים שמגבילים את כל הנקודה ואת הנקודה הכהה הפנימית (כלומר,נשמר (p)pppp עקב כריכת החלבון שנבדק). אות האיגוד הספציפי הוא האות הרדיואקטיבי של המעגל הפנימי (S1) לאחר חיסור אות הרקע הלא ספציפי (מחושב על-ידי A1 × ((S2-S1)/(A2-A1))). שבר האיגוד הוא אות האיגוד הספציפי חלקי האות הרדיואקטיבי הכולל (S2). קיצורים: DRaCALA = פעולה נימית רדיאלית דיפרנציאלית של ליגנד אסאי; (p)ppGpp = גואנוסין פנטה וטטרפוספטים; RT = טמפרטורת החדר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנת lysates תא שלם
- לחסן את E. coli K-12 ASKA ORFeome אוסף זנים15 לתוך 1.5 מ"ל ציר ליסוגניה (LB) המכיל 25 מיקרוגרם / מ"ל כלורמפניקול ב 96 היטב לוחות באר עמוקה. לגדול לילה (O / N) עבור 18 שעות ב 30 °C (50 °F) עם רועד ב 160 סל"ד. למחרת, להוסיף איזופרופיל β-d-1-thiogalactopyranoside (IPTG) (0.5 מ"מ סופי) לתרבויות O/N כדי לגרום ביטוי חלבון ב 30 °C (6 שעות).
- כדורי תאים ב 500 x g במשך 10 דקות. להקפיא את הכדורים ב -80 °C (80 °F) עד לשימוש. כדי לתייג את התאים, להוסיף 150 μL של מאגר תמוגה L1 (40 mM טריס pH 7.5, 100 mM NaCl, 10 mM MgCl2, בתוספת 2 mM פנילמתילסולפוניל פלואוריד (PMSF), 40 מיקרוגרם / מ"ל DNase 1, ו 0.5 מ"ג / מ"ל lysozyme) כדי resuspend הכדור.
- להקפיא את התאים ב -80 °C (30 °F) במשך 30 דקות, ולאחר מכן להפשיר ב 37 °C (50 °F) במשך 20 דקות. חזור על מחזור זה שלוש פעמים כדי לתפס את התאים. יש לאחסן את ה- lysates ב- -80 °C (70 °F) לפני השימוש.
2. טיהור רלסלק ו- GppA
הערה: החלבונים רקומביננטיים Relseq מסטרפטוקוקוס אקוויזימיליס ו- GppA מ- E. coli K-12 משמשים לסנתז את pppGpp ו- ppGpp עם כבל רדיו, בהתאמה.
- לגדל ולאסוף תאים הממחשים יתר על המידה כל חלבון.
- לגדל את זן E. coli BL21 DE3 עד לשלב מעריכי (צפיפות אופטית (OD) ~ 0.3-0.4) במרק LB, ולסובב למטה 1 מ"ל של תרבות ב 6000 x g במשך 5 דקות. דקאנט סופרנטנט, ו resuspend התאים עם 100 μL של מרק TSB קר כקרח (מרק LB בתוספת 0.1 g / mL PEG3350, 0.05 מ"ל / מ"ל דימתילסולפוקסיד, 20 mM MgCl2).
- מערבבים את הפלסמידים הנושאים את ההיסטידין המתויגים relseq ו- gppA, כל אחד 100 ננוגרם, עם מתלים התא לעיל ב- TSB, ודגרה על קרח במשך 30 דקות. חום-לזעזע את התאים ב 42 °C (40 מעלות צלזיוס). מניחים את התערובת על קרח במשך 2 דקות, ולהוסיף 1 מ"ל של מרק LB בטמפרטורת החדר כדי לאפשר לתאים להתאושש במשך שעה אחת ב 37 °C (77 °F) עם תסיסה ב 160 סל"ד.
- צלחת התאים התאושש על לוחות אגר LB בתוספת אנטיביוטיקה המתאימה (Rel seq:100 מיקרוגרם / mL אמפיצ'ילין; GppA: 30 מיקרוגרם / מ"ל קנאמיצין). למחרת, לחסן את המושבות במרק LB להתחיל O / N precultures של שני הזנים ב 37 °C (50 °F).
- לאחר 18 שעות, לחסן 500 מ"ל של מדיום LB עם 10 מ"ל של תרביות O / N ואת האנטיביוטיקה המתאימה. לגדל את התרבויות על ידי רועד ב 160 סל"ד ב 37 °C (50 °F). כאשר OD600nm מגיע 0.5-0.7, לגרום ביטוי חלבון על ידי הוספת 0.5 mM IPTG וצמיחה במשך 3 שעות ב 30 °C (5 °F) עם רועד ב 160 סל"ד.
- לאסוף את התאים על ידי ספינינג ב 6084 x g במשך 10 דקות ב 4 °C (70 °F). resuspend הכדור ב 20 מ"ל של קרח קר 1x תמיסת מלח חוצץ פוספט (PBS), וצנטריפוגה מחדש ב 1912 x g במשך 20 דקות ב 4 °C (50 °F). דקאנט סופרנטנט, ולהקפיא את הכדורים ב -20 °C (70 °F) לפני השימוש.
- ניקל-nitrilotriacetic חומצה (Ni-NTA) טיהור זיקה
הערה: מנקודה זו ואילך, ודא כי הדגימות קרות.- הוסף 40 מ"ל של חוצץ תמוגה קר כקרח L2 (50 mM טריס pH 7.5, 150 mM NaCl, 5% גליצריל, 10 mM imidazole, 10 mM β-mercaptoethanol בתוספת מעכבי פרוטאז (לוח ללא EDTA; ראה את טבלת החומרים) כדי לחבר מחדש את הכדור. ללקק את התאים באמצעות sonication (60% משרעת, 2 s ON / 4 s כבוי במשך 8 דקות ON). נקה את lysate על ידי ספינינג ב 23,426 x g במשך 40 דקות ב 4 °C (70 °F), ולהמשיך עם supernatant לטיהור.
- במהלך צנטריפוגה לעיל, להכין את שרף Ni-NTA.
- העבר 500 μL של שרף Ni-NTA הומוגני לתוך עמוד כרומטוגרפיה פוליפרופילן עומד, ולתת לו להסתפק 15 דקות פתרון האחסון לנקז דרך. לשטוף את השרף עם 15 מ"ל של מים אולטרה-pure פעמיים, ולאחר מכן לשטוף את העמוד עם 15 מ"ל של חוצץ תמה L2.
- טען את supernatant פינה של lysate התא מן השלב 1 על העמודה, ולתת לו לזרום דרך. לשטוף את העמודה עם 30 מ"ל של חוצץ כביסה (50 mM טריס pH 7.5, 150 mM NaCl, 5% גליצל, 20 mM imidazole).
- יש לאלוט את החלבונים עם 400 מיקרו-אל של מאגר האלוטיון (50 מ"מ של טריס pH 7.5, 150 מ"מ NaCl, 5% גליצל, 500 מ"מ אימידזול) שלוש פעמים. לאחר מכן, חזור על ההתחמקות עם עוד 300 μL של חיץ elution. שלב את החלבונים הנבהים לנפח סופי של 700 μL.
- סינון ג'ל
- הכן מאגר סינון ג'ל (50 מ"מ טריס, pH 7.5; 200 mM NaCl; 5% גליצריל). לשטוף את עמודת אי-הכללה בגודל עם אמצעי אחסון עמודה אחד (25 מ"ל) של מאגר סינון הג'ל.
- לטעון את המדגם לעיל 700 μL באמצעות לולאה 500 μL, לרוץ ב 0.5 מ"ל / דקה, ולאסוף 2-3 שברים, כל נפח 0.5 מ"ל, המכיל את החלבונים המתאימים.
- שלבו ורכזו את השברים המכילים כל אחד מהחלבונים באמצעות עמודת ספין, ומדדו את ריכוז החלבון באמצעות ה-Bradford assay.
3. סינתזה של 32P-שכותרת p pppGpp ו ppGpp
- להרכיב תגובת Relseq בקנה מידה קטן בצינור כובע בורג (ראה טבלה 1).
הערה: עבודה עם ריאגנטים רדיואקטיביים רק במקום מורשה ועם ציוד מגן אישי.
| אמצעי אחסון (μL) | ||
| קנה מידה קטן | קנה מידה גדול | |
| מים אולטרה-תותים | ||
| 10x מאגרSeq Rel* | 2 | 50 |
| ATP (8 מ"מ גמר) | ||
| רלסלק (4 μM סופי) | ||
| 32 P-α-גואנוסין טריפוספט (GTP) (120 ננומטר סופי) (זהירות) | 0.2 | 5 |
| סך | 20 | 500 |
טבלה 1: הרכבת מידע לתגובות סינתזה בקנה מידה קטן וגדול של 32pppGpp עם תווית P. *10x מאגר Relseq מכיל 250 mM Tris-HCl, pH 8.6; 1M NaCl; 80 מ"מ MgCl2. קיצור: pppGpp = גואנוסין פנטפוספט.
- לדגור על הצינור ב 37 °C (5 °F) בתרמומיקסר במשך 1 שעות, ולאחר מכן ב 95 °C (5 דקות), ומניחים על קרח במשך 5 דקות. ספין למטה את החלבון המזרז ב 15,700 x g במשך 5 דקות, ולהעביר את supernatant (מסונתז 32P-pppGpp) לצינור כובע בורג חדש.
- כדי לסנתז 32P-ppGpp מ 32P-pppGpp, להעביר מחצית המוצר 32p-pppGpp לצינור כובע בורג חדש, ולהוסיף 1 μM GppA. לדגור על הצינור ב 37 °C (5 °F) במשך 10 דקות, ב 95 °C (5 דקות), ולאחר מכן למקם על קרח במשך 5 דקות.
- ספין למטה את החלבון המואצן ב 15,700 x g במשך 5 דקות, ולהעביר את supernatant (מסונתז 32P-ppGpp) לצינור כובע בורג חדש.
- נתח את 32P-pppGpp ו 32P-ppGpp על ידי הפעלת 1 μL של הדגימות על צלחת כרומטוגרפיה שכבה דקה (TLC) (לוחות TLC תאית בפולייתילנין שונה) באמצעות 1.5 M KH2PO4, pH 3.4, כשלב נייד.
הערה: השתמש α-32P-תווית גואנוסין 5'-triphosphate (32P-α-GTP) כבקרה. - יבש את צלחת TLC לחלוטין, למקם אותו בין תיקיית פלסטיק שקופה, ולחשוף אותו למסך זרחן אחסון במשך 5 דקות. דמיינו וכימתו את האותות באמצעות זרחן.
הערה: כאשר היחסים של 32P-pppGpp ו 32P-ppGpp גבוהים מ -85%, תגובה בקנה מידה גדול (500 μL, מספיק להקרנת 20 לוחות 96-well) יכול להיות מורכב מסונתז באמצעות טבלה 1.
4. הקרנת DRaCALA של חלבוני היעד של (p)ppGpp
- להפשיר ולהעביר 20 μL של תא שלם lysates ללוח microtiter 96 טוב תחתון V. הוסף 2.5 U / well של אנדונוקלאז מסראטיה marcescens, ודגרה ב 37 °C (5 °F) במשך 15 דקות כדי להפחית את צמיגות ליסאט. מניחים את lysates על קרח במשך 20 דקות.
- מערבבים את 32P-pppGpp ו-32P-ppGpp ביחס של 1:1, והוסיפו חיץ תמוגה 1X L1 כדי להפוך את הריכוז הסופי של (p)ppGpp שווה ל- 4 ננומטרים.
הערה: בהתחשב הדמיון הכימי בין pppGpp ו ppGpp, תערובת של שני הכימיקלים יהיה לפשט את תהליך ההקרנה. - השתמש פיפטה רב ערוצית וטיפים פיפטה מסוננת להוסיף ולערבב 10 μL של (p)ppGpp תערובת עם lysate התא. דגירה בטמפרטורת החדר (RT) למשך 5 דקות.
- לשטוף את הכלי 96 x פין על ידי הצבת 0.01% פתרון של חומר ניקוי לא יוני עבור 30 s, ולייבש על נייר טישו במשך 30 s. חזור על הכביסה של כלי הסיכה 3x.
- מניחים את כלי הסיכה בלוחות הדגימה של 96 הבאר לעיל, וממתינים ל-30 s. הרם את כלי הסיכה ישר למעלה, והנח אותו ישר למטה על קרום ניטרוצלולוז במשך 30 s.
הערה: אם חסרה נקודה, נקודה 2 μL של הדגימות המתאימות עם pipette וטיפים מסוננים. מומלץ לעשות נקודה כפולה של אותה מדגם כפי שצוין להלן. - ייבשו את הממברנה במשך 5 דקות ב-RT. הניחו את הממברנה בין תיקיית פלסטיק שקופה, וחשפו אותה למסך זרחן אחסון למשך 5 דקות. דמיינו באמצעות זרחן.
5. כימות וזיהוי חלבוני יעד פוטנציאליים
- השתמש בתוכנת הניתוח המשויכת לזרחן כדי לפתוח את קובץ ה- .gel של הלוחות החזותיים. השתמש בפונקציה ניתוח מערך כדי להגדיר את 96 הכתמים על-ידי הגדרת רשת של 12 עמודות x 8 שורות.
- הגדר עיגולים גדולים כדי להגביל את הקצה החיצוני של כל המקומות (ראו איור 1B). יצא את Volumn+רקע ואזור של העיגולים הגדולים המוגדרים, ושמור בגיליון אלקטרוני.
הערה: במידת הצורך, מקם מחדש כל עיגול בודד כך שיהפוך לחפיפה מושלמת עם הכתמים, ושנה את גודלו של כל עיגול בודד כדי להפוך אותו לקצת יותר גדול מהנקודה עצמה. - שנה את גודל העיגולים המוגדרים כדי להגביל את הנקודות הפנימיות הקטנות. יצא את Volumn+רקעואת האזור של העיגולים הקטנים המוגדרים, ושמור בגיליון אלקטרוני.
- חשב את שברי האיגוד בגיליון האלקטרוני באמצעות המשוואה באיור 1Bוהתווה את הנתונים. זהה את החלבונים הכרוכים הפוטנציאליים בבארות המציגים שברים מחייבים גבוהים בהשוואה לרוב בארות אחרות.

איור 2: זרימת עבודה כוללת של תהליך המיון של DRaCALA. ייצור חלבונים מאוסף Escherichia coli ASKA מושרה, והתאים הם lysed. בינתיים, החלבונים רקומביננטיים Relseq-שלו ו- GppA-His מטוהרים ומשמשים לסנתז 32P-labeled pppGpp ו- ppGpp מ-32P-α-GTP. מולקולות ppGpp המסומנות באופן רדיואקטיבי מעורבבות לאחר מכן עם הליזטים, וכלי סיכה 96 משמש לזיהוי התערובות על קרום ניטרוצלולוז לחשיפה מאוחרת יותר למסך אחסון זרחן, הדמיה וכימות של האותות הרדיואקטיביים. קיצורים: DRaCALA = פעולה נימית רדיאלית דיפרנציאלית של ליגנד אסאי; (p)ppGpp = גואנוסין פנטה וטטרפוספטים; RT = טמפרטורת החדר; IPTG = איזופרופיל β-d-1-thiogalactopyranoside; GTP = גואנוסין 5'-טריפוספט; SDS-PAGE = נתרן דודצילסולפט-פולאקרילמיד ג'ל אלקטרופורזה ; TLC = כרומטוגרפיה של שכבה דקה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ביצוע הפרוטוקול המתואר לעיל יניב בדרך כלל שני סוגי תוצאות (איור 3).
איור 3A מציג לוח עם אותות כריכה נמוכים יחסית ברקע (שברים מחייבים < 0.025) מרוב בארות. אות האיגוד החיובי מהבאר H3 נותן שבר מחייב של ~ 0.35 שהוא הרבה יותר גבוה מזה שנצפה עבור בארות אחרות. ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
אחד השלבים הקריטיים בביצוע הקרנת DRaCALA הוא להשיג lysates תא שלם טוב. ראשית, החלבונים שנבדקו צריכים להיות מיוצרים בכמויות גדולות ובצורות מסיסות. שנית, התמותה של התאים צריכה להיות שלמה, ואת הצמיגות של lysate חייב להיות מינימלי. הכללת lysozyme ושימוש בשלושה מחזורים של הפשרת הקפאה הם לעתים קרובות מספיק כד...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגוד אינטרסים לחשוף.
Acknowledgements
העבודה נתמכת על ידי מענק פרויקט NNF (NNF19OC0058331) ל- YEZ, ותוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענקים מארי Skłodowska-Curie (Nº 801199) ל- MLS.

Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 32P-α-GTP | Perkinelmer | BLU006X250UC | |
| 96 x pin tool | V&P Scientific | VP 404 | 96 Bolt Replicator, on 9 mm centers, 4.2 mm Bolt Diameter, 24 mm long |
| 96-well V-bottom microtiter plate | Sterilin | MIC9004 | Sterilin Microplate V Well 611V96 |
| Agar | OXOID - Thermo Fisher | LP0011 | Agar no. 1 |
| ASKA collection strain | NBRP, SHIGEN, JAPAN | Ref: DNA Research, Volume 12, Issue 5, 2005, Pages 291–299. https://doi.org/10.1093/dnares/dsi012 | |
| Benzonase | SIGMA | E1014-25KU | genetically engineered endonuclease from Serratia marcescens |
| Bradford Protein Assay Dye | Bio-Rad | 5000006 | Reagent Concentrate |
| DMSO | SIGMA | D8418 | ≥99.9% |
| DNase 1 | SIGMA | DN25-1G | |
| gel filtration10x300 column | GE Healthcare | 28990944 | contains 20% ethanol as preservative |
| Glycerol | PanReac AppliChem | 122329.1214 | Glycerol 87% for analysis |
| Hypercassette | Amersham | RPN 11647 | 20 x 40 cm |
| Imidazole | SIGMA | 56750 | puriss. p.a., ≥ 99.5% (GC) |
| IP Storage Phosphor Screen | FUJIFILM | 28956474 | BAS-MS 2040 20x 40 cm |
| Isopropyl β-d-1-thiogalactopyranoside (IPTG) | SIGMA | I6758 | Isopropyl β-D-thiogalactoside |
| Lysogeny Broth (LB) | Invitrogen - Thermo Fisher | 12795027 | Miller's LB Broth Base |
| Lysozyme | SIGMA | L4949 | from chicken egg white; BioUltra, lyophilized powder, ≥98% |
| MgCl2 (Magnesium chloride) | SIGMA | 208337 | |
| MilliQ water | ultrapure water | ||
| multichannel pipette | Thermo Scientific | 4661110 | F1 - Clip Tip; 1-10 ul, 8 x channels |
| NaCl | VWR Chemicals | 27810 | AnalaR NORMAPUR, ACS, Reag. Ph. Eur. |
| Ni-NTA Agarose | Qiagen | 30230 | |
| Nitrocellulose Blotting Membrane | Amersham Protran | 10600003 | Premium 0.45 um 300 mm x 4 m |
| PBS | OXOID - Thermo Fisher | BR0014G | Phosphate buffered saline (Dulbecco A), Tablets |
| PEG3350 (Polyethylene glycol 3350) | SIGMA | 202444 | |
| phenylmethylsulfonyl fluoride (PMSF) | SIGMA | 93482 | Phenylmethanesulfonyl fluoride solution - 0.1 M in ethanol (T) |
| Phosphor-imager | GE Healthcare | 28955809 | Typhoon FLA-7000 Phosphor-imager |
| Pipette Tips, filtered | Thermo Scientific | 94410040 | ClipTip 12.5 μl nonsterile |
| Poly-Prep Chromatography column | Bio-Rad | 7311550 | polypropylene chromatography column |
| Protease inhibitor Mini | Pierce | A32955 | Tablets, EDTA-free |
| screw cap tube | Thermo Scientific | 3488 | Microcentifuge Tubes, 2.0 ml with screw cap, nonsterile |
| SLS 96-deep Well plates | Greiner | 780285 | MASTERBLOCK, 2 ML, PP, V-Bottom, Natural |
| spin column | Millipore | UFC500396 | Amicon Ultra -0.5 ml Centrifugal Filters |
| Thermomixer | Eppendorf | 5382000015 | Thermomixer C |
| TLC plate (PEI-cellulose F TLC plates) | Merck Millipore | 105579 | DC PEI-cellulose F (20 x 20 cm) |
| Tris | SIGMA | BP152 | Tris Base for Molecular Biology |
| Tween 20 | SIGMA | P1379 | viscous non-ionic detergent |
| β-mercaptoethanol | SIGMA | M3148 | 99% (GC/titration) |
References
- Kalia, D., et al. Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis. Chemical Society Reviews. 42 (1), 305-341 (2013).
- Camilli, A., Bassler, B. L. Bacterial small-molecule signaling pathways. Science. 311 (5764), 1113-1116 (2006).
- Luo, Y., et al. The cAMP capture compound mass spectrometry as a novel tool for targeting cAMP-binding proteins: from protein kinase A to potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channels. Molecular & Cellular Proteomics. 8 (12), 2843-2856 (2009).
- Nesper, J., Reinders, A., Glatter, T., Schmidt, A., Jenal, U. A novel capture compound for the identification and analysis of cyclic di-GMP binding proteins. Journal of Proteomics. 75 (15), 4874-4878 (2012).
- Laventie, B. J., et al. Capture compound mass spectrometry--a powerful tool to identify novel c-di-GMP effector proteins. Journal of Visual Experiments. (97), e51404(2015).
- Roelofs, K. G., Wang, J., Sintim, H. O., Lee, V. T. Differential radial capillary action of ligand assay for high-throughput detection of protein-metabolite interactions. Proceedings of the National Academy of Sciences of the United States of America. 108 (37), 15528-15533 (2011).
- Zhang, Y., et al. Evolutionary adaptation of the essential tRNA methyltransferase TrmD to the signaling molecule 3 ',5 '-cAMP in bacteria. Journal of Biological Chemistry. 292 (1), 313-327 (2017).
- Corrigan, R. M., et al. Systematic identification of conserved bacterial c-di-AMP receptor proteins. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 9084-9089 (2013).
- Roelofs, K. G., et al. Systematic identification of cyclic-di-GMP binding proteins in Vibrio cholerae reveals a novel class of cyclic-di-GMP-binding ATPases associated with type II secretion systems. PLoS Pathogen. 11 (10), 1005232(2015).
- Fang, X., et al. GIL, a new c-di-GMP-binding protein domain involved in regulation of cellulose synthesis in enterobacteria. Molecular Microbiology. 93 (3), 439-452 (2014).
- Corrigan, R. M., Bellows, L. E., Wood, A., Grundling, A. ppGpp negatively impacts ribosome assembly affecting growth and antimicrobial tolerance in Gram-positive bacteria. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 1710-1719 (2016).
- Zhang, Y., Zbornikova, E., Rejman, D., Gerdes, K. Novel (p)ppGpp binding and metabolizing proteins of Escherichia coli. Mbio. 9 (2), 02188(2018).
- Yang, J., et al. The nucleotide pGpp acts as a third alarmone in Bacillus, with functions distinct from those of (p) ppGpp. Nature Communications. 11 (1), 5388(2020).
- Orr, M. W., Lee, V. T. Differential radial capillary action of ligand assay (DRaCALA) for high-throughput detection of protein-metabolite interactions in bacteria. Methods in Molecular Biology. 1535, 25-41 (2017).
- Kitagawa, M., et al. Complete set of ORF clones of Escherichia coli ASKA library (A complete Set of E. coli K-12 ORF archive): Unique resources for biological research. DNA Research. 12 (5), 291-299 (2005).
- Hochstadt-Ozer, J., Cashel, M. The regulation of purine utilization in bacteria. V. Inhibition of purine phosphoribosyltransferase activities and purine uptake in isolated membrane vesicles by guanosine tetraphosphate. Journal of Biological Chemistry. 247 (21), 7067-7072 (1972).
- Zhang, Y. E., et al. p)ppGpp regulates a bacterial nucleosidase by an allosteric two-domain switch. Molecular Cell. 74 (6), 1239-1249 (2019).
- Wang, B., et al. Affinity-based capture and identification of protein effectors of the growth regulator ppGpp. Nature Chemical Biology. 15 (2), 141-150 (2019).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved