Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Identificación de las proteínas de unión de pequeños ligandos con la acción capilar radial diferencial del ensayo de ligandos (DRaCALA)
En este artículo
Resumen
El ensayo Differential Radial Capillary Action of Ligand Assay (DRaCALA) se puede utilizar para identificar pequeñas proteínas de unión a ligandos de un organismo mediante el uso de una biblioteca ORFeome.
Resumen
La última década ha visto un tremendo progreso en la comprensión de pequeñas moléculas de señalización en la fisiología bacteriana. En particular, las proteínas diana de varios mensajeros secundarios derivados de nucleótidos (NSM) se han identificado y estudiado sistemáticamente en organismos modelo. Estos logros se deben principalmente al desarrollo de varias técnicas nuevas, incluida la técnica de compuestos de captura y la acción capilar radial diferencial del ensayo de ligando (DRaCALA), que se utilizaron para identificar sistemáticamente las proteínas diana de estas pequeñas moléculas. Este artículo describe el uso de los NSM, penta- y tetrafosfatos de guanosina (p)ppGpp, como ejemplo y demostración en video de la técnica DRaCALA. Usando DRaCALA, se identificaron 9 de las 20 proteínas diana conocidas y 12 nuevas de (p)ppGpp en el organismo modelo, Escherichia coli K-12, lo que demuestra el poder de este ensayo. En principio, DRaCALA podría usarse para estudiar pequeños ligandos que pueden ser etiquetados por isótopos radiactivos o colorantes fluorescentes. Los pasos críticos, los pros y los contras de DRaCALA se discuten aquí para una mayor aplicación de esta técnica.
Introducción
Las bacterias utilizan varias moléculas de señalización pequeñas para adaptarse a entornos en constante cambio1,2. Por ejemplo, los autoinductores, las lactonas de N-acilhomoserina y sus oligopéptidos modificados, median la comunicación intercelular entre las bacterias para coordinar el comportamiento de la población, un fenómeno conocido como detección de quórum2. Otro grupo de moléculas de señalización pequeñas son los NSM, incluidos el ampliamente estudiado monofosfato de adenosina cíclico (cAMP), el di-AMP cíclico, el monofosfato de di-guanosina cíclico (di-GMP cíclico) y los pentafosfatos de guanosina y tetra (p)ppGpp1. Las bacterias producen estos NSM como respuesta a una variedad de diferentes condiciones de estrés. Una vez producidas, estas moléculas se unen a sus proteínas diana y regulan varias vías fisiológicas y metabólicas diferentes para hacer frente a las tensiones encontradas y mejorar la supervivencia bacteriana. Por lo tanto, la identificación de las proteínas diana es un requisito previo inevitable para descifrar las funciones moleculares de estas pequeñas moléculas.
La última década ha sido testigo de un auge del conocimiento de estas pequeñas moléculas de señalización, principalmente debido a varias innovaciones técnicas que dieron a conocer las proteínas objetivo de estas pequeñas moléculas. Estos incluyen la técnica del compuesto de captura3,4,5y la acción capilar radial diferencial del ensayo de ligando (DRaCALA)6 que se discutirá en este artículo.
Inventado por Vincent Lee y sus compañeros de trabajo en 20116,DRaCALA despliega la capacidad de una membrana de nitrocelulosa para secuestrar diferencialmente ligandos libres y unidos a proteínas. Las moléculas como las proteínas no pueden difundirse en una membrana de nitrocelulosa, mientras que los ligandos pequeños, como los NSM, pueden hacerlo. Al mezclar el NSM(por ejemplo,ppGpp) con la proteína a probar y detectarlos en la membrana, se pueden esperar dos escenarios (Figura 1): Si (p)ppGpp se une a la proteína, el radiomarcado (p)ppGpp será retenido en el centro del punto por la proteína y no se difundirá hacia afuera, dando un punto pequeño intenso (es decir, señal radiactiva fuerte) bajo un fosforrimager. Sin embargo, si (p)ppGpp no se une a la proteína, se difundirá libremente hacia afuera para producir una gran mancha con una señal radiactiva de fondo uniforme.
Además, DRaCALA puede detectar la interacción entre una molécula pequeña y una proteína no purificada en un lisato de células enteras si la proteína está presente en una cantidad suficiente. Esta simplicidad permite el uso de DRaCALA en la identificación rápida de objetivos de proteínas mediante el uso de una biblioteca de expresiones ORFeome. De hecho, las proteínas diana de cAMP7, cíclico di-AMP8, cíclico di-GMP9,10y (p)ppGpp11,12,13 se han identificado sistemáticamente mediante el uso de DRaCALA. Este artículo en vídeo utiliza (p)ppGpp como ejemplo para demostrar y describir los pasos y consideraciones críticos para realizar una proyección exitosa de DRaCALA. Cabe destacar que se recomienda leer una descripción más completa de DRaCALA14 en combinación con este artículo antes de realizar DRaCALA.
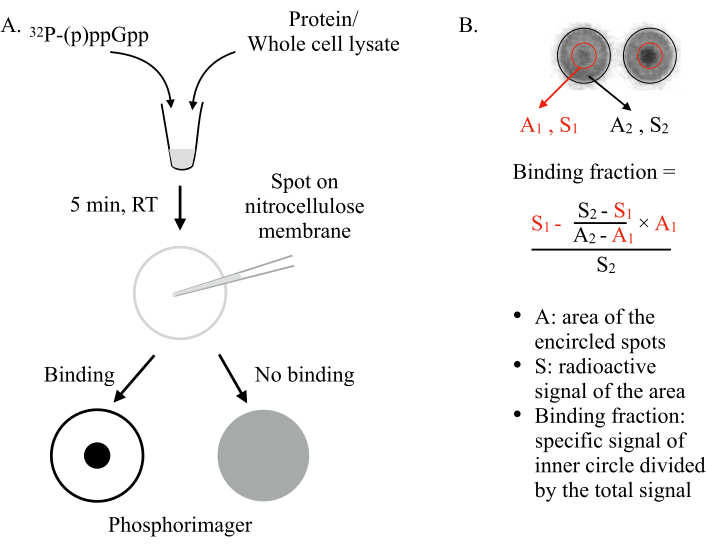
Figura 1: El principio de DRaCALA. (A) Esquema del ensayo DRaCALA. Consulte el texto para obtener más información. (B) Cuantificación y cálculo de la fracción de enlace. Consulte el texto para obtener más información. Brevemente, las manchas DRaCALA se analizarán dibujando dos círculos que circunscriben toda la mancha y el punto oscuro interno(es decir,el (p) ppGpp retenido debido a la unión de la proteína probada). La señal de unión específica es la señal radiactiva del círculo interior (S1) después de restar la señal de fondo no específica (calculada por A1 × ((S2-S1)/(A2-A1))). La fracción de unión es la señal de unión específica dividida por la señal radiactiva total (S2). Abreviaturas: DRaCALA = Acción Capilar Radial Diferencial del Ensayo de Ligandos; p)ppGpp = pentafosfatos de guanosina y tetrafosfatos; RT = temperatura ambiente. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación de lisatos de células enteras
- Inocular las cepas de recolección de E. coli K-12 ASKA ORFeome15 en caldo de lisogenia (LB) de 1,5 ml que contiene 25 μg / ml de cloranfenicol en placas de pozos profundos de 96 pozos. Cultivar durante la noche (O/N) durante 18 h a 30 °C con agitación a 160 rpm. Al día siguiente, añadir isopropilo β-d-1-tiogalactopyranoside (IPTG) (0,5 mM final) a los cultivos de O/N para inducir la expresión de proteínas a 30 °C durante 6 h.
- Células de pellet a 500 x g durante 10 min. Congelar los pellets a -80 °C hasta su uso. Para lisar las células, agregue 150 μL de tampón de lisis L1 (40 mM Tris pH 7.5, 100 mM NaCl, 10 mM MgCl2,complementado con 2 mM de fenilmetilsulfonil fluoruro (PMSF), 40 μg / ml DNasa 1 y 0.5 mg / ml lisozima) para resuspend el pellet.
- Congelar las células a -80 °C durante 30 min, y luego descongelar a 37 °C durante 20 min. Repita este ciclo tres veces para lisar las células. Conservar los lisatos a -80 °C antes de su uso.
2. Purificación de Relseq y GppA
NOTA: Las proteínas recombinantes Relseq de Streptococcus equisimilis y GppA de E. coli K-12 se utilizan para sintetizar las radiomarcadas pppGpp y ppGpp, respectivamente.
- Cultivar y recolectar células que sobreexpresan cada proteína.
- Cultive la cepa E. coli BL21 DE3 hasta la fase exponencial (densidad óptica (OD) ~ 0.3-0.4) en caldo LB, y gire hacia abajo 1 ml de cultivo a 6000 x g durante 5 min. Decantar el sobrenadante, y resuspend las células con 100 μL de caldo TSB helado (caldo LB suplementado con 0,1 g/mL PEG3350, 0,05 mL/mL dimetilsulfóxido, 20 mM MgCl2).
- Mezcle los plásmidos que llevan el relseq y gppAmarcados con histidina, cada uno de 100 ng, con las suspensiones celulares anteriores en TSB, e incube en hielo durante 30 min. Choque térmico de las células a 42 °C durante 40 s. Coloque la mezcla en hielo durante 2 min y agregue 1 ml de caldo LB a temperatura ambiente para permitir que las células se recuperen durante 1 h a 37 ° C con agitación a 160 rpm.
- Placa de las células recuperadas en placas de agar LB suplementadas con los antibióticos correspondientes (Relseq:100 μg/mL ampicilina; GppA: 30 μg/ml de kanamicina). Al día siguiente, inocular las colonias en caldo LB para iniciar los precultivos de O/N de ambas cepas a 37 °C.
- Después de 18 h, inocular 500 mL de LB medio con 10 mL de los cultivos O/N y los antibióticos correspondientes. Cultiva los cultivos agitando a 160 rpm a 37 °C. Cuando el OD600nm alcanza 0.5-0.7, induzca la expresión de proteínas agregando 0.5 mM IPTG y creciendo durante 3 h a 30 °C con agitación a 160 rpm.
- Recoge las células girando a 6084 x g durante 10 min a 4 °C. Resuspenda el pellet en 20 ml de solución salina tamponada con fosfato (PBS) helada y vuelva a centrifugar a 1912 x g durante 20 min a 4 °C. Decantar el sobrenadante y congelar los gránulos a -20 °C antes de su uso.
- Purificación de afinidad de ácido nitrilotriacético (Ni-NTA)
NOTA: A partir de este momento, asegúrese de que las muestras estén frías.- Agregue 40 ml de tampón de lisis helado L2 (50 mM Tris pH 7.5, 150 mM NaCl, 5% de glicerol, 10 mM de imidazol, 10 mM de β-mercaptoetanol suplementado con inhibidores de la proteasa (tableta sin EDTA; consulte la Tabla de materiales)para resuspend el pellet. Lise las células mediante sonicación (60% de amplitud, 2 s ON/ 4 s OFF durante 8 min ON). Limpiar el lisato haciendo girar a 23.426 x g durante 40 min a 4 °C, y continuar con el sobrenadante para la purificación.
- Durante la centrifugación anterior, prepare la resina Ni-NTA.
- Transfiera 500 μL de resina de Ni-NTA homogeneizada a una columna de cromatografía de polipropileno en pie, y deje que se asiente durante 15 minutos y la solución de almacenamiento se drene. Lave la resina con 15 ml de agua ultrapura dos veces, y luego lave la columna con 15 ml del tampón de lisis L2.
- Cargue el sobrenadante despejado del lisado de celda del paso 1 en la columna y déjelo fluir. Lavar la columna con 30 mL de tampón de lavado (50 mM Tris pH 7.5, 150 mM NaCl, 5% glicerol, 20 mM imidazol).
- Eluyen las proteínas con 400 μL del tampón de elución (50 mM Tris pH 7.5, 150 mM NaCl, 5% glicerol, 500 mM imidazol) tres veces. Luego, repita la elución con otros 300 μL del tampón de elución. Combine las proteínas eluidas a un volumen final de 700 μL.
- Filtración en gel
- Prepare el tampón de filtración en gel (50 mM Tris, pH 7.5; 200 mM NaCl; 5% de glicerol). Lave la columna de exclusión de tamaño con un volumen de columna (25 ml) del tampón de filtración de gel.
- Cargue la muestra anterior de 700 μL utilizando un bucle de 500 μL, corra a 0,5 ml / min y recolecte 2-3 fracciones, cada una de 0,5 ml de volumen, que contengan las proteínas respectivas.
- Combine y concentre las fracciones que contienen cada una de las proteínas utilizando una columna de espín, y mida la concentración de proteínas utilizando el ensayo de Bradford.
3. Síntesis de 32pppGpp y ppGpp marcados con P
- Montar una reacción Relseq a pequeña escala en un tubo de tapón de rosca (ver Tabla 1).
NOTA: Trabaje con reactivos radiactivos solo en un lugar con licencia y con equipo de protección personal.
| Volumen (μL) | ||
| Pequeña escala | A gran escala | |
| Agua ultrapura | ||
| 10x búferRel seq* | 2 | 50 |
| ATP (final de 8 mM) | ||
| Relseq (4 μM final) | ||
| 32 P-α-guanosina trifosfato (GTP) (final 120 nM) (PRECAUCIÓN) | 0.2 | 5 |
| total | 20 | 500 |
Tabla 1: Información de ensamblaje para las reacciones de síntesis a pequeña y gran escala de 32pppGpp marcados con P. *10x el tampón Relseq contiene 250 mM Tris-HCl, pH 8.6; 1M NaCl; 80 mM MgCl2. Abreviatura: pppGpp = pentafosfato de guanosina.
- Incubar el tubo a 37 °C en un termomezclador durante 1 h, luego a 95 °C durante 5 min, y colocar sobre hielo durante 5 min. Gire hacia abajo la proteína precipitada a 15.700 x g durante 5 min, y transfiera el sobrenadante (sintetizado 32P-pppGpp) a un nuevo tubo de tapón de rosca.
- Para sintetizar 32P-ppGpp a partir de 32P-pppGpp, transfiera la mitad del producto de 32p-pppGpp a un nuevo tubo de tapón de rosca y agregue 1 μM GppA. Incubar el tubo a 37 °C durante 10 min, a 95 °C durante 5 min, y luego colocar sobre hielo durante 5 min.
- Gire hacia abajo la proteína precipitada a 15.700 x g durante 5 min, y transfiera el sobrenadante (sintetizado 32P-ppGpp) a un nuevo tubo de tapón de rosca.
- Analizar los 32P-pppGpp y 32P-ppGpp ejecutando 1 μL de las muestras en una placa de cromatografía en capa fina (TLC) (placas TLC de celulosa modificada con polietileneimina) utilizando el 1,5 M KH2PO4,pH 3,4, como fase móvil.
NOTA: Utilice la guanosina 5'-trifosfato con etiquetaα-32P(32P-α-GTP) como control. - Seque la placa TLC por completo, colóquela entre una carpeta de plástico transparente y expóndala a una pantalla de fósforo de almacenamiento durante 5 minutos. Visualice y cuantifique las señales mediante el uso de un fosforador.
NOTA: Cuando las proporciones de 32P-pppGpp y 32P-ppGpp son superiores al 85%, se podría ensamblar y sintetizar una reacción a gran escala (500 μL, suficiente para el cribado de 20 placas de 96 pozos) utilizando la Tabla 1.
4. Cribado DRaCALA de las proteínas diana de (p)ppGpp
- Descongelar y transferir 20 μL de lisatos de células enteras a una placa de microtitulación de fondo en V de 96 pozos. Añadir 2,5 U/pozo de endonucleasa de Serratia marcescense incubar a 37 °C durante 15 min para reducir la viscosidad del lisato. Coloque los lisates en hielo durante 20 min.
- Mezcle 32P-pppGpp y 32P-ppGpp en una proporción de 1:1, y agregue 1x tampón de lisis L1 para que la concentración final de (p)ppGpp sea igual a 4 nM.
NOTA: Dada la similitud química entre pppGpp y ppGpp, una mezcla de ambos productos químicos simplificará el proceso de selección. - Utilice una pipeta multicanal y puntas de pipeta filtradas para agregar y mezclar 10 μL de la mezcla (p)ppGpp con el lisato celular. Incubar a temperatura ambiente (RT) durante 5 min.
- Lave la herramienta de 96 x pasador colocando en una solución al 0,01% de detergente no iónico durante 30 s, y séquelo en un papel de seda durante 30 s. Repita el lavado de la herramienta de pasador 3x.
- Coloque la herramienta de pasador en las placas de muestra de 96 pozos anteriores y espere 30 s. Levante la herramienta de pasador hacia arriba y colóquela directamente hacia abajo sobre una membrana de nitrocelulosa durante 30 s.
NOTA: Si falta un punto, anote 2 μL de las muestras correspondientes con una pipeta y puntas filtradas. Es recomendable hacer un punto duplicado de la misma muestra como se indica a continuación. - Seque la membrana durante 5 minutos en RT. Coloque la membrana entre una carpeta de plástico transparente y expóndala a una pantalla de fósforo de almacenamiento durante 5 minutos. Visualice usando un fosforrimager.
5. Cuantificación e identificación de posibles proteínas diana
- Utilice el software de análisis asociado con el fosforimager para abrir el archivo .gel de las placas visualizadas. Utilice la función de análisis Array para definir los 96 puntos configurando una cuadrícula de 12 columnas x 8 filas.
- Defina círculos grandes para circunscribir el borde exterior de todos los puntos (ver Figura 1B). Exporte el Volumn+Background y el área de los círculos grandes definidos y guárdelo en una hoja de cálculo.
NOTA: Si es necesario, reposicione cada círculo individual para que se superponga perfectamente con los puntos y redimensione cada círculo individual para que sea un poco más grande que el punto real. - Baja el tamaño de los círculos definidos para circunscribir los pequeños puntos internos. Exporte Volumn+Backgroundy El área de los círculos pequeños definidos y guárdelo en una hoja de cálculo.
- Calcule las fracciones de enlace en la hoja de cálculo utilizando la ecuación de la Figura 1By trace los datos. Identificar las proteínas de unión potencial en los pozos que muestran altas fracciones de unión en comparación con la mayoría de los otros pozos.

Figura 2: Flujo de trabajo general del proceso de selección de DRaCALA. Se induce la producción de proteínas a partir de una colección de ASKA de Escherichia coli y se lisan las células. Mientras tanto, las proteínas recombinantes Relseq-His y GppA-His se purifican y se utilizan para sintetizar 32pppGpp y ppGpp etiquetados con P a partir de 32P-α-GTP. Las moléculas (p)ppGpp etiquetadas radiactivamente se mezclan con los lisatos, y se utiliza una herramienta de 96 pines para detectar las mezclas en una membrana de nitrocelulosa para su posterior exposición a una pantalla de almacenamiento de fósforo, imágenes y cuantificación de las señales radiactivas. Abreviaturas: DRaCALA = Acción Capilar Radial Diferencial del Ensayo de Ligandos; p)ppGpp = pentafosfatos de guanosina y tetrafosfatos; RT = temperatura ambiente; IPTG = isopropilo β-d-1-tiogalactopyranoside; GTP = guanosina 5'-trifosfato; SDS-PAGE = electroforesis en gel de dodecilsulfato de sodio-poliacrilamida; TLC = cromatografía en capa delgada. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Seguir el protocolo descrito anteriormente normalmente producirá dos tipos de resultados(Figura 3).
La Figura 3A muestra una placa con señales de unión de fondo relativamente bajas (fracciones de unión < 0.025) de la mayoría de los pozos. La señal de unión positiva del pozo H3 da una fracción de unión de ~0.35 que es mucho más alta que la observada para los otros pozos. Incluso sin cuantificación, el pozo H3 es notable, lo ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Uno de los pasos críticos para realizar el cribado de DRaCALA es obtener buenos lisados de células enteras. Primero, las proteínas probadas deben producirse en grandes cantidades y en formas solubles. En segundo lugar, la lisis de las células debe ser completa, y la viscosidad del lisato debe ser mínima. La inclusión de lisozima y el uso de tres ciclos de congelación-descongelación son a menudo suficientes para lisar las células por completo. Sin embargo, el ADN cromosómico liberado hace que el lisato sea visco...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que revelar.
Agradecimientos
El trabajo está respaldado por una subvención del proyecto NNF (NNF19OC0058331) a YEZ, y el programa de investigación e innovación Horizonte 2020 de la Unión Europea en virtud del acuerdo de subvención Marie Skłodowska-Curie (Nº 801199) a MLS.

Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 32P-α-GTP | Perkinelmer | BLU006X250UC | |
| 96 x pin tool | V&P Scientific | VP 404 | 96 Bolt Replicator, on 9 mm centers, 4.2 mm Bolt Diameter, 24 mm long |
| 96-well V-bottom microtiter plate | Sterilin | MIC9004 | Sterilin Microplate V Well 611V96 |
| Agar | OXOID - Thermo Fisher | LP0011 | Agar no. 1 |
| ASKA collection strain | NBRP, SHIGEN, JAPAN | Ref: DNA Research, Volume 12, Issue 5, 2005, Pages 291–299. https://doi.org/10.1093/dnares/dsi012 | |
| Benzonase | SIGMA | E1014-25KU | genetically engineered endonuclease from Serratia marcescens |
| Bradford Protein Assay Dye | Bio-Rad | 5000006 | Reagent Concentrate |
| DMSO | SIGMA | D8418 | ≥99.9% |
| DNase 1 | SIGMA | DN25-1G | |
| gel filtration10x300 column | GE Healthcare | 28990944 | contains 20% ethanol as preservative |
| Glycerol | PanReac AppliChem | 122329.1214 | Glycerol 87% for analysis |
| Hypercassette | Amersham | RPN 11647 | 20 x 40 cm |
| Imidazole | SIGMA | 56750 | puriss. p.a., ≥ 99.5% (GC) |
| IP Storage Phosphor Screen | FUJIFILM | 28956474 | BAS-MS 2040 20x 40 cm |
| Isopropyl β-d-1-thiogalactopyranoside (IPTG) | SIGMA | I6758 | Isopropyl β-D-thiogalactoside |
| Lysogeny Broth (LB) | Invitrogen - Thermo Fisher | 12795027 | Miller's LB Broth Base |
| Lysozyme | SIGMA | L4949 | from chicken egg white; BioUltra, lyophilized powder, ≥98% |
| MgCl2 (Magnesium chloride) | SIGMA | 208337 | |
| MilliQ water | ultrapure water | ||
| multichannel pipette | Thermo Scientific | 4661110 | F1 - Clip Tip; 1-10 ul, 8 x channels |
| NaCl | VWR Chemicals | 27810 | AnalaR NORMAPUR, ACS, Reag. Ph. Eur. |
| Ni-NTA Agarose | Qiagen | 30230 | |
| Nitrocellulose Blotting Membrane | Amersham Protran | 10600003 | Premium 0.45 um 300 mm x 4 m |
| PBS | OXOID - Thermo Fisher | BR0014G | Phosphate buffered saline (Dulbecco A), Tablets |
| PEG3350 (Polyethylene glycol 3350) | SIGMA | 202444 | |
| phenylmethylsulfonyl fluoride (PMSF) | SIGMA | 93482 | Phenylmethanesulfonyl fluoride solution - 0.1 M in ethanol (T) |
| Phosphor-imager | GE Healthcare | 28955809 | Typhoon FLA-7000 Phosphor-imager |
| Pipette Tips, filtered | Thermo Scientific | 94410040 | ClipTip 12.5 μl nonsterile |
| Poly-Prep Chromatography column | Bio-Rad | 7311550 | polypropylene chromatography column |
| Protease inhibitor Mini | Pierce | A32955 | Tablets, EDTA-free |
| screw cap tube | Thermo Scientific | 3488 | Microcentifuge Tubes, 2.0 ml with screw cap, nonsterile |
| SLS 96-deep Well plates | Greiner | 780285 | MASTERBLOCK, 2 ML, PP, V-Bottom, Natural |
| spin column | Millipore | UFC500396 | Amicon Ultra -0.5 ml Centrifugal Filters |
| Thermomixer | Eppendorf | 5382000015 | Thermomixer C |
| TLC plate (PEI-cellulose F TLC plates) | Merck Millipore | 105579 | DC PEI-cellulose F (20 x 20 cm) |
| Tris | SIGMA | BP152 | Tris Base for Molecular Biology |
| Tween 20 | SIGMA | P1379 | viscous non-ionic detergent |
| β-mercaptoethanol | SIGMA | M3148 | 99% (GC/titration) |
Referencias
- Kalia, D., et al. Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis. Chemical Society Reviews. 42 (1), 305-341 (2013).
- Camilli, A., Bassler, B. L. Bacterial small-molecule signaling pathways. Science. 311 (5764), 1113-1116 (2006).
- Luo, Y., et al. The cAMP capture compound mass spectrometry as a novel tool for targeting cAMP-binding proteins: from protein kinase A to potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channels. Molecular & Cellular Proteomics. 8 (12), 2843-2856 (2009).
- Nesper, J., Reinders, A., Glatter, T., Schmidt, A., Jenal, U. A novel capture compound for the identification and analysis of cyclic di-GMP binding proteins. Journal of Proteomics. 75 (15), 4874-4878 (2012).
- Laventie, B. J., et al. Capture compound mass spectrometry--a powerful tool to identify novel c-di-GMP effector proteins. Journal of Visual Experiments. (97), e51404(2015).
- Roelofs, K. G., Wang, J., Sintim, H. O., Lee, V. T. Differential radial capillary action of ligand assay for high-throughput detection of protein-metabolite interactions. Proceedings of the National Academy of Sciences of the United States of America. 108 (37), 15528-15533 (2011).
- Zhang, Y., et al. Evolutionary adaptation of the essential tRNA methyltransferase TrmD to the signaling molecule 3 ',5 '-cAMP in bacteria. Journal of Biological Chemistry. 292 (1), 313-327 (2017).
- Corrigan, R. M., et al. Systematic identification of conserved bacterial c-di-AMP receptor proteins. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 9084-9089 (2013).
- Roelofs, K. G., et al. Systematic identification of cyclic-di-GMP binding proteins in Vibrio cholerae reveals a novel class of cyclic-di-GMP-binding ATPases associated with type II secretion systems. PLoS Pathogen. 11 (10), 1005232(2015).
- Fang, X., et al. GIL, a new c-di-GMP-binding protein domain involved in regulation of cellulose synthesis in enterobacteria. Molecular Microbiology. 93 (3), 439-452 (2014).
- Corrigan, R. M., Bellows, L. E., Wood, A., Grundling, A. ppGpp negatively impacts ribosome assembly affecting growth and antimicrobial tolerance in Gram-positive bacteria. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 1710-1719 (2016).
- Zhang, Y., Zbornikova, E., Rejman, D., Gerdes, K. Novel (p)ppGpp binding and metabolizing proteins of Escherichia coli. Mbio. 9 (2), 02188(2018).
- Yang, J., et al. The nucleotide pGpp acts as a third alarmone in Bacillus, with functions distinct from those of (p) ppGpp. Nature Communications. 11 (1), 5388(2020).
- Orr, M. W., Lee, V. T. Differential radial capillary action of ligand assay (DRaCALA) for high-throughput detection of protein-metabolite interactions in bacteria. Methods in Molecular Biology. 1535, 25-41 (2017).
- Kitagawa, M., et al. Complete set of ORF clones of Escherichia coli ASKA library (A complete Set of E. coli K-12 ORF archive): Unique resources for biological research. DNA Research. 12 (5), 291-299 (2005).
- Hochstadt-Ozer, J., Cashel, M. The regulation of purine utilization in bacteria. V. Inhibition of purine phosphoribosyltransferase activities and purine uptake in isolated membrane vesicles by guanosine tetraphosphate. Journal of Biological Chemistry. 247 (21), 7067-7072 (1972).
- Zhang, Y. E., et al. p)ppGpp regulates a bacterial nucleosidase by an allosteric two-domain switch. Molecular Cell. 74 (6), 1239-1249 (2019).
- Wang, B., et al. Affinity-based capture and identification of protein effectors of the growth regulator ppGpp. Nature Chemical Biology. 15 (2), 141-150 (2019).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados