A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח מורפולוגיה אורגנואידית רקטלית (ROMA): בדיקה אבחנתית בסיסטיק פיברוזיס
In This Article
Summary
פרוטוקול זה מתאר ניתוח מורפולוגיה אורגנואידית רקטלית (ROMA), בדיקה אבחנתית חדשנית לסיסטיק פיברוזיס (CF). מאפיינים מורפולוגיים, כלומר המעוגלות (מדד מעגליות, CI) ונוכחות לומן (יחס עוצמה, IR), הם מדד לפונקציית CFTR. ניתוח של 189 נבדקים הראה אפליה מושלמת בין CF ללא CF.
Abstract
אבחון של סיסטיק פיברוזיס (CF) אינו תמיד פשוט, במיוחד כאשר ריכוז הזיעה הכלוריד הוא בינוני ו/או פחות משתי מוטציות CFTR הגורמות למחלות. מבחני CFTR פיזיולוגיים (הפרש פוטנציאלים באף, מדידת זרם מעיים) נכללו באלגוריתם האבחון אך לא תמיד זמינים או אפשריים (למשל, בתינוקות). אורגנואידים רקטליים הם מבנים תלת-ממדיים שגדלים מתאי גזע שבודדו מקריפטות של ביופסיה רקטלית כאשר הם מתורבתים בתנאים מסוימים. לאורגנואידים מנבדקים שאינם CF יש צורה עגולה ולומן מלא בנוזל, שכן הובלת כלוריד בתיווך CFTR מניעה מים לתוך לומן. אורגנואידים עם פונקציית CFTR פגומה אינם מתנפחים, שומרים על צורה לא סדירה ואין להם לומן נראה לעין. הבדלים במורפולוגיה בין אורגנואידים מסוג CF לבין אורגנואידים שאינם CF מכמתים ב'ניתוח מורפולוגיה אורגנואידית רקטלית' (ROMA) כבדיקה פיזיולוגית חדשנית של CFTR. עבור מבחן ROMA, אורגנואידים מצופים בלוחות 96 באר, מוכתמים בקלצין, ומצולמים במיקרוסקופ קונפוקלי. הבדלים מורפולוגיים מכמתים באמצעות שני מדדים: מדד המעגליות (CI) מכמת את העגולות של האורגנואידים, ויחס העוצמה (IR) הוא מדד לנוכחות לומן מרכזי. לאורגנואידים שאינם CF יש CI גבוה ו-IR נמוך בהשוואה לאורגנואידים של CF. מדדי ROMA מפלים באופן מושלם 167 נבדקים עם CF מ-22 נבדקים ללא CF, מה שהופך את ROMA לבדיקת CFTR פיזיולוגית מושכת המסייעת באבחון CF. ביופסיות רקטליות יכולות להתבצע באופן שגרתי בכל הגילאים ברוב בתי החולים וניתן לשלוח רקמות למעבדה מרכזית לתרבית אורגנואידית ו-ROMA. בעתיד, ROMA עשוי להיות מיושם גם כדי לבחון את היעילות של מודולטורים CFTR במבחנה. מטרת הדו"ח הנוכחי היא להסביר באופן מלא את השיטות המשמשות את ROMA, כדי לאפשר שכפול במעבדות אחרות.
Introduction
סיסטיק פיברוזיס (CF) היא מחלה אוטוזומלית רצסיבית הנגרמת על ידי מוטציות בגן מווסת מוליכות טרנסממברנה CF (CFTR). חלבון CFTR הוא תעלת כלוריד וביקרבונט, המבטיחה הידרציה של מספר אפיתליה1. CF היא מחלה רב-מערכתית בעלת עומס גבוה, מקצרת חיים, המתבטאת בעיקר כמחלה נשימתית, אך משפיעה גם על מערכת העיכול, הלבלב, הכבד ומערכת הרבייה2.
מוטציות CFTR הגורמות למחלות מובילות לירידה בכמות או בתפקוד של CFTR , וכתוצאה מכך גורמות להתייבשות ליחה. יותר מ -2,000 וריאנטים בגן CFTR תוארו3, מתוכם רק 466 אופיינו ביסודיות4.
אבחנה של CF יכולה להיעשות כאשר ריכוז הזיעה הכלוריד (SCC) הוא מעל הסף של 60 mmol / L או כאשר שתי מוטציות CFTR הגורמות למחלה (על פי מסד הנתונים CFTR2) מזוהות 4,5. בנבדקים עם SCC מוגבר בינוני בלבד (30-60 מילימול לליטר), המופיע בכ-4%-5% מבדיקות הזיעה6, ומוטציות CFTR בעלות השלכות קליניות שונות או לא ידועות, לא ניתן לאשר או לשלול את האבחנה, גם כאשר יש להם תסמינים תואמי CF או בדיקת סקר חיובית לילודים. במקרים אלה, מבחני CFTR פיזיולוגיים בקו שני (הפרש פוטנציאל האף (NPD) ומדידות זרם מעיים (ICM)) נכללו באלגוריתם האבחון. בדיקות אלה אינן זמינות ברוב המרכזים ואינן ניתנות לביצוע בכל הגילאים, במיוחד בתינוקות5.
אורגנואידים רקטליים הם מבנים תלת-ממדיים הגדלים מתאי גזע של מעי בוגרים Lgr5(+) מקריפטות מעיים המתקבלות באמצעות ביופסיה רקטלית7. אורגנואידים נמצאים בשימוש הולך וגובר במחקר ביו-רפואי, כגון בדיקת טיפול במודולטור ב-CF8. ביופסיה בת קיימא ניתן להשיג על ידי יניקה או ביופסיה מלקחיים, הליך שגורם רק אי נוחות מינימלית והוא בטוח גם בתינוקות, עם שיעורי סיבוכים נמוכים9. הקריפטות שבודדו מהביופסיות הרקטליות מועשרות בתאי גזע, ובתנאי גידול ספציפיים, אלה מתארגנים בעצמם לאורגנואידים רקטליים. המורפולוגיה של אורגנואידים אלה נקבעת על ידי הביטוי והתפקוד של CFTR, הממוקם בקרום האפיקלי של תאי אפיתל. CFTR פונקציונלי מאפשר לכלוריד ולמים להיכנס לומן האורגנואידים, ובכך לגרום לנפיחות של אורגנואידים שאינם CF. אורגנואידים של CF אינם מתנפחים ואין להם לומן נראה לעין10,11.
ניתוח מורפולוגיה אורגנואידית רקטלית (ROMA) מאפשר הבחנה בין אורגנואידים CF לאורגנואידים שאינם CF בהתבסס על הבדלים אלה במורפולוגיה האורגנואידית. אורגנואידים שאינם CF הם עגולים יותר ויש להם לומן נראה לעין, בעוד שההפך הוא הנכון עבור אורגנואידים CF. לצורך בדיקה זו, אורגנואידים ספציפיים למטופל מצופים ב -32 בארות של צלחת 96 באר. לאחר יום אחד של גידול, האורגנואידים מוכתמים בירוק קלצ'ין ומצולמים במיקרוסקופ קונפוקלי. האורגנואידים שאינם CF מראים צורה מעגלית יותר וחלק מרכזי פחות פלואורסצנטי, שכן לומן מכיל כתמי נוזל וקלצין בלבד. הבדלים אלה במורפולוגיה מכמתים באמצעות שני מדדי ROMA: מדד המעגליות (CI) מכמת את העגולות של האורגנואידים, ואילו יחס העוצמה (IR) הוא מדד לנוכחות או היעדרות של לומן מרכזי. בדוח זה אנו מתארים בפירוט את הפרוטוקול לקבלת אינדקסים מפלים אלה, כדי לאפשר שכפול של הטכניקה.
Protocol
עבור כל ההליכים המערבים רקמה אנושית, נרכש אישור של ועדת האתיקה למחקר UZ/KU Leuven (מחקר EC). כל המחקרים בוצעו בהסכמה מדעת ו/או בהסכמה של הורים, נציגים ו/או מטופלים.
הערה: כל ההליכים הכוללים ביופסיות רקטליות ואורגנואידים צריכים להתבצע בזרימה למינרית כדי להגן על החוקר מפני כל סכנה ביולוגית ולמזער את הסיכון לזיהום התרביות. באשר לכל הליך מעבדה, החוקרים צריכים בכל עת ללבוש מעילי מעבדה, כפפות ומשקפי מגן כדי לתמרן דגימות.
1. ביופסיה רקטלית, בידוד תאי גזע בוגרים מקריפטות, ותרבית אורגנואיד
- עבור חלק ראשוני זה של הפרוטוקול, הכולל ייצור ושימוש במדיה, תרבית אורגנואידית, פיצול, הרחבה והקפאה עבור ביובנקאות, עקוב אחר שני הפרוטוקוליםשפורסמו בעבר 8,12.
- בקיצור, יש לנקוט בצעדים הבאים:
- קח שלוש עד ארבע ביופסיות רקטליות עם מלקחיים או מכשיר יניקה ואסוף במיכל סטרילי (למשל, צינור מיקרוצנטריפוגה של 1.5 מ"ל) עם מדיום Ad-DF+++ כמתואר בפרוטוקול שהוזכר לעיל.
- הובלת ביופסיות למעבדה מרכזית על קרח או בטמפרטורה של 4 מעלות צלזיוס. תחבורה למרכזים אחרים אפשרית, והאיכות אינה מושפעת באופן משמעותי גם כאשר ההובלה אורכת עד 48 שעות. אם ההובלה צפויה להימשך יותר מ-6 שעות, השתמש בצינור חרוטי של 15 מ"ל עם 6 מ"ל של מדיום Ad-DF+++ במקום בצינור מיקרוצנטריפוגה של 1.5 מ"ל.
- שטפו את הביופסיות ב-PBS קר עד שהסופר-נטנט יהיה ברור כדי להסיר את הפסולת ורקמות שאינן אפיתל כגון רקמת שומן.
- דגירה של הביופסיות עם EDTA (ריכוז סופי של 10 מ"מ) כדי לנתק את הקריפטות. צלחת את הקריפטות במטריצת קרום מרתף. הוסיפו אנטיביוטיקה רחבת טווח (גנטמיצין 50 מיקרוגרם/מ"ל ו-ונקומיצין 50 מיקרוגרם/מ"ל) למדיום בשבוע הראשון של התרבות כדי למנוע זיהום חיידקי.
- כאשר הקריפטות ניצתו והן סגורות ומתרבות, בצע פיצול מכני, בדרך כלל לאחר 7 ימים.
- פיצול האורגנואידים המתקבלים בערך כל 7 ימים. בדרך זו, להרחיב את התרבית, להקפיא דגימות גיבוי בביובנק, או להשתמש באורגנואידים לבדיקות.
2. ציפוי אורגנואידים ל-ROMA (יום 1)
- פיצול מכני של האורגנואידים לציפוי
- לאסוף אורגנואידים משלוש בארות שגודלו היטב מצלחת של 24 בארות על ידי שטיפה פעמיים עם מדיום Ad-DF+++ קר, לאסוף אותם בצינור מיקרוצנטריפוגה של 1.5 מ"ל, ולהעריך אותם תחת המיקרוסקופ12.
- ודא שהאורגנואידים הם בני קיימא ואיכותיים, מה שבדרך כלל ניתן להשיג לאחר 5-7 ימים של צמיחה לאחר שפוצלו קודם לכן (איור 1).
- פיצול מכני של האורגנואידים על פי הפרוטוקול הנ"ל 8,12. חזרו על הפעולה עד שרוב האורגנואידים, כפי שהוערכו באמצעות מיקרוסקופ שדה הבהיר, יהיו קטנים מספיק בהשוואה לתצפית הראשונית.
- אסוף את האורגנואידים הקטנים יותר, המתאימים בדרך כלל לאוסף של כ-4/5 העליונים של התמיסה האורגנואידית-בינונית בצינור מיקרוצנטריפוגה חדש, כאשר אורגנואידים גדולים שוקעים לתחתית הצינור בשל כוח הכבידה ואורגנואידים קטנים נשארים תלויים בחלק העליון של העמודה הבינונית.
- צנטריפוגה את הדגימה של אורגנואידים קטנים יותר ב 0.3 x 1000 גרם במשך 2 דקות ולהשליך את המדיום.
- לדלל את הכדור של אורגנואידים קטנים יותר ב 130 μL של מטריצת קרום מרתף 40%-50% (מדולל עם Ad-DF+++ בינוני12).
- יש להשעות היטב באמצעות מיקרופיפטה של 200 μL.
- צלחת את האורגנואידים בצלחת של 96 בארות
- באמצעות פיפטה של 20 μL, אורגנואידים של צלחת ב-32 בארות של צלחת 96 בארות שחוממה מראש. ודא שכל באר מכילה טיפה אחת של 4 μL של תמיסת מטריצת האורגנואיד המיוצרת בשלב הקודם.
- האורגנואידים בתמיסה נוטים ליצור גלולה בתחתית הצינור עקב תזוזה תלוית כבידה כלפי מטה. כדי למנוע זאת ולהבטיח ציפוי אחיד, יש להשעות באופן קבוע את תמיסת המטריצה האורגנואידית באמצעות מיקרופיפטה של 200 μL (למשל, בכל פעם לאחר ציפוי ארבע עד שמונה בארות).
- ציפו כל טיפה במרכז הבאר כדי למנוע מהטיפה לזרום לכיוון שולי הבאר, מה שיפחית את איכות התמונה בהמשך.
- יש לשאוף לכ-30 אורגנואידים בכל באר (מינימום 15, מקסימום 90) ללא אורגנואידים חופפים.
- זכור כי אורגנואידים אלה יצטרכו להיות דגירה בן לילה ויגדלו מעט במהלך תקופה זו, ועשויים להתחיל לחפוף אם צפיפות הציפוי גבוהה מדי.
- בדוק את צפיפות הציפוי באמצעות מיקרוסקופ שדה בהיר עם מטרת הגדלה של פי 5 לאחר ציפוי הבארות הראשונות או שתיים.
- אם צפיפות הציפוי גבוהה מדי, דללו את תמיסת המטריצה האורגנואידית בשלב עם הוספת מטריצת קרום המרתף עד להגעה לצפיפות הציפוי הרצויה (איור 2).
- לאחר הציפוי, יש להקיש בעדינות על הלוח על משטח שטוח כדי לוודא שרוב האורגנואידים נמצאים באותו מישור מוקד.
- לדגור על הצלחת
- דגירה של צלחת 96 באר ב 37 °C ו 5% CO2 במהלך 8-10 דקות כדי לאפשר gelation של מטריצת קרום המרתף.
- יש להוסיף 50 μL של מדיום אורגנואידי המעי הגס האנושי +/+12 בכל באר ולדגור למשך לילה במשך 16-24 שעות.
- אין להוסיף forskolin ולא מודולטורים CFTR, כך האורגנואידים לגדול בתנאים בסיסיים.
3. הדמיה אורגנואידית באמצעות מיקרוסקופיה קונפוקלית (יום 2)
- להכתים את האורגנואידים בירוק קלצין
- הכן תמיסת מלאי של 1 mM של קלצין ירוק על ידי הוספת 50 μL של דימתילסולפוקסיד (DMSO) לבקבוקון אחד המכיל 50 מיקרוגרם של קלצין ירוק.
- הכן תמיסה עובדת של קלצין ירוק על ידי הוספת 1.2 μL מתמיסת המלאי ל-200 μL של Ad-DF+++ (ריכוז 6 μM).
- הוסיפו 5 μL מתערובת קלצ'ין זו לכל באר של צלחת 96 הבאר שבה צופו אורגנואידים (ריכוז קלצין סופי 0.6 μM). אין לגעת ולפזר את טיפת המטריצה בתוך הבאר בעת ביצוע שלב זה.
- סובב והטה מעט את הצלחת עם המכסה על כמה פעמים כדי להבטיח הפצה הומוגנית של ירוק קלצין בכל הבאר.
- דגרו שוב את הצלחת למשך 15-30 דקות בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 כדי להבטיח צביעה של כל האורגנואידים בבארות.
- מעבירים את הצלחת למיקרוסקופ הקונפוקלי
- מעבירים את הצלחת למיקרוסקופ הקונפוקלי עם שלב אוטומטי ואינקובטור משולב. ודא שהצלחת קבועה היטב במחזיק הצלחת.
- דגירה ב-37 מעלות צלזיוס ו-5% CO2 היא אופציונלית אך לא הכרחית, בהתחשב במשך הזמן הקצר (כ-10 דקות) של תהליך ההדמיה.
- התמקדות באורגנואידים (איור 3)
- באמצעות מיקרוסקופ קונפוקלי, יש לקבוע את מיקום ה-x/y והמיקוד האופטימליים (מיקום z) של האורגנואידים בכל באר באופן ידני, ולשמור מיקומים אלה בתוכנת ההדמיה.
- המיקוד הטוב ביותר מרמז על התיחום החד ביותר האפשרי של האורגנואידים והדמיה של החלק הגדול ביותר האפשרי של טיפת האורגנואידים. אם התפלגות הכתם אינה מספקת, חזור על שלבים 3.1.4 ו- 3.1.5 (דגירה, למשל, למשך 5-10 דקות נוספות).
- השתמש בהגדרות הדמיה של תאים חיים עם פליטה של 488 ננומטר ועירור של 515 ננומטר (ספציפית להדמיה של פלואורסצנציה של קלצ'ין) ויעד הגדלה של 5x LD.
- רכשו תמונות אורגנואידיות של 32 הבארות באמצעות המיקרוסקופ הקונפוקלי (איור 3 ואיור 4).
- צלם תמונות באופן חד-כיווני עם רזולוציה של 1024 פיקסלים x 1024 פיקסלים (גודל פיקסל 2.5 מיקרומטר x 2.5 מיקרומטר) ועומק של 16 סיביות.
- בחר את עוצמת הלייזר ואת רווח המאסטר להמחשה אופטימלית של הבדלים מורפולוגיים בין אורגנואידים שאינם CF לבין אורגנואידים שאינם CF (למשל, הבחנה בין לומן מרכזי שאינו מוכתם במים (אם קיים) לבין גבול תאי מוכתם).
הערה: אורגנואידים לא יסומנו כראוי כאשר הרווח הראשי ולכן אות הפלואורסצנציה נמוך מדי; הגדרת רווח המאסטר גבוה מדי תגרום לתמונות עם אורגנואידים עם עוצמת אות הומוגנית מאוד, מה שימנע הדמיה של הבדלים מורפולוגיים עדינים יותר (איור 2). - שמור תמונה אחת לכל באר עבור כל 32 הבארות בפורמט מיקרוסקופ וייצא אותן כקבצי TIFF.
4. ניתוח תמונות (איור 5)
- טען את קבצי TIFF בתוכנת ניתוח התמונות.
- בצע את בדיקת האיכות הראשונה בהתבסס על קריטריוני אי-הכללה שנקבעו על-ידי האופרטור (איור 2): מבנים או פסולת מובחנים או מתים רבים, צפיפות ציפוי לא מספקת, רבים מדי (למשל, חופפים) או מעט מדי אורגנואידים, והתפלגות פלואורסצנטית לא מספקת (אורגנואידים שאינם מסומנים בבירור, אות רקע גבוה מדי).
הערה: ניתן לבצע שלב זה גם לפני ייצוא תמונות כקובצי TIFF בשלב 3.4. - הכנת תמונות לניתוח
- כייל מחדש תמונות, כך שפיקסל אחד יתאים ל- 2.5 μm x 2.5 μm.
- יצירה ופתיחה של נתוני רשת אחד (. ND) קובץ של כל 32 התמונות עבור כל תרבית אורגנואידית, המאפשר ניתוח סימולטני של כל 32 התמונות לכל נושא.
- תיחום האורגנואידים
- תיחום מבנים באמצעות סף עוצמה נמוך יותר של 4,500 וסף עליון של 65,535 (פונקציות חלקות ונקיות כבויות; פונקציית מילוי חורים על; פונקציה נפרדת ב- x3).
הערה: זה תוחם מבנים פלואורסצנטיים, עם חורי מילוי הכוללים את הלומן במבנה המסומן אם קיים.
- תיחום מבנים באמצעות סף עוצמה נמוך יותר של 4,500 וסף עליון של 65,535 (פונקציות חלקות ונקיות כבויות; פונקציית מילוי חורים על; פונקציה נפרדת ב- x3).
- לספור את האורגנואידים
- בחר את כל המבנים ≥40 מיקרומטר.
- לחץ על הלחצן עדכן מדידת ND (בכל פעם שיש צורך במדידה); האורגנואידים שנספרו יהיו ממוספרים.
הערה: זה שווה למספר הכולל של אורגנואידים ב -32 בארות, בעוד פסולת קטנה, כגון תאים מתים, אינו נכלל.
- מדידת עוצמה ומעגליות לחישוב המדדים
- בחר את כל המבנים ≥60 מיקרומטר וספור.
הערה: פעולה זו סופרת את האורגנואידים גדולים מספיק כדי להראות מורפולוגיה אופיינית ל-CF או ללא-CF. אורגנואידים >40 מיקרומטר ו-<60 מיקרומטר הם קטנים וצפופים, הן ב-CF שאינו CF והן ב-CF. - הסר את כל המבנים הנוגעים לגבולות התמונה. עשה זאת כדי להסיר אורגנואידים שאינם גלויים לחלוטין, שכן לא ניתן לכמת במדויק את המורפולוגיה שלהם.
- שחיקת פיקסל אחד (= 2.5 מיקרומטר) מהגבול של כל מבנה ≥60 מיקרומטר. פעולה זו מסירה את ההילה של פלואורסצנטיות קלצין מפוזרת סביב האורגנואידים.
- מדוד את העוצמה הממוצעת של כל מבנה. בדרך זו נמדדת הפלואורסצנטיות הממוצעת של האורגנואידים.
- בחר שוב את כל המבנים ≥60 מיקרומטר והסר את כל המבנים הנוגעים בגבולות.
- שחיקת 10 פיקסלים (= 25 מיקרומטר) מהגבול של כל מבנה ≥60 מיקרומטר.
הערה: באורגנואידים שאינם CF, פעולה זו שוחקת את הגבול התאי ומשאירה רק את הלומן. באורגנואידים של CF, זה שוחק את החלק החיצוני של האורגנואיד, שיש לו בערך את אותה פלואורסצנטיות כמו החלק הפנימי שנשאר. - מדוד את העוצמה הממוצעת של כל מבנה שנשחק. בדרך זו נמדדת הפלואורסצנטיות הממוצעת של החלק המרכזי של האורגנואידים.
- מדוד את המעגליות של כל מבנה. זה מתאים למעגליות הממוצעת של האורגנואידים.
- בחר את כל המבנים ≥60 מיקרומטר וספור.
- בצע את בדיקת האיכות השנייה: קריטריוני אי הכללה שנקבעו על-ידי התוכנה. אל תכלול את קבוצת התמונות כאשר פחות מ-50% מהאורגנואידים (המוגדרים כמבנים ≥40 מיקרומטר) הם ≥60 מיקרומטר, מכיוון שמספיק אורגנואידים צריכים להיות גדולים מספיק כדי להראות מורפולוגיה אופיינית ל-CF או ללא CF. כמו כן, אין לכלול כאשר <500 או >3,000 אורגנואידים (המוגדרים כמבנים ≥40 מיקרומטר) נמצאים ב-32 הבארות.
5. מדידת המדדים בתוכנת ההדמיה (איור 6)
- מדוד את מדד המעגליות (CI).
הערה: זה מתאים למעגליות הממוצעת שנמדדה בשלב 4.6, שהיא המעגליות הממוצעת של כל האורגנואידים בכל 32 הבארות. CI מכמת את המעוגלות של האורגנואידים, המוגדרת כ - , שהיא נמוכה יותר ב- CF מאשר באורגנואידים שאינם CF
- , שהיא נמוכה יותר ב- CF מאשר באורגנואידים שאינם CF - מדידת יחס העוצמה (IR)
- חשב את ה- IR על ידי חלוקת ממוצע מדידת העוצמה לאחר שחיקה של 25 מיקרומטר מהגבול של כל מבנה ≥60 מיקרומטר בממוצע מדידת העוצמה לאחר שחיקה של 2.5 מיקרומטר מהגבול של כל מבנה ≥60 מיקרומטר.
הערה: IR מודד את הנוכחות או ההיעדרות של לומן מרכזי. IR שווה ל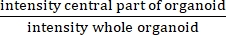 - , והוא גבוה יותר ב- CF מאשר באורגנואידים שאינם CF.
- , והוא גבוה יותר ב- CF מאשר באורגנואידים שאינם CF.
- חשב את ה- IR על ידי חלוקת ממוצע מדידת העוצמה לאחר שחיקה של 25 מיקרומטר מהגבול של כל מבנה ≥60 מיקרומטר בממוצע מדידת העוצמה לאחר שחיקה של 2.5 מיקרומטר מהגבול של כל מבנה ≥60 מיקרומטר.
- פשט את תהליך הניתוח
- הכן גליון עבודה רגיל באמצעות תוכנת גיליון אלקטרוני כדי לחשב מדדים אלה באופן אוטומטי בעת העתקת הנתונים (איור 7).
- כדי לחשב את ה- IR:
- קח את מדידת העוצמה לאחר שחיקה של 2.5 מיקרומטר מהגבול של כל מבנה ≥60 מיקרומטר. השתמש בממוצע לחישוב (מכנה).
- קח את מדידת העוצמה לאחר שחיקה של 25 מיקרומטר מהגבול של כל מבנה ≥60 מיקרומטר. השתמש בממוצע לחישוב (נומרטור).
- כדי לחשב את CI, לקחת את המעגליות של כל האורגנואידים בכל הבארות. הממוצע מתאים ל- CI.
הערה: כאשר נדרש ניתוח של קבוצות גדולות של תמונות, תהליך ניתוח התמונות כמתואר בסעיף 4 יכול להיות אוטומטי למחצה, החל מקבצי ND מכוילים והפעלת מאקרו עם כל השלבים משולבים.
תוצאות
אורגנואידים מ-212 נבדקים נאספו במהלך ביקורים קליניים שגרתיים. לא התרחשו תופעות לוואי במהלך או לאחר הליך הביופסיה הרקטלית. אורגנואידים צולמו על ידי חוקר אחד עיוור למאפייני הנושא כגון גנוטיפ ומידע קליני. בשל תמונות באיכות נמוכה, 23 נושאים לא נכללו. דוגמאות לתרביות אורגנואידיות מוצלחות וכושלו...
Discussion
אנו מספקים פרוטוקול מפורט לניתוח מורפולוגיה אורגנואידית רקטלית (ROMA). שני המדדים שחושבו באמצעות ROMA, IR ו-CI, הבדילו בין אורגנואידים לנבדקים עם CF לבין אלה ללא CF בדיוק מושלם. לפיכך, ROMA יכול לתפקד כבדיקת CFTR פיזיולוגית חדשנית המשלימה את SCC ובדיקות אחרות הזמינות כיום13,14,15
Disclosures
מחקר זה מומן על ידי האגודה הבלגית לחולי CF "Mucovereniging/Association Muco", מענק המחקר של האגודה הבלגית לרפואת ילדים BVK-SBP 2019, ומענק מקרן UZ Leuven למחקר ביו-רפואי תרגומי. המחברים מצהירים על היעדר ניגוד עניינים.
Acknowledgements
אנו מודים למטופלים ולהורים שהשתתפו במחקר זה. אנו מודים לאבידה ביבי על כל עבודת התרבות עם האורגנואידים. אנו מודים לאלס ארטגרטס, קרוליין ברוניל, קלייר קולארד, ליליאן קוליניון, מוניק דלפוסה, אניה דלפורטה, נטלי פיירטס, ססיל למברמונט, לוט ניובורג, נטלי פיטרס, אן ראמאן, פים סנסן, הילדה סטיבנס, מריאן שולטה, אלס ואן רנסביק, כריסטל ואן דה ברנדה, ברוך ואן דן איינדה, מרלין ונדרקרקן, אינגה ואן דייק, אודרי וגנר, מוניקה ווסקייביץ' וברנרד ונדריקס על התמיכה הלוגיסטית. אנו מודים גם ל-Mucovereniging/Association Muco, ובמיוחד לסטפן ג'וריס ולד"ר יאן ונליווה, על התמיכה והמימון שלהם. אנו מודים לכל משתפי הפעולה מפרויקט האורגנואיד הבלגי: הדוויג' בובולי (CHR Citadelle, ליאז ', בלגיה), לינדה בולאנז'ה (בתי חולים אוניברסיטאיים לוון, בלגיה), ז'ורז ' קזימיר (HUDERF, בריסל, בלגיה), בנדיקט דה מאייר (בית החולים האוניברסיטאי גנט, בלגיה), אלקה דה וכטר (בית החולים האוניברסיטאי בריסל, בלגיה), דני דה לוזה (בית החולים האוניברסיטאי גנט, בלגיה), איזבל אטיין (CHU Erasme, בריסל, בלגיה), לורנס הנסנס (HUDERF, בריסל), כריסטיאן קנופ (CHU Erasme, בריסל, בלגיה), מוניק לקסנה (בית החולים האוניברסיטאי אנטוורפן, בלגיה), ויקי נובה (GZA בית החולים סנט וינסנטיוס אנטוורפן), דירק סטאסן (GZA סנט וינסנטיוס בית החולים אנטוורפן), סטפני ואן בירבליט (בית החולים האוניברסיטאי גנט, בלגיה), אווה ואן ברקל (בית החולים האוניברסיטאי גנט, בלגיה), קים ואן הורנביק (בית החולים האוניברסיטאי אנטוורפן, בלגיה), Eef Vanderhelst (בית החולים האוניברסיטאי בריסל, בלגיה), Stijn Verhulst (בית החולים האוניברסיטאי אנטוורפן, בלגיה), סטפני וינקן (בית החולים האוניברסיטאי בריסל, בלגיה).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
References
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved