このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
直腸オルガノイド形態分析(ROMA):嚢胞性線維症の診断アッセイ
要約
このプロトコルは、嚢胞性線維症(CF)の新しい診断アッセイである直腸オルガノイド形態分析(ROMA)について説明しています。形態学的特徴、すなわち真円度(円形度指数、CI)および内腔の存在(強度比、IR)は、CFTR機能の尺度である。189人の被験者の分析は、CFと非CFの間の完全な識別を示しました。
要約
嚢胞性線維症(CF)の診断は、特に汗の塩化物濃度が中程度である場合、および/または2つ未満の疾患の原因となる CFTR 変異を特定できる場合、必ずしも簡単ではありません。生理学的CFTRアッセイ(鼻電位差、腸電流測定)は診断アルゴリズムに含まれていますが、必ずしも容易に利用可能または実行可能であるとは限りません(例:乳児)。直腸オルガノイドは、特定の条件下で培養した場合に直腸生検の陰窩から分離された幹細胞から成長する3D構造です。非CF被験者からのオルガノイドは、CFTRを介した塩化物輸送が水を内腔に送り込むため、丸い形状と液体で満たされた内腔を有する。CFTR機能に欠陥のあるオルガノイドは膨潤せず、不規則な形状を保ち、目に見える内腔を持たない。CFオルガノイドと非CFオルガノイドの形態の違いは、新しいCFTR生理学的アッセイとして「直腸オルガノイド形態分析」(ROMA)で定量化されています。ROMAアッセイでは、オルガノイドを96ウェルプレートにプレーティングし、カルセインで染色し、共焦点顕微鏡でイメージングします。形態学的差異は、2つの指標を使用して定量化されます:円形度指数(CI)はオルガノイドの真円度を定量化し、強度比(IR)は中心内腔の存在の尺度です。非CFオルガノイドは、CFオルガノイドと比較してCIが高く、IRが低い。ROMAインデックスは、CFの167人の被験者とCFのない22人の被験者を完全に区別し、ROMAをCF診断に役立つ魅力的な生理学的CFTRアッセイにしました。直腸生検は、ほとんどの病院ですべての年齢層で日常的に行うことができ、組織はオルガノイド培養とROMAのために中央研究所に送ることができます。将来的には、ROMAはCFTRモジュレーターの有効性を in vitroで試験するためにも適用される可能性があります。本レポートの目的は、ROMAに使用される方法を完全に説明し、他のラボでの複製を可能にすることです。
概要
嚢胞性線維症(CF)は、CF膜貫通コンダクタンス制御因子(CFTR)遺伝子の変異によって引き起こされる常染色体劣性疾患です。CFTRタンパク質は塩化物および重炭酸塩チャネルであり、いくつかの上皮1の水和を確実にする。CFは、主に呼吸器疾患として現れるだけでなく、胃腸管、膵臓、肝臓、および生殖管にも影響を与える、高負荷で寿命を縮める多系統疾患です2。
病気の原因となるCFTR変異は、 CFTR の量または機能の低下につながり、粘液脱水を引き起こします。 CFTR 遺伝子には2,000を超える変異体が記載されており3、そのうち466のみが完全に特徴付けられています4。
CFの診断は、汗塩化物濃度(SCC)が60 mmol / Lのしきい値を超えている場合、または2つの疾患の原因となるCFTR変異(CFTR2データベースによる)が特定された場合に行うことができます4,5。汗検査の約4%〜5%で発生する中程度に上昇した(30〜60 mmol / L)SCCのみの被験者6、およびさまざまなまたは未知の臨床的結果のCFTR変異では、CF互換の症状または新生児スクリーニング検査が陽性であっても、診断を確認または除外することはできません。これらの場合、セカンドラインの生理学的CFTRアッセイ(鼻電位差(NPD)および腸電流測定(ICM))が診断アルゴリズムに含まれています。これらの検査は、ほとんどのセンターで容易に利用できるわけではなく、すべての年齢、特に乳児5で実施可能ではありません。
直腸オルガノイドは、直腸生検7によって得られた腸陰窩からのLgr5(+)成体腸幹細胞から増殖した3D構造です。オルガノイドは、CF8でのモジュレーター治療のテストなど、生物医学研究でますます使用されています。実行可能な生検は、吸引生検または鉗子生検のいずれかによって得ることができ、不快感を最小限に抑え、乳児でも安全で、合併症の発生率は低い9。直腸生検から単離された陰窩は幹細胞に富み、特定の培養条件下では、これらは直腸オルガノイドに自己組織化します。これらのオルガノイドの形態は、上皮細胞の頂端膜に位置するCFTRの発現および機能によって決定される。機能的なCFTRは、塩化物と水がオルガノイド内腔に入ることを可能にし、それによって非CFオルガノイドの膨潤を誘発します。CFオルガノイドは膨潤せず、目に見える内腔を持たない10,11。
直腸オルガノイド形態解析(ROMA)は、オルガノイド形態におけるこれらの違いに基づいて、CFオルガノイドと非CFオルガノイドを区別することを可能にする。非CFオルガノイドはより丸く、目に見える内腔を有するが、CFオルガノイドはその逆である。このアッセイでは、患者特異的オルガノイドを96ウェルプレートの32ウェルにプレーティングします。成長の1日後、オルガノイドをカルセイングリーンで染色し、共焦点顕微鏡で画像化します。非CFオルガノイドは、内腔に液体が含まれ、カルセインが細胞のみを染色するため、より円形で蛍光性の低い中央部を示します。これらの形態の違いは、2つのROMAインデックスを使用して定量化されます:円形度インデックス(CI)はオルガノイドの真円度を定量化し、強度比(IR)は中心内腔の有無の尺度です。本報告では、これらの識別指標を取得し、技術の複製を可能にするためのプロトコルについて詳細に説明する。
プロトコル
ヒト組織に関わるすべての手順について、倫理委員会研究UZ/KUルーヴェン(EC研究)の承認を取得しました。すべての研究は、親、代表者、および/または患者からのインフォームドコンセントおよび/または同意を得て実施されました。
注:直腸生検およびオルガノイドを含むすべての手順は、研究者を生物学的危険から保護し、培養物の汚染のリスクを最小限に抑えるために、層流で実行する必要があります。ラボの手順に関しては、研究者は常にサンプルを操作するために白衣、手袋、および安全ゴーグルを着用する必要があります。
1.直腸生検、陰窩からの成体幹細胞の分離、およびオルガノイド培養
- 培地の製造と使用、オルガノイド培養、分割、拡張、およびバイオバンキングのための凍結を含むプロトコルのこの最初の部分については、以前に公開された2つのプロトコル8,12に従います。
- つまり、次の手順を実行する必要があります。
- 鉗子または吸引装置を使用して3〜4回の直腸生検を行い、滅菌容器(例:.、1.5 mLマイクロ遠心チューブ)に、上記のプロトコルに記載されているAd-DF + ++培地で収集します。
- 生検を氷上または4°Cで中央ラボに輸送します。 他のセンターへの輸送は可能であり、輸送に最大48時間かかる場合でも品質に大きな影響はありません。輸送に6時間以上かかると予想される場合は、1.5 mLの微量遠心チューブの代わりに、6 mLのAd-DF+++培地を含む15 mLのコニカルチューブを使用してください。
- 上清が透明になるまで冷たいPBSで生検を洗浄し、破片や脂肪組織などの非上皮組織を取り除きます。
- EDTA(最終濃度10 mM)で生検をインキュベートし、陰窩を剥離します。地下膜マトリックスに陰窩をプレートします。細菌汚染を防ぐために、培養の最初の週に広域抗生物質(ゲンタマイシン50 μg/mLおよびバンコマイシン50 μg/mL)を培地に追加します。
- 陰窩が出芽し、閉じて増殖したら、通常7日後に機械的分割を実行します。
- 得られたオルガノイドを約7日ごとに分割します。このようにして、培養を拡大したり、バイオバンクでバックアップサンプルを凍結したり、オルガノイドをアッセイに使用したりできます。
2. ROMAのオルガノイドメッキ(1日目)
- めっき用のオルガノイドを機械的に分割
- 冷たいAd-DF+++培地で2回洗浄することにより、24ウェルプレートから3つのウェルからオルガノイドを収集し、1.5 mLマイクロ遠心チューブに収集し、顕微鏡下で評価します12。
- オルガノイドが実行可能で高品質であることを確認し、これは通常、以前に分割された後、5〜7日間の増殖後に達成できます(図1)。
- 前述のプロトコル8,12に従ってオルガノイドを機械的に分割します。明視野顕微鏡を使用して評価されたオルガノイドの大部分が、最初の観察と比較して十分に小さくなるまで繰り返します。
- 大きなオルガノイドは重力によってチューブの底に沈み、小さなオルガノイドは培地カラムの上部に浮遊したままであるため、通常は新しいマイクロ遠心チューブ内のオルガノイド-培地溶液の上部約4/5の収集に対応する小さなオルガノイドを収集します。
- 小さなオルガノイドのサンプルを0.3 x 1000 g で2分間遠心分離し、培地を廃棄します。
- より小さなオルガノイドのペレットを130 μLの40%-50%基底膜マトリックス(Ad-DF+++培地12で希釈)で希釈します。
- 200 μLマイクロピペットを使用してよく再懸濁します。
- オルガノイドを96ウェルプレートにプレート化
- 20 μLピペットを使用して、予め加温した96ウェルプレートの32ウェルにオルガノイドをプレートします。各ウェルに、前のステップで生成したオルガノイドマトリックス溶液の4 μL滴が1滴含まれていることを確認します。
- 溶液中のオルガノイドは、重力に依存する下方への変位のために、チューブの底部にペレットを形成する傾向があります。これを防ぎ、均一なめっきを確実にするために、200 μLのマイクロピペットを使用してオルガノイドマトリックス溶液を定期的に再懸濁します(たとえば、4〜8ウェルのめっき後、毎回)。
- 各液滴をウェルの中央にプレートして、液滴がウェルの端に向かって流れないようにします。
- オルガノイドが重複することなく、ウェルあたり約30個のオルガノイド(最小15個、最大90個)を目指します。
- これらのオルガノイドは一晩インキュベートする必要があり、この間にわずかに成長し、メッキ密度が高すぎると重なり始める可能性があることに注意してください。
- 最初の1つまたは2つのウェルをめっきした後、倍率5倍の対物レンズを備えた明視野顕微鏡を使用してめっき密度を確認します。
- めっき密度が高すぎる場合は、目的のめっき密度に達するまで、基底膜マトリックスを添加してオルガノイドマトリックス溶液を段階的に希釈します(図2)。
- めっき後、平らな面でプレートを軽くたたいて、オルガノイドの大部分が同じ焦点面にあることを確認します。
- プレートをインキュベートする
- 96ウェルプレートを37°Cおよび5%CO2 で8〜10分間インキュベートして、基底膜マトリックスのゲル化を可能にします。
- 各ウェルに50 μLのヒト結腸オルガノイド培地+/+12 を加え、16〜24時間一晩インキュベートします。
- フォルスコリンやCFTRモジュレーターを添加しないため、オルガノイドは基礎条件下で成長します。
3. 共焦点顕微鏡を用いたオルガノイドイメージング(2日目)
- オルガノイドをカルセイングリーンで染色する
- 50 μgのカルセイングリーンを含む1つのバイアルに50 μLのジメチルスルホキシド(DMSO)を加えて、カルセイングリーンの1 mMストック溶液を調製します。
- 200 μLのAd-DF+++(濃度6 μM)に1.2 μLのストック溶液を加えて、カルセイングリーンの作業溶液を調製します。
- オルガノイドを播種した96ウェルプレートの各ウェルに、このカルセイン混合物5 μLを加えます(最終カルセイン濃度0.6 μM)。このステップを実行するときは、ウェル内のマトリックスドロップに触れたり、脱臼させたりしないでください。
- 蓋をした状態でプレートを数回回転させてわずかに傾け、ウェル全体にカルセイングリーンが均一に分布するようにします。
- プレートを37°Cおよび5%CO2 で15〜30分間インキュベートして、ウェル内のすべてのオルガノイドを確実に染色します。
- プレートを共焦点顕微鏡に移します
- プレートを自動ステージと一体型インキュベーターを備えた共焦点顕微鏡に移します。プレートがプレートホルダーにしっかりと固定されていることを確認してください。
- 37°Cおよび5%CO2 でのインキュベーションはオプションですが、イメージングプロセスの持続時間が短い(約10分)ことを考えると必須ではありません。
- オルガノイドに注目(図3)
- 共焦点顕微鏡を使用して、各ウェル内のオルガノイドの最適なx/y位置と焦点(z位置)を手動で決定し、これらの位置をイメージングソフトウェアに保存します。
- 最良の焦点は、オルガノイドの可能な限り鮮明な描写と、オルガノイドドロップの可能な限り最大の部分の視覚化を意味します。汚れの分布が適切でない場合は、手順3.1.4と3.1.5を繰り返します(たとえば、さらに5〜10分間インキュベートします)。
- 488 nmの発光と515 nmの励起(カルセイン蛍光の可視化に特異的)と5倍のLD倍率対物レンズを備えたライブセルイメージング設定を使用します。
- 共焦点顕微鏡で32ウェルのオルガノイド画像を取得します(図3 および 図4)。
- 解像度 1024 ピクセル x 1024 ピクセル (ピクセル サイズ 2.5 μm x 2.5 μm)、深度 16 ビットの単方向の画像を撮影します。
- CFオルガノイドと非CFオルガノイドの形態学的差異を最適に可視化するために、レーザー強度とマスターゲインを選択します(例:染色されていない水で満たされた中央内腔(存在する場合)と染色された細胞境界の識別)。
注:オルガノイドは、マスターゲイン、したがって蛍光シグナルが低すぎると正しく描写されません。マスターゲインを高く設定しすぎると、シグナル強度が非常に高い均質なオルガノイドの画像が得られ、より微妙な形態の違いをイメージングできなくなります(図2)。 - 顕微鏡形式で32ウェルすべてのウェルごとに1枚の画像を保存し、TIFFファイルとしてエクスポートします。
4. 画像解析(図5)
- TIFFファイルを画像解析ソフトウェアにロードします。
- オペレーターが決定した除外基準に基づいて最初の品質チェックを実行します(図2):多くの分化または死んだ構造または破片、不十分なメッキ密度、多すぎる(重なり合うなど)または少なすぎる、および不十分な蛍光分布(オルガノイドが明確に描写されていない、バックグラウンドシグナルが高すぎる)。
注: この手順は、手順 3.4 で画像を TIFF ファイルとしてエクスポートする前に実行することもできます。 - 解析用の画像を準備する
- 画像を再調整して、1ピクセルが2.5 μm x 2.5 μmに対応するようにします。
- ネットワーク データ (.ND)ファイルを各オルガノイド培養について全32枚の写真に収め、被験者ごとに全32枚の写真を同時に解析することができます。
- オルガノイドの描写
- 低強度しきい値4,500、上限しきい値65,535を使用して構造を描写します(スムーズ および クリーン 機能はオフです。 穴埋め 機能はオンです。x3で 別の 関数)。
注:これは蛍光構造を描写し、 フィルホール には、描写された構造の内腔(存在する場合)が含まれます。
- 低強度しきい値4,500、上限しきい値65,535を使用して構造を描写します(スムーズ および クリーン 機能はオフです。 穴埋め 機能はオンです。x3で 別の 関数)。
- オルガノイドを数える
- 40 μm≥すべての構造を選択します。
- [ND測定の更新]ボタンをクリックします(測定が必要になるたびに)。カウントされたオルガノイドには番号が付けられます。
注:これは32ウェルのオルガノイドの総数に相当しますが、死んだ細胞などの小さな破片は除外されます。
- インデックスの計算のための強度と円形度の測定
- すべての構造≥60 μmを選択してカウントします。
注:これは、CFまたは非CFのいずれかに典型的な形態を示すのに十分な大きさのオルガノイドをカウントします。オルガノイド>40 μmおよび<60 μmは、非CFおよびCFの両方で小さくて高密度です。 - 画像の境界線に接しているすべての構造を削除します。形態を正確に定量化できないため、完全に見えないオルガノイドを除去するためにこれを行います。
- 各≥60 μm構造の境界から1ピクセル(= 2.5 μm)を侵食します。これにより、オルガノイドを取り囲む拡散カルセイン蛍光のハローが除去されます。
- 各構造の平均強度を測定します。このようにして、オルガノイドの平均蛍光が測定されます。
- すべての構造≥60 μmを再度選択し、境界に接するすべての構造を削除します。
- 各≥60 μm構造体の境界から10ピクセル(= 25 μm)を侵食します。
注:非CFオルガノイドでは、これは細胞の境界を侵食し、内腔のみを残します。CFオルガノイドでは、これはオルガノイドの外側部分を侵食し、オルガノイドは残っている内側部分とほぼ同じ蛍光を発します。 - 侵食された各構造の平均強度を測定します。このようにして、オルガノイドの中央部分の平均蛍光が測定される。
- 各構造の真円度を測定します。これはオルガノイドの平均円形度に対応する。
- すべての構造≥60 μmを選択してカウントします。
- 2番目の品質チェック(ソフトウェアによって決定された除外基準)を実行します。オルガノイド(構造≥40μm)として定義)の50%未満が≥60μmである場合、CFまたは非CFのいずれかに典型的な形態を示すのに十分な大きさのオルガノイドが必要であるため、一連の写真を除外します。また、32ウェルに<500または>3,000のオルガノイド(構造≥40 μmとして定義)が存在する場合も除外します。
5. イメージングソフトウェアでインデックスを測定します(図6)
- 循環度指数(CI)を測定します。
注:これは、ステップ4.6で測定された平均円形度に対応し、32ウェルすべてのすべてのオルガノイドの平均円形度です。CIは、オルガノイドの真円度を定量化し、次のように定義 され、非CFオルガノイドよりもCFの方が低くなります。
され、非CFオルガノイドよりもCFの方が低くなります。 - 強度比(IR)を測定する
- 各≥60μm構造の境界から25μm侵食した後の強度測定の平均を、各≥60μm構造の境界から2.5μm侵食した後の強度測定の平均で割ってIRを計算します。
注意: IRは、中心内腔の有無を測定します。IRはに等しく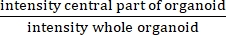 、非CFオルガノイドよりもCFの方が高い。
、非CFオルガノイドよりもCFの方が高い。
- 各≥60μm構造の境界から25μm侵食した後の強度測定の平均を、各≥60μm構造の境界から2.5μm侵食した後の強度測定の平均で割ってIRを計算します。
- 分析プロセスの簡素化
- 表計算ソフトを使用して標準のワークシートを作成し、データのコピー時にこれらのインデックスを自動的に計算します(図7)。
- IRを計算するには:
- 各≥60μm構造の境界から2.5μm侵食した後の強度測定を行います。計算には平均を使用します(分母)。
- 各≥60μm構造の境界から25μm侵食した後の強度測定を行います。計算には平均を使用します(分子)。
- CIを計算するには、すべてのウェルのすべてのオルガノイドの円形度を取ります。平均はCIに対応します。
注:画像の大規模なバッチの分析が必要な場合、セクション4で説明されている画像分析プロセスは、キャリブレーションされたNDファイルから始めて、すべてのステップを組み合わせてマクロを実行する半自動化できます。
結果
212人の被験者からのオルガノイドは、定期的な臨床訪問中に収集されました。直腸生検処置中または直腸生検後に有害事象は発生しなかった。オルガノイドは、遺伝子型や臨床情報などの被験者の特徴を知らされていない1人の研究者によって画像化されました。画像の品質が低いため、23人の被験者が除外されました。オルガノイド培養と画像取得の成功例と失敗例を 図2
ディスカッション
直腸オルガノイド形態解析(ROMA)のための詳細なプロトコルを提供します。ROMA、IR、およびCIで計算された2つの指標は、CFのある被験者とCFのない被験者のオルガノイドを完全な精度で区別しました。したがって、ROMAは、SCCおよび他の現在利用可能な試験を補完する新しい生理学的CFTRアッセイとして機能する可能性がある13、14、
開示事項
この研究は、ベルギーのCF患者協会「Mucovereniging/Association Muco」、ベルギー小児科学会BVK-SBP 2019の研究助成金、およびUZルーヴェントランスレーショナル生物医学研究基金からの助成金によって資金提供されました。著者は利益相反を宣言しません。
謝辞
この研究に参加した患者と保護者に感謝します。オルガノイドを使ったすべての培養作業について、アビダビビに感謝します。エルス・アールトゲルツ、カロリアン・ブルニール、クレア・コラード、リリアン・コリニョン、モニーク・デルフォス、アニヤ・デルポルト、ナタリー・フェイヤールツ、セシル・ランブルモン、ルート・ニューボルグ、ナタリー・ピーターズ、アン・ラマン、ピム・サンセン、ヒルデ・スティーブンス、マリアンヌ・シュルテ、エルス・ヴァン・ランズビーク、クリステル・ヴァン・デ・ブランデ、グリート・ヴァン・デン・アインデ、マーリーン・ヴァンデルケルケン、インゲ・ヴァン・ダイク、オードリー・ワグネル、モニカ・ワスキエヴィッチ、バーナード・ウェンデリックスの後方支援に感謝します。また、Mucovereniging/Association Muco、特にStefan JorisとJan Vanleeuwe博士の支援と資金提供にも感謝します。ヘドウィゲ・ボボリ(CHRシタデル、リエージュ、ベルギー)、リンダ・ブーランジェ(ベルギー、ルーヴェン大学病院)、ジョルジュ・カシミール(HUDERF、ブリュッセル、ベルギー)、ベネディクト・デ・マイエール(ゲント大学病院、ベルギー)、エルケ・デ・ワクター(ベルギー、ブリュッセル大学病院)、ダニー・デ・ルーズ(ゲント大学病院、ベルギー)、イザベル・エティエンヌ(CHUエラスム、ブリュッセル、ベルギー)、ローレンス・ハンセンス(HUDERF、 ブリュッセル)、クリスティアーネ・クヌープ(CHUエラスム、ブリュッセル、ベルギー)、モニーク・ルケイン(アントワープ大学病院、ベルギー)、ヴィッキー・ノウェ(GZAセントビンセンティウス病院アントワープ)、ディルク・シュテッセン(GZAセントビンセンティウス病院アントワープ)、ステファニー・ヴァン・ビアヴリート(ゲント大学病院、ベルギー)、エヴァ・ヴァン・ブレーケル(ゲント大学病院、ベルギー)、キム・ファン・ホーレンベック(アントワープ大学病院、ベルギー)、イーフ・ヴァンダーヘルスト(ブリュッセル大学病院、ベルギー)、スティン・フェルフルスト(アントワープ大学病院、 ベルギー)、ステファニーヴィンケン(ベルギー、ブリュッセル大学病院)。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
参考文献
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved