Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ морфологии органоидов прямой кишки (ROMA): диагностический анализ при муковисцидозе
В этой статье
Резюме
Этот протокол описывает анализ морфологии ректальных органоидов (ROMA), новый диагностический анализ муковисцидоза (МВ). Морфологические характеристики, а именно округлость (индекс циркулярности, CI) и наличие светового потока (коэффициент интенсивности, IR), являются мерой функции CFTR. Анализ 189 испытуемых показал идеальную дискриминацию между муковисцидозом и без муковисцидоза.
Аннотация
Диагностика муковисцидоза (МВ) не всегда проста, особенно когда концентрация хлорида пота является промежуточной и/или менее двух болезнетворных мутаций CFTR . Физиологические анализы CFTR (разность носовых потенциалов, измерение кишечного тока) были включены в диагностический алгоритм, но не всегда легко доступны или осуществимы (например, у младенцев). Ректальные органоиды представляют собой 3D-структуры, которые растут из стволовых клеток, выделенных из крипт ректальной биопсии при культивировании в определенных условиях. Органоиды у субъектов, не страдающих CF, имеют круглую форму и заполненный жидкостью просвет, поскольку Опосредованный CFTR транспорт хлоридов приводит воду в просвет. Органоиды с дефектной функцией CFTR не набухают, сохраняя неправильную форму и не имея видимого просвета. Различия в морфологии между органоидами МВ и без МВ количественно определены в «Анализе морфологии ректальных органоидов» (ROMA) в качестве нового физиологического анализа CFTR. Для анализа ROMA органоиды покрываются 96-луночными пластинами, окрашиваются кальцеином и визуализируются в конфокальном микроскопе. Морфологические различия количественно оцениваются с использованием двух индексов: индекс циркулярности (CI) количественно определяет округлость органоидов, а коэффициент интенсивности (IR) является мерой наличия центрального просвета. Органоиды, не относящиеся к CF, имеют высокий CI и низкий IR по сравнению с органоидами CF. Индексы ROMA идеально различали 167 субъектов с муковисцидозом из 22 субъектов без муковисцидоза, что делает ROMA привлекательным физиологическим анализом CFTR, помогающим в диагностике муковисцидоза. Ректальные биопсии могут регулярно выполняться в любом возрасте в большинстве больниц, а ткани могут быть отправлены в центральную лабораторию для культуры органоидов и ROMA. В будущем ROMA может также применяться для проверки эффективности модуляторов CFTR in vitro. Цель настоящего доклада состоит в том, чтобы полностью разъяснить методы, используемые для РОМА, с тем чтобы можно было воспроизвести их в других лабораториях.
Введение
Муковисцидоз (CF) является аутосомно-рецессивным заболеванием, вызванным мутациями в гене трансмембранного регулятора проводимости CF (CFTR). Белок CFTR представляет собой хлоридно-бикарбонатный канал, обеспечивающий гидратацию нескольких эпителий1. Муковисцидоз является тяжелым, укорачивающим жизнь, многосистемным заболеванием, проявляющимся в первую очередь как респираторное заболевание, но также поражающим желудочно-кишечный тракт, поджелудочную железу, печень и репродуктивный тракт2.
Болезнетворные мутации CFTR приводят к уменьшению количества или функции CFTR, что, в свою очередь, вызывает обезвоживание слизи. Более 2000 вариантов гена CFTR были описаны3, из которых только 466 были тщательно охарактеризованы4.
Диагноз МВ может быть поставлен, когда концентрация хлорида пота (SCC) выше порога 60 ммоль/л или когда выявлены две болезнетворные мутации CFTR (согласно базе данных CFTR2) 4,5. У субъектов с только промежуточным повышенным (30-60 ммоль /л) SCC, который встречается примерно в 4%-5% тестов пота6, и мутациями CFTR с различными или неизвестными клиническими последствиями, диагноз не может быть подтвержден или исключен, даже если у них есть симптомы, совместимые с муковисцидозом, или положительный неонатальный скрининг-тест. Для этих случаев в диагностический алгоритм были включены физиологические анализы CFTR второй линии (разность носовых потенциалов (NPD) и измерения кишечного тока (ICM)). Эти тесты недоступны в большинстве центров и не возможны во всех возрастах, особенно у младенцев5 лет.
Ректальные органоиды представляют собой 3D-структуры, выращенные из lgr5(+) взрослых кишечных стволовых клеток из кишечных крипт, полученных путем ректальной биопсии7. Органоиды все чаще используются в биомедицинских исследованиях, таких как тестирование модуляторного лечения приCF 8. Жизнеспособная биопсия может быть получена либо путем отсасывания, либо путем щипцовой биопсии, процедуры, которая вызывает только минимальный дискомфорт и безопасна даже у младенцев, с низкой частотой осложнений9. Крипты, выделенные из ректальных биопсий, обогащаются стволовыми клетками, и при определенных условиях культивирования они самоорганизуются в ректальные органоиды. Морфология этих органоидов определяется экспрессией и функцией CFTR, расположенного на апикальной мембране эпителиальных клеток. Функциональный CFTR позволяет хлориду и воде проникать в органоидный просвет, тем самым вызывая отек органоидов, не относящихся к CF. Органоиды cf не набухают и не имеют видимого просвета10,11.
Анализ морфологии ректальных органоидов (ROMA) позволяет различать органоиды CF и без CF на основе этих различий в морфологии органоидов. Органоиды, не относящиеся к МУКовисцидозу, более круглые и имеют видимый просвет, в то время как для органоидов муковисцидоза верно обратное. Для этого анализа органоиды, специфичные для пациента, покрываются в 32 лунках 96-луночной пластины. После 1 дня роста органоиды окрашиваются кальцеином зеленого цвета и визуализируются в конфокальный микроскоп. Органоиды без CF показывают более круглую форму и менее флуоресцентную центральную часть, так как просвет содержит жидкость, а пятна кальцеина только клетки. Эти различия в морфологии количественно оцениваются с использованием двух индексов ROMA: индекс циркулярности (CI) количественно определяет округлость органоидов, в то время как коэффициент интенсивности (IR) является мерой наличия или отсутствия центрального просвета. В этом отчете мы подробно описываем протокол для получения этих дискриминирующих индексов, чтобы обеспечить репликацию метода.
протокол
Для всех процедур, связанных с тканями человека, было получено одобрение Комитета по этике исследований UZ/KU Leuven (EC research). Все исследования проводились с информированного согласия и/или согласия родителей, представителей и/или пациентов.
ПРИМЕЧАНИЕ: Все процедуры, связанные с ректальной биопсией и органоидами, должны выполняться в ламинарном потоке, чтобы защитить исследователя от любой биологической опасности и свести к минимуму риск загрязнения культур. Как и для любой лабораторной процедуры, исследователи должны всегда носить лабораторные халаты, перчатки и защитные очки для манипулирования образцами.
1. Ректальная биопсия, выделение взрослых стволовых клеток из крипт и органоидная культура
- Для этой начальной части протокола, включая производство и использование сред, культуру органоидов, расщепление, расширение и замораживание для биобанкинга, следуйте двум ранее опубликованным протоколам 8,12.
- Короче говоря, необходимо предпринять следующие шаги:
- Возьмите три-четыре ректальные биопсии с помощью щипцов или всасывающего устройства и соберите в стерильный контейнер (например, микроцентрифужную трубку объемом 1,5 мл) со средой Ad-DF+++, как описано в протоколе, упомянутом выше.
- Транспортировка биопсии в центральную лабораторию на льду или при 4 °C. Транспортировка в другие центры возможна, и качество существенно не влияет даже тогда, когда транспортировка занимает до 48 ч. Если ожидается, что транспортировка займет более 6 ч, используйте коническую трубку объемом 15 мл с 6 мл среды Ad-DF+++ вместо трубки микроцентрифуги объемом 1,5 мл.
- Промывайте биопсию в холодном PBS до тех пор, пока супернатант не станет прозрачным, чтобы удалить мусор и неэпителиальные ткани, такие как жировая ткань.
- Инкубируйте биопсию с ЭДТА (конечная концентрация 10 мМ) для отделения крипт. Обложите крипты матрицей базальной мембраны. Добавляйте антибиотики широкого спектра действия (гентамицин 50 мкг/мл и ванкомицин 50 мкг/мл) в среду в первую неделю культивирования для предотвращения бактериального загрязнения.
- Когда крипты сдвинулись и закрылись и размножились, выполните механическое расщепление, обычно через 7 дней.
- Расщепляйте полученные органоиды примерно каждые 7 дней. Таким образом, расширьте культуру, заморозьте резервные образцы в биобанке или используйте органоиды для анализов.
2. Органоидное покрытие для ROMA (день 1)
- Механически расщепляет органоиды для нанесения покрытий
- Соберите органоиды из трех хорошо выращенных колодцев из 24-луночной пластины, промыв дважды холодной средой Ad-DF+++, соберите их в микроцентрифужную трубку объемом 1,5 мл и оцените их под микроскопом12.
- Убедитесь, что органоиды жизнеспособны и высокого качества, что обычно может быть достигнуто через 5-7 дней роста после предварительного разделения (рисунок 1).
- Механически расщепляет органоиды согласно вышеупомянутому протоколу 8,12. Повторяйте до тех пор, пока большинство органоидов, оцененных с помощью микроскопа Brightfield, не станут достаточно маленькими по сравнению с первоначальным наблюдением.
- Соберите более мелкие органоиды, обычно соответствующие сбору около верхних 4/5 раствора органоидно-среды в новую микроцентрифужную трубку, так как большие органоиды опускаются на дно трубки из-за гравитации, а мелкие органоиды остаются подвешенными в верхней части среднего столба.
- Центрифугируют образец более мелких органоидов при 0,3 х 1000 г в течение 2 мин и отбрасывают среду.
- Разбавляют гранулы более мелких органоидов в 130 мкл 40%-50% базальной мембранной матрицы (разбавляют средой Ad-DF+++12).
- Хорошо суспендировать с помощью микропипетки объемом 200 мкл.
- Пластинчатые органоиды в 96-луночной пластине
- Используя пипетку объемом 20 мкл, пластинчатые органоиды в 32 лунках предварительно нагретой 96-луночной пластины. Убедитесь, что каждая лунка содержит одну каплю 4 мкл органоидно-матричного раствора, полученного на предыдущей стадии.
- Органоиды в растворе, как правило, образуют гранулу на дне трубки из-за гравитационно-зависимого смещения вниз. Чтобы предотвратить это и обеспечить равномерное покрытие, регулярно повторно суспендируйте органоидно-матричный раствор с использованием микропипетты 200 мкл (например, каждый раз после покрытия четырех-восьми лунок).
- Пластина каждой капли в центре скважины, чтобы капля не стекала к краям скважины, что позже снизит качество изображения.
- Стремитесь к тому, чтобы на лунку приходилось около 30 органоидов (минимум 15, максимум 90) без перекрытия органоидов.
- Имейте в виду, что эти органоиды должны быть инкубированы в течение ночи и будут немного расти в течение этого времени, и могут начать перекрываться, если плотность покрытия слишком высока.
- Проверьте плотность покрытия с помощью микроскопа с ярким полем с объективом с 5-кратным увеличением после покрытия первых одной или двух скважин.
- Если плотность покрытия слишком высока, разбавляют органоидно-матричный раствор поэтапно с добавлением матрицы базальной мембраны до достижения желаемой плотности покрытия (рис. 2).
- После нанесения покрытия осторожно постучите пластиной по плоской поверхности, чтобы убедиться, что большинство органоидов находятся в одной фокальной плоскости.
- Инкубация пластины
- Инкубируйте 96-луночную пластину при 37 °C и 5% CO2 в течение 8-10 мин, чтобы обеспечить гелеобразование матрицы базальной мембраны.
- Добавьте 50 мкл органоидной среды толстой кишки человека +/+12 в каждую лунку и инкубируйте в течение 16-24 ч.
- Не добавляйте ни форсколин, ни модуляторы CFTR, поэтому органоиды растут в базальных условиях.
3. Органоидная визуализация с помощью конфокальной микроскопии (день 2)
- Окрашивание органоидов кальцеином зеленого цвета
- Приготовьте 1 мМ запасного раствора зеленого кальцеина, добавив 50 мкл диметилсульфоксида (ДМСО) в один флакон, содержащий 50 мкг зеленого кальцеина.
- Готовят рабочий раствор кальциина зеленого путем добавления 1,2 мкл запасного раствора к 200 мкл Ad-DF+++ (концентрация 6 мкМ).
- Добавьте 5 мкл этой смеси кальцеина в каждую лунку 96-луночной пластины, в которой были покрыты органоиды (конечная концентрация кальциина 0,6 мкМ). Не трогайте и не вывихните матрицу падения внутри колодца при выполнении этого шага.
- Поверните и слегка наклоните пластину с крышкой на несколько раз, чтобы обеспечить равномерное распределение зеленого кальцеина во всей лунке.
- Снова инкубируйте пластину в течение 15-30 мин при 37 °C и 5% CO2 для обеспечения окрашивания всех органоидов в лунках.
- Перенесите пластину в конфокальный микроскоп
- Перенесите пластину в конфокальный микроскоп с автоматизированной ступенью и встроенным инкубатором. Убедитесь, что пластина хорошо закреплена в держателе пластины.
- Инкубация при 37 °C и 5% CO2 является необязательной, но не обязательной, учитывая короткую продолжительность (около 10 мин) процесса визуализации.
- Фокус на органоидах (рисунок 3)
- Используя конфокальный микроскоп, вручную определите оптимальное положение x/y и фокус (z положение) органоидов в каждой скважине и сохраните эти положения в программном обеспечении для визуализации.
- Наилучший фокус подразумевает максимально четкое разграничение органоидов и визуализацию максимально возможной части органоидной капли. Если распределение пятна недостаточно, повторите шаги 3.1.4 и 3.1.5 (инкубируйте, например, в течение дополнительных 5-10 минут).
- Используйте настройки визуализации живых клеток с излучением при 488 нм и возбуждением при 515 нм (специфичными для визуализации флуоресценции кальциина) и объективом увеличения 5x LD.
- Получите органоидные снимки 32 скважин с помощью конфокального микроскопа (рисунок 3 и рисунок 4).
- Делайте снимки в одном направлении с разрешением 1024 x 1024 пикселя (размер пикселя 2,5 мкм x 2,5 мкм) и глубиной 16 бит.
- Выберите интенсивность лазера и коэффициент усиления для оптимальной визуализации морфологических различий между органоидами CF и non-CF (например, различение между неокрашенным заполненным водой центральным просветом (если он присутствует) и окрашенной клеточной границей).
ПРИМЕЧАНИЕ: Органоиды не будут правильно очерчены, когда главный коэффициент усиления и, следовательно, сигнал флуоресценции слишком низкий; Слишком высокий коэффициент усиления мастера приведет к получению изображений с органоидами с однородной очень высокой интенсивностью сигнала, что предотвратит визуализацию более тонких морфологических различий (рисунок 2). - Сохраните по одному снимку на скважину для всех 32 скважин в формате микроскопа и экспортируйте их в виде файлов TIFF.
4. Анализ изображений (рисунок 5)
- Загрузите файлы TIFF в программы для анализа изображений.
- Выполните первую проверку качества на основе критериев исключения, определенных оператором (рисунок 2): много дифференцированных или мертвых структур или обломков, неадекватная плотность покрытия, слишком много (например, перекрытие) или слишком мало органоидов и неадекватное распределение флуоресценции (органоиды не четко очерчены, фоновый сигнал слишком высок).
ПРИМЕЧАНИЕ: Этот шаг также может быть выполнен перед экспортом изображений в виде файлов TIFF на шаге 3.4. - Подготовка изображений к анализу
- Повторная калибровка изображений, таким образом, 1 пиксель соответствует 2,5 мкм х 2,5 мкм.
- Создайте и откройте один сетевой данный (. ND) файл всех 32 изображений для каждой органоидной культуры, позволяющий одновременно анализировать все 32 изображения на субъект.
- Очертите органоиды
- Разграничить структуры, используя более низкий порог интенсивности 4 500 и верхний порог 65 535 (функции Smooth and Clean выключены; Функция заполнения отверстий включена; Отдельная функция при x3).
ПРИМЕЧАНИЕ: Это очерчивает флуоресцентные структуры, с заполняющими отверстиями , включая просвет в очерченной структуре, если он присутствует.
- Разграничить структуры, используя более низкий порог интенсивности 4 500 и верхний порог 65 535 (функции Smooth and Clean выключены; Функция заполнения отверстий включена; Отдельная функция при x3).
- Подсчет органоидов
- Выберите все конструкции ≥40 мкм.
- Нажмите кнопку Обновить измерение ND (каждый раз, когда требуется измерение); подсчитанные органоиды будут пронумерованы.
ПРИМЕЧАНИЕ: Это равно общему количеству органоидов в 32 скважинах, в то время как мелкий мусор, такой как мертвые клетки, исключается.
- Измерение интенсивности и цикличности для расчета индексов
- Выберите все структуры ≥60 мкм и подсчитайте.
ПРИМЕЧАНИЕ: Это учитывает органоиды, достаточно большие, чтобы показать морфологию, типичную для CF или без CF. Органоиды >40 мкм и <60 мкм малы и плотны, как при немозовом, так и при МВ. - Удалите все структуры, касающиеся границ рисунка. Сделайте это, чтобы удалить органоиды, которые не видны полностью, так как их морфология не может быть точно количественно определена.
- Эрозия 1 пикселя (= 2,5 мкм) от границы каждой структуры ≥60 мкм. Это удаляет ореол диффузной флуоресценции кальцеина, окружающей органоиды.
- Измерьте среднюю интенсивность каждой структуры. Таким образом, измеряется средняя флуоресценция органоидов.
- Снова выберите все структуры ≥60 мкм и удалите все структуры, касающиеся границ.
- Эрозия 10 пикселей (= 25 мкм) от границы каждой структуры ≥60 мкм.
ПРИМЕЧАНИЕ: В органоидах без CF это разрушает клеточную границу и оставляет только просвет. В органоидах CF это разрушает внешнюю часть органоида, которая имеет примерно ту же флуоресценцию, что и внутренняя часть, которая остается. - Измерьте среднюю интенсивность каждой эродированной структуры. Таким образом измеряется средняя флуоресценция центральной части органоидов.
- Измерьте цикличность каждой структуры. Это соответствует средней циркулярности органоидов.
- Выберите все структуры ≥60 мкм и подсчитайте.
- Выполните вторую проверку качества: критерии исключения, определенные программным обеспечением. Исключите набор изображений, когда менее 50% органоидов (определяемых как структуры ≥40 мкм) составляют ≥60 мкм, так как достаточно органоидов должно быть достаточно большим, чтобы показать морфологию, типичную для CF или без CF. Также исключить, когда <500 или >3000 органоидов (определяемых как структуры ≥40 мкм) присутствуют в 32 скважинах.
5. Измерение показателей в программном обеспечении для визуализации (рисунок 6)
- Измерьте индекс циркулярности (CI).
ПРИМЕЧАНИЕ: Это соответствует средней цикличности, измеренной на этапе 4.6, которая представляет собой среднюю циркулярность всех органоидов во всех 32 скважинах. CI количественно определяет округлость органоидов, определяемую как , которая ниже при муковисцидозе, чем у органоидов без МВ
, которая ниже при муковисцидозе, чем у органоидов без МВ - Измерение коэффициента интенсивности (ИК)
- Рассчитайте ИК, разделив среднее значение измерения интенсивности после эрозии на 25 мкм от границы каждой структуры ≥60 мкм на среднее значение измерения интенсивности после эрозии 2,5 мкм от границы каждой структуры ≥60 мкм.
ПРИМЕЧАНИЕ: ИК измеряет наличие или отсутствие центрального просвета. ИК равен , и выше при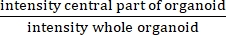 муковисцидозе, чем у органоидов без МВ.
муковисцидозе, чем у органоидов без МВ.
- Рассчитайте ИК, разделив среднее значение измерения интенсивности после эрозии на 25 мкм от границы каждой структуры ≥60 мкм на среднее значение измерения интенсивности после эрозии 2,5 мкм от границы каждой структуры ≥60 мкм.
- Упрощение процесса анализа
- Подготовьте стандартный рабочий лист с помощью программного обеспечения для электронных таблиц для автоматического расчета этих индексов при копировании данных (рисунок 7).
- Чтобы рассчитать IR:
- Возьмем измерение интенсивности после эрозии на 2,5 мкм от границы каждой структуры ≥60 мкм. Используйте среднее для расчета (знаменатель).
- Возьмите измерение интенсивности после эрозии на 25 мкм от границы каждой структуры ≥60 мкм. Используйте среднее для вычисления (числитель).
- Чтобы рассчитать ДИ, возьмем круговорот всех органоидов во всех скважинах. Среднее значение соответствует КИ.
ПРИМЕЧАНИЕ: Когда требуется анализ больших партий изображений, процесс анализа изображений, как описано в разделе 4, может быть полуавтоматизированным, начиная с калиброванных файлов ND и запуская макрос со всеми объединенными шагами.
Результаты
Органоиды у 212 испытуемых были собраны во время обычных клинических посещений. Никаких побочных эффектов не произошло во время или после процедуры биопсии прямой кишки. Органоиды были изображены одним исследователем, слепым к предметным характеристикам, таким как генотип и клиническа...
Обсуждение
Мы предоставляем подробный протокол анализа морфологии ректальных органоидов (ROMA). Два индекса, рассчитанные с помощью ROMA, IR и CI, отличали органоиды от субъектов с муковисцидозом от тех, у кого не было МУКовисцидоза, с идеальной точностью. Таким образом, ROMA может функционировать как новы...
Раскрытие информации
Это исследование финансировалось Бельгийской ассоциацией пациентов с муковисцидозом «Mucovereniging/Association Muco», исследовательским грантом Бельгийского общества педиатрии BVK-SBP 2019 и грантом Фонда трансляционных биомедицинских исследований UZ Leuven. Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы благодарим пациентов и родителей, которые участвовали в этом исследовании. Мы благодарим Abida Bibi за всю работу по культивированию органоидов. Мы благодарим Эльса Эртгертса, Каролин Брунель, Клэр Коллард, Лилиан Коллиньон, Моник Дельфосс, Аню Дельпорт, Натали Фейертс, Сесиль Ламбремон, Лют Ньювборг, Натали Петерс, Энн Раман, Пима Сансена, Хильду Стивенс, Марианну Шульте, Элса Ван Рансбека, Кристель Ван де Бранде, Грет Ван ден Эйнде, Марлин Вандеркеркен, Инге Ван Дейк, Одри Вагенер, Монику Васкевич и Бернарда Вендерикса за материально-техническую поддержку. Мы также благодарим Mucovereniging/Association Muco, и в частности Стефана Йориса и д-ра Яна Ванлеуве, за их поддержку и финансирование. Мы благодарим всех сотрудников Бельгийского органоидного проекта: Хедвиг Боболи (CHR Citadelle, Льеж, Бельгия), Линду Буланже (Университетские больницы Лёвена, Бельгия), Жоржа Казимира (HUDERF, Брюссель, Бельгия), Бенедикта Де Мейера (Университетская клиника Гента, Бельгия), Эльке Де Вахтер (Университетская клиника Брюсселя, Бельгия), Дэнни Де Лооза (Университетская клиника Гента, Бельгия), Изабель Этьен (CHU Erasme, Брюссель, Бельгия), Лоуренса Ханссенса (HUDERF, Брюссель), Кристиан Кнуп (CHU Erasme, Брюссель, Бельгия), Моник Лекен (Университетская клиника Антверпена, Бельгия), Вики Нове (GZA St. Vincentius Hospital Antwerp), Дирк Штаессен (GZA St. Vincentius Hospital Antwerp), Стефани Ван Бирвлиет (Университетская клиника Гента, Бельгия), Ева Ван Брекель (Университетская клиника Гента, Бельгия), Ким Ван Хуренбек (Университетская клиника Антверпена, Бельгия), Эф Вандерхельст (Университетская клиника Брюсселя, Бельгия), Стейн Верхульст (Университетская клиника Антверпена, Бельгия), Стефани Винкен (Университетская клиника Брюсселя, Бельгия).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
Ссылки
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены