Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Rektal Organoid Morfoloji Analizi (ROMA): Kistik Fibroziste Tanısal Bir Tahlil
Bu Makalede
Özet
Bu protokol, kistik fibroz (KF) için yeni bir tanısal test olan rektal organoid morfoloji analizini (ROMA) tanımlamaktadır. Morfolojik özellikler, yani yuvarlaklık (dairesellik indeksi, CI) ve bir lümenin varlığı (yoğunluk oranı, IR), CFTR fonksiyonunun bir ölçüsüdür. 189 deneğin analizi, CF ve CF olmayan arasında mükemmel bir ayrım olduğunu göstermiştir.
Özet
Kistik fibrozis (KF) tanısı her zaman kolay değildir, özellikle ter klorür konsantrasyonu orta ve / veya ikiden az hastalığa neden olan CFTR mutasyonları tanımlanabilir. Fizyolojik CFTR testleri (nazal potansiyel fark, bağırsak akımı ölçümü) tanı algoritmasına dahil edilmiştir, ancak her zaman hazır veya uygulanabilir değildir (örneğin, bebeklerde). Rektal organoidler, belirli koşullar altında kültürlendiğinde rektal biyopsi kriptlerinden izole edilen kök hücrelerden büyüyen 3D yapılardır. CF olmayan deneklerden gelen organoidler yuvarlak bir şekle ve sıvı dolu bir lümene sahiptir, çünkü CFTR aracılı klorür taşınması suyu lümene yönlendirir. Kusurlu CFTR fonksiyonuna sahip organoidler şişmez, düzensiz bir şekil alır ve görünür lümeni yoktur. KF ve KF olmayan organoidler arasındaki morfolojideki farklılıklar, yeni bir CFTR fizyolojik testi olarak 'Rektal Organoid Morfoloji Analizi'nde (ROMA) ölçülmüştür. ROMA testi için, organoidler 96 delikli plakalar halinde kaplanır, kalsein ile boyanır ve konfokal mikroskopta görüntülenir. Morfolojik farklılıklar iki indeks kullanılarak ölçülür: Dairesellik indeksi (CI) organoidlerin yuvarlaklığını ölçer ve yoğunluk oranı (IR) merkezi bir lümenin varlığının bir ölçüsüdür. CF olmayan organoidler, CF organoidlerine kıyasla yüksek CI ve düşük IR'ye sahiptir. ROMA indeksleri, CF'siz 22 denekten KF'li 167 deneği mükemmel bir şekilde ayırt etti ve ROMA'yı KF tanısına yardımcı olmak için çekici bir fizyolojik CFTR testi haline getirdi. Rektal biyopsiler çoğu hastanede her yaşta rutin olarak yapılabilir ve doku organoid kültür ve ROMA için merkezi bir laboratuvara gönderilebilir. Gelecekte, ROMA in vitro CFTR modülatörlerinin etkinliğini test etmek için de uygulanabilir. Bu raporun amacı, ROMA için kullanılan yöntemleri tam olarak açıklamak ve diğer laboratuvarlarda replikasyona izin vermektir.
Giriş
Kistik fibroz (KF), KF transmembran iletkenlik regülatörü (KFTR) genindeki mutasyonların neden olduğu otozomal resesif geçişli bir hastalıktır. CFTR proteini, birkaç epitel1'in hidrasyonunu sağlayan bir klorür ve bikarbonat kanalıdır. KF, öncelikle solunum yolu hastalığı olarak kendini gösteren, aynı zamanda gastrointestinal sistemi, pankreası, karaciğeri ve üreme sistemini de etkileyen, yüksek yüklü, yaşamı kısaltan, çok sistemli bir hastalıktır2.
Hastalığa neden olan CFTR mutasyonları, CFTR'nin miktarında veya fonksiyonunda bir azalmaya yol açar ve bu da mukus dehidrasyonuna neden olur. CFTR genindeki 2.000'den fazla varyant3 olarak tanımlanmıştır, bunlardan sadece 466'sı 4iyice karakterize edilmiştir.
CF tanısı, ter klorür konsantrasyonu (SCC) 60 mmol / L eşiğinin üzerinde olduğunda veya hastalığa neden olan iki CFTR mutasyonu (CFTR2 veritabanına göre) 4,5 tanımlandığında yapılabilir. Ter testlerinin yaklaşık% 4-5'inde ortaya çıkan sadece orta derecede yüksek (30-60 mmol / L) SCC'si olan deneklerde6 ve değişen veya bilinmeyen klinik sonuçlara sahip CFTR mutasyonlarında, KF uyumlu semptomları veya pozitif bir yenidoğan tarama testi olsa bile, tanı doğrulanamaz veya dışlanamaz. Bu olgular için ikinci basamak fizyolojik KFTR testleri (nazal potansiyel fark (NPD) ve intestinal akım ölçümleri (ICM)) tanı algoritmasına dahil edilmiştir. Bu testler çoğu merkezde hazır değildir ve her yaşta, özellikle de bebeklerde5.
Rektal organoidler, rektal biyopsi ile elde edilen bağırsak kriptlerinden Lgr5(+) erişkin bağırsak kök hücrelerinden yetiştirilen 3D yapılardır7. Organoidler, CF8'de modülatör tedavisinin test edilmesi gibi biyomedikal araştırmalarda giderek daha fazla kullanılmaktadır. Uygulanabilir bir biyopsi, emme veya forseps biyopsisi ile elde edilebilir, bu prosedür sadece minimum rahatsızlığa neden olur ve bebeklerde bile güvenlidir, düşük komplikasyon oranları9. Rektal biyopsilerden izole edilen kriptler kök hücrelerle zenginleştirilir ve spesifik kültürleme koşulları altında, bunlar rektal organoidler halinde kendi kendini organize eder. Bu organoidlerin morfolojisi, epitel hücrelerinin apikal zarında bulunan CFTR'nin ekspresyonu ve işlevi ile belirlenir. Fonksiyonel CFTR, klorür ve suyun organoid lümene girmesine izin verir, böylece CF olmayan organoidlerin şişmesine neden olur. CF organoidleri şişmez ve görünür lümen 10,11'e sahip değildir.
Rektal organoid morfoloji analizi (ROMA), organoid morfolojisindeki bu farklılıklara dayanarak KF ve KF dışı organoidler arasında ayrım yapılmasına olanak sağlar. CF olmayan organoidler daha yuvarlaktır ve görünür bir lümene sahipken, bunun tersi CF organoidleri için geçerlidir. Bu analiz için, hastaya özgü organoidler, 96 kuyucuklu bir plakanın 32 kuyusuna kaplanır. 1 günlük büyümeden sonra, organoidler kalsein yeşili ile boyanır ve konfokal bir mikroskopta görüntülenir. CF olmayan organoidler daha dairesel bir şekil ve daha az floresan bir orta kısım gösterir, çünkü lümen sıvı içerir ve kalsein sadece hücreleri boyar. Morfolojideki bu farklılıklar iki ROMA indeksi kullanılarak ölçülür: dairesellik indeksi (CI) organoidlerin yuvarlaklığını ölçerken, yoğunluk oranı (IR) merkezi bir lümenin varlığının veya yokluğunun bir ölçüsüdür. Bu raporda, tekniğin çoğaltılmasına izin vermek için bu ayrımcı indeksleri elde etmek için protokolü ayrıntılı olarak açıklayacağız.
Protokol
İnsan dokusunu içeren tüm prosedürler için Etik Kurul Araştırma UZ/KU Leuven (EC araştırması) tarafından onay alınmıştır. Tüm araştırmalar bilgilendirilmiş onam ve / veya ebeveynlerin, temsilcilerin ve / veya hastaların onayı ile gerçekleştirilmiştir.
NOT: Rektal biyopsileri ve organoidleri içeren tüm prosedürler, araştırmacıyı herhangi bir biyolojik tehlikeden korumak ve kültürlerin kontaminasyon riskini en aza indirmek için laminer bir akışta yapılmalıdır. Herhangi bir laboratuvar prosedürüne gelince, araştırmacılar numuneleri manipüle etmek için her zaman laboratuvar önlüğü, eldiven ve güvenlik gözlüğü giymelidir.
1. Rektal biyopsi, yetişkin kök hücrelerin kriptlerden izolasyonu ve organoid kültür
- Medya üretimi ve kullanımı, organoid kültürü, biyobankacılık için bölme, genişleme ve dondurma dahil olmak üzere protokolün bu ilk kısmı için, daha önce yayınlanmış iki protokolüizleyin 8,12.
- Kısacası, aşağıdaki adımların atılması gerekir:
- Forseps veya emme cihazı ile üç ila dört rektal biyopsi alın ve yukarıda belirtilen protokolde açıklandığı gibi Ad-DF + ++ ortamı ile steril bir kapta (örneğin, 1.5 mL mikrosantrifüj tüpü) toplayın.
- Biyopsileri buz üzerinde veya 4 ° C'de merkezi bir laboratuvara taşıyın. Diğer merkezlere ulaşım mümkündür ve nakliye 48 saate kadar sürdüğünde bile kalite önemli ölçüde etkilenmez. Taşımanın 6 saatten fazla sürmesi bekleniyorsa, 1,5 mL mikrosantrifüj tüpü yerine 6 mL Ad-DF + ++ ortamına sahip 15 mL'lik bir konik tüp kullanın.
- Biyopsileri, enkazı ve yağ dokusu gibi epitel olmayan dokuları çıkarmak için süpernatant temizlenene kadar soğuk PBS'de yıkayın.
- Kriptoları ayırmak için biyopsileri EDTA (son konsantrasyon 10 mM) ile inkübe edin. Kriptleri bir bazal membran matrisine yerleştirin. Bakteriyel kontaminasyonu önlemek için kültürlemenin ilk haftasında ortama geniş spektrumlu antibiyotikler (gentamisin 50 μg / mL ve vankomisin 50 μg / mL) ekleyin.
- Kriptolar tomurcuklandığında ve kapatılıp çoğaldığında, genellikle 7 gün sonra mekanik bölünme gerçekleştirin.
- Elde edilen organoidleri yaklaşık her 7 günde bir bölün. Bu şekilde, kültürü genişletin, yedek örnekleri bir biyobankada dondurun veya organlar tahliller için kullanın.
2. ROMA için organoid kaplama (1. gün)
- Kaplama için organoidleri mekanik olarak ayırın
- Soğuk Ad-DF + ++ ortamı ile iki kez yıkayarak 24 kuyucuklu bir plakadan üç iyi büyümüş kuyudan organoidleri toplayın, 1,5 mL'lik bir mikrosantrifüj tüpünde toplayın ve mikroskop altında değerlendirin12.
- Organoidlerin canlı ve yüksek kalitede olduğundan emin olun, bu genellikle daha önce bölündükten sonra 5-7 günlük büyümeden sonra elde edilebilir (Şekil 1).
- Organoidleri yukarıda belirtilen protokol 8,12'ye göre mekanik olarak bölün. Organoidlerin çoğunluğu, parlak alan mikroskobu kullanılarak değerlendirildiği gibi, ilk gözleme kıyasla yeterince küçük olana kadar tekrarlayın.
- Genellikle organoid-orta çözeltinin üst 4 / 5'inin yeni bir mikrosantrifüj tüpünde toplanmasına karşılık gelen daha küçük organoidleri toplayın, çünkü büyük organoidler yerçekimi nedeniyle tüpün dibine batar ve küçük organoidler orta sütunun üst kısmında asılı kalır.
- Daha küçük organoidlerin numunesini 2 dakika boyunca 0,3 x 1000 g'da santrifüj edin ve ortamı atın.
- Daha küçük organoidlerin peletini %40-%50 bazal membran matrisinin 130 μL'sinde seyreltin (Ad-DF+++ medium12 ile seyreltilir).
- 200 μL mikropipet kullanarak iyice askıya alın.
- Organoidleri 96 delikli bir plakaya yerleştirin
- 20 μL'lik bir pipet kullanarak, önceden ısıtılmış 96 delikli bir plakanın 32 kuyusunda organ organoidleri bulunur. Her bir kuyucuğun, önceki adımda üretilen organoid-matris çözeltisinin bir 4 μL damlasını içerdiğinden emin olun.
- Çözeltideki organoidler, yerçekimine bağlı aşağı doğru yer değiştirmesi nedeniyle tüpün dibinde bir pelet oluşturma eğilimindedir. Bunu önlemek ve düzgün bir kaplama sağlamak için, organoid-matris çözeltisini 200 μL'lik bir mikropipet kullanarak düzenli olarak yeniden askıya alın (örneğin, dört ila sekiz kuyucuğu kapladıktan sonra her seferinde).
- Damlanın kuyunun kenarlarına doğru akmasını önlemek için her damlayı kuyunun ortasına yerleştirin, bu da daha sonra görüntü kalitesini düşürür.
- Üst üste binen organoidler olmadan kuyu başına yaklaşık 30 organoid (minimum 15, maksimum 90) hedefleyin.
- Bu organoidlerin gece boyunca inkübe edilmesi gerekeceğini ve bu süre zarfında hafifçe büyüyeceğini ve kaplama yoğunluğu çok yüksekse üst üste binmeye başlayabileceğini unutmayın.
- İlk bir veya iki kuyuyu kapladıktan sonra 5x büyütme hedefine sahip bir parlak alan mikroskobu kullanarak kaplama yoğunluğunu kontrol edin.
- Kaplama yoğunluğu çok yüksekse, istenen kaplama yoğunluğuna ulaşılana kadar bazal membran matrisinin eklenmesiyle organoid-matris çözeltisini kademeli olarak seyreltin (Şekil 2).
- Kaplamadan sonra, organoidlerin çoğunun aynı odak düzleminde olduğundan emin olmak için plakayı düz bir yüzeye hafifçe dokunun.
- Plakayı inkübe edin
- Bodrum membran matrisinin jelleşmesine izin vermek için 96 delikli plakayı 37 ° C'de ve 8-10 dakika boyunca% 5 CO2'de inkübe edin.
- Her bir kuyucuğa 50 μL insan kolon organoid ortamı +/+12 ekleyin ve 16-24 saat boyunca gece boyunca inkübe edin.
- Forskolin veya CFTR modülatörleri eklemeyin, böylece organoidler bazal koşullar altında büyür.
3. Konfokal mikroskopi kullanarak organoid görüntüleme (2. gün)
- Kalsein yeşili ile organoidleri lekeleyin
- 50 μg kalsein yeşili içeren bir şişeye 50 μL dimetilsülfoksit (DMSO) ekleyerek 1 mM'lik bir kalsein yeşili stok çözeltisi hazırlayın.
- 200 μL Ad-DF+++'a (konsantrasyon 6 μM) 1.2 μL stok çözeltisi ekleyerek çalışan bir kalsein yeşili çözeltisi hazırlayın.
- Bu kalsein karışımından 5 μL'yi, organoidlerin kaplandığı 96 delikli plakanın her bir kuyucuğuna ekleyin (son kalsein konsantrasyonu 0.6 μM). Bu adımı gerçekleştirirken kuyunun içindeki matris damlasına dokunmayın ve yerinden çıkarmayın.
- Kalsein yeşilinin tüm kuyucukta homojen dağılımını sağlamak için plakayı kapakla birkaç kez döndürün ve hafifçe eğin.
- Kuyucuklardaki tüm organoidlerin lekelenmesini sağlamak için plakayı 37 ° C'de 15-30 dakika ve% 5 CO2'de tekrar inkübe edin.
- Plakayı konfokal mikroskopa aktarın
- Plakayı otomatik bir aşama ve entegre inkübatör ile konfokal mikroskopa aktarın. Plakanın plaka tutucusuna iyi sabitlendiğinden emin olun.
- 37 °C ve %5 CO2'de inkübasyon isteğe bağlıdır, ancak görüntüleme işleminin kısa süresi (yaklaşık 10 dakika) göz önüne alındığında gerekli değildir.
- Organoidlere odaklanma (Şekil 3)
- Konfokal mikroskopu kullanarak, her bir kuyucuktaki organoidlerin optimal x/y pozisyonunu ve odağını (z pozisyonu) manuel olarak belirleyin ve bu pozisyonları görüntüleme yazılımına kaydedin.
- En iyi odak, organoidlerin mümkün olan en keskin şekilde tanımlanması ve organoid damlasının mümkün olan en büyük kısmının görselleştirilmesi anlamına gelir. Lekenin dağılımı yeterli değilse, 3.1.4 ve 3.1.5 adımlarını tekrarlayın (örneğin, fazladan 5-10 dakika boyunca inkübe edin).
- 488 nm'de emisyon ve 515 nm'de uyarma (kalsein floresansının görselleştirilmesi için özel) ve 5x LD büyütme hedefi ile canlı hücre görüntüleme ayarlarını kullanın.
- Konfokal mikroskop ile 32 kuyucuğun organoid resimlerini elde edin (Şekil 3 ve Şekil 4).
- 1024 piksel x 1024 piksel çözünürlük (piksel boyutu 2,5 μm x 2,5 μm) ve 16 bit derinlikle görüntüleri tek yönlü olarak çekin.
- CF ve CF olmayan organoidler arasındaki morfolojik farklılıkların optimal olarak görselleştirilmesi için lazer yoğunluğunu ve ana kazancını seçin (örneğin, lekesiz su dolu merkezi lümen (varsa) ile lekeli bir hücresel sınır arasındaki ayrım).
NOT: Ana kazanç ve dolayısıyla floresan sinyali çok düşük olduğunda organoidler doğru şekilde tanımlanmayacaktır; Master kazancın çok yüksek ayarlanması, homojen çok yüksek sinyal yoğunluğuna sahip organoidlerle görüntülerle sonuçlanacak ve daha ince morfolojik farklılıkların görüntülenmesini önleyecektir (Şekil 2). - Mikroskop formatında 32 kuyucuğun tümü için kuyucuk başına bir resim kaydedin ve bunları TIFF dosyaları olarak dışa aktarın.
4. Görüntü analizi (Şekil 5)
- TIFF dosyalarını görüntü analiz yazılımına yükleyin.
- Operatör tarafından belirlenen dışlama kriterlerine dayanarak ilk kalite kontrolünü gerçekleştirin (Şekil 2): birçok farklılaşmış veya ölü yapı veya döküntü, yetersiz kaplama yoğunluğu, çok fazla (örneğin, üst üste binen) veya çok az organoid ve yetersiz floresan dağılımı (organoidler açıkça tanımlanmamış, arka plan sinyali çok yüksek).
NOT: Bu adım, adım 3.4'te görüntüleri TIFF dosyaları olarak dışa aktarmadan önce de gerçekleştirilebilir. - Görüntüleri analiz için hazırlama
- 1 piksel 2,5 μm x 2,5 μm'ye karşılık gelecek şekilde görüntüleri yeniden kalibre edin.
- Bir Ağ Verileri oluşturun ve açın (. ND) her organoid kültür için 32 resmin tümünün dosyası, konu başına 32 resmin hepsinin eşzamanlı analizini sağlar.
- Organoidleri tanımlayın
- 4.500 düşük yoğunluk eşiği ve 65.535 üst eşik kullanarak yapıları tanımlayın (Pürüzsüz ve Temiz işlevleri kapalı; Dolgu Delikleri işlevi açık; x3'te ayrı işlev).
NOT: Bu, floresan yapıları, varsa tarif edilen yapıdaki lümen de dahil olmak üzere Dolgu Delikleri ile tanımlar.
- 4.500 düşük yoğunluk eşiği ve 65.535 üst eşik kullanarak yapıları tanımlayın (Pürüzsüz ve Temiz işlevleri kapalı; Dolgu Delikleri işlevi açık; x3'te ayrı işlev).
- Organoidleri sayın
- Tüm yapıları seçin ≥40 μm.
- ND Ölçümünü Güncelle düğmesini tıklayın (her ölçüm gerektiğinde); sayılan organoidler numaralandırılacaktır.
NOT: Bu, 32 kuyudaki toplam organoid sayısına eşittir, ölü hücreler gibi küçük döküntüler hariç tutulur.
- İndekslerin hesaplanması için yoğunluk ve döngüselliğin ölçülmesi
- Tüm yapıları ≥60 μm olarak seçin ve sayın.
NOT: Bu, CF veya CF olmayanlar için tipik morfolojiyi gösterecek kadar büyük organoidleri sayar. Organoidler >40 μm ve <60 μm, hem CF olmayan hem de CF'de küçük ve yoğundur. - Resmin kenarlıklarına dokunan tüm yapıları kaldırın. Bunu, morfolojileri doğru bir şekilde ölçülemediğinden, tamamen görünmeyen organoidleri çıkarmak için yapın.
- Her ≥60 μm yapının kenarlığından 1 piksel (= 2,5 μm) aşındırın. Bu, organoidleri çevreleyen dağınık kalsein floresan halesini ortadan kaldırır.
- Her yapının ortalama yoğunluğunu ölçün. Bu şekilde, organoidlerin ortalama floresansı ölçülür.
- Tüm yapıları ≥60 μm'yi tekrar seçin ve sınırlara temas eden tüm yapıları kaldırın.
- Her ≥60 μm yapının kenarlığından 10 piksel (= 25 μm) aşındırın.
NOT: CF olmayan organoidlerde, bu hücresel sınırı aşındırır ve sadece lümeni bırakır. CF organoidlerinde, bu, kalan iç kısımla kabaca aynı floresana sahip olan organoidin dış kısmını aşındırır. - Her aşınmış yapının ortalama yoğunluğunu ölçün. Bu şekilde, organoidlerin orta kısmının ortalama floresansı ölçülür.
- Her yapının daireselliğini ölçün. Bu, organoidlerin ortalama daireselliğine karşılık gelir.
- Tüm yapıları ≥60 μm olarak seçin ve sayın.
- İkinci kalite kontrolünü gerçekleştirin: yazılım tarafından belirlenen dışlama kriterleri. Organoidlerin% 50'sinden azı (yapılar ≥40 μm olarak tanımlanır) ≥60 μm olduğunda, yeterli organoidin CF veya CF olmayanlara özgü morfolojiyi gösterecek kadar büyük olması gerektiğinden, resim kümesini hariç tutun. Ayrıca, 32 kuyuda <500 veya >3.000 organoid (yapılar ≥40 μm olarak tanımlanır) bulunduğunda da hariç tutun.
5. Görüntüleme yazılımındaki indeksleri ölçün (Şekil 6)
- Dairesellik indeksini (CI) ölçün.
NOT: Bu, 32 kuyunun tamamındaki tüm organoidlerin ortalama daireselliği olan adım 4.6'da ölçülen ortalama daireselliğe karşılık gelir. CI, CF'de CF olmayan organoidlerden daha düşük olan organoidlerin yuvarlaklığını ölçer.
CF'de CF olmayan organoidlerden daha düşük olan organoidlerin yuvarlaklığını ölçer. - Yoğunluk oranını (IR) ölçme
- IR'yi, her ≥60 μm yapının sınırından 25 μm aşındırdıktan sonra yoğunluk ölçümünün ortalamasını, her ≥60 μm yapının sınırından 2,5 μm aşındırdıktan sonra yoğunluk ölçümünün ortalamasına bölerek hesaplayın.
NOT: IR, merkezi bir lümenin varlığını veya yokluğunu ölçer. IR, CF'ye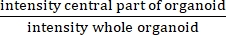 eşittir ve CF'de CF olmayan organoidlerden daha yüksektir.
eşittir ve CF'de CF olmayan organoidlerden daha yüksektir.
- IR'yi, her ≥60 μm yapının sınırından 25 μm aşındırdıktan sonra yoğunluk ölçümünün ortalamasını, her ≥60 μm yapının sınırından 2,5 μm aşındırdıktan sonra yoğunluk ölçümünün ortalamasına bölerek hesaplayın.
- Analiz sürecini basitleştirin
- Verileri kopyaladıktan sonra bu endeksleri otomatik olarak hesaplamak için elektronik tablo yazılımını kullanarak standart bir çalışma sayfası hazırlayın (Şekil 7).
- IR'yi hesaplamak için:
- Her ≥60 μm yapının sınırından 2,5 μm aşındırdıktan sonra yoğunluk ölçümünü yapın. Hesaplama için ortalamayı kullanın (payda).
- Her ≥60 μm yapının sınırından 25 μm aşındırdıktan sonra yoğunluk ölçümünü yapın. Hesaplama için ortalamayı kullanın (pay).
- CI'yi hesaplamak için, tüm kuyucuklardaki tüm organoidlerin daireselliğini alın. Ortalama CI'ye karşılık gelir.
NOT: Büyük görüntü gruplarının analizi gerektiğinde, bölüm 4'te açıklandığı gibi görüntü analizi işlemi, kalibre edilmiş ND dosyalarından başlayarak ve tüm adımların birleştirildiği bir makro çalıştırılarak yarı otomatik hale getirilebilir.
Sonuçlar
Rutin klinik ziyaretler sırasında 212 denekten organoidler toplandı. Rektal biyopsi prosedürü sırasında veya sonrasında herhangi bir yan etki meydana gelmedi. Organoidler, genotip ve klinik bilgi gibi özne özelliklerine kör olan bir araştırmacı tarafından görüntülendi. Düşük kaliteli görüntüler nedeniyle, 23 denek hariç tutuldu. Başarılı ve başarısız organoid kültürlere ve görüntü edinimine örnekler Şekil 2'de görülebilir.
K...
Tartışmalar
Rektal organoid morfoloji analizi (ROMA) için ayrıntılı bir protokol sunuyoruz. ROMA, IR ve CI ile hesaplanan iki indeks, organoidleri CF'li deneklerden CF'siz olanlardan mükemmel doğrulukla ayırdı. ROMA böylece SCC'yi ve şu anda mevcut olan diğer testleri 13,14,15'i tamamlayan yeni bir fizyolojik CFTR testi olarak işlev görebilir.
Protokol, CFTR işlevsel olduğunda yuvarlak bir şekle v...
Açıklamalar
Bu çalışma, Belçika KF hastaları derneği "Mucovereniging / Association Muco", Belçika Pediatri Derneği BVK-SBP 2019 Araştırma Bursu ve UZ Leuven Translasyonel Biyomedikal Araştırma Fonu'ndan bir hibe tarafından finanse edilmiştir. Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışmaya katılan hasta ve velilere teşekkür ederiz. Abida Bibi'ye organoidlerle yaptığı tüm kültür çalışmaları için teşekkür ederiz. Els Aertgeerts, Karolien Bruneel, Claire Collard, Liliane Collignon, Monique Delfosse, Anja Delporte, Nathalie Feyaerts, Cécile Lambremont, Lut Nieuwborg, Nathalie Peeters, Ann Raman, Pim Sansen, Hilde Stevens, Marianne Schulte, Els Van Ransbeeck, Christel Van de Brande, Greet Van den Eynde, Marleen Vanderkerken, Inge Van Dijck, Audrey Wagener, Monika Waskiewicz ve Bernard Wenderickx'e lojistik destek için teşekkür ederiz. Ayrıca Mucovereniging/Association Muco'ya ve özellikle Stefan Joris ve Dr. Jan Vanleeuwe'ye destekleri ve finansmanları için teşekkür ederiz. Belçika Organoid Projesi'nden tüm işbirlikçilere teşekkür ederiz: Hedwige Boboli (CHR Citadelle, Liège, Belçika), Linda Boulanger (Üniversite Hastaneleri Leuven, Belçika), Georges Casimir (HUDERF, Brüksel, Belçika), Benedicte De Meyere (Üniversite Hastanesi Gent, Belçika), Elke De Wachter (Üniversite Hastanesi Brüksel, Belçika), Danny De Looze (Üniversite Hastanesi Gent, Belçika), Isabelle Etienne (CHU Erasme, Brüksel, Belçika), Laurence Hanssens (HUDERF, Brüksel), Christiane Knoop (CHU Erasme, Brüksel, Belçika), Monique Lequesne (Anvers Üniversite Hastanesi, Belçika), Vicky Nowé (GZA St. Vincentius Hastanesi Anvers), Dirk Staessen (GZA St. Vincentius Hastanesi Anvers), Stephanie Van Biervliet (Gent Üniversitesi Hastanesi, Belçika), Eva Van Braeckel (Üniversite Hastanesi Gent, Belçika), Kim Van Hoorenbeeck (Üniversite Hastanesi Anvers, Belçika), Eef Vanderhelst (Üniversite Hastanesi Brüksel, Belçika), Stijn Verhulst (Anvers Üniversite Hastanesi, Belçika), Stefanie Vincken (Brüksel Üniversite Hastanesi, Belçika).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
Referanslar
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır