JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
직장 오가노이드 형태 분석(ROMA): 낭포성 섬유증의 진단 분석
요약
이 프로토콜은 낭포성 섬유증(CF)에 대한 새로운 진단 분석인 직장 오가노이드 형태 분석(ROMA)을 설명합니다. 형태 학적 특성, 즉 진원도 (원형도 지수, CI)와 루멘의 존재 (강도 비율, IR)는 CFTR 기능의 척도입니다. 189 명의 피험자를 분석 한 결과 CF와 비 CF가 완벽하게 구별되었습니다.
초록
낭포성 섬유증(CF)의 진단은 항상 간단한 것은 아니며, 특히 땀 염화물 농도가 중간이거나 질병을 유발하는 CFTR 돌연변이가 2개 미만인 경우 더욱 그렇습니다. 생리학적 CFTR 분석(비강 전위차, 장 전류 측정)이 진단 알고리즘에 포함되었지만 항상 쉽게 이용 가능하거나 실현 가능한 것은 아닙니다(예: 유아에서). 직장 오가노이드는 특정 조건에서 배양할 때 직장 생검의 음와에서 분리된 줄기 세포에서 자라는 3D 구조입니다. 비 CF 피험자의 유기체는 CFTR 매개 염화물 수송이 물을 내강으로 유도하기 때문에 둥근 모양과 유체로 채워진 내강을 가지고 있습니다. CFTR 기능에 결함이있는 유기체는 팽창하지 않고 불규칙한 모양을 유지하고 눈에 보이는 루멘이 없습니다. CF와 비 CF 오가노이드 간의 형태 차이는 새로운 CFTR 생리학적 분석으로 '직장 오가노이드 형태 분석'(ROMA)에서 정량화됩니다. ROMA 분석을 위해 오가노이드를 96웰 플레이트에 플레이팅하고 칼세인으로 염색한 다음 컨포칼 현미경으로 이미지화합니다. 형태 학적 차이는 두 가지 지수를 사용하여 정량화됩니다 : 원형도 지수 (CI)는 유기체의 진원도를 정량화하고 강도비 (IR)는 중심 루멘의 존재를 측정 한 것입니다. 비 CF 오가노이드는 CF 오가노이드에 비해 높은 CI와 낮은 IR을 갖는다. ROMA 지수는 CF가 없는 22명의 피험자와 CF가 있는 167명의 피험자를 완벽하게 구별하여 ROMA를 CF 진단에 도움이 되는 매력적인 생리학적 CFTR 분석법으로 만들었습니다. 직장 생검은 대부분의 병원에서 모든 연령대에서 일상적으로 수행 할 수 있으며 조직은 오가노이드 배양 및 ROMA를 위해 중앙 실험실로 보낼 수 있습니다. 미래에는 ROMA를 적용하여 체외에서 CFTR 조절제의 효능을 테스트할 수도 있습니다. 본 보고서의 목적은 ROMA에 사용되는 방법을 완전히 설명하고 다른 실험실에서 복제를 허용하는 것입니다.
서문
낭포성 섬유증(CF)은 CF 막횡단 전도도 조절제(CFTR) 유전자의 돌연변이로 인해 발생하는 상염색체 열성 질환입니다. CFTR 단백질은 염화물 및 중탄산염 채널로 여러 상피1의 수화를 보장합니다. CF는 주로 호흡기 질환으로 나타나지만 위장관, 췌장, 간 및 생식 기관에도 영향을 미치는 고부담, 수명 단축, 다중 시스템 질환입니다2.
질병을 유발하는 CFTR 돌연변이는 CFTR의 양이나 기능을 감소시켜 점액 탈수를 유발합니다. CFTR 유전자의 2,000개 이상의 변이체가 기술되었으며3, 그 중 466개만이 완전히 특성화되었습니다4.
CF의 진단은 땀 염화물 농도 (SCC)가 60 mmol / L의 임계 값을 초과하거나 두 가지 질병 유발 CFTR 돌연변이 (CFTR2 데이터베이스에 따름)가 확인 될 때 4,5 할 수 있습니다. 땀 검사의 약 4%-5%에서 발생하는 중간 상승(30-60mmol/L) SCC만 있는 피험자6와 다양하거나 알려지지 않은 임상적 결과의 CFTR 돌연변이가 있는 피험자의 경우 CF 호환 증상이 있거나 신생아선별 검사에서 양성인 경우에도 진단을 확인하거나 배제할 수 없습니다. 이러한 경우 2차 생리학적 CFTR 분석(비강 전위차(NPD) 및 장 전류 측정(ICM))이 진단 알고리즘에 포함되었습니다. 이러한 검사는 대부분의 센터에서 쉽게 이용할 수 없으며 모든 연령대, 특히 유아에서 가능합니다5.
직장 오가노이드는 직장 생검을 통해 얻은 장자루에서 Lgr5(+) 성체 장 줄기 세포에서 성장한 3D 구조입니다7. 오가노이드는 CF8에서 변조기 처리 테스트와 같은 생물 의학 연구에서 점점 더 많이 사용되고 있습니다. 생존 가능한 생검은 흡입 또는 겸자 생검으로 얻을 수 있으며, 이는 최소한의 불편 함을 유발하고 유아에서도 안전하며 합병증 비율이 낮습니다9. 직장 생검에서 분리 된 음와에는 줄기 세포가 풍부하며 특정 배양 조건에서 이들은 직장 오가노이드로 자체 구성됩니다. 이 유기체의 형태는 상피 세포의 정점 막에 위치한 CFTR의 발현과 기능에 의해 결정됩니다. 기능성 CFTR은 염화물과 물이 오가노이드 내강으로 들어가도록 하여 비-CF 오가노이드의 팽창을 유도합니다. CF 유기체는 팽창하지 않으며 눈에 보이는 루멘이 없습니다10,11.
직장 오가노이드 형태 분석(ROMA)은 이러한 오가노이드 형태의 차이를 기반으로 CF와 비-CF 오가노이드를 구별할 수 있습니다. 비 CF 오가노이드는 더 둥글고 눈에 보이는 루멘을 갖는 반면, CF 오가노이드의 경우 그 반대입니다. 이 분석을 위해 환자 특이적 오가노이드를 96웰 플레이트의 32개 웰에 플레이팅합니다. 성장 1일 후, 오가노이드는 칼세인 그린으로 염색되고 컨포칼 현미경으로 이미지화됩니다. 비 CF 오가노이드는 내강에 유체가 포함되어 있고 칼세인이 세포만 염색하기 때문에 더 원형이고 덜 형광적인 중앙 부분을 보여줍니다. 이러한 형태의 차이는 두 개의 ROMA 지수를 사용하여 정량화됩니다 : 원형도 지수 (CI)는 유기체의 진원도를 정량화하는 반면, 강도비 (IR)는 중심 루멘의 유무를 측정 한 것입니다. 이 보고서에서는 기술의 복제를 허용하기 위해 이러한 차별적 지수를 얻는 프로토콜에 대해 자세히 설명합니다.
프로토콜
인체 조직과 관련된 모든 절차에 대해 윤리위원회 연구 UZ/KU Leuven(EC 연구)의 승인을 획득했습니다. 모든 연구는 부모, 대리인 및/또는 환자의 사전 동의 및/또는 동의를 받아 수행되었습니다.
알림: 직장 생검 및 오가노이드와 관련된 모든 절차는 생물학적 위험으로부터 연구원을 보호하고 배양 물의 오염 위험을 최소화하기 위해 층류로 수행되어야 합니다. 모든 실험실 절차와 관련하여 연구원은 샘플을 조작하기 위해 항상 실험실 코트, 장갑 및 안전 고글을 착용해야 합니다.
1. 직장 생검, 음와에서 성체 줄기세포 분리 및 오가노이드 배양
- 바이오뱅킹을 위한 배지 생산 및 사용, 오가노이드 배양, 분할, 확장 및 동결을 포함한 프로토콜의 초기 부분에 대해서는 이전에 발표된 두 가지 프로토콜 8,12를 따르십시오.
- 즉, 다음 단계를 수행해야합니다.
- 집게 또는 흡입 장치로 3-4 개의 직장 생검을하고 위에서 언급 한 프로토콜에 설명 된대로 Ad-DF + ++ 배지로 멸균 용기 (예 : 1.5mL 미세 원심 분리 튜브)에 수집합니다.
- 생검을 얼음 위 또는 4 ° C의 중앙 실험실로 운반하십시오. 다른 센터로의 운송이 가능하며 운송이 최대 48 시간이 걸리는 경우에도 품질에 큰 영향을 미치지 않습니다. 이송에 6시간 이상 걸릴 것으로 예상되는 경우 1.5mL 미세 원심분리 튜브 대신 6mL의 Ad-DF+++ 배지가 있는 15mL 원추형 튜브를 사용하십시오.
- 상층액이 투명해질 때까지 차가운 PBS로 생검을 세척하여 지방 조직과 같은 이물질 및 비상피 조직을 제거한다.
- EDTA (최종 농도 10mM)로 생검을 배양하여 음와를 분리합니다. 지하실 막 매트릭스에 지하실을 도금하십시오. 박테리아 오염을 방지하기 위해 배양 첫 주에 광범위한 항생제(겐타마이신 50μg/mL 및 반코마이신 50μg/mL)를 배지에 추가합니다.
- 지하실이 싹이 트고 닫히고 증식하면 일반적으로 7 일 후에 기계적 분할을 수행하십시오.
- 생성 된 유기체를 약 7 일마다 분할하십시오. 이러한 방식으로 배양을 확장하거나, 바이오뱅크에서 백업 샘플을 동결하거나, 분석에 오가노이드를 사용할 수 있습니다.
2. 로마용 오가노이드 도금(1일차)
- 도금을 위해 유기물을 기계적으로 분할
- 차가운 Ad-DF+++ 배지로 두 번 세척하여 24웰 플레이트에서 잘 자란 3개의 웰에서 오가노이드를 수집하고 1.5mL 미세 원심분리 튜브에 수집하고 현미경으로 평가합니다12.
- 오가노이드가 실행 가능하고 고품질인지 확인하며, 이는 일반적으로 이전에 분할된 후 5-7일 동안 성장한 후에 달성할 수 있습니다(그림 1).
- 전술한 프로토콜 8,12에 따라 유기체를 기계적으로 분할한다. 명시야 현미경을 사용하여 평가한 대부분의 오가노이드가 초기 관찰에 비해 충분히 작을 때까지 반복합니다.
- 큰 오가노이드는 중력으로 인해 튜브 바닥으로 가라앉고 작은 오가노이드는 배지 컬럼의 상부에 부유 상태로 유지되므로 일반적으로 새로운 미세 원심분리 튜브에서 오가노이드-배지 용액의 상단 약 4/5 수집에 해당하는 더 작은 오가노이드를 수집합니다.
- 더 작은 유기체 샘플을 0.3 x 1000g에서 2분 동안 원 심분리하고 배지를 버립니다.
- 더 작은 유기체의 펠릿을 130%-40% 기저막 매트릭스(Ad-DF+++ 배지12로 희석)의 50μL에 희석합니다.
- 200 μL 마이크로피펫을 사용하여 잘 재현탁합니다.
- 96웰 플레이트에 오가노이드 플레이팅
- 20 μL 피펫을 사용하여, 미리 예열된 96-웰 플레이트의 32개 웰에 오가노이드를 플레이트한다. 각 웰에 이전 단계에서 생성된 4μL 오가노이드 매트릭스 용액 한 방울이 포함되어 있는지 확인합니다.
- 용액의 유기체는 중력에 의존하는 하향 변위로 인해 튜브 바닥에 펠릿을 형성하는 경향이 있습니다. 이를 방지하고 균일한 도금을 보장하려면 200μL 마이크로피펫을 사용하여 오가노이드 매트릭스 용액을 정기적으로 재현탁하십시오(예: 4-8웰을 도금한 후마다).
- 방울이 우물 가장자리를 향해 흐르는 것을 방지하기 위해 우물 중앙에 각 방울을 도금하여 나중에 이미지 품질을 저하시킵니다.
- 겹치는 오가노이드 없이 웰당 약 30개의 오가노이드(최소 15개, 최대 90개)를 목표로 합니다.
- 이러한 유기체는 밤새 배양해야 하며 이 기간 동안 약간 성장하며 도금 밀도가 너무 높으면 겹치기 시작할 수 있습니다.
- 처음 하나 또는 두 개의 웰을 도금한 후 5x 배율 대물렌즈가 있는 명시야 현미경을 사용하여 도금 밀도를 확인합니다.
- 도금 밀도가 너무 높으면 원하는 도금 밀도에 도달할 때까지 기저막 매트릭스를 추가하여 유기물 매트릭스 용액을 단계적으로 희석합니다(그림 2).
- 도금 후 평평한 표면의 플레이트를 부드럽게 두드려 대부분의 유기체가 동일한 초점면에 있는지 확인합니다.
- 접시를 배양
- 96-웰 플레이트를 37°C 및 5%CO2 에서 8-10분 동안 인큐베이션하여 기저막 매트릭스의 겔화를 허용한다.
- 각 웰에 50μL의 인간 결장 오가노이드 배지 +/+12 를 추가하고 16-24시간 동안 밤새 배양합니다.
- 포스콜린이나 CFTR 조절제를 첨가하지 않으므로 오가노이드는 기저 조건에서 성장합니다.
3. 컨포칼 현미경을 사용한 오가노이드 이미징(2일차)
- 칼세인 그린으로 오가노이드를 염색
- 50μg의 칼세인 그린을 함유하는 하나의 바이알에 50μL의 디메틸설폭사이드(DMSO)를 첨가하여 칼세인 그린의 1mM 스톡 용액을 준비합니다.
- 200 μL의 Ad-DF+++(농도 6 μM)에 1.2 μL의 저장 용액을 첨가하여 칼세인 그린의 작업 용액을 준비합니다.
- 이 칼세인 혼합물 5μL를 오가노이드를 플레이팅한 96웰 플레이트의 각 웰에 추가합니다(최종 칼세인 농도 0.6μM). 이 단계를 수행할 때 우물 내부의 매트릭스 드롭을 만지거나 탈구하지 마십시오.
- 뚜껑을 몇 번 씌운 상태에서 플레이트를 회전시키고 약간 기울여 전체 우물에서 칼 세인 그린의 균질 한 분포를 보장합니다.
- 플레이트를 37°C 및 5%CO2 에서 15-30분 동안 다시 인큐베이션하여 웰 내의 모든 오가노이드의 염색을 보장한다.
- 플레이트를 컨포칼 현미경으로 옮깁니다.
- 플레이트를 자동화된 스테이지와 통합 인큐베이터가 있는 컨포칼 현미경으로 옮깁니다. 플레이트가 플레이트 홀더에 잘 고정되어 있는지 확인하십시오.
- 37°C 및 5%CO2 에서의 인큐베이션은 선택적이지만 이미징 과정의 짧은 기간(약 10분)을 고려할 때 필수는 아니다.
- 오가노이드에 초점을 맞춥니다(그림 3).
- 컨포칼 현미경을 사용하여 각 웰에서 오가노이드의 최적 x/y 위치와 초점(z 위치)을 수동으로 결정하고 이러한 위치를 이미징 소프트웨어에 저장합니다.
- 최상의 초점은 오가노이드의 가능한 가장 선명한 묘사와 오가노이드 드롭의 가능한 가장 큰 부분의 시각화를 의미합니다. 얼룩의 분포가 적절하지 않으면 3.1.4 단계와 3.1.5 단계를 반복하십시오 (예 : 추가 5-10 분 동안 배양).
- 488nm에서 방출, 515nm에서 여기(칼세인 형광 시각화에 적합) 및 5x LD 배율 대물렌즈가 있는 라이브 셀 이미징 설정을 사용합니다.
- 컨포칼 현미경으로 32개 웰의 오가노이드 사진을 획득합니다(그림 3 및 그림 4).
- 1024 픽셀 x 1024 픽셀 (픽셀 크기 2.5 μm x 2.5 μm)의 해상도와 16 비트 깊이로 단방향으로 이미지를 촬영합니다.
- CF와 비 CF 오가노이드 간의 형태학적 차이를 최적으로 시각화하려면 레이저 강도와 마스터 게인을 선택합니다(예: 염색되지 않은 물로 채워진 중앙 내강(있는 경우)과 염색된 세포 경계 간의 구별).
알림: 오가노이드는 마스터 게인과 형광 신호가 너무 낮을 때 올바르게 묘사되지 않습니다. 마스터 게인을 너무 높게 설정하면 신호 강도가 균일하고 매우 높은 오가노이드가 있는 이미지가 생성되어 더 미묘한 형태학적 차이가 이미징되지 않습니다(그림 2). - 현미경 형식으로 32개 웰 모두에 대해 웰당 하나의 사진을 저장하고 TIFF 파일로 내보냅니다.
4. 이미지 분석(그림 5)
- 이미지 분석 소프트웨어에서 TIFF 파일을 로드합니다.
- 작업자가 결정한 제외 기준(그림 2)에 따라 첫 번째 품질 검사를 수행합니다: 많은 분화되거나 죽은 구조물 또는 파편, 부적절한 도금 밀도, 너무 많거나(예: 겹침) 또는 너무 적은 오가노이드, 부적절한 형광 분포(오가노이드가 명확하게 설명되지 않음, 배경 신호가 너무 높음).
참고: 이 단계는 3.4단계에서 이미지를 TIFF 파일로 내보내기 전에 수행할 수도 있습니다. - 분석할 이미지 준비
- 1픽셀이 2.5μm x 2.5μm에 해당하도록 이미지를 다시 보정합니다.
- 하나의 네트워크 데이터(. ND) 파일을 사용하여 각 오가노이드 배양에 대한 32개의 사진을 모두 저장할 수 있어 대상당 32개의 사진을 모두 동시에 분석할 수 있습니다.
- 유기체 묘사
- 하한 강도 임계값 4,500과 상한 임계값 65,535를 사용하여 구조물을 묘사합니다(매끄럽 고 깨끗한 기능 끄기; 구멍 채우기 기능 켜짐; x3에서 별도의 기능).
참고: 이것은 형광 구조를 묘사하며, 있는 경우 묘사된 구조에 루멘을 포함하는 채우기 구멍 이 있습니다.
- 하한 강도 임계값 4,500과 상한 임계값 65,535를 사용하여 구조물을 묘사합니다(매끄럽 고 깨끗한 기능 끄기; 구멍 채우기 기능 켜짐; x3에서 별도의 기능).
- 유기체 계산
- ≥40 μm의 모든 구조를 선택하십시오.
- ND 측정 업데이트 버튼을 클릭합니다(측정이 필요할 때마다). 계산된 오가노이드에 번호가 매겨집니다.
참고: 이것은 32개 웰에 있는 오가노이드의 총 수와 같지만 죽은 세포와 같은 작은 파편은 제외됩니다.
- 지수 계산을 위한 강도 및 원형도 측정
- ≥60 μm의 모든 구조를 선택하고 계수하십시오.
참고: 이것은 CF 또는 비 CF에 전형적인 형태를 나타낼 만큼 충분히 큰 오가노이드를 계산합니다. >40 μm 및 <60 μm의 오가노이드는 비 CF와 CF 모두에서 작고 밀도가 높습니다. - 그림의 경계에 닿는 모든 구조를 제거하십시오. 완전히 보이지 않는 유기체는 형태를 정확하게 정량화할 수 없으므로 제거하려면 이렇게 하십시오.
- 각 ≥60μm 구조의 경계에서 1픽셀(= 2.5μm)을 침식합니다. 이것은 유기체를 둘러싸고 있는 확산된 칼세인 형광의 후광을 제거합니다.
- 각 구조의 평균 강도를 측정합니다. 이러한 방식으로 오가노이드의 평균 형광이 측정됩니다.
- 60 μm ≥ 모든 구조물을 다시 선택하고 경계에 닿는 모든 구조물을 제거하십시오.
- 각 ≥60μm 구조의 경계에서 10픽셀(= 25μm)을 침식합니다.
참고: 비 CF 오가노이드에서 이것은 세포 경계를 침식하고 내강만 남깁니다. CF 오가노이드에서 이것은 오가노이드의 외부 부분을 침식하며, 이는 남아 있는 내부 부분과 거의 동일한 형광을 갖습니다. - 침식된 각 구조물의 평균 강도를 측정합니다. 이러한 방식으로 오가노이드의 중앙 부분의 평균 형광이 측정됩니다.
- 각 구조의 원형도를 측정합니다. 이것은 유기체의 평균 원형도에 해당합니다.
- ≥60 μm의 모든 구조를 선택하고 계수하십시오.
- 두 번째 품질 검사를 수행합니다: 소프트웨어에 의해 결정된 제외 기준. 오가노이드(구조체≥40μm로 정의됨)의 50% 미만이 ≥60μm인 경우 CF 또는 비CF에 전형적인 형태를 나타낼 만큼 충분히 커야 하므로 사진 세트를 제외합니다. 또한 32개의 웰에 <500 또는 >3,000개의 오가노이드(구조 ≥40μm로 정의됨)가 존재하는 경우 제외합니다.
5. 이미징 소프트웨어에서 인덱스 측정(그림 6)
- 원형도 지수(CI)를 측정합니다.
참고: 이것은 4.6단계에서 측정된 평균 원형도에 해당하며, 이는 32개 웰 모두에 있는 모든 유기체의 평균 원형도입니다. CI는 로 정의되는 오가노이드의 진원도를 정량화하며, 이는 비 CF 오가노이드보다 CF에서 더 낮습니다.
오가노이드의 진원도를 정량화하며, 이는 비 CF 오가노이드보다 CF에서 더 낮습니다. - 강도비(IR) 측정
- 각 ≥60 μm 구조의 경계로부터 25 μm 침식한 후의 강도 측정의 평균을 각 ≥60 μm 구조의 경계로부터 2.5 μm 침식한 후의 강도 측정의 평균으로 나누어 IR을 계산한다.
알림: IR은 중앙 루멘의 유무를 측정합니다. IR은 와 같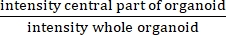 으며 비 CF 오가노이드보다 CF에서 더 높습니다.
으며 비 CF 오가노이드보다 CF에서 더 높습니다.
- 각 ≥60 μm 구조의 경계로부터 25 μm 침식한 후의 강도 측정의 평균을 각 ≥60 μm 구조의 경계로부터 2.5 μm 침식한 후의 강도 측정의 평균으로 나누어 IR을 계산한다.
- 분석 프로세스 간소화
- 스프레드시트 소프트웨어를 사용하여 데이터를 복사할 때 이러한 지수를 자동으로 계산하는 표준 워크시트를 준비합니다(그림 7).
- IR을 계산하려면:
- 각 ≥60 μm 구조의 경계에서 2.5 μm를 침식시킨 후 강도를 측정한다. 계산에 평균(분모)을 사용합니다.
- 각 ≥60 μm 구조의 경계에서 25 μm를 침식한 후 강도를 측정한다. 계산에 평균을 사용합니다(분자).
- CI를 계산하려면 모든 웰에서 모든 유기체의 원형도를 취하십시오. 평균은 CI에 해당합니다.
참고: 대량의 이미지 배치를 분석해야 하는 경우 섹션 4에 설명된 이미지 분석 프로세스는 보정된 ND 파일에서 시작하여 모든 단계가 결합된 매크로를 실행하여 반자동화될 수 있습니다.
결과
212명의 피험자로부터의 오가노이드가 일상적인 임상 방문 동안 수집되었습니다. 직장 생검 절차 중 또는 후에 부작용이 발생하지 않았습니다. 오가노이드는 유전자형 및 임상 정보와 같은 피험자 특성에 눈이 먼 한 연구원에 의해 이미지화되었습니다. 저화질 이미지로 인해 23 명의 피사체가 제외되었습니다. 성공 및 실패한 오가노이드 배양 및 이미지 획득의 예는 그림 2에...
토론
우리는 직장 오가노이드 형태 분석 (ROMA)을위한 상세한 프로토콜을 제공합니다. ROMA, IR 및 CI로 계산된 두 지수는 CF가 있는 피험자와 CF가 없는 피험자의 오가노이드를 완벽한 정확도로 구별했습니다. 따라서, ROMA는 SCC 및 다른 현재 이용 가능한 시험13,14,15를 보완하는 새로운 생리학적 CFTR 분석으로서 기능할 수 있다.
공개
이 연구는 벨기에 CF 환자 협회 "Mucovereniging/Association Muco", 벨기에 소아과 학회 BVK-SBP 2019의 연구 보조금 및 UZ Leuven Fund for Translational Biomedical Research의 보조금으로 지원되었습니다. 저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구에 참여한 환자와 부모에게 감사드립니다. 우리는 오가노이드를 사용한 모든 배양 작업에 대해 Abida Bibi에게 감사드립니다. 엘스 에어트게르츠, 카롤리엔 브루닐, 클레어 콜라드, 릴리안 콜리뇽, 모니크 델포세, 안야 델포르테, 나탈리 페야르츠, 세실 람브레몽, 루트 니우보르그, 나탈리 피터스, 앤 라만, 핌 산센, 힐데 스티븐스, 마리안 슐테, 엘스 반 란스비크, 크리스텔 반 데 브랜드, 그리트 반 덴 아인데, 마를린 반데커켄, 잉게 반 다이크, 오드리 바게너, 모니카 와스키에비츠, 버나드 벤데릭스에게 물류 지원에 감사드립니다. 우리는 또한 Mucovereniging / Association Muco, 특히 Stefan Joris와 Jan Vanleeuwe 박사의 지원과 자금 지원에 감사드립니다. Hedwige Boboli (CHR Citadelle, Liège, 벨기에), Linda Boulanger (벨기에 루벤 대학 병원), Georges Casimir (HUDERF, 브뤼셀, 벨기에), Benedicte De Meyere (벨기에 겐트 대학 병원), Elke de Wachter (벨기에 브뤼셀 대학 병원), Danny De Looze (벨기에 겐트 대학 병원), Isabelle Etienne (CHU Erasme, 브뤼셀, 벨기에), Laurence Hanssens (HUDERF, 브뤼셀), 크리스티안 크눕 (CHU 에라스메, 브뤼셀, 벨기에), 모니크 르케스네 (벨기에 앤트워프 대학 병원), 비키 노베 (앤트워프 세인트 빈센티우스 병원 GZA), 더크 슈테센 (GZA 세인트 빈센티우스 병원 앤트워프), 스테파니 반 비에르블리에 (벨기에 겐트 대학 병원), 에바 반 브라켈 (벨기에 겐트 대학 병원), 킴 반 후렌비크 (벨기에 앤트워프 대학 병원), 에프 반데르헬스트 (벨기에 브뤼셀 대학 병원), Stijn Verhulst (앤트워프 대학 병원, 벨기에), 스테파니 빈켄 (벨기에 브뤼셀 대학 병원).
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
참고문헌
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유