É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise da Morfologia Organoide Retal (ADM): Um Ensaio Diagnóstico na Fibrose Cística
Neste Artigo
Resumo
Este protocolo descreve a análise da morfologia organoide retal (ADM), um novo ensaio diagnóstico para fibrose cística (FC). As características morfológicas, nomeadamente a arredondamento (índice de circularidade, IC) e a presença de um lúmen (razão de intensidade, RI), são uma medida da função CFTR. A análise de 189 sujeitos mostrou perfeita discriminação entre FC e não FC.
Resumo
O diagnóstico de fibrose cística (FC) nem sempre é simples, especialmente quando a concentração de cloreto no suor é intermediária e/ou inferior a duas mutações da CFTR causadoras da doença podem ser identificadas. Ensaios fisiológicos de CFTR (diferença de potencial nasal, medição da corrente intestinal) foram incluídos no algoritmo de diagnóstico, mas nem sempre estão prontamente disponíveis ou viáveis (por exemplo, em lactentes). Os organoides retais são estruturas 3D que crescem a partir de células-tronco isoladas de criptas de uma biópsia retal quando cultivadas sob condições específicas. Os organoides de indivíduos não-FC têm uma forma redonda e um lúmen cheio de fluido, já que o transporte de cloreto mediado por CFTR leva a água para o lúmen. Organoides com função CFTR defeituosa não incham, mantendo uma forma irregular e não tendo lúmen visível. As diferenças na morfologia entre organoides CF e não-CF são quantificadas na 'Rectal Organoid Morphology Analysis' (ROMA) como um novo ensaio fisiológico CFTR. Para o ensaio de ROMA, os organoides são banhados em placas de 96 poços, corados com calceína e fotografados em microscópio confocal. As diferenças morfológicas são quantificadas usando dois índices: o índice de circularidade (IC) quantifica a arredondamento dos organoides e a razão de intensidade (RI) é uma medida da presença de um lúmen central. Os organoides não-CF têm um IC alto e um IR baixo em comparação com os organoides da FC. Os índices de ROMA discriminaram perfeitamente 167 indivíduos com FC de 22 indivíduos sem FC, tornando a ROMA um ensaio fisiológico atraente de CFTR para auxiliar no diagnóstico de FC. As biópsias retais podem ser realizadas rotineiramente em todas as idades na maioria dos hospitais e o tecido pode ser enviado para um laboratório central para cultura de organoides e ROMA. No futuro, a ROMA também pode ser aplicada para testar a eficácia dos moduladores CFTR in vitro. O objetivo do presente relatório é explicar completamente os métodos utilizados para ROMA, para permitir a replicação em outros laboratórios.
Introdução
A fibrose cística (FC) é uma doença autossômica recessiva causada por mutações no gene do regulador de condutância transmembrana da FC (CFTR). A proteína CFTR é um canal de cloreto e bicarbonato, garantindo a hidratação de vários epitélios1. A FC é uma doença multissistêmica de alta carga, que encurta a vida, manifestando-se principalmente como uma doença respiratória, mas também afetando o trato gastrointestinal, pâncreas, fígado e trato reprodutivo2.
As mutações do CFTR causadoras de doenças levam a uma diminuição na quantidade ou função do CFTR , por sua vez, causando desidratação do muco. Mais de 2.000 variantes no gene CFTR foram descritas3, das quais apenas 466 foram completamente caracterizadas4.
O diagnóstico de FC pode ser feito quando a concentração de cloreto no suor (CCE) está acima do limiar de 60 mmol/L ou quando duas mutações CFTR causadoras de doenças (de acordo com o banco de dados CFTR2) são identificadas 4,5. Em indivíduos com CEC apenas intermitentemente elevado (30-60 mmol/L), que ocorre em cerca de 4%-5% dos testes de suor6, e mutações CFTR de consequência clínica variável ou desconhecida, o diagnóstico não pode ser confirmado nem descartado, mesmo quando apresentam sintomas compatíveis com FC ou teste de triagem neonatal positivo. Para esses casos, ensaios fisiológicos de CFTR de segunda linha (diferença de potencial nasal (NPD) e medidas de corrente intestinal (ICM)) foram incluídos no algoritmo diagnóstico. Esses testes não estão prontamente disponíveis na maioria dos centros nem são viáveis em todas as idades, especialmente em lactentes5.
Os organoides retais são estruturas 3D cultivadas a partir de células-tronco intestinais adultas Lgr5(+) de criptas intestinais obtidas através de biópsia retal7. Os organoides estão sendo cada vez mais utilizados em pesquisas biomédicas, como o teste de tratamento de moduladores na FC8. Uma biópsia viável pode ser obtida por sucção ou biópsia a fórceps, procedimento que causa apenas um mínimo de desconforto e é seguro mesmo em lactentes, com baixas taxas de complicações9. As criptas isoladas das biópsias retais são enriquecidas em células-tronco e, sob condições específicas de cultivo, estas se auto-organizam em organoides retais. A morfologia desses organoides é determinada pela expressão e função da CFTR, localizada na membrana apical das células epiteliais. O CFTR funcional permite que o cloreto e a água entrem no lúmen organoide, induzindo assim o inchaço dos organoides não-CF. Os organoides da FC não incham e não apresentam lúmen visível10,11.
A análise da morfologia organoide retal (ADM) permite a discriminação entre organoides FC e não FC com base nessas diferenças na morfologia organoide. Os organoides não-CF são mais redondos e têm um lúmen visível, enquanto o oposto é verdadeiro para os organoides da FC. Para este ensaio, os organoides específicos do paciente são banhados em 32 poços de uma placa de 96 poços. Após 1 dia de crescimento, os organoides são corados com verde calceína e fotografados em um microscópio confocal. Os organoides não-FC apresentam uma forma mais circular e uma parte central menos fluorescente, pois o lúmen contém fluido e a calceína mancha apenas células. Essas diferenças na morfologia são quantificadas usando dois índices de ROMA: o índice de circularidade (IC) quantifica a arredondamento dos organoides, enquanto a razão de intensidade (RI) é uma medida da presença ou ausência de um lúmen central. Neste relato, descrevemos detalhadamente o protocolo para obtenção desses índices discriminativos, para permitir a replicação da técnica.
Protocolo
Para todos os procedimentos que envolvam tecidos humanos, foi obtida a aprovação pelo Comité de Ética em Investigação UZ/KU Leuven (investigação CE). Todas as pesquisas foram realizadas com consentimento informado e/ou consentimento dos pais, representantes e/ou pacientes.
NOTA: Todos os procedimentos envolvendo biópsias retais e organoides devem ser realizados em fluxo laminar para proteger o pesquisador de qualquer risco biológico e minimizar o risco de contaminação das culturas. Como para qualquer procedimento de laboratório, os pesquisadores devem sempre usar jalecos, luvas e óculos de segurança para manipular amostras.
1. Biópsia retal, isolamento de células-tronco adultas de criptas e cultura organoide
- Para essa parte inicial do protocolo, incluindo produção e uso de meios, cultura de organoides, divisão, expansão e congelamento para biobanco, siga os dois protocolos publicados anteriormente 8,12.
- Em suma, os seguintes passos devem ser tomados:
- Faça de três a quatro biópsias retais com uma pinça ou dispositivo de sucção e colete em um recipiente estéril (por exemplo, tubo de microcentrífuga de 1,5 mL) com o meio Ad-DF+++, conforme descrito no protocolo mencionado acima.
- Transportar biópsias para um laboratório central no gelo ou a 4 °C. O transporte para outros centros é possível, e a qualidade não é significativamente afetada, mesmo quando o transporte leva até 48 horas. Se se espera que o transporte demore mais de 6 h, use um tubo cônico de 15 mL com 6 mL de meio Ad-DF+++ em vez de um tubo de microcentrífuga de 1,5 mL.
- Lave as biópsias em PBS frio até que o sobrenadante esteja claro para remover os detritos e tecidos não epiteliais, como o tecido adiposo.
- Incubar as biópsias com EDTA (concentração final de 10 mM) para desprender as criptas. Chapear as criptas em uma matriz de membrana basal. Adicione antibióticos de amplo espectro (gentamicina 50 μg/mL e vancomicina 50 μg/mL) ao meio na primeira semana de cultivo para evitar a contaminação bacteriana.
- Quando as criptas tiverem brotado e estiverem fechadas e proliferadas, realize a divisão mecânica, geralmente após 7 dias.
- Divida os organoides resultantes aproximadamente a cada 7 dias. Dessa forma, expanda a cultura, congele amostras de backup em um biobanco ou use os organoides para ensaios.
2. Revestimento organoide para ROMA (dia 1)
- Dividir mecanicamente os organoides para chapeamento
- Coletar organoides de três poços bem cultivados de uma placa de 24 poços lavando duas vezes com meio frio Ad-DF+++, coletá-los em um tubo de microcentrífuga de 1,5 mL e avaliá-los ao microscópio12.
- Certifique-se de que os organoides sejam viáveis e de alta qualidade, o que geralmente pode ser alcançado após 5-7 dias de crescimento após serem divididos previamente (Figura 1).
- Dividir mecanicamente os organoides de acordo com o protocolo supracitado 8,12. Repita até que a maioria dos organoides, conforme avaliado usando o microscópio de campo brilhante, seja pequena o suficiente em comparação com a observação inicial.
- Colete os organoides menores, geralmente correspondendo à coleta de cerca de 4/5 superior da solução do meio organoide em um novo tubo de microcentrífuga, pois os grandes organoides afundam no fundo do tubo devido à gravidade e os pequenos organoides permanecem suspensos na parte superior da coluna média.
- Centrifugar a amostra de organoides menores a 0,3 x 1000 g por 2 min e descartar o meio.
- Diluir o pellet de organoides menores em 130 μL de matriz de membrana basal de 40%-50% (diluído com meio Ad-DF+++12).
- Ressuspeite bem usando uma micropipeta de 200 μL.
- Placa os organoides em uma placa de 96 poços
- Usando uma pipeta de 20 μL, organoides de placa em 32 poços de uma placa de 96 poços pré-aquecida. Certifique-se de que cada poço contenha uma gota de 4 μL da solução de matriz organoide produzida na etapa anterior.
- Os organoides na solução tendem a formar um pellet na parte inferior do tubo devido ao deslocamento descendente dependente da gravidade. Para evitar isso e garantir o revestimento uniforme, ressuscite regularmente a solução de matriz organoide usando uma micropipeta de 200 μL (por exemplo, todas as vezes após o revestimento de quatro a oito poços).
- Placa cada gota no centro do poço para evitar que a queda corra em direção às bordas do poço, o que reduziria a qualidade da imagem mais tarde.
- Aponte para cerca de 30 organoides por poço (mínimo 15, máximo 90) sem sobreposição de organoides.
- Tenha em mente que esses organoides terão que ser incubados durante a noite e crescerão ligeiramente durante esse tempo, e podem começar a se sobrepor se a densidade de revestimento for muito alta.
- Verifique a densidade de revestimento usando um microscópio de campo brilhante com uma objetiva de ampliação de 5x após o revestimento do primeiro ou dois poços.
- Se a densidade de revestimento for muito alta, diluir a solução de matriz organoide passo a passo com a adição da matriz de membrana basal até que a densidade de revestimento desejada seja atingida (Figura 2).
- Após o revestimento, bata suavemente na placa em uma superfície plana para garantir que a maioria dos organoides esteja no mesmo plano focal.
- Incubar a placa
- Incubar a placa de 96 poços a 37 °C e 5% de CO2 durante 8-10 min para permitir a gelificação da matriz da membrana basal.
- Adicionar 50 μL de meio organoide do cólon humano +/+12 em cada poço e incubar durante a noite por 16-24 h.
- Não adicione forskolina nem moduladores CFTR, para que os organoides cresçam sob condições basais.
3. Imagem organoide usando microscopia confocal (dia 2)
- Manchar os organoides com verde calceína
- Preparar uma solução-mãe de 1 mM de verde calceína adicionando 50 μL de dimetilsulfóxido (DMSO) a um frasco para injetáveis contendo 50 μg de verde calceína.
- Preparar uma solução de trabalho de verde calceína adicionando 1,2 μL da solução-mãe a 200 μL de Ad-DF+++ (concentração de 6 μM).
- Adicionar 5 μL desta mistura de calceína a cada poço da placa de 96 poços em que os organoides foram banhados (concentração final de calceína 0,6 μM). Não toque e desloque a queda da matriz dentro do poço ao executar esta etapa.
- Gire e incline ligeiramente a placa com a tampa sobre algumas vezes para garantir a distribuição homogênea do verde calceína em todo o poço.
- Incubar a placa novamente por 15-30 min a 37 °C e 5% de CO2 para garantir a coloração de todos os organoides nos poços.
- Transfira a placa para o microscópio confocal
- Transfira a placa para o microscópio confocal com um estágio automatizado e incubadora integrada. Certifique-se de que a placa está bem fixada no suporte da placa.
- A incubação a 37 °C e 5% de CO2 é opcional, mas não necessária, dada a curta duração (cerca de 10 min) do processo de imagem.
- Foco nos organoides (Figura 3)
- Usando o microscópio confocal, determine a posição x/y ideal e o foco (posição z) dos organoides em cada poço manualmente e salve essas posições no software de imagem.
- O melhor foco implica a delimitação mais nítida possível dos organoides e a visualização da maior parte possível da gota organoide. Se a distribuição da mancha não for adequada, repita as etapas 3.1.4 e 3.1.5 (incubar, por exemplo, por um extra de 5-10 min).
- Use configurações de imagem de células vivas com emissão a 488 nm e excitação a 515 nm (específicas para visualização da fluorescência da calceína) e um objetivo de ampliação de 5x LD.
- Adquirir imagens organoides dos 32 poços com o microscópio confocal (Figura 3 e Figura 4).
- Tire imagens de forma unidirecional com uma resolução de 1024 pixels x 1024 pixels (tamanho de pixel 2,5 μm x 2,5 μm) e profundidade de 16 bits.
- Escolha a intensidade do laser e o ganho mestre para uma visualização ideal das diferenças morfológicas entre organoides com e sem FC (por exemplo, discriminação entre um lúmen central não corado cheio de água (se presente) e uma borda celular corada).
NOTA: Os organoides não serão delineados corretamente quando o ganho mestre e, portanto, o sinal de fluorescência for muito baixo; a definição do ganho mestre muito alto resultará em imagens com organoides com intensidade de sinal homogênea muito alta, impedindo imagens de diferenças morfológicas mais sutis (Figura 2). - Salve uma imagem por poço para todos os 32 poços no formato microscópio e exporte-os como arquivos TIFF.
4. Análise de imagem (Figura 5)
- Carregue os arquivos TIFF no software de análise de imagem.
- Realizar a primeira verificação de qualidade com base nos critérios de exclusão determinados pelo operador (Figura 2): muitas estruturas ou detritos diferenciados ou mortos, densidade de revestimento inadequada, muitos (por exemplo, sobreposição) ou poucos organoides e distribuição de fluorescência inadequada (organoides não claramente delineados, sinal de fundo muito alto).
Observação : essa etapa também pode ser executada antes de exportar imagens como arquivos TIFF na etapa 3.4. - Preparar imagens para análise
- Recalibre as imagens, de modo que 1 pixel corresponda a 2,5 μm x 2,5 μm.
- Criar e abrir um Dados de Rede (. ND) de todas as 32 imagens para cada cultura organoide, permitindo a análise simultânea de todas as 32 figuras por sujeito.
- Delinear os organoides
- Delinear estruturas usando um limiar de intensidade inferior de 4.500 e um limiar superior de 65.535 (funções Smooth e Clean off; Função Preencher Furos em; Função separada em x3).
NOTA: Isso delineia estruturas fluorescentes, com orifícios de preenchimento incluindo o lúmen na estrutura delineada, se houver.
- Delinear estruturas usando um limiar de intensidade inferior de 4.500 e um limiar superior de 65.535 (funções Smooth e Clean off; Função Preencher Furos em; Função separada em x3).
- Conte os organoides
- Selecione todas as estruturas ≥40 μm.
- Clique no botão Atualizar medição ND (sempre que uma medição for necessária); os organoides contados serão numerados.
NOTA: Isso equivale ao número total de organoides nos 32 poços, enquanto pequenos detritos, como células mortas, são excluídos.
- Medir intensidade e circularidade para cálculo dos índices
- Selecione todas as estruturas ≥60 μm e conte.
NOTA: Isso conta os organoides grandes o suficiente para mostrar a morfologia típica da FC ou não-FC. Os organoides >40 μm e <60 μm são pequenos e densos, tanto na FC quanto na FC. - Remova todas as estruturas que tocam as bordas da imagem. Faça isso para remover organoides que não são completamente visíveis, pois sua morfologia não pode ser quantificada com precisão.
- Corroer 1 pixel (= 2,5 μm) da borda de cada estrutura de ≥60 μm. Isso remove o halo de fluorescência difusa de calceína ao redor dos organoides.
- Meça a intensidade média de cada estrutura. Desta forma, a fluorescência média dos organoides é medida.
- Selecione todas as estruturas ≥60 μm novamente e remova todas as estruturas que tocam as bordas.
- Corroer 10 pixels (= 25 μm) da borda de cada estrutura de ≥60 μm.
NOTA: Em organoides não-CF, isso corrói a borda celular e deixa apenas o lúmen. Nos organoides da FC, isso corrói a parte externa do organoide, que tem aproximadamente a mesma fluorescência que a parte interna que permanece. - Meça a intensidade média de cada estrutura erodida. Desta forma, a fluorescência média da parte central dos organoides é medida.
- Meça a circularidade de cada estrutura. Isso corresponde à circularidade média dos organoides.
- Selecione todas as estruturas ≥60 μm e conte.
- Realize a segunda verificação de qualidade: critérios de exclusão determinados pelo software. Exclua o conjunto de figuras quando menos de 50% dos organoides (definidos como estruturas ≥40 μm) estiverem ≥60 μm, pois organoides suficientes devem ser grandes o suficiente para mostrar morfologia típica da FC ou não-FC. Também exclua quando <500 ou >3.000 organoides (definidos como estruturas ≥40 μm) estiverem presentes nos 32 poços.
5. Medir os índices no software de imagem (Figura 6)
- Meça o índice de circularidade (IC).
NOTA: Isso corresponde à circularidade média medida na etapa 4.6, que é a circularidade média de todos os organoides em todos os 32 poços. O IC quantifica a arredondamento dos organoides, definida como , que é menor na FC do que nos organoides não CF
, que é menor na FC do que nos organoides não CF - Medir a razão de intensidade (IR)
- Calcular o IR dividindo a média da medição da intensidade após erosão de 25 μm da borda de cada estrutura de ≥60 μm pela média da medição de intensidade após erosão de 2,5 μm da borda de cada estrutura de ≥60 μm.
NOTA: A RI mede a presença ou ausência de um lúmen central. A RI é igual a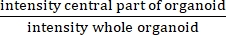 , e é maior na FC do que nos organoides não-FC.
, e é maior na FC do que nos organoides não-FC.
- Calcular o IR dividindo a média da medição da intensidade após erosão de 25 μm da borda de cada estrutura de ≥60 μm pela média da medição de intensidade após erosão de 2,5 μm da borda de cada estrutura de ≥60 μm.
- Simplifique o processo de análise
- Prepare uma planilha padrão usando um software de planilha para calcular automaticamente esses índices ao copiar os dados (Figura 7).
- Para calcular o IR:
- Faça a medição de intensidade depois de erodir 2,5 μm da borda de cada estrutura de ≥60 μm. Use a média para o cálculo (denominador).
- Faça a medição de intensidade depois de erodir 25 μm da borda de cada estrutura de ≥60 μm. Use a média para o cálculo (numerador).
- Para calcular o IC, tome a circularidade de todos os organoides em todos os poços. A média corresponde ao IC.
NOTA: Quando a análise de grandes lotes de imagens é necessária, o processo de análise de imagem, conforme descrito na seção 4, pode ser semi-automatizado, começando a partir dos arquivos ND calibrados e executando uma macro com todas as etapas combinadas.
Resultados
Organoides de 212 indivíduos foram coletados durante as visitas clínicas de rotina. Nenhum evento adverso ocorreu durante ou após o procedimento de biópsia retal. Os organoides foram fotografados por um pesquisador cego para as características do sujeito, como genótipo e informações clínicas. Devido à baixa qualidade das imagens, 23 sujeitos foram excluídos. Exemplos de culturas organoides bem-sucedidas e fracassadas e aquisição de imagens podem ser vistos na Figura 2.
Discussão
Fornecemos um protocolo detalhado para análise da morfologia organológica retal (ADM). Os dois índices calculados com ROMA, RI e IC distinguiram organoides de indivíduos com FC daqueles sem FC com perfeita acurácia. A ROMA poderia, assim, funcionar como um novo ensaio fisiológico de CFTR complementar ao CEC e a outros testes atualmente disponíveis13,14,15.
O protocolo é dependente do uso de or...
Divulgações
Este estudo foi financiado pela associação belga de pacientes com FC "Mucovereniging/Association Muco", pela Bolsa de Pesquisa da Sociedade Belga de Pediatria BVK-SBP 2019 e por uma bolsa do Fundo UZ Leuven para Pesquisa Biomédica Translacional. Os autores declaram não haver conflito de interesses.
Agradecimentos
Agradecemos aos pacientes e pais que participaram deste estudo. Agradecemos a Abida Bibi por todo o trabalho de cultivo com os organoides. Agradecemos a Els Aertgeerts, Karolien Bruneel, Claire Collard, Liliane Collignon, Monique Delfosse, Anja Delporte, Nathalie Feyaerts, Cécile Lambremont, Lut Nieuwborg, Nathalie Peeters, Ann Raman, Pim Sansen, Hilde Stevens, Marianne Schulte, Els Van Ransbeeck, Christel Van de Brande, Greet Van den Eynde, Marleen Vanderkerken, Inge Van Dijck, Audrey Wagener, Monika Waskiewicz e Bernard Wenderickx pelo apoio logístico. Também agradecemos ao Mucovereniging/Association Muco, e especificamente a Stefan Joris e ao Dr. Jan Vanleeuwe, por seu apoio e financiamento. Agradecemos a todos os colaboradores do Projeto Organoide Belga: Hedwige Boboli (CHR Citadelle, Liège, Bélgica), Linda Boulanger (Hospitais Universitários de Lovaina, Bélgica), Georges Casimir (HUDERF, Bruxelas, Bélgica), Benedicte De Meyere (Hospital Universitário de Ghent, Bélgica), Elke De Wachter (Hospital Universitário de Bruxelas, Bélgica), Danny De Looze (Hospital Universitário de Ghent, Bélgica), Isabelle Etienne (CHU Erasme, Bruxelas, Bélgica), Laurence Hanssens (HUDERF, Bruxelas), Christiane Knoop (CHU Erasme, Bruxelas, Bélgica), Monique Lequesne (Hospital Universitário de Antuérpia, Bélgica), Vicky Nowé (GZA St. Vincentius Hospital Antuérpia), Dirk Staessen (GZA St. Vincentius Hospital Antuérpia), Stephanie Van Biervliet (Hospital Universitário de Gante, Bélgica), Eva Van Braeckel (Hospital Universitário de Gante, Bélgica), Kim Van Hoorenbeeck (Hospital Universitário de Antuérpia, Bélgica), Eef Vanderhelst (Hospital Universitário de Bruxelas, Bélgica), Stijn Verhulst (Hospital Universitário de Antuérpia, Bélgica), Stefanie Vincken (Hospital Universitário de Bruxelas, Bélgica).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
Referências
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados