Method Article
לכידת קונפורמציה של כרומוזומים על פני סולמות אורך
In This Article
Summary
Hi-C 3.0 הוא פרוטוקול Hi-C משופר המשלב פורמלדהיד ודיסוקינימידיל גלוטראט קרוסלינקרים עם קוקטייל של אנזימי הגבלה DpnII ו- DdeI כדי להגדיל את יחס האות לרעש ואת הרזולוציה של זיהוי אינטראקציית כרומטין.
Abstract
לכידת קונפורמציה של כרומוזומים (3C) משמשת לזיהוי אינטראקציות כרומטין תלת-ממדיות. בדרך כלל, קישור צולב כימי עם פורמלדהיד (FA) משמש לתיקון אינטראקציות כרומטין. לאחר מכן, עיכול כרומטין עם אנזים הגבלה וחיבור מחדש של קצות השבר לאחר מכן ממיר קרבה תלת-ממדית (3D) לתוצרי קשירה ייחודיים. לבסוף, לאחר היפוך של קישורים צולבים, הסרת חלבונים ובידוד דנ"א, הדנ"א נגזל ומוכן לריצוף בתפוקה גבוהה. תדירות קשירת הקרבה של זוגות לוקוסים היא מדד לתדירות הקולוקליזציה שלהם במרחב תלת-ממדי באוכלוסיית התא.
ספריית Hi-C ברצף מספקת מידע כלל-גנומי על תדרי אינטראקציה בין כל זוגות הלוקים. הרזולוציה והדיוק של Hi-C מסתמכים על הצלבה יעילה השומרת על מגעי כרומטין ועל פיצול תכוף ואחיד של הכרומטין. מאמר זה מתאר פרוטוקול Hi-C משופר באתרו , Hi-C 3.0, המגביר את היעילות של crosslinking על ידי שילוב של שני crosslinkers (פורמלדהיד [FA] ו disuccinimidyl גלוטראט [DSG]), ולאחר מכן עיכול עדין יותר באמצעות שני אנזימי הגבלה (DpnII ו- DdeI). Hi-C 3.0 הוא פרוטוקול יחיד לכימות מדויק של תכונות קיפול גנום בקני מידה קטנים יותר כגון לולאות ותחומים המשויכים טופולוגית (TADs), כמו גם תכונות בקנה מידה גדול יותר של גרעין כגון תאים.
Introduction
לכידת קונפורמציה של כרומוזומים נמצאת בשימוש מאז 20021. ביסודו של דבר, כל וריאנט לכידת קונפורמציה מסתמך על קיבוע של אינטראקציות DNA-חלבון וחלבון-חלבון כדי לשמר את ארגון הכרומטין התלת-ממדי. לאחר מכן מתבצע פיצול דנ"א, בדרך כלל על ידי הגבלת עיכול, ולבסוף, חיבור מחדש של קצוות דנ"א סמוכים כדי להמיר מוקדים פרוקסימליים מרחביים לרצפי דנ"א קוולנטיים ייחודיים. פרוטוקולי 3C ראשוניים השתמשו ב-PCR כדי לדגום אינטראקציות ספציפיות של "אחד על אחד". מבחני 4C מאוחרים יותר אפשרו זיהוי של אינטראקציות "אחד לכל"2, בעוד 5C זיהה אינטראקציות "רבים לרבים"3. לכידת קונפורמציית הכרומוזומים באה לידי ביטוי מלא לאחר יישום ריצוף הדור הבא בתפוקה גבוהה (NGS), שאיפשר זיהוי של אינטראקציות גנומיות "הכל לכל" באמצעות, Hi-C4 כלל-גנומי וטכניקות דומות כגון 3C-seq5, TCC6 ו- Micro-C 7,8 (ראו גם סקירה של Denker ו- De Laat9).
ב-Hi-C, נוקלאוטידים שעברו ביוטינילציה משמשים לסימון 5′ שלוחות לאחר העיכול ולפני הקשירה (איור 1). זה מאפשר בחירה של שברים מעוכלים כראוי religated באמצעות חרוזים מצופים streptavidin, מבדיל אותו GCC10. עדכון חשוב לפרוטוקול Hi-C יושם על ידי Rao et al.11, שביצעו את העיכול והחיבור מחדש בגרעינים שלמים (כלומר, באתרם) כדי להפחית תוצרי קשירת מזויפים. יתר על כן, החלפת עיכול HindIII בעיכול MboI (או DpnII) הפחיתה את גודל השבר והגדילה את פוטנציאל הרזולוציה של Hi-C. עלייה זו אפשרה זיהוי של מבנים בקנה מידה קטן יחסית ולוקליזציה גנומית מדויקת יותר של נקודות מגע, כגון לולאות DNA בין אלמנטים קטנים של ציס, למשל, לולאות בין אתרים הקשורים ל- CTCF שנוצרו על ידי שחול לולאה11,12. עם זאת, לפוטנציאל הזה יש מחיר. ראשית, עלייה של פי שניים ברזולוציה דורשת עלייה של פי ארבעה (22) בקריאות הרצף13. שנית, גודל השברים הקטנים מגדיל את האפשרות לטעות בניצול שגוי של שברים שכנים לא מעוכלים עבור שברים מעוכלים ורגישים14. כאמור, ב- Hi-C, שברים מעוכלים ומחוברים מחדש נבדלים משברים לא מעוכלים על ידי נוכחות ביוטין בצומת הקשירה. עם זאת, נדרשת הסרה נכונה של ביוטין מקצוות לא קשורים כדי להבטיח שרק צמתי קשירה יימשכו למטה14,15.
עם העלות הפוחתת של NGS, זה הופך להיות ריאלי לחקור קיפול כרומוזומים בפירוט רב יותר. כדי להקטין את גודל מקטעי הדנ"א, ובכך להגדיל את הרזולוציה, ניתן להתאים את פרוטוקול Hi-C לשימוש תכוף יותר באנזימי הגבלה16 או להשתמש בשילובים של אנזימי הגבלה17,18,19. לחלופין, ניתן לשרבט MNase 7,8 במיקרו-C ו-DNase ב-DNaseHi-C 20 כדי להשיג עיכול מיטבי.
הערכה שיטתית עדכנית של יסודות שיטות 3C הראתה כי הזיהוי של תכונות קיפול כרומוזומים בכל קנה מידה של אורך השתפר מאוד עם crosslinking רציף עם 1% FA ואחריו 3 mM DSG17. יתר על כן, Hi-C עם עיכול HindIII היה האפשרות הטובה ביותר לזיהוי תכונות קיפול בקנה מידה גדול, כגון תאים, וכי Micro-C היה מעולה בזיהוי תכונות קיפול בקנה מידה קטן כגון לולאות DNA. תוצאות אלה הובילו לפיתוח אסטרטגיה אחת ברזולוציה גבוהה "Hi-C 3.0", המשתמשת בשילוב של קרוסלינקרים של FA ו- DSG ולאחר מכן עיכול כפול עם DpnII ו- DdeI endonucleases21. Hi-C 3.0 מספק אסטרטגיה יעילה לשימוש כללי מכיוון שהוא מזהה במדויק תכונות קיפול בכל קני המידה באורך17. החלק הניסיוני של פרוטוקול Hi-C 3.0 מפורט כאן ותוצאות אופייניות שניתן לצפות לאחר ריצוף מוצגות.

איור 1: הליך Hi-C בשישה שלבים. התאים קבועים תחילה באמצעות FA ולאחר מכן DSG (1). לאחר מכן, ליזיס מקדים עיכול כפול עם DdeI ו- DpnII (2). ביוטין מתווסף על ידי מילוי תקרה וקצוות קהים פרוקסימליים נקשרים (3) לפני טיהור DNA (4). ביוטין מוסר מקצוות לא מחוברים לפני סוניקציה ובחירת גודל (5). לבסוף, משיכת ביוטין מאפשרת קשירת מתאם והגברה של הספרייה על ידי PCR (6). קיצורים: FA = פורמלדהיד; DSG = דיסוצ'ינימידיל גלוטראט; B = ביוטין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
1. קיבוע על ידי הצלבה
- קיבוע פורמלדהיד: החל מתאים במונולאייר
- זרעו תאים במדיום המתאים כדי לקצור 5 × 106 תאים לכל צלחת 150 מ"מ.
הערה: משתמשים יכולים לבחור כל מיכל מועדף המבטיח צמיחה אופטימלית של כל קו תאי יונקים. בנוסף, ניתן לבודד תאים מרקמה. - שאפו את המדיום עם פיפטה פסטר המצומדת למלכודת ואקום מצלחת 150 מ"מ, שטפו פי 2 עם ~ 10 מ"ל HBSS.
- מיד לפני ההצלבה, הכן תמיסת הצלבה של 1% FA בצינור של 50 מ"ל על ידי שילוב של 22.5 מ"ל של HBSS ו- 625 μL של 37% FA לריכוז סופי של 1%. מערבבים בעדינות על ידי נדנדה.
התראה: יש להשתמש במכסה אדים; פורמלדהיד הוא רעיל. - כדי להצליב את התאים, לשפוך 23.125 מ"ל של תמיסת FA 1% לכל צלחת 15 ס"מ.
- דוגרים בטמפרטורת החדר למשך 10 דקות ומנדנדים בעדינות את הצלחות ביד כל 2 דקות.
- הוסיפו 1.25 מ"ל של 2.5 מ' גליצין (128 מ"מ סופי) וסובבו בעדינות את הצלחת כדי להרוות את תגובת ההצלבה.
- יש לדגור בטמפרטורת החדר למשך 5 דקות ולהמשיך את הדגירה על הקרח למשך 15 דקות לפחות כדי להפסיק את ההצלבה.
- מגרדים את התאים מהצלחות בעזרת מגרד תאים או שוטר גומי.
- העבר את ההשעיה התא לצינור חרוטי של 50 מ"ל עם פיפט. צנטריפוגה ב-1,000 × גרם למשך 10 דקות בטמפרטורת החדר והשליכו את הסופר-נטנט על ידי שאיפה.
- שטפו את כדור התא פעם אחת עם 10 מ"ל של תמיסת מלח (DPBS) של דולבקו, תוך שימוש בפיפט להחייאה. לאחר מכן, צנטריפוגה ב 1,000 × גרם במשך 10 דקות בטמפרטורת החדר. המשך מיד לקישור צולב של DSG.
הערה: היזהר בעת שטיפת כדור התא מכיוון שכדורי התא עלולים להיות רופפים, ותאים עלולים ללכת לאיבוד.
- זרעו תאים במדיום המתאים כדי לקצור 5 × 106 תאים לכל צלחת 150 מ"מ.
- קיבוע פורמלדהיד: החל מתאים בהשעיה
- זרעו תאים במדיום מתאים כדי לקצור 5 × 106 תאים לכל כלי.
הערה: משתמשים יכולים לבחור כל מיכל מועדף המבטיח צמיחת תאים אופטימלית של כל קו תאי יונקים. - מיד לפני הקציר, לספור את התאים ולהעביר 5 × 106 תאים לצינור חרוטי 50 מ"ל.
- גלול בעדינות את התאים על ידי צנטריפוגה ב 300 × גרם במשך 10 דקות בטמפרטורת החדר.
- הכן תמיסת הצלבה של 1% FA על ידי הוספת 1.25 מ"ל של 37% FA ל-45 מ"ל של HBSS וערבב על ידי היפוך הצינור מספר פעמים.
הערה: הוסף את כל 1.25 מ"ל ה-FA מבלי לפצל את הסכום.
אזהרה: פורמלדהיד הוא רעיל ביותר. - השהה את גלולת התא בתמיסת ההצלבה של 46.25 מ"ל של 1% FA שהוכנה בשלב הקודם על ידי צנרת למעלה ולמטה.
- דגירה בטמפרטורת החדר למשך 10 דקות בדיוק על סיבוב, נדנדה, או על ידי היפוך ידני עדין של הצינור כל 1-2 דקות.
- הרוו את תגובת ההצלבה על ידי הוספת 2.5 מ"ל של 2.5 M גליצין (128 mM סופי) וערבבו היטב על ידי היפוך הצינור.
- דגירה במשך 5 דקות בטמפרטורת החדר, ולאחר מכן על קרח לפחות 15 דקות כדי להפסיק crosslinking לחלוטין.
- צנטריפוגה בטמפרטורת החדר כדי לזרוק את התאים הצולבים ב 1,000 × גרם במשך 10 דקות ולהשליך את supernatant על ידי שאיפה.
- שטפו את התאים פעם אחת עם 10 מ"ל של DPBS, ולאחר מכן צנטריפוגה ב 1,000 × גרם במשך 10 דקות בטמפרטורת החדר. יש להשליך את ה-supernatant לחלוטין באמצעות פיפט ולהמשיך מיד להצלבת DSG.
הערה: היזהר בעת שטיפת כדור התא מכיוון שכדורי התא עלולים להיות רופפים, ותאים עלולים ללכת לאיבוד.
- זרעו תאים במדיום מתאים כדי לקצור 5 × 106 תאים לכל כלי.
- הצלבה עם דיסוצ'ינימידיל גלוטראט
- החזירו את התאים הכדוריים ב-9.9 מ"ל של DPBS לפני הוספת 100 מיקרולטר של 300 mM DSG (3 mM סופי). מערבבים לפי היפוך.
הערה: DSG רגיש ללחות. חשוב להכין מלאי טרי של 300 mM DSG ב- DMSO ביום ההצלבה.
אזהרה: DSG ב-DMSO הוא רעיל ביותר. - קשר את התאים בטמפרטורת החדר למשך 40 דקות על סיבוב.
- הוסיפו 1.925 מ"ל של 2.5 מ' גליצין (400 מ"מ סופי), הפכו כדי לערבב ודגרו בטמפרטורת החדר למשך 5 דקות.
- צנטריפוגה התאים ב 2,000 × גרם במשך 15 דקות בטמפרטורת החדר.
הערה: היזהר בעת הסרת הסופרנטנט מכדורי תאים רופפים. - יש להשעות את הכדור ב-1 מ"ל של אלבומין בסרום בקר (BSA)-DPBS של 0.05% ולהעביר לצינור של 1.7 מ"ל.
הערה: תוספת של BSA יכולה לעזור להפחית את התגבשות התאים. - צנטריפוגה של התאים ב 2,000 × גרם במשך 15 דקות ב 4 מעלות צלזיוס ולהסיר את supernatant על ידי פיפט.
הערה: כדי למנוע אובדן של הכדור, הסר במהירות ובאופן מוחלט את הסופרנטנט. - הצמד להקפיא את הכדור בחנקן נוזלי ולאחסן ב -80 °C או מיד להמשיך לשלב הבא.
- החזירו את התאים הכדוריים ב-9.9 מ"ל של DPBS לפני הוספת 100 מיקרולטר של 300 mM DSG (3 mM סופי). מערבבים לפי היפוך.
2. לכידת קונפורמציה של כרומוזומים
- תזה של תאים ועיכול כרומטין
- יש לתלות מחדש (פיפט) את האליקוטים של התאים המקושרים (~5 × 106 תאים ) ב-1 מ"ל של חיץ ליזיס קר כקרח (מתכון בטבלה משלימה S1) המכיל 10 μL של קוקטייל מעכבי פרוטאזות ולהעביר להומוגנייזר של דאנס למשך דגירה של 15 דקות על קרח.
הערה: יש להוסיף מעכבי פרוטאז למאגר התזה מיד לפני השימוש. - הזיזו באיטיות את מזיק A למעלה ולמטה 30 פעמים כדי ליצור הומוגניות של התאים על הקרח ולדגור על הקרח למשך דקה אחת כדי לאפשר לתאים להתקרר, לפני עוד 30 פעימות.
- מעבירים את הליזאט לצינור מיקרוצנטריפוגה של 1.7 מ"ל.
הערה: שמור על ההשעיה בתנועה מכיוון שלעתים תאים נדבקים בקצה הפיפטה. - צנטריפוגה מתלה lysed ב 2,500 × גרם במשך 5 דקות בטמפרטורת החדר.
- השליכו את הסופר-נטנט והזיזו או מערבלו את הכדור הרטוב כדי לבצע החייאה. הסר כמה שיותר מהסופרנטנט כדי להשיג חומר דמוי יוגורט עם מינימום גושים.
- יש להשעות את הכדור ב-500 מיקרו-ליטר של 1x Restriction Buffer קר כקרח (מ-10x; ראו מתכון בטבלה המשלימה S1) ולהשתמש בצנטריפוגה למשך 5 דקות ב-2,500 × גרם. חזור על שלב זה לשטיפה שנייה.
הערה: הכדור במאגר הגבלה 1x הוא גרגירי יותר מהכדור הקודם במאגר תזה. - השהה את התאים בנפח סופי של 360 μL של 1x Restriction Buffer על ידי פיפטינג לאחר הוספת ~ 340 μL לנפח הנשיאה של הכדור, אשר תלוי בגודל התא.
- יש להפריש 18 μL מכל ליזאט לבדיקת תקינות הכרומטין (CI). אחסן את דגימות ה- CI ב- 4 °C.
- הוסיפו 38 μL של 1% נתרן דודציל סולפט (SDS) לכל צינור Hi-C (נפח כולל של 380 μL) וערבבו בזהירות על ידי פיפטינג מבלי להציג בועות.
אזהרה: SDS הוא רעיל. - דגירה של הדגימות בטמפרטורה של 65 מעלות צלזיוס מבלי לרעוד במשך 10 דקות בדיוק כדי לפתוח את הכרומטין.
- הניחו מיד את הצינורות על הקרח והכינו את תערובת העיכול עם Triton X-100 כדי להרוות את ה-SDS כמתואר בטבלה 1.
- הוסיפו 107 μL מתערובת העיכול לצינור Hi-C (487 μL סה"כ) כדי לעכל את הכרומטין למשך הלילה (~16 שעות) בטמפרטורה של 37 מעלות צלזיוס בתרמומיקסר עם רעידות מרווחים (למשל, 900 סל"ד, 30 שניות, 4 דקות הפסקה).
הערה: התוספת של טריטון לריכוז סופי של 1% משמשת להרוות את ה- SDS.
- יש לתלות מחדש (פיפט) את האליקוטים של התאים המקושרים (~5 × 106 תאים ) ב-1 מ"ל של חיץ ליזיס קר כקרח (מתכון בטבלה משלימה S1) המכיל 10 μL של קוקטייל מעכבי פרוטאזות ולהעביר להומוגנייזר של דאנס למשך דגירה של 15 דקות על קרח.
- ביוטינילציה של קצוות הדנ"א
- לאחר עיכול בן לילה, העבירו את הדגימות ל-65 מעלות צלזיוס למשך 20 דקות כדי להשבית את פעילות האנדונוקלאז הנותרת.
- במהלך הדגירה, הכינו תערובת אב למילוי כפי שמוצג בטבלה 2.
- לאחר הדגירה, הניחו את הדגימות מיד על קרח.
- מניחים בצד בקרת עיכול (DC) של 10 μL לכל דגימה ומאחסנים בטמפרטורה של 4 מעלות צלזיוס.
- הסר את העיבוי מהמכסה עם פיפט או על ידי סיבוב. לכל דגימה, יש להוסיף 58 μL של תערובת מילוי ביוטין (נפח דגימה כולל 535 μL) ופיפט בעדינות מבלי ליצור בועות.
- דגירה של הדגימות ב-23 מעלות צלזיוס למשך 4 שעות בתרמומיקסר (למשל, 900 סל"ד, 30 שניות, 4 דקות הפסקה).
- קשירת מקטעי דנ"א פרוקסימליים
- הכינו את תערובת הקשירה כפי שמוצג בטבלה 3 בזמן שמילוי הביוטין נמצא בדגירה.
- הוסף 665 μL של תערובת הקשירה לכל דגימה (נפח דגימה כולל 1,200 μL). מערבבים בעדינות על ידי פיפטציה.
- דגירה של הדגימות ב-16°C למשך 4 שעות בתרמומיקסר עם רעידות מרווחים (למשל, 900 סל"ד, 30 שניות על, 4 דקות הפסקה). אחסן דגימות אלה המכילות כרומטין מקושר באופן קוולנטי ב-4 מעלות צלזיוס למשך מספר ימים.
- היפוך של הצלבה
- הביאו את הנפחים של דגימות CI ו-DC ל-50 μL עם 1x Tris Low EDTA (TLE; ראו את המתכון בטבלה המשלימה S1).
- הוסף 10 μL של 10 מ"ג/מ"ל פרוטאינאז K לדגימות CI ו-DC.
- דגירה ב-65°C למשך הלילה עם רעידות מרווחים (למשל, 900 סל"ד, 30 שניות, 4 דקות הפסקה). לחלופין, בצע היפוך של 30 דקות של crosslinking עבור פקדים אלה במהלך טיהור DNA של דגימות Hi-C.
- לכל דגימת Hi-C, יש להוסיף 50 μL של 10 מ"ג/מ"ל פרוטאינאז K ולדגור בטמפרטורה של 65 מעלות צלזיוס למשך שעתיים לפחות עם רעידות מרווח (למשל, 900 סל"ד, 30 שניות, 4 דקות הפסקה).
- הוסיפו עוד 50 מיקרולטר של 10 מ"ג/מ"ל פרוטאינאז K לכל צינור Hi-C (נפח דגימה כולל 1,300 מיקרולטר) והמשיכו לדגור בטמפרטורה של 65 מעלות צלזיוס למשך הלילה. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס עד לטיהור הדנ"א.
הערה: פיצול הדגירה של Proteinase K מבטיח עיכול חלבון כולל.
- טיהור דנ"א
- מניחים לצינורות להתקרר מ-65°C עד לטמפרטורת החדר.
- מעבירים כל דגימה לצינור חרוטי של 15 מ"ל ומוסיפים 2.6 מ"ל (נפח פי 2) של פנול:כלורופורם:אלכוהול איזואמיל לכל צינור.
אזהרה: פנול:כלורופורם:אלכוהול איזואמיל הוא חומר מגרה רעיל מאוד ועלול להיות מסרטן. - מערבלים כל צינור למשך דקה אחת ולאחר מכן מעבירים את תכולתו לצינור נעילת פאזה של 15 מ"ל.
- צנטריפוגה את הדגימות במשך 5 דקות במהירות מקסימלית (1,500-3,500 × גרם) בצנטריפוגה על ספסל.
- שפכו בזהירות את הפאזה המימית לתוך צינור אולטרה-צנטריפוגה של 35 מ"ל והוסיפו מים אולטרה-פוריים לנפח סופי של 1,250 מיקרו-ליטר.
הערה: השתמש בצינורות כדי להתאים את האולטרה-צנטריפוגה הזמינה או התפצל למספר צינורות מיקרוצנטריפוגה. - מוסיפים נפחשל 1/10 (~125 μL) של 3 M נתרן אצטט ומערבבים היטב על ידי היפוך.
- הוסף נפח של 2.5x (~ 3.4 מ"ל) של 100% אתנול קר כקרח לכל דגימה, אזן את הצינורות עבור ultracentrifugation על ידי הוספת 100% אתנול קר כקרח, וערבב היטב על ידי היפוך.
- לדגום את הצינורות על קרח יבש במשך ~ 15 דקות (למנוע התמצקות).
- צנטריפוגה הצינורות ב 18,000 × גרם במשך 30 דקות ב 4 מעלות צלזיוס.
הערה: עבור רוטורים זוויתיים: סמן את הצינורות עבור המקום שבו הכדור יהיה. - בעזרת פיפטה, יש להסיר ולהשליך את הסופר-נטנט לחלוטין מהצד שאינו גלולה.
הערה: בשלב זה, הכדור צריך להיות גלוי וניתן לסמן אותו על הצינור, מכיוון שהוא לא יכול להיות גלוי בבירור לאחר הייבוש בשלב הבא. - יש לייבש באוויר את הדגימות במשך כ-10 דקות או עד שהן יבשות באופן נראה לעין.
- ניתן לבודד כל כדור בנפח של 450 μL של 1x TLE על ידי פיפטינג או מערבולת והעברה ליחידת מסנן צנטריפוגלית (CFU) של 0.5 מ"ל עם חיתוך משקל מולקולרי של 3 kDa.
- צנטריפוגה CFU במהירות מקסימלית במשך 10 דקות ולהשליך את הזרימה. יש לשטוף כל צינור אולטרה-צנטריפוגה עם 450 μL נוספים של 1x TLE ולהעביר ל- CFU שלו לשטיפה נוספת.
הערה: שטיפת CFU בדרך זו מגבילה את אובדן הדנ"א תוך הפחתת ריכוז המלח. - צנטריפוגה CFU במהירות מקסימלית במשך 10 דקות ולהשליך את הזרימה.
- הוסף 80 μL של 1x TLE לעמודה והפוך את הטור לצינור איסוף חדש לפני צנטריפוגה במשך 2 דקות במהירות מקסימלית כדי לקבל נפח סופי של ~ 100 μL.
- יש להוסיף 1 μL של RnaseA (1 מ"ג/מ"ל; דילול פי 10 של מלאי של 10 מ"ג/מ"ל) לכל דגימה ולדגור בטמפרטורה של 37°C על בלוק חום, באמבט מים או בתרמומיקסר למשך 30 דקות לפחות.
- לאחר הטיפול ב- Rnase, הסר את הדגימות מ- 37 °C ואחסן ב- 4 °C עד לשלב בקרת האיכות.
- בדיקת איכות הכרומטין, עיכול אנזימים וקשירת דגימות
- קרר את דגימות CI ו- DC לטמפרטורת החדר לאחר היפוך הקישורים הצולבים בשלב 2.4.5. לאחר מכן, העבר לצינור נעילת פאזה של 2 מ"ל.
הערה: ודא שתכולת נעילת הפאזה היא צנטריפוגה לכדור (מהירות מרבית למשך 2 דקות). - הוסף 200 μL של פנול:כלורופורם:אלכוהול איזואמיל וערבב את הדגימות על ידי מערבולת במשך דקה אחת.
- צנטריפוגה את הצינורות במשך 5 דקות במהירות מקסימלית.
- העבר את הפאזה המימית מכל דגימה (~ 50 μL) לצינור מיקרופוגה חדש של 1.7 מ"ל.
- יש להוסיף 1 μL של Rnase A (מ-1 מ"ג/מ"ל) ולדגור בטמפרטורה של 37°C למשך 30 דקות לפחות.
- העמיסו את הדגימות על ג'ל אגרוז של 0.8% כפי שמומלץ בטבלה 4.
הערה: התוצאות הצפויות מבקרת איכות מוצגות באיור 2. - כימות הדנ"א על ידי דחיסות מהג'ל או באמצעות קיוביט או ננודרופ.
הערה: כימות מדויק מבטיח את נפח הקלט הנכון בחלק הבא של הפרוטוקול. השתמש במספר תקנים עם כמות ידועה כדי לבנות עקומה סטנדרטית.
- קרר את דגימות CI ו- DC לטמפרטורת החדר לאחר היפוך הקישורים הצולבים בשלב 2.4.5. לאחר מכן, העבר לצינור נעילת פאזה של 2 מ"ל.
טבלה 1: ריאגנטים לעיכול. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: ריאגנטים למילוי ביוטין. *שים לב שאנזימים משתנים עשויים לדרוש מאגרים שונים ו-dNTPs שעברו ביוטינילציה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: ריאגנטים לתערובת ליגציה. קיצור: BSA = אלבומין בסרום בקר. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: פרמטרים להעמסת ג'ל להערכת איכות ובחירת גודל. אנא לחץ כאן כדי להוריד טבלה זו.
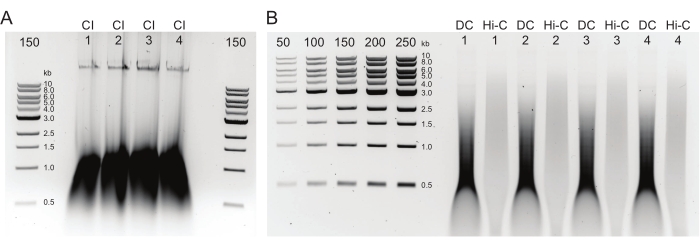
איור 2: ג'ל אגרוז המציג תוצאות בקרת איכות טיפוסיות לאחר טיהור DNA . (A) בקרת CI צריכה להצביע על פס של דנ"א בעל משקל מולקולרי גבוה. (B) דגימות DC ו-Hi-C מראות מגוון גדלים של דנ"א. דגימת Hi-C, לאחר ששולבה לשברים גדולים יותר, צריכה להיות בעלת משקל מולקולרי גבוה יותר מה-DC. טווח הריכוזים של הסמנים מאפשר יצירת עקומה סטנדרטית. שים לב, בדוגמה זו, ה- CI נטען על ג'ל נפרד, אך מומלץ לטעון ולהפעיל את כל הדגימות והפקדים יחד. קיצורים: CI = שלמות הכרומטין; DC = בקרת עיכול; Hi-C = קרבה-ליגה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. הכנת ספריית ריצוף Hi-C
- הסרת ביוטין מקצוות לא קשורים
- הכן תגובות להסרת ביוטין כפי שמוצג בטבלה 5.
הערה: בדרך כלל, 10 מיקרוגרם דנ"א מספיקים, אך ניתן להשתמש בעד 30 מיקרוגרם. - הפץ 2 x 65 μL aliquots מכל תגובה של 130 μL לשני צינורות PCR.
- העברה לתרמוציקלר או למכונת PCR ודגירה כמתואר בטבלה 5.
הערה: ניתן לאחסן כאן דגימות בטמפרטורה של 4 מעלות צלזיוס (ימים עד שבועות), -20°C (לטווח ארוך), או להעביר אותן מיד לסוניקציה.
- הכן תגובות להסרת ביוטין כפי שמוצג בטבלה 5.
- סוניקציה
- איחד את כפילויות הדגימה משלב הסרת הביוטין (נפח דגימה כולל של 130 μL) לצינור סוניקטור של 130 μL עבור סוניקציה.
- סוניק את הדגימות באמצעות הפרמטרים שניתנו בטבלה 6 כדי להשיג התפלגות צרה הדוקה מתחת ל- 500 bp.
הערה: ניתן להשתמש בסוגים שונים של סוניקטורים, אך עבור התפלגות מקטע צרה (100-500 bp), הגדרות הסוניקטור עשויות לדרוש אופטימיזציה.
- בחירת גודל עם חרוזים מגנטיים
- פירמוט הדנ"א הסוניקטי מצינור(ים) הסוניקטור לצינור קשירה נמוך של 1.7 מ"ל.
- הבא כל דגימה לנפח כולל של 500 μL עם TLE אחד. נסה לקבל את עוצמת הקול קרוב ככל האפשר ל 500 μL, שכן היחס בין המדגם לתערובת חרוזים מגנטיים הוא חיוני לבחירת גודל.
- הוסף 400 μL של תערובת חרוזים מגנטיים לכל צינור כדי להשיג יחס של תערובת חרוזים מגנטיים לנפח הדגימה של 0.8.
הערה: בתנאים אלה, חרוזים לוכדים מקטעי דנ"א >300 bp, שיהיו השבר העליון. הסופר-נאטנט יכיל שברים <300 bp, שיהיו השבר התחתון. - מערבבים את הצינורות על ידי מערבולת ודוגרים במשך 10 דקות בטמפרטורת החדר על סיבוב. עבור יחסי בחירת גודל אלה ואחרים, ודא שהנפח המלא של המדגם מתערבב היטב. חפש את "מצב לא יציב" כי כמה רוטורים יש, אשר עובד היטב עבור נפחים קטנים יותר.
- דגירה במשך 5 דקות בטמפרטורת החדר על מפריד חלקיקים מגנטי (MPS).
- בזמן הדגירה, הוסיפו 500 μL מתערובת החרוזים המגנטיים לצינור קשירה טרי של 1.7 μL נמוך עבור כל דגימה.
הערה: צינורות אלה ישמשו לבחירת הגודל הבא של החלק התחתון על ידי יצירת תערובת חרוזים מגנטיים ליחס דגימה של 1.1:1. - השאר את הצינורות על MPS במשך 5 דקות.
- הסר את supernatant מן החרוזים ו resupancy עם 150 μL של תערובת חרוזים מגנטיים.
הערה: שלב זה מונע רוויה של החרוזים עם DNA על ידי הגדלת מספר החרוזים מבלי להגדיל את נפח. - העבר את הסופר-נטנט משלב 3.3.5 לצינור המסומן המוכן לבחירת השבר התחתון (שלב 3.3.8).
הערה: 150 μL של תערובת חרוזים מגנטיים + 400 μL של תערובת חרוזים מגנטיים 0.8x (550 μL סה"כ) חלקי 500 μL של דגימה ראשונית = 1.1x תערובת חרוזים מגנטיים ליחס דגימה. - מערבבים את צינורות השבר התחתון על ידי מערבולת ודוגרים במשך 10 דקות בטמפרטורת החדר על סיבוב.
הערה: החרוזים יקשרו מקטעי דנ"א >100 bp, והתוצאה תהיה שבר סופי הקשור לחרוזים של 100-300 bp. - שים את צינורות השבר התחתון על MPS למשך 5 דקות (טמפרטורת החדר).
- הסר את הסופרנטנט וצנטריפוגה של הצינורות לזמן קצר כדי להסיר עוד יותר את הסופרנטנט ככל האפשר.
- שטפו את החרוזים משני השברים פעמיים באמצעות 200 μL של 70% אתנול והחזירו את החרוזים למשך 5 דקות על MPS בכל פעם.
- לאחר סיבוב מהיר בצנטריפוגה, הסר את האתנול לחלוטין ויייבש עוד יותר את החרוזים ב- MPS.
הערה: יש לייבש עד שהאלכוהול מתאדה לחלוטין. הכדור צריך להיראות כמו שוקולד מריר ללא פיצוח (יכול לקחת ~ 10 דקות). - השהה מחדש את שני השברים ב- 50 μL של מאגר TLE 1x. יש לדגור בטמפרטורת החדר למשך 10 דקות ולהקיש או להזיז את הצינורות כל דקה נוספת כדי לעורר ערבוב והבהרה.
- הפרד את החרוזים מהסופרנטנט ב- MPS למשך 5 דקות עבור שני השברים.
- שמור את הסופר-נטנט מכל דגימה. מכניסים את הסופר-נאטנט לצינור קשירה נמוך של 1.7 מ"ל.
הערה: ניתן לשמור את הדגימות בטמפרטורה של 4 מעלות צלזיוס למשך מספר ימים או בטמפרטורה של -20 מעלות צלזיוס לטווח ארוך. - הפעל ג'ל אגרוז של 2% כמו בטבלה 4 כדי לקבוע את איכות המדגם וכמותו. ראו איור 3 כדוגמה לג'ל כזה.
הערה: אם מניסיון, סוניקציה ניתנת לשחזור רב, ניתן לדלג על ג'ל זה ולהמשיך לסיים את התיקון באופן מיידי. מומלץ למשתמשים להחזיק את השברים העליונים עד לאחר טיטרציה PCR. ניתן להציל כמויות דנ"א לא אופטימליות שידרשו הרבה הגברה של PCR מחומר בחלק העליון. - לכמת את כמות הדנ"א מהג'ל ישירות לאחר יצירת עקומה סטנדרטית מכניסת סולם הדנ"א הידועה או באמצעות קיוביט או ננודרופ.
- תיקון סוף
- הכינו את תערובת התיקון הסופית כמו בטבלה 7 (כמות לכל תגובה שניתנה).
- מעבירים את 46 ה-μL הנותרים של דנ"א מלוטש מהשבר התחתון לצינורות PCR ומוסיפים 24 מיקרון מתערובת תיקון הקצה המוכנה. דגירה במכונת PCR, כפי שהוצע בטבלה 7.
- לאחר השלמת התוכנית, שמור את הדגימות בטמפרטורה של 4 מעלות צלזיוס עד למשיכה כלפי מטה.
- משיכה כלפי מטה של מוצרי קשירה ביוטיניליים עם חרוזי ציפוי סטרפטאבידין
- קבעו את כמות החרוזים המצופים בסטרפטווידין עבור כל ספרייה מתוך בחירת הגודל המאומת (שלב 3.3.19).
הערה: חרוזים מצופים סטרפטאבידין אלה (תמיסה של 10 מ"ג/מ"ל) יכולים לקשור 20 מיקרוגרם של DNA דו-גדילי לכל חרוזים מ"ג (= 20 מיקרוגרם / 100 מיקרוגרם חרוזים). השתמש ב- 2 μL עבור כל 1 מיקרוגרם של DNA Hi-C אך לא פחות מ- 10 μL. - מערבבים את החרוזים המצופים בסטרפטאבידין ומקטרים את נפח החרוזים הדרושים לכל ספרייה (שחושבו בשלב הקודם) לצינורות קשירה נמוכים של 1.7 מ"ל בודדים.
- יש להשעות את החרוזים ב-400 מיקרו-ליטר של מאגר הכביסה של Tween (TWB; ראו מתכון בטבלה המשלימה S1) ולדגור במשך ~3 דקות בטמפרטורת החדר על מסובב (ראו הוראות בשלב 3.3.4).
- הפרד את החרוזים מהסופרנטנט ב- MPS למשך דקה אחת והסר את הסופרנטנט.
- לשטוף את החרוזים על ידי pipetting עוד 400 μL של TWB.
- הפרד את החרוזים מהסופרנטנט ב- MPS למשך דקה אחת והסר את הסופרנטנט.
- הוסף 400 μL של 2x מאגר כריכה (BB) (מתכון בטבלה משלימה S1) לחרוזים והחייאה. בנוסף, הוסף 330 μL של 1x TLE ואת הפתרון מתיקון קצה (משלב 3.4.3).
- דגירה של הדגימות במשך 15 דקות בטמפרטורת החדר תוך כדי ערבוב על רוטטור.
- הפרד את החרוזים מהסופרנטנט ב- MPS למשך דקה אחת והסר את הסופרנטנט.
- הוסף 400 μL של 1x BB לחרוזים והחייאה.
- הפרד את החרוזים מהסופרנטנט ב- MPS למשך דקה אחת והסר את הסופרנטנט.
- הוסיפו 100 מיקרון ליטר של 1x TLE כדי לשטוף את החרוזים.
- הפרד את החרוזים מהסופרנטנט ב- MPS למשך דקה אחת והסר את הסופרנטנט.
- לבסוף, הוסף 41 μL של 1x TLE כדי להשעות את החרוזים.
- קבעו את כמות החרוזים המצופים בסטרפטווידין עבור כל ספרייה מתוך בחירת הגודל המאומת (שלב 3.3.19).
- א-זנב
- הכינו את תערובת ה-A-tailing כמו בטבלה 8.
- צירו את התגובות לצינורות PCR ודגירה כמו בטבלה 8.
- הניחו את צינורות ה-PCR על קרח מיד לאחר ההסרה מהתרמוציקלר והעבירו את התכולה לצינורות קשירה נמוכים של 1.7 מ"ל.
- הפרד את החרוזים מהסופרנאטנט ב- MPS למשך דקה אחת והשליך את הסופרנטנט.
- הוסף 400 μL של חיץ קשירה 1x, מדולל מ 5x T4 DNA ליגאז חיץ עם מים אולטרה-טהורים.
- הפרד את החרוזים מהסופרנאטנט ב- MPS למשך דקה אחת, ולאחר מכן השליך את הסופרנטנט.
- הוסף מאגר קשירת 1x לנפח סופי של 40 μL.
- מתאם חישול אוליגוס
- הכינו מלאי אוליגו מתאם של 100 מיקרומטר (טבלה 9).
הערה: הזמינו 250 nmoles של אוליגוס מטוהרים על ידי HPLC. - אנאל את המתאמים בצינורות PCR כמתואר בטבלה 9.
- השתמש בתרמוציקלר PCR כדי להעלות בהדרגה את הטמפרטורה ב-0.5 °C/s ל-97.5 °C. החזק בטמפרטורה של 97.5°C למשך 2.5 דקות.
- השתמש בתרמוציקלר PCR כדי להעלות בהדרגה את הטמפרטורה ב-0.1 °C/s למשך 775 מחזורים (להגיע ל-20 °C). יש להחזיק את הטמפרטורה ב-4 מעלות צלזיוס עד לשימוש נוסף.
- הוסף 83 μL של חיץ חישול 1x (מתכון בטבלה משלימה S1) כדי לדלל את המתאמים ל-15 μM. אחסן את המתאמים בטמפרטורה של -20°C.
- הכינו מלאי אוליגו מתאם של 100 מיקרומטר (טבלה 9).
- קשירת מתאם רצף
- הכן את תערובת קשירת המתאם בצינור קשירה נמוך של 1.7 מ"ל (טבלה 10).
- ליגייט במשך שעתיים בטמפרטורת החדר.
- הפרד את החרוזים מהסופרנאטנט ב- MPS למשך דקה אחת והשליך את הסופרנטנט.
- מוסיפים 400 μL של TWB ומעבירים את החרוזים למעלה ולמטה בזהירות לפני הדגירה על המסובב במשך 5 דקות בטמפרטורת החדר. הפרד את החרוזים מהסופר-נטנט ב- MPS וחזור על שלב זה פעם נוספת.
- הפרד את החרוזים מהסופרנאטנט ב- MPS (~ 1 דקות), השליך את הסופרנטנט והוסף 200 μL של 1x BB.
- הפרד את החרוזים מהסופרנאטנט ב- MPS (~ דקה אחת) והשלך את הסופרנטנט.
- הוסף 200 μL של חיץ קדם-PCR 1x (מ-10x; מתכון בטבלה משלימה S1) והעבר לצינור קשירה נמוך חדש של 1.7 מ"ל.
- הפרד את החרוזים מהסופרנאטנט ב- MPS (~ דקה אחת) והשלך את הסופרנטנט.
- הוסף 20 μL של 1x טרום PCR Buffer ומערבבים על ידי פיפטציה.
- יש לשמור את הצינורות על הקרח בזמן השימוש או לאחסן בטמפרטורה של 4°C.
- אופטימיזציה של מספר מחזור ה-PCR על ידי טיטרציה
- הגדר 30 μL של תגובות תערובת אב לכל דגימה כמו בטבלה 11 (כמות לכל תגובה שניתנה).
- הפעל את המספר הנמוך ביותר של מחזורים ולקחת aliquot 5 μL. הפעל 2-3 מחזורים נוספים על התגובה הנותרת לפני נטילת 5 μL aliquot הבא. חזור על הפעולה כדי לאסוף ארבעה אליקוטים.
- השתמש בפרמטרים של PCR מטבלה 11 עבור כל aliquot.
- הוסף 5 μL של מים ו-2 μL של 6x צבע לכל דגימה של 5 μL. הפעל על ג'ל TBE של 2% אגרוז (מתכון בטבלה משלימה S1) עם 25-150 ננוגרם של סולם משקל מולקולרי נמוך. ראו איור 4 לקבלת התוצאות הצפויות.
הערה: מספר אופטימלי של מחזורים עבור הגברת PCR סופית בספרייה [שלב 3.10] הוא המספר הנמוך ביותר של מחזורים כדי לקבל מוצר נראה לעין על הג'ל פחות מחזור אחד.
- הגברה סופית של PCR בספרייה
- הגדר תגובות של 12 x 30 μL כדי להגביר כל ספריה סופית לריצוף כמו בטבלה 11.
- מחזור תגובות ה-PCR לפי טבלה 11 לאחר קביעת מספר המחזורים לאחר טיטרציה של PCR (שלב 3.9.3).
- לאחר השלמת ה-PCR, איחד את דגימות השכפול לתוך צינור מיקרופוגה בעל קשירה נמוכה של 1.7 מ"ל.
- הנח את הצינורות על ה- MPS והעבר את ה- supernatant לצינור מיקרופוגה חדש עם קשירה נמוכה של 1.7 מ"ל.
- החזירו את שאריות החרוזים המצופים בסטרפטווידין ב-20 מיקרו-ליטר של מאגר אחד לפני PCR.
הערה: ניתן לעשות שימוש חוזר בתבנית זו כאשר היא מאוחסנת ב-4 °C למשך ימים עד שבועות או לטווח ארוך ב-20°C-.
- הסרת פריימרים עם תערובת חרוזים מגנטיים
- השתמש במאגר TLE אחד (מתכון בטבלה משלימה S1) כדי לכוונן את עוצמת הקול משלב 3.10.4 ל-360 μL בדיוק.
- לכל דגימה, הוסיפו 360 μL מתערובת החרוזים המגנטיים ופיפטה למעלה ולמטה כדי לערבב.
- על רוטטור, מערבבים את הדגימות במשך 10 דקות בטמפרטורת החדר.
- הפרידו את החרוזים מהסופר-נטנט ב-MPS בטמפרטורת החדר (3-5 דקות).
- שטפו את החרוזים פעמיים באמצעות 200 מיקרוליטר של 70% אתנול והחזירו את החרוזים למשך 5 דקות על MPS בכל פעם.
- סיבוב מהיר בצנטריפוגה ופיפטה מוחלטת מהאתנול. יבשו את החרוזים באוויר על ה-MPS כדי לאדות עוד יותר את האתנול.
הערה: הכדור צריך להיראות כמו שוקולד מריר ללא פיצוח (יכול לקחת ~ 10 דקות). - יש להוסיף 30 μL של מים אולטרה-טהורים ולהשהות את הדנ"א למשך 10 דקות בטמפרטורת החדר. הזיזו את הצינורות כל 2 דקות כדי לסייע בערבוב.
- הפרד את החרוזים מהסופר-נטנט ב- MPS למשך 5 דקות.
- אסוף את הסופרנטנט מכל דגימה בצינור טרי של 1.7 מ"ל.
- הפעל 1 μL של הספרייה על 2% agarose TBE (מתכון בטבלה משלימה S1) ג'ל כדי לקבל התפלגות גודל שבר ולכמת את הספרייה הסופית (איור 5).
הערה: עיכול ClaI יכול להתרחש רק עבור צמתים DpnII-DpnII ומשמש כבקרת קשירה חיובית שאמורה לגרום להתפלגות גודל מקטע נמוכה יותר עבור הספרייה הסופית. ספריות סופיות ניתן לאחסן במשך כמה ימים ב 4 °C, לטווח ארוך ב -20 °C, או מיד מדולל ונשלח לריצוף.
טבלה 5: ריאגנטים להסרת ביוטין וטמפרטורות אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 6: פרמטרים לסוניקציה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 7: ריאגנטים לתיקון קצה וטמפרטורות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 8: ריאגנטים וטמפרטורות A-tailing. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 9: פריימרים PCR ואוליגוים עם מתאם קצה מזווג עם ריאגנטים לחישול. קיצור: 5PHOS = 5 ' פוספט. כוכביות מציינות בסיסי דנ"א זרחניים. # שלב אוליגו באינדקס עם אוליגו אוניברסלי כדי להפוך אותו למתאם בעל אינדקס. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 10: ריאגנטים לקשירת מתאם. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 11: ריאגנטים PCR ופרמטרים לרכיבה על אופניים. אנא לחץ כאן כדי להוריד טבלה זו.

איור 3: ג'ל אגרוז המציג תוצאות בחירה טיפוסיות לאחר גודל. מוצגים השברים העליונים והתחתונים עבור ארבע דגימות (ממוספרות 1-4) של DpnII-DdeI Hi-C. הנתיב הראשון עבור כל דגימה מכיל את השבר העליון, הנגזר מתערובת חרוזים מגנטיים 0.8x, והנתיב השני והשלישי מכילים דילול של השבר התחתון הנגזר מתערובת חרוזים מגנטיים 1.1x. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: ג'ל אגרוז עם תוצאות טיטרציה של PCR. החל מ-5 מחזורים של PCR, דגימות נלקחות לאחר כל 2 מחזורים (5, 7, 9 ו-11 מחזורים) עבור כל אחת מארבע ספריות. בהתבסס על נתון זה, 6 מחזורים נבחרו כמחזור האופטימלי עבור כל דגימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
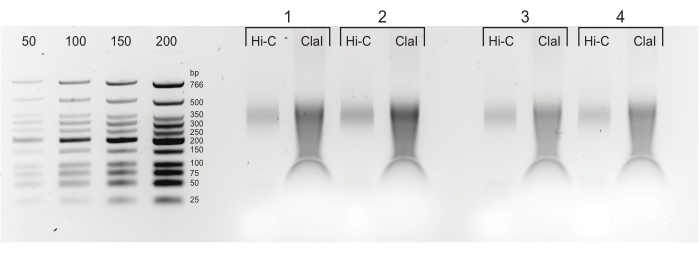
איור 5: מוצרי PCR סופיים. לאחר ניקוי ובחירת גודל, מוצרי PCR (Hi-C) הועמסו ליד חלק מעוכל ClaI של אותה ספרייה (ClaI). שברים מעוכלים ClaI מצביעים על נוכחות של קשירת DpnII-DpnII מבוקשת. שים לב ש- ClaI אינו מעכל צמתי DpnII-DdeI, ולכן לא כל הקשיריות יתרמו להקטנת גודל מהגבלה זו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
הדמויות בכתב יד זה נוצרו מניסוי נפרד, משוכפל, של זה שפורסם בעבר על ידי Lafontaine et al.21. לאחר קבלת נתוני רצף בתפוקה גבוהה, קולקטיב הכרומטין הפתוח (Open2C: https://github.com/open2c) שימש לעיבוד נתוני Hi-C. צינור דומה ניתן למצוא בפורטל הנתונים של פרויקט נוקלאום 4D (https://data.4dnucleome.org/resources/data-analysis/hi_c-processing-pipeline). בקצרה, מזקקת צינור Nextflow (https://github.com/open2c/distiller-nf) יושמה כדי (1) ליישר את הרצפים של מולקולות Hi-C לגנום הייחוס, (2) לנתח קבצי יישור .sam וליצור קבצים עם זוגות Hi-C, (3) לסנן כפילויות PCR, ו-(4) זוגות מצטברים למטריצות משולבות של אינטראקציות Hi-C. מטריצות בפורמט HDF5 אלה, הנקראות צידניות, ניתנות לצפייה (1) בשרת HiGlass (https://higlass.io/) ו-(2) לניתוח באמצעות קבוצה גדולה של כלים חישוביים בקוד פתוח הנמצאים באוסף "cooltools" המתוחזק על ידי קולקטיב הכרומטין הפתוח (https://github.com/open2c/cooltools) כדי לחלץ ולכמת תכונות קיפול כגון תאים, TADs ולולאות.
ניתן להעריך כמה מדדי איכות של ספריות Hi-C3.0 מיד לאחר מיפוי זוגות קריאה לגנום ייחוס, באמצעות כמה מדדים / אינדיקטורים פשוטים. ראשית, בדרך כלל ~50% מזוגות הקריאה המרוצפים ניתנים למיפוי ייחודי עבור תאים אנושיים. בשל האופי הפולימרי של הכרומוזומים, רוב הקריאות הממופות הללו (~60%-90%) מייצגות אינטראקציות בתוך כרומוזום (cis), כאשר תדרי האינטראקציה מתפוררים במהירות עם הגדלת המרחק הגנומי (דעיכה תלוית מרחק). ניתן לדמיין את הדעיכה התלויה במרחק בצורה הטובה ביותר ב"חלקת קנה מידה", המציגה את הסתברות המגע (לכל זרוע כרומוזום) כפונקציה של מרחק גנומי. מצאנו ששימוש בקישורים ואנזימים שונים יכול לשנות את הדעיכה התלויה במרחק במרחקים ארוכים וקצרים17. התוספת של קישור צולב DSG מגבירה את יכולת הגילוי של אינטראקציות במרחקים קצרים בשילוב עם אנזימים כגון Mnase ושילובים של DpnII-DdeI שמייצרים שברים קטנים יותר (איור 6A).
ניתן גם לצפות בדעיכה תלוית מרחק ישירות ממטריצות אינטראקציה דו-ממדיות: אינטראקציות נעשות נדירות יותר כאשר הן ממוקמות רחוק יותר מהאלכסון המרכזי (איור 6B). בנוסף, ניתן לזהות תכונות קיפול גנומיות, כגון תאים, TADs ולולאות ממטריצות Hi-C ומזימות קנה מידה כסטיות מהדעיכה הממוצעת התלויה במרחק הממוצע של הגנום הכללי. חשוב לציין שהצלבה עם DSG בנוסף ל-FA מפחיתה קשירה אקראית, שאינה מוגבלת בשל האופי הפולימרי של הכרומוזומים, ולכן סביר יותר שתתרחש בין כרומוזומים (בטרנס) (איור 6C). הפחתת קשירת אקראיות מובילה ליחסי אות לרעש מוגברים, במיוחד עבור אינטראקציות תוך-כרומוזומליות בין-כרומוזומליות וארוכות טווח מאוד (>10-50 מגה-בתים).

איור 6: תוצאות מייצגות של ספריות Hi-C ממופות ומסוננות. (A) עלילות קנה מידה עם הסתברות מגע ונגזרתה עבור אנזימים שונים, מסודרים לפי אורך השבר (למעלה) והצלבה עם FA או FA + DSG (למטה). עיכול עם MNAse (microC) או DpnII-DdeI (Hi-C 3.0) מגדיל באופן משמעותי את המגעים לטווח קצר (למעלה) וכך גם הוספת DSG ל-FA (למטה). (B) עמודות מציגות מפות חום Hi-C של עיכול DpnII לאחר הצלבת FA בלבד ועיכול DpnII או DdeI לאחר קישור צולב של FA+DSG. חיצים לבנים מראים חוזק הולך וגובר של "נקודות" לאחר הצלבת DSG ועיכול DdeI, מה שמרמז על זיהוי טוב יותר של לולאות DNA. שורות מציגות חלקים שונים של כרומוזום 3 ברזולוציה הולכת וגדלה, תוך יישור עם לוח C: שורה עליונה: כרומוזום שלם 3 (0-198,295,559 Mb); שורה אמצעית: 186-196 מגהבייט; שורה תחתונה: 191.0-191.5 Mb. (C) גרפי כיסוי עבור האזורים המתוארים ב-A. חצים שחורים מציגים את הכיסוי הנמוך יותר (%cis reads) עבור קישור צולב של FA בלבד. קיצורים: FA = פורמלדהיד; DSG = דיסוצ'ינימידיל גלוטראט; chr = כרומוזום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
לא כל הקריאות הממופות שימושיות. מחוון איכות שני הוא מספר כפילויות PCR. קריאות כפולות מדויקות אינן סבירות מאוד להתרחש במקרה לאחר קשירה וסוניקציה. לפיכך, קריאות כאלה ככל הנראה נבעו מהגברת PCR וצריך לסנן אותן. כפילויות מתעוררות לעתים קרובות כאשר נדרשים מחזורי PCR רבים מדי כדי להגביר ספריות בעלות מורכבות נמוכה. באופן כללי, עבור Hi-C, רוב הספריות זקוקות רק ל-5-8 מחזורים של הגברה סופית של PCR, כפי שנקבע על-ידי טיטרציה PCR (ראה שלב 3.9; איור 4). עם זאת, ספריות עם מורכבות מספקת ניתן להשיג גם לאחר 14 מחזורים של הגברת PCR.
קטגוריה נוספת של קריאות כפולות, מה שמכונה כפילויות אופטיות, יכולה לנבוע מתהליך ההגברה בפלטפורמות ריצוף Illumina המשתמשות בתאי זרימה מעוצבים (כגון HiSeq4000). כפילויות אופטיות מתגלות כתוצאה מעומס יתר על תא הזרימה, מה שגורם לצבירים (גדולים) להיקרא שני צבירים נפרדים, או מקיבוץ מחדש מקומי של המולקולה הזוגית המקורית לאחר סיבוב ראשון של PCR. מכיוון ששני סוגי הכפילויות האופטיות הם מקומיים, ניתן לזהות אותם ולהבחין בינם לבין כפילויות PCR לפי מיקומם בתא הזרימה. בעוד שספריות עם כפילויות PCR של >15% יזדקקו לשחזור, ספריות עם כפילויות אופטיות יכולות להיטען מחדש לאחר אופטימיזציה של תהליך הטעינה.
טבלה משלימה S1: מאגרים ופתרונות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
שלבים קריטיים לטיפול בתאים
למרות שניתן להשתמש במספר נמוך יותר של תאי קלט, פרוטוקול זה עבר אופטימיזציה עבור ~ 5 × 106 תאים לכל נתיב ריצוף (~ 400 M קריאה) כדי להבטיח מורכבות נאותה לאחר ריצוף עמוק. התאים נספרים בצורה הטובה ביותר לפני הקיבוע. עבור הדור של ספריות אולטרה-עמוקות, אנו בדרך כלל מכפילים את מספר הנתיבים (והתאים) עד להגעה לעומק הקריאה הרצוי. לקיבוע אופטימלי, יש להחליף מדיום המכיל סרום ב- PBS לפני קיבוע FA, ולהוסיף פתרונות מקבעים באופן מיידי וללא שיפועי ריכוז15,22. עבור קצירת תאים, גירוד עדיף על פני טריפסיניזציה, מכיוון שהמעבר מצורה שטוחה יותר לצורה כדורית לאחר טריפסיניזציה עלול להשפיע על הקונפורמציה הגרעינית. לאחר תוספת של DSG, כדורי תאים רופפים ומגושמים הולכים לאיבוד בקלות. היזהר בעת טיפול בתאים בשלב זה והוסף עד 0.05% BSA כדי להפחית גושים.
שינויים בשיטה
פרוטוקול זה פותח באמצעות תאים אנושיים17. עם זאת, בהתבסס על ניסיון עם לכידת קונפורמציה כרומוזומית, פרוטוקול זה אמור לעבוד עבור רוב התאים האאוקריוטים. עבור קלט נמוך משמעותית (~1 × 106 תאים), אנו ממליצים להשתמש במחצית מהנפחים עבור הליכי לכידת התזה והקונפורמציה [שלבים 2.1-2.4]. זה גם יאפשר לבצע בידוד דנ"א [שלב 2.5] בצנטריפוגה שולחנית עם צינורות של 1.7 מ"ל, מה שיכול לשפר את הכדוריות לריכוזי דנ"א נמוכים. כימות הדנ"א (שלב 2.6.6) יציין כיצד להמשיך. עבור כמויות נמוכות של דנ"א מבודד (1-5 מיקרוגרם), אנו מציעים לדלג על בחירת הגודל (שלב 3.3) ולהמשיך בהסרת ביוטין לאחר הקטנת הנפח מ-130 μL ל~45 μL עם CFU.
פרוטוקול זה פותח במיוחד כדי להבטיח נתונים באיכות גבוהה לאחר הצלבה לאחר קישור צולב עם FA ו- DSG ועיכול עם DpnII ו- DdeI. עם זאת, אסטרטגיות חלופיות של crosslinking כגון FA ואחריו EGS (אתילן גליקול ביס (succinimidyl succinate)), המשמש גם ב- ChIP-seq23 ו- ChIA-PET24, עשויות לעבוד באותה מידה17. באופן דומה, שילובי אנזימים שונים, כגון DpnII ו- HinfI18 או MboI, MseI ו- NlaIII19 יכולים לשמש לעיכול. כשאתם מתאימים שילובי אנזימים, הקפידו להשתמש בנוקלאוטידים שעברו ביוטינילציה שיכולים למלא את השלוחות הספציפיות של 5' ולהשתמש במאגרים האופטימליים ביותר לכל קוקטייל. DpnII מגיע עם מאגר משלו ויצרן האנזימים ממליץ על חיץ ספציפי לעיכול DdeI. עם זאת, עבור עיכול כפול עם DpnII ו- DdeI בפרוטוקול זה, מאגר ההגבלה מומלץ מכיוון שהוא מדורג ב- 100% פעילות עבור שני האנזימים.
פתרון בעיות בלכידת קונפורמציה
שלושת השלבים המרכזיים בלכידת קונפורמציה של כרומוזומים: crosslinking, עיכול ו-religation בוצעו כולם לפני שניתן היה לדמיין את התוצאות על ג'ל. כדי לקבוע את האיכות של כל אחד משלושת השלבים האלה ולהבחין היכן היו יכולות להיווצר בעיות, אליקוטים לפני (CI) ואחרי העיכול (DC) נלקחים ונטענים על הג'ל יחד עם דגימת Hi-C קשירה (איור 2). ג'ל זה משמש לקביעת איכות מדגם Hi-C והאם יהיה כדאי להמשיך בפרוטוקול. ללא CI ו- DC, קשה לאתר שלבים תת-אופטימליים פוטנציאליים. ראוי לציין כי קשירת לא אופטימלית יכולה לנבוע מבעיה בקשירת עצמה, במילוי, או מבעיה בהצלבה. כדי לפתור בעיות של קישור צולב, הקפד לא להשתמש ביותר מ- 1 × 107 תאים לכל ספריה ולהתחיל עם ריאגנטים מוצלבים טריים ותאים נקיים (כלומר, שטופים עם PBS). לצורך קשירה, יש לוודא שהתאים ותערובת הקשירה נשמרים על הקרח. מוסיפים ליגאז DNA T4 ממש לפני הדגירה של 4 שעות ב-16 מעלות צלזיוס ומערבבים היטב.
פתרון בעיות בהכנת ספרייה
אם יש צורך ביותר מ-10 מחזורי PCR או אם לא ניתן לראות מוצר PCR על ג'ל לאחר טיטרציה של PCR (איור 4), יש כמה אפשרויות לשמור את דגימת ה-Hi-C. בעבודה חזרה מטיטרציית ה- PCR, האפשרות הראשונה היא לנסות את ה- PCR שוב. אם עדיין אין מספיק מוצר, ניתן לנסות סיבוב נוסף של זנב A וקשירת מתאם (שלב 3.6) לאחר שטיפת החרוזים פעמיים עם חיץ TLE 1x. לאחר קשירת A-tailing ומתאם נוספת זו, ניתן להמשיך לטיטרציית ה- PCR כמו קודם. אם עדיין אין מוצר, האפשרות האחרונה היא לשחזר את השבר 0.8x משלב 3.3 ולהמשיך משם.
מגבלות ויתרונות של Hi-C3.0
חשוב להבין כי Hi-C היא שיטה מבוססת אוכלוסייה הלוכדת את התדירות הממוצעת של אינטראקציות בין זוגות לוקוסים באוכלוסיית התא. חלק מהניתוחים החישוביים נועדו לנטרל שילובים של קונפורמציות מאוכלוסייה25, אך באופן עקרוני, Hi-C עיוור להבדלים בין תאים. למרות שניתן לבצע Hi-C חד-תאי26,27 וניתן להסיק מסקנות חישוביות 28, Hi-C חד-תאי אינו מתאים לקבלת מידע 3C ברזולוציה גבוהה במיוחד. מגבלה נוספת של Hi-C היא שהוא מזהה רק אינטראקציות זוגיות. כדי לזהות אינטראקציות רב-מגעיות, ניתן להשתמש בחותכים תכופים בשילוב עם ריצוף קריאה קצר (Illumina)16 או לבצע ריבוי מגעים 3C29 או 4C30, באמצעות רצף קריאה ארוך מפלטפורמות PacBio או Oxford Nanopore. נגזרות Hi-C לזיהוי ספציפי של מגעים בין ולאורך כרומטידים אחיות פותחו גםהן ב-31,32.
למרות שניתן להשתמש ב- Hi-C19 וב- Micro-C33 כדי ליצור מפות מגע ברזולוציות תת-קרקעיות, שתיהן דורשות כמות גדולה של קריאות רצף וזה יכול להפוך להתחייבות יקרה. כדי להגיע לרזולוציה דומה או אפילו גבוהה יותר ללא העלויות, ניתן ליישם העשרה עבור אזורים גנומיים ספציפיים (capture-C 34) או אינטראקציות חלבון ספציפיות (ChiA-PET 35, PLAC-seq36, Hi-ChIP37). החוזק והחיסרון של יישומי העשרה אלה הוא שרק מספר מצומצם של אינטראקציות נדגמות. עם העשרה כזו, ההיבט הגלובלי של Hi-C (ואת האפשרות של נורמליזציה גלובלית) הוא איבד.
חשיבות ויישומים פוטנציאליים של Hi-C3.0
פרוטוקול זה תוכנן לאפשר רזולוציה גבוהה ואולטרה-עמוקה של 3C תוך זיהוי בו-זמני של תכונות קיפול בקנה מידה גדול כגון TADs ותאים17 (איור 6). פרוטוקול זה מתחיל עם 5 × 106 תאים לכל צינור עבור כל ספריית Hi-C, אשר אמור להיות יותר ממספיק חומר כדי לרצף נתיב אחד או שניים על תא זרימה כדי לקבל עד 1 מיליארד קריאות קצה זוגי. עבור ריצוף אולטרה-עמוק, יש להכין צינורות מרובים של 5 × 106 תאים, בהתאם למספר הקריאות הממופות וכפילויות PCR. ברזולוציה הגבוהה ביותר (<1 קילובייט), אינטראקציות לולאה נמצאות בעיקר בין אתרי CTCF, אך ניתן לזהות גם אינטראקציות מקדם-משפר. הקוראים יכולים לעיין ב- Akgol Oksuz et al.17 לתיאור מפורט של ניתוח הנתונים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
ברצוננו להודות לדניס לפונטיין על פיתוח הפרוטוקול ולסרגיי ונב על הסיוע הביואינפורמטי. עבודה זו נתמכה על ידי מענק מהמכונים הלאומיים לבריאות משותפת קרן 4D Nucleome תוכנית ל- J.D. (U54-DK107980, UM1-HG011536). ג'יי.די הוא חוקר במכון הרפואי ע"ש הווארד יוז.
מאמר זה כפוף למדיניות הגישה הפתוחה לפרסומים של HHMI. ראשי המעבדות של HHMI העניקו בעבר רישיון CC BY 4.0 לא בלעדי לציבור ורישיון משנה ל-HHMI במאמרי המחקר שלהם. בהתאם לרישיונות אלה, ניתן להפוך את כתב היד המקובל על המחבר של מאמר זה לזמין באופן חופשי תחת רישיון CC BY 4.0 מיד עם פרסומו.
Materials
| Name | Company | Catalog Number | Comments |
| 1 kb Ladder | New England Biolabs | N3232L | |
| Agarose | Invitrogen | 16500100 | |
| Agencourt AMPure XP magnetic beads , 60 mL | Beckman Coulter | A63881 | |
| Amicon Ultra-0.5 Centrifugal Filter Unit (CFU) | EMD Millipore | UFC500396 | |
| Annealing Buffer (5x) | See recipe in supplemental materials | ||
| ATP 10 mM | ThermoFisher | R0441 | |
| Avanti J-25i High Speed Refrigerated ultra-centrifuge | Beckman Coulter | ||
| beckman ultracentrifuge tube 35 mL | Beckman Coulter | 357002 | |
| Binding Buffer (2x) | See recipe in supplemental materials | ||
| biotin-14-dATP 0.4 mM | Invitrogen | 19524-016 | |
| BSA 10 mg/mL | New England Biolabs | B9000S | dilute from 20 mg/mL |
| Cell scraper | Falcon | 353089 | |
| Cell scraper | Corning | 3008 | |
| Conical polypropylene tubes 50 mL | Denville | C1062-P | |
| Conical tube 15 mL | Denville | C1017-P | |
| Covaris micro tube AFA fiber with snap-cap 130 µL | Covaris | 520045/520077 | |
| Covaris Sonicator | Covaris | E220/E220evolution/M220 | |
| Culture flask 175 cm2 | Falcon | 353112 | |
| Culture plates 150 mm x 25 mm | Corning | 430599 | |
| dATP 1 mM | Invitrogen | 56172 | |
| dATP 10 mM | Invitrogen | 56172 | |
| dCTP 10 mM | Invitrogen | 56173 | |
| DdeI | New England Biolabs | R0175L | |
| dGTP 10 mM | Invitrogen | 56174 | |
| DMSO | Sigma | D2650-5x10ML | |
| dNTP mix 25 mM | Invitrogen | 10297117 | |
| Dounce homogenizer | DWK Life Sciences | 8853010002/8853030002 | |
| DPBS | Gibco | 14190-144 | |
| DpnII | New England Biolabs | R0543M | |
| DSG | ThermoScientific | 20593 | |
| dTTP 10 mM | Invitrogen | 56175 | |
| Ethanol 70% | Fisher | A409-4 | Diluted from 100% |
| Ethidium Bromide | Fisher | BP1302-10 | |
| Formaldehyde (37%) | Fisher | BP531-500 | |
| Gel loading dye (6x ) | New England Biolabs | B7024S | |
| Glycine in ultrapure water 2.5 M | Sigma | G8898-1KG | |
| HBSS | Gibco | 14025-092 | |
| Igepal CA-630 detergent | MP Biomedicals | 198596 | |
| Klenow DNA polymerase 5 U/µL | New England Biolabs | M0210L | |
| Klenow Fragment 3-->5’ exo-, 5 U/µL | New England Biolabs | M0212L | |
| ligation buffer (10x) | New England Biolabs | B7203S | |
| Liquid nitrogen | |||
| LoBind microcentrifuge tube 1.7 mL | Eppendorf | 22431021 | |
| Low Molecular Weight DNA Ladder | New England Biolabs | N3233L | |
| Lysis buffer | See recipe in supplemental materials | ||
| Magnetic Particle separator | ThermoFisher | 12321D | |
| Microfuge tubes 1.7 mL | Axygen | MCT-175-C | |
| MyOne Streptavidin C1 beads | Invitrogen | 65001 | |
| NEBuffer 2.1 (10x) | New England Biolabs | B7002S | |
| NEBuffer 3.1 (10x) | New England Biolabs | B7203S | |
| PBS | Gibco | 70013-032 | |
| PCR (strip) tubes | Biorad | TBS0201/ TCS0803 | |
| PCR thermocycler | Biorad | T100 | |
| Pfu Ultra II Buffer (10x) | Agilent | Comes with Pfu Ultra | |
| PfuUltra II Fusion HS DNA Polymerase | Agilent | 600674 | |
| Phase lock tube 15 mL | Qiagen | 129065 | |
| Phase lock tubes 2 mL | Qiagen | 129056 | |
| Phenol:chloroform:isoamyl alcohol | Invitrogen | 15593-049 | |
| Protease inhibitor cocktail | ThermoFisher | 78440 | |
| Proteinase K in ultrapure water 10 mg/mL | Invitrogen | 25530-031 | |
| Refrigerated Centrifuge | Eppendorf | 5810R | |
| RNase A, DNase and protease-free 10 mg/mL | Thermo Scientific | EN0531 | |
| Rotator | Argos technologies | EW-04397-40 or rocking platform | |
| SDS 1% | Fisher | BP13111 | |
| Sodium acetate pH = 5.2, 3 M | Sigma | ||
| Sub-Cell GT Horizontal Electrophoresis System | Biorad | 1704401 | |
| T4 DNA ligase 1 U/µL | Invitrogen | 100004817 | |
| T4 DNA polymerase | New England Biolabs | M0203L | |
| T4 DNA polymerase | New England Biolabs | M0203L | |
| T4 DNA polymerase 3 U/µL | New England Biolabs | M0203L | |
| T4 ligation buffer (5x) | Invitrogen | Y90001 | |
| T4 polynucleotide kinase 10 U/µL | New England Biolabs | M0201L | |
| Tabletop centrifuge | Eppendorf | 5425 | |
| TBE buffer | See recipe in supplemental materials | ||
| Tris Low EDTA Buffer (TLE) | See recipe in supplemental materials | ||
| Triton X-100 (10%) | Sigma | 93443 | |
| Truseq adapter oligos | Integrated DNA Technologies (IDT)) | https://www.idtdna.com/site/order/oligoentry | 250 nmole and HPLC purified |
| Tween 20 detergent | Fisher | 9005-64-5 | |
| Tween Wash Buffer | See recipe in supplemental materials | ||
| Vortex | Scientific Industries | (G560)SI-0236 |
References
- Dekker, J., Rippe, K., Dekker, M., Kleckner, N. Capturing chromosome conformation. Science. 295 (5558), 1306-1311 (2002).
- Simonis, M., et al. Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture-on-chip (4C). Nature Genetics. 38 (11), 1348-1354 (2006).
- Dostie, J., et al. Chromosome Conformation Capture Carbon Copy (5C): a massively parallel solution for mapping interactions between genomic elements. Genome Research. 16 (10), 1299-1309 (2006).
- Lieberman-Aiden, E., et al. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science. 326 (5950), 289-293 (2009).
- Stadhouders, R., et al. Multiplexed chromosome conformation capture sequencing for rapid genome-scale high-resolution detection of long-range chromatin interactions. Nature Protocols. 8 (3), 509-524 (2013).
- Kalhor, R., Tjong, H., Jayathilaka, N., Alber, F., Chen, L. Genome architectures revealed by tethered chromosome conformation capture and population-based modeling. Nature Biotechnology. 30 (1), 90-98 (2012).
- Hsieh, T. H., et al. Mapping nucleosome resolution chromosome folding in yeast by micro-C. Cell. 162 (1), 108-119 (2015).
- Hsieh, T. -H. S., Fudenberg, G., Goloborodko, A., Rando, O. J. Micro-C XL: assaying chromosome conformation from the nucleosome to the entire genome. Nature Methods. 13 (12), 1009-1011 (2016).
- Denker, A., de Laat, W. The second decade of 3C technologies: detailed insights into nuclear organization. Genes & Development. 30 (12), 1357-1382 (2016).
- Rodley, C. D., Bertels, F., Jones, B., O’Sullivan, J. M. Global identification of yeast chromosome interactions using Genome conformation capture. Fungal Genetics and Biology. 46 (11), 879-886 (2009).
- Rao, S. S., et al. A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell. 159 (7), 1665-1680 (2014).
- Alipour, E., Marko, J. F. Self-organization of domain structures by DNA-loop-extruding enzymes. Nucleic Acids Research. 40 (22), 11202-11212 (2012).
- Lajoie, B. R., Dekker, J., Kaplan, N. The Hitchhiker’s guide to Hi-C analysis: Practical guidelines. Methods. 72, 65-75 (2015).
- Belaghzal, H., Dekker, J., Gibcus, J. H. Hi-C 2.0: An optimized Hi-C procedure for high-resolution genome-wide mapping of chromosome conformation. Methods. 123, 56-65 (2017).
- Golloshi, R., Sanders, J. T., McCord, R. P. Iteratively improving Hi-C experiments one step at a time. Methods. 142, 47-58 (2018).
- Darrow, E. M., et al. Deletion of DXZ4 on the human inactive X chromosome alters higher-order genome architecture. Proceedings of the National Academy of Sciences of the United States of America. 113 (31), 4504-4512 (2016).
- Akgol Oksuz, B., et al. Systematic evaluation of chromosome conformation capture assays. Nature Methods. 18 (9), 1046-1055 (2021).
- Ghuryeid, J., et al. Integrating Hi-C links with assembly graphs for chromosome-scale assembly. PLoS Computational Biology. 15 (8), 1007273(2019).
- Gu, H., et al. Fine-mapping of nuclear compartments using ultra-deep Hi-C shows that active promoter and enhancer elements localize in the active A compartment even when adjacent sequences do not. bioRxiv. , (2021).
- Ramani, V., et al. Mapping 3D genome architecture through in situ DNase Hi-C. Nature Protocols. 11 (11), 2104-2121 (2016).
- Lafontaine, D. L., Yang, L., Dekker, J., Gibcus, J. H. Hi-C 3.0: Improved Protocol for Genome-Wide Chromosome Conformation Capture. Current Protocols. 1 (7), 198(2021).
- Belton, J. -M. M., et al. Hi-C: A comprehensive technique to capture the conformation of genomes. Methods. 58 (3), 268-276 (2012).
- Truch, J., Telenius, J., Higgs, D. R., Gibbons, R. J. How to tackle challenging ChIP-Seq, with long-range cross-linking, Using ATRX as an example. Methods in Molecular Biology. 1832, Clifton, N.J. 105-130 (2018).
- Wang, P., et al. In situ chromatin interaction analysis using paired-end tag sequencing. Current Protocols. 1 (8), 174(2021).
- Tjong, H., et al. Population-based 3D genome structure analysis reveals driving forces in spatial genome organization. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 1663-1672 (2016).
- Nagano, T., et al. Cell-cycle dynamics of chromosomal organization at single-cell resolution. Nature. 547 (7661), 61-67 (2017).
- Ramani, V., et al. Massively multiplex single-cell Hi-C. Nature Methods. 14 (3), 263-266 (2017).
- Meng, L., Wang, C., Shi, Y., Luo, Q. Si-C is a method for inferring super-resolution intact genome structure from single-cell Hi-C data. Nature Communications. 12 (1), 4369(2021).
- Tavares-Cadete, F., Norouzi, D., Dekker, B., Liu, Y., Dekker, J. Multi-contact 3C reveals that the human genome during interphase is largely not entangled. Nature Structural & Molecular Biology. 27 (12), 1105-1114 (2020).
- Vermeulen, C., et al. Multi-contact 4C: long-molecule sequencing of complex proximity ligation products to uncover local cooperative and competitive chromatin topologies. Nature Protocols. 15 (2), 364-397 (2020).
- Oomen, M. E., Hedger, A. K., Watts, J. K., Dekker, J. Detecting chromatin interactions between and along sister chromatids with SisterC. Nature Methods. 17 (10), 1002-1009 (2020).
- Mitter, M., et al. Conformation of sister chromatids in the replicated human genome. Nature. 586 (7827), 139-144 (2020).
- Krietenstein, N., et al. Ultrastructural Details of Mammalian Chromosome Architecture. Molecular Cell. 78 (3), 554-565 (2020).
- Hughes, J. R., et al. Analysis of hundreds of cis-regulatory landscapes at high resolution in a single, high-throughput experiment. Nature Genetics. 46 (2), 205-212 (2014).
- Fullwood, M. J., et al. An oestrogen-receptor-alpha-bound human chromatin interactome. Nature. 462 (7269), 58-64 (2009).
- Fang, R., et al. Mapping of long-range chromatin interactions by proximity ligation-assisted ChIP-seq. Cell Research. 26 (12), 1345-1348 (2016).
- Mumbach, M. R., et al. HiChIP: efficient and sensitive analysis of protein-directed genome architecture. Nature Methods. 13 (11), 919-922 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved