Method Article
Uzunluk Ölçekleri Arasında Kromozom Konformasyonunu Yakalama
Bu Makalede
Özet
Hi-C 3.0, sinyal-gürültü oranını ve kromatin etkileşimi algılamasının çözünürlüğünü artırmak için formaldehit ve dissüksinimidil glutarat çapraz bağlayıcılarını DpnII ve DdeI kısıtlama enzimlerinin bir kokteyli ile birleştiren geliştirilmiş bir Hi-C protokolüdür.
Özet
Kromozom konformasyon yakalama (3C), üç boyutlu kromatin etkileşimlerini tespit etmek için kullanılır. Tipik olarak, kromatin etkileşimlerini düzeltmek için formaldehit (FA) ile kimyasal çapraz bağlanma kullanılır. Daha sonra, bir kısıtlama enzimi ile kromatin sindirimi ve ardından parça uçlarının bağlanması, üç boyutlu (3D) yakınlığı benzersiz ligasyon ürünlerine dönüştürür. Son olarak, çapraz bağların tersine çevrilmesi, protein uzaklaştırılması ve DNA izolasyonundan sonra, DNA kesilir ve yüksek verimli dizileme için hazırlanır. Lokus çiftlerinin yakınlık ligasyonu sıklığı, bir hücre popülasyonunda üç boyutlu uzayda kolokalizasyon sıklığının bir ölçüsüdür.
Sıralanmış bir Hi-C kütüphanesi, tüm lokus çiftleri arasındaki etkileşim frekansları hakkında genom çapında bilgi sağlar. Hi-C'nin çözünürlüğü ve hassasiyeti, kromatin temaslarını ve kromatinin sık ve düzgün parçalanmasını sağlayan verimli çapraz bağlamaya dayanır. Bu yazıda, iki çapraz bağlayıcıyı (formaldehit [FA] ve dissüksinimidil glutarat [DSG]) birleştirerek çapraz bağlamanın verimliliğini artıran, ardından iki kısıtlama enzimi (DpnII ve DdeI) kullanılarak daha ince bir sindirim ile geliştirilmiş bir in situ Hi-C protokolü olan Hi-C 3.0 açıklanmaktadır. Hi-C 3.0, döngüler ve topolojik olarak ilişkili alanlar (TAD'lar) gibi daha küçük ölçeklerde genom katlama özelliklerinin ve ayrıca bölmeler gibi daha büyük çekirdek genişliğindeki ölçeklerdeki özelliklerin doğru bir şekilde ölçülmesi için tek bir protokoldür.
Giriş
Kromozom konformasyon yakalama 2002 yılından beri kullanılmaktadır1. Temel olarak, her konformasyon yakalama varyantı, 3D kromatin organizasyonunu korumak için DNA-protein ve protein-protein etkileşimlerinin sabitlenmesine dayanır. Bunu DNA parçalanması, genellikle kısıtlama sindirimi izler ve son olarak, uzamsal olarak proksimal lokusları benzersiz kovalent DNA dizilerine dönüştürmek için yakındaki DNA uçlarının bağlanması. İlk 3C protokolleri, spesifik "bire bir" etkileşimleri örneklemek için PCR'yi kullandı. Sonraki 4C analizleri "bire bir" etkileşimlerin 2'sinin tespitine izin verirken, 5C "çok-çok" etkileşimleritespit etti 3. Kromozom konformasyon yakalama, genom çapında Hi-C4 ve 3C-seq5, TCC6 ve Micro-C7,8 gibi karşılaştırılabilir teknikler kullanılarak "hepsi bir arada" genomik etkileşimlerin tespit edilmesine izin veren yeni nesil, yüksek verimli dizilemeyi (NGS) uyguladıktan sonra tam meyvesini verdi (ayrıca Denker ve De Laat9 tarafından yapılan incelemeye bakınız).
Hi-C'de, biyotinile nükleotidler, sindirimden sonra ve ligasyondan önce 5' çıkıntıları işaretlemek için kullanılır (Şekil 1). Bu, streptavidin kaplı boncuklar kullanılarak uygun şekilde sindirilmiş ve bağlanmış parçaların seçilmesine izin verir ve GCC10'dan ayrılır. Hi-C protokolünde önemli bir güncelleme, sahte ligasyon ürünlerini azaltmak için bozulmamış çekirdeklerde (yani in situ) sindirim ve religasyonu gerçekleştiren Rao ve ark.11 tarafından uygulanmıştır. Dahası, HindIII sindirimini MboI (veya DpnII) sindirimi ile değiştirmek, parça boyutunu azalttı ve Hi-C'nin çözünürlük potansiyelini arttırdı. Bu artış, nispeten küçük ölçekli yapıların tespitine ve küçük cis elementleri arasındaki DNA döngüleri, örneğin döngü ekstrüzyonu11,12 tarafından üretilen CTCF'ye bağlı bölgeler arasındaki döngüler gibi temas noktalarının daha kesin bir genomik lokalizasyonuna izin verdi. Ancak, bu potansiyelin bir bedeli vardır. İlk olarak, çözünürlükte iki kat artış, sıralamada dört kat (2 2) artış gerektirir13 okur. İkincisi, küçük parça boyutları, sindirilmemiş ve bağlanmış parçalar için sindirilmemiş komşu parçaların yanlış alınması olasılığını arttırır14. Belirtildiği gibi, Hi-C'de, sindirilmiş ve bağlanmış fragmanlar, ligasyon kavşağında biyotin varlığı ile sindirilmemiş fragmanlardan farklıdır. Bununla birlikte, sadece ligasyon bağlantılarının14,15 aşağı çekilmesini sağlamak için bağlanmamış uçlardan uygun biyotin çıkarılması gerekir.
NGS'nin azalan maliyeti ile kromozom katlanmasını daha ayrıntılı olarak incelemek mümkün hale gelir. DNA fragmanlarının boyutunu azaltmak ve böylece çözünürlüğü artırmak için, Hi-C protokolü daha sık kesme kısıtlama enzimleri16 veya kısıtlama enzimleri kombinasyonlarını kullanmak için uyarlanabilir17,18,19. Alternatif olarak, Micro-C'deki MNase 7,8 ve DNase Hi-C20'deki DNase, optimum sindirim elde etmek için titre edilebilir.
3C yöntemlerinin temellerinin yakın tarihli bir sistematik değerlendirmesi, her uzunluk ölçeğinde kromozom katlama özelliklerinin tespitinin,% 1 FA ile sıralı çapraz bağlanma ve ardından 3 mM DSG17 ile büyük ölçüde geliştiğini göstermiştir. Ayrıca, HindIII sindirimli Hi-C, bölmeler gibi büyük ölçekli katlama özelliklerini tespit etmek için en iyi seçenekti ve Micro-C, DNA döngüleri gibi küçük ölçekli katlama özelliklerini tespit etmede üstündü. Bu sonuçlar, FA ve DSG çapraz bağlayıcılarının kombinasyonunu kullanan ve ardından DpnII ve DdeI endonükleazları21 ile çift sindirimi kullanan tek, yüksek çözünürlüklü bir "Hi-C 3.0" stratejisinin geliştirilmesine yol açtı. Hi-C 3.0, tüm uzunluk ölçeklerinde katlama özelliklerini doğru bir şekilde algıladığı için genel kullanım için etkili bir strateji sağlar17. Hi-C 3.0 protokolünün deneysel kısmı burada ayrıntılı olarak açıklanmıştır ve sıralamadan sonra beklenebilecek tipik sonuçlar gösterilmiştir.

Şekil 1: Altı adımda Hi-C prosedürü. Hücreler önce FA, sonra DSG ile sabitlenir (1). Daha sonra, lizis, DdeI ve DpnII ile çift sindirimden önce gelir (2). Biotin, çıkıntı dolgusu ile eklenir ve DNA saflaştırmasından (4) önce proksimal körelmiş uçlar bağlanır (3). Biotin, sonikasyon ve boyut seçiminden önce bağlanmamış uçlardan çıkarılır (5). Son olarak, biyotinin aşağı çekilmesi, PCR ile adaptör ligasyonu ve kütüphane amplifikasyonuna izin verir (6). Kısaltmalar: FA = formaldehit; DSG = dissüksinimidil glutarat; B = Biotin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
1. Çapraz bağlama ile sabitleme
- Formaldehit fiksasyonu: tek katmanlı hücrelerden başlayarak
- 150 mm plaka başına 5 × 106 hücre hasat etmek için uygun ortamda tohumlanmış hücrelere sahip olun.
NOT: Kullanıcılar, herhangi bir memeli hücre hattının optimum büyümesini sağlayan tercih edilen herhangi bir kabı seçebilir. Ek olarak, hücreler dokudan izole edilebilir. - Ortamı 150 mm plakadan bir vakum kapanına bağlı bir Pasteur pipetle aspire edin, ~ 10 mL HBSS ile 2x yıkayın.
- Çapraz bağlamadan hemen önce, 22.5 mL HBSS ve 625 μL% 37 FA'yı nihai% 1'lik bir konsantrasyona birleştirerek 50 mL'lik bir tüpte% 1'lik bir FA çapraz bağlama çözeltisi hazırlayın. Sallanarak hafifçe karıştırın.
DİKKAT: Davlumbaz kullanın; formaldehit toksiktir. - Hücreleri çapraz bağlamak için, her 15 cm'lik plakaya% 1 FA çözeltisinin 23.125 mL'sini dökün.
- Oda sıcaklığında 10 dakika boyunca inkübe edin ve plakaları her 2 dakikada bir elle hafifçe sallayın.
- 1,25 mL 2,5 M glisin (128 mM final) ekleyin ve çapraz bağlanma reaksiyonunu söndürmek için plakayı yavaşça döndürün.
- Oda sıcaklığında 5 dakika inkübe edin ve çapraz bağlantıyı durdurmak için en az 15 dakika boyunca buz üzerinde inkübasyona devam edin.
- Hücreleri plakalardan bir hücre kazıyıcı veya lastik polisi ile kazıyın.
- Hücre süspansiyonunu bir pipet ile 50 mL'lik bir konik tüpe aktarın. Oda sıcaklığında 10 dakika boyunca 1.000 × g'da santrifüj yapın ve süpernatantı aspirasyonla atın.
- Hücre peletini bir kez 10 mL Dulbecco'nun fosfat tamponlu salini (DPBS) ile yıkayın, yeniden askıya almak için bir pipet kullanın. Daha sonra, oda sıcaklığında 10 dakika boyunca 1.000 × g'da santrifüj yapın. Hemen DSG çapraz bağlamaya geçin.
NOT: Hücre peletini yıkarken dikkatli olun, çünkü hücre peletleri gevşeyebilir ve hücreler kaybolabilir.
- 150 mm plaka başına 5 × 106 hücre hasat etmek için uygun ortamda tohumlanmış hücrelere sahip olun.
- Formaldehit fiksasyonu: süspansiyondaki hücrelerden başlayarak
- Damar başına 5 × 106 hücre toplamak için uygun ortamda tohumlanmış hücrelere sahip olun.
NOT: Kullanıcılar, herhangi bir memeli hücre hattının optimal hücre büyümesini sağlayan tercih edilen herhangi bir kabı seçebilir. - Hasattan hemen önce, hücreleri sayın ve 5 × 106 hücreyi 50 mL'lik bir konik tüpe aktarın.
- Oda sıcaklığında 10 dakika boyunca 300 × g'da santrifüj yaparak hücreleri nazikçe pelet edin.
- 45 mL HBSS'ye 1,25 mL% 37 FA ekleyerek % 1 FA çapraz bağlama çözeltisi hazırlayın ve tüpü birkaç kez ters çevirerek karıştırın.
NOT: Miktarı bölmeden 1,25 mL FA'nın tamamını ekleyin.
DİKKAT: Formaldehit oldukça toksiktir. - Hücre peletini, önceki adımda hazırlanan 46.25 mL'lik %1 FA çapraz bağlama çözeltisinde yukarı ve aşağı pipetle indirerek yeniden askıya alın.
- Oda sıcaklığında rotatorda, rocker'da tam 10 dakika boyunca veya her 1-2 dakikada bir tüpün nazikçe manuel olarak ters çevrilmesiyle inkübe edin.
- 2,5 mL 2,5 M glisin (128 mM final) ekleyerek çapraz bağlanma reaksiyonunu söndürün ve tüpü ters çevirerek iyice karıştırın.
- Oda sıcaklığında 5 dakika boyunca inkübe edin ve daha sonra çapraz bağlantıyı tamamen durdurmak için en az 15 dakika boyunca buz üzerinde inkübe edin.
- Çapraz bağlı hücreleri 10 dakika boyunca 1.000 × g'da peletlemek için oda sıcaklığında santrifüj yapın ve süpernatantı aspirasyonla atın.
- Hücreleri bir kez 10 mL DPBS ile yıkayın ve ardından oda sıcaklığında 10 dakika boyunca 1.000 × g'da santrifüj yapın. Bir pipet kullanarak süpernatantı tamamen atın ve hemen DSG çapraz bağlamaya geçin.
NOT: Hücre peletini yıkarken dikkatli olun, çünkü hücre peletleri gevşeyebilir ve hücreler kaybolabilir.
- Damar başına 5 × 106 hücre toplamak için uygun ortamda tohumlanmış hücrelere sahip olun.
- Dissüksinimidil glutarat ile çapraz bağlanma
- Pelet edilmiş hücreleri 9,9 mL DPBS'de 100 μL 300 mM DSG (3 mM final) eklemeden önce yeniden askıya alın. Ters çevirerek karıştırın.
NOT: DSG neme duyarlıdır. Çapraz bağlama gününde DMSO'da 300 mM DSG'lik taze bir stok hazırlamak önemlidir.
DİKKAT: DMSO'daki DSG oldukça toksiktir. - Hücreleri oda sıcaklığında bir rotatorda 40 dakika boyunca çapraz bağlayın.
- 1,925 mL 2,5 M glisin (400 mM final) ekleyin, karıştırmak için ters çevirin ve oda sıcaklığında 5 dakika kuluçkaya yatırın.
- Hücreleri oda sıcaklığında 15 dakika boyunca 2.000 × g'da santrifüj yapın.
NOT: Süpernatantı gevşek hücre peletlerinden çıkarırken dikkatli olun. - Peleti 1 mL% 0.05 sığır serum albümini (BSA)-DPBS içinde yeniden askıya alın ve 1.7 mL'lik bir tüpe aktarın.
NOT: BSA ilavesi, hücre kümelenmesini azaltmaya yardımcı olabilir. - Hücreleri 4 ° C'de 15 dakika boyunca 2.000 × g'da santrifüj edin ve süpernatantı pipetle çıkarın.
NOT: Peletin kaybolmasını önlemek için, süpernatanı hızlı ve tamamen çıkarın. - Peleti sıvı azot içinde çıtçıtlayın ve -80 ° C'de saklayın veya hemen bir sonraki adıma geçin.
- Pelet edilmiş hücreleri 9,9 mL DPBS'de 100 μL 300 mM DSG (3 mM final) eklemeden önce yeniden askıya alın. Ters çevirerek karıştırın.
2. Kromozom konformasyonu yakalama
- Hücre lizisi ve kromatin sindirimi
- 10 μL proteaz inhibitörü kokteyli içeren 1 mL buz gibi soğuk lizis tamponunda (Ek Tablo S1'deki tarif) çapraz bağlı hücre alikotlarını (~5 × 106 hücre) yeniden askıya alın (pipet) ve buz üzerinde 15 dakikalık bir inkübasyon için bir sıçrama homojenizatörüne aktarın.
NOT: Proteaz inhibitörlerini kullanımdan hemen önce lizis tamponuna ekleyin. - Buz üzerindeki hücreleri homojenize etmek için havaneli A'yı yavaşça yukarı ve aşağı hareket ettirin ve hücrelerin soğumasını sağlamak için 1 dakika boyunca buz üzerinde inkübe edin, 30 vuruştan önce.
- Lisatı 1.7 mL'lik bir mikrosantrifüj tüpüne aktarın.
NOT: Bazen hücreler pipet ucuna yapıştığı için süspansiyonu hareket halinde tutun. - Lize süspansiyonu oda sıcaklığında 5 dakika boyunca 2.500 × g'da santrifüj yapın.
- Süpernatantı atın ve yeniden askıya almak için ıslak peleti hafifçe vurun veya vorteks yapın. Minimum kümelenme ile yoğurt benzeri bir madde elde etmek için süpernatantın mümkün olduğunca çoğunu çıkarın.
- Peleti 500 μL buz gibi soğuk 1x Kısıtlama Tamponunda (10x'ten itibaren; Ek Tablo S1'deki tarife bakın) yeniden askıya alın ve 2.500 × g'da 5 dakika boyunca santrifüj yapın. İkinci bir yıkama için bu adımı tekrarlayın.
NOT: 1x Kısıtlama Tamponundaki pelet, lizis tamponundaki önceki peletten daha granülerdir. - Hücreleri, hücre boyutuna bağlı olarak peletin taşıma hacmine ~ 340 μL ekledikten sonra pipetle pipetleyerek 360 μL'lik son hacimde 1x Kısıtlama Arabelleğinde yeniden askıya alın.
- Kromatin Bütünlüğünü (CI) test etmek için her lizattan 18 μL'yi ayırın. CI örneklerini 4 °C'de saklayın.
- Her Hi-C tüpüne 38 μL% 1 sodyum dodesil sülfat (SDS) ekleyin (toplam hacim 380 μL) ve kabarcıklar sokmadan pipetleme yaparak dikkatlice karıştırın.
DİKKAT: SDS zehirlidir. - Kromatini açmak için numuneleri 65 ° C'de tam olarak 10 dakika boyunca sallamadan inkübe edin.
- Tüpleri hemen buz üzerine yerleştirin ve Tablo 1'de açıklandığı gibi SDS'yi söndürmek için Triton X-100 ile Sindirim Karışımını hazırlayın.
- Hi-C-tüpüne 107 μL Sindirim Karışımı ekleyin (toplam 487 μL) kromatini 37 °C'de gece boyunca (~16 saat) aralıklı çalkalanan bir termomikserde sindirmek için (örneğin, 900 rpm, 30 s açık, 4 dakika kapalı).
NOT: Triton'un %1'lik nihai konsantrasyona eklenmesi, SDS'nin söndürülmesine hizmet eder.
- 10 μL proteaz inhibitörü kokteyli içeren 1 mL buz gibi soğuk lizis tamponunda (Ek Tablo S1'deki tarif) çapraz bağlı hücre alikotlarını (~5 × 106 hücre) yeniden askıya alın (pipet) ve buz üzerinde 15 dakikalık bir inkübasyon için bir sıçrama homojenizatörüne aktarın.
- DNA uçlarının biyotinilasyonu
- Gece boyunca sindirimden sonra, kalan endonükleaz aktivitesini devre dışı bırakmak için örnekleri 20 dakika boyunca 65 ° C'ye aktarın.
- Kuluçka sırasında, Tablo 2'de gösterildiği gibi bir doldurma ana karışımı hazırlayın.
- Kuluçkadan sonra, örnekleri hemen buzun üzerine yerleştirin.
- Her numune için 10 μL Sindirim Kontrolü (DC) ayırın ve 4 °C'de saklayın.
- Yoğuşmayı kapaktan pipetle veya eğirerek çıkarın. Her numuneye, 58 μL biyotin doldurma karışımı (toplam numune hacmi 535 μL) ekleyin ve kabarcık oluşturmadan yavaşça pipet ekleyin.
- Numuneleri bir termomikserde 4 saat boyunca 23 °C'de inkübe edin (örneğin, 900 rpm, 30 s açık, 4 dakika kapalı).
- Proksimal DNA fragmanlarının ligasyonu
- Ligasyon karışımını Tablo 3'te gösterildiği gibi biyotin dolgusu inkübe edilirken hazırlayın.
- Her numuneye 665 μL ligasyon karışımı ekleyin (toplam numune hacmi 1.200 μL). Pipetleme yaparak nazikçe karıştırın.
- Numuneleri aralıklı sallanan bir termomikserde 4 saat boyunca 16 °C'de inkübe edin (örneğin, 900 rpm, 30 s açık, 4 dakika kapalı). Kovalent olarak bağlı kromatin içeren bu örnekleri birkaç gün boyunca 4 ° C'de saklayın.
- Çapraz bağlamanın tersine çevrilmesi
- CI ve DC numunelerinin hacimlerini 1x Tris Low EDTA ile 50 μL'ye getirin (TLE; Ek Tablo S1'deki tarife bakın).
- CI ve DC örneklerine 10 μL 10 mg / mL Proteinaz K ekleyin.
- Aralıklı sallama ile gece boyunca 65 ° C'de inkübe edin (örneğin, 900 rpm, 30 s açık, 4 dakika kapalı). Alternatif olarak, Hi-C örneklerinin DNA saflaştırılması sırasında bu kontroller için çapraz bağlamanın 30 dakikalık bir tersine çevrilmesini gerçekleştirin.
- Her Hi-C numunesine 50 μL 10 mg/mL Proteinaz K ekleyin ve aralıklı sallama ile en az 2 saat boyunca 65 °C'de inkübe edin (örneğin, 900 rpm, 30 s açık, 4 dakika kapalı).
- Her Hi-C tüpüne 50 μL 10 mg / mL Proteinaz K ekleyin (toplam numune hacmi 1.300 μL) ve gece boyunca 65 ° C'de inkübe etmeye devam edin. DNA saflaştırılana kadar 4 °C'de saklayın.
NOT: Proteinaz K inkübasyonlarının bölünmesi, toplam protein sindirimini sağlar.
- DNA saflaştırma
- Tüplerin 65 °C'den oda sıcaklığına kadar soğumasını bekleyin.
- Her numuneyi 15 mL'lik bir konik tüpe aktarın ve her tüpe 2,6 mL (2x hacim) fenol: kloroform: izoamil alkol ekleyin.
DİKKAT: Fenol:kloroform:izoamil alkol çok toksik bir tahriş edicidir ve potansiyel olarak kanserojendir. - Her tüpü 1 dakika boyunca vorteks yapın ve ardından içeriğini 15 mL'lik bir faz kilidi tüpüne aktarın.
- Numuneleri tezgah üstü bir santrifüjde maksimum hızda (1.500-3.500 × g) 5 dakika boyunca santrifüj yapın.
- Sulu fazı dikkatlice 35 mL'lik bir ultrasantrifüj tüpüne dökün ve 1.250 μL'lik son hacme ultra saf su ekleyin.
NOT: Mevcut ultrasantrifüje uyacak veya birden fazla mikrosantrifüj tüpüne bölünmüş tüpleri kullanın. - 1/10'uncu hacim (~ 125 μL) 3 M sodyum asetat ekleyin ve ters çevirerek iyice karıştırın.
- Her numuneye 2,5x hacimli (~3,4 mL) buz soğuk% 100 etanol ekleyin, buz soğuk% 100 etanol ekleyerek ultrasantrifüjleme tüplerini dengeleyin ve ters çevirerek iyice karıştırın.
- Tüpleri kuru buz üzerinde ~ 15 dakika boyunca inkübe edin (katılaşmadan kaçının).
- Tüpleri 4 °C'de 30 dakika boyunca 18.000 × g'de santrifüj yapın.
NOT: Açılı rotorlar için: Boruları peletin nerede olacağı konusunda işaretleyin. - Bir pipet kullanarak, süpernatantı pelet olmayan taraftan tamamen çıkarın ve atın.
NOT: Bu noktada, pelet görünür hale gelmeli ve tüp üzerinde işaretlenebilir, çünkü bir sonraki adımda kuruduktan sonra açıkça görülemeyebilir. - Numuneleri yaklaşık 10 dakika boyunca veya gözle görülür şekilde kuruyana kadar hava ile kurutun.
- Her bir peleti pipetleme veya döndürme yoluyla 450 μL 1x TLE içinde çözündürün ve 3 kDa moleküler ağırlık kesme ile 0,5 mL Santrifüj Filtre Ünitesine (CFU) aktarın.
- CFU'yu 10 dakika boyunca maksimum hızda santrifüj yapın ve akışı atın. Her ultrasantrifüj tüpünü ilave 450 μL 1x TLE ile yıkayın ve başka bir yıkama için CFU'suna aktarın.
NOT: CFU'yu bu şekilde yıkamak, tuz konsantrasyonunu azaltırken DNA kaybını sınırlar. - CFU'yu 10 dakika boyunca maksimum hızda santrifüj yapın ve akışı atın.
- Sütuna 80 μL 1x TLE ekleyin ve ~ 100 μL'lik bir son hacim elde etmek için maksimum hızda 2 dakika santrifüj yapmadan önce sütunu yeni bir toplama tüpüne çevirin.
- Her numuneye 1 μL RnaseA (1 mg/mL; 10 mg/mL stokun 10 kat seyreltilmesi) ekleyin ve 37 °C'de bir ısı bloğunda, bir su banyosunda veya bir termomikserde en az 30 dakika inkübe edin.
- Rnase işleminden sonra, numuneleri 37 °C'den çıkarın ve kalite kontrol adımına kadar 4 °C'de saklayın.
- Kromatin kalitesini, enzim sindirimini ve numune ligasyonunu kontrol etme
- Adım 2.4.5'teki çapraz bağlantıları tersine çevirdikten sonra CI ve DC numunelerini oda sıcaklığına soğutun. Ardından, önceden bükülmüş 2 mL faz kilidi tüpüne aktarın.
NOT: Faz kilidi içeriğinin bir pelet üzerine santrifüj edildiğinden emin olun (2 dakika boyunca maksimum hız). - 200 μL fenol: kloroform: izoamil alkol ekleyin ve örnekleri 1 dakika boyunca vorteks yaparak karıştırın.
- Tüpleri maksimum hızda 5 dakika boyunca santrifüj yapın.
- Sulu fazı her numuneden (~ 50 μL) yeni bir 1.7 mL mikrofüj tüpüne aktarın.
- 1 μL Rnase A (1 mg / mL'den) ekleyin ve en az 30 dakika boyunca 37 ° C'de inkübe edin.
- Numuneleri Tablo 4'te önerildiği gibi% 0.8'lik bir agaroz jeli üzerine yükleyin.
NOT: Bir kalite kontrolünden beklenen sonuçlar Şekil 2'de gösterilmiştir. - DNA'yı jelden dansitometri ile veya Qubit veya Nanodrop kullanarak sayısallaştırın.
NOT: Doğru niceleme, protokolün bir sonraki bölümünde doğru giriş hacmini sağlar. Standart bir eğri oluşturmak için bilinen bir miktara sahip birkaç standart kullanın.
- Adım 2.4.5'teki çapraz bağlantıları tersine çevirdikten sonra CI ve DC numunelerini oda sıcaklığına soğutun. Ardından, önceden bükülmüş 2 mL faz kilidi tüpüne aktarın.
Tablo 1: Sindirim reaktifleri. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Biotin dolgu reaktifleri. * Enzimlerin değiştirilmesinin farklı tamponlar ve biyotinile dNTP'ler gerektirebileceğini unutmayın. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 3: Ligasyon karışımı reaktifleri. Kısaltma: BSA = sığır serum albümini. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 4: Kalite ve boyut seçimi değerlendirmesi için jel yükleme parametreleri. Bu tabloyu indirmek için lütfen tıklayınız.
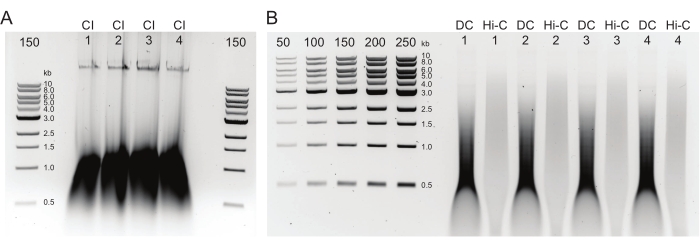
Şekil 2: Tipik postDNA saflaştırma kalite kontrol sonuçlarını gösteren agaroz jeli . (A) CI kontrolü, yüksek moleküler ağırlıklı DNA'nın bir bandını göstermelidir. (B) DC ve Hi-C örnekleri bir dizi DNA boyutu gösterir. Daha büyük parçalar halinde birleştirilen Hi-C örneği, DC'den daha yüksek moleküler ağırlığa sahip olmalıdır. İşaretçilerin konsantrasyon aralığı, standart bir eğri oluşturulmasına izin verir. Bu örnekte, CI'nin ayrı bir jel üzerine yüklendiğini, ancak tüm numunelerin ve kontrollerin birlikte yüklenmesi ve çalıştırılması önerilir. Kısaltmalar: CI = kromatin bütünlüğü; DC = sindirim kontrolü; Hi-C = yakınlık bağlı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Hi-C sıralama kütüphanesi hazırlama
- Bitotinin bağlanmamış uçlardan uzaklaştırılması
- Tablo 5'te gösterildiği gibi biyotin giderme reaksiyonları hazırlayın.
NOT: Tipik olarak, 10 μg DNA yeterlidir, ancak 30 μg'a kadar kullanılabilir. - Her 130 μL reaksiyondan 2 x 65 μL alikotu iki PCR tüpüne dağıtın.
- Bir termosikler veya PCR makinesine aktarın ve Tablo 5'te açıklandığı gibi inkübe edin.
NOT: Örnekler burada 4 ° C'de (günlerden haftalara), -20 ° C'de (uzun vadeli) saklanabilir veya hemen sonikasyona aktarılabilir.
- Tablo 5'te gösterildiği gibi biyotin giderme reaksiyonları hazırlayın.
- Sonication
- Numune, biyotin kaldırma adımından (130 μL toplam numune hacmi) sonikasyon için 130 μL sonikatör tüpüne kopyalanır.
- 500 bp'nin altında sıkı bir dar dağılım elde etmek için Tablo 6'da verilen parametreleri kullanarak örnekleri sonikleştirin.
NOT: Farklı sonicator türleri kullanılabilir, ancak dar bir parça dağılımı (100-500 bp) için sonicator ayarları optimizasyon gerektirebilir.
- Manyetik boncuklarla boyut seçimi
- Sonik DNA'yı sonikatör tüplerinden 1.7 mL'lik düşük bağlayıcı bir tüpe pipet yapın.
- Her numuneyi 1x THE ile toplam 500 μL hacme getirin. Hacmi mümkün olduğunca 500 μL'ye yaklaştırmaya çalışın, çünkü numunenin manyetik boncuk karışımına oranı boyut seçimi için gereklidir.
- Manyetik boncuk karışımının 0.8'lik numune hacmine oranını elde etmek için her tüpe 400 μL manyetik boncuk karışımı ekleyin.
NOT: Bu koşullar altında, boncuklar Üst Fraksiyon olacak >300 bp DNA fragmanlarını yakalar. Süpernatant, Alt Fraksiyon olacak <300 bp parçaları içerecektir. - Tüpleri vorteks ile karıştırın ve bir döndürücü üzerinde oda sıcaklığında 10 dakika kuluçkaya yatırın. Bu ve diğer boyut seçim oranları için, numunenin tam hacminin iyi karıştığından emin olun. Bazı rotorların sahip olduğu ve daha küçük hacimler için iyi çalışan "düzensiz modu" arayın.
- Manyetik parçacık ayırıcı (MPS) üzerinde oda sıcaklığında 5 dakika boyunca inkübe edin.
- Kuluçka sırasında, her numune için taze 1.7 μL düşük bağlayıcı tüpe 500 μL manyetik boncuk karışımı ekleyin.
NOT: Bu tüpler, 1.1: 1'lik numune oranına manyetik boncuk karışımı oluşturarak alt fraksiyonun bir sonraki boyut seçimi için kullanılacaktır. - Tüpleri MPS üzerinde 5 dakika bekletin.
- Süpernatantı boncuklardan çıkarın ve manyetik boncuk karışımının 150 μL'si ile yeniden askıya alın.
NOT: Bu adım, hacmi arttırmadan boncuk sayısını artırarak boncukların DNA ile doygunluğunu önler. - Süpernatantı adım 3.3.5'ten Alt Fraksiyonu seçmek için hazırlanan etiketli tüpe aktarın (adım 3.3.8).
NOT: 150 μL manyetik boncuk karışımı + 400 μL 0,8x manyetik boncuk karışımı (toplam 550 μL), 500 μL başlangıç numunesine bölünür = 1,1x manyetik boncuk karışımı numune oranına. - Alt Fraksiyon tüplerini vorteks ile karıştırın ve bir rotatorda oda sıcaklığında 10 dakika boyunca inkübe edin.
NOT: Boncuklar, DNA parçalarını 100 bp'> bağlayacak ve 100-300 bp'lik son bir boncuk bağlı fraksiyonla sonuçlanacaktır. - Alt Fraksiyonlu tüpleri MPS'ye 5 dakika (oda sıcaklığında) koyun.
- Süpernatantı çıkarın ve süpernatantı mümkün olduğunca daha fazla çıkarmak için tüpleri kısaca santrifüj yapın.
- Her iki fraksiyondaki boncukları 200 μL %70 etanol kullanarak iki kez yıkayın ve boncukları her seferinde MPS'de 5 dakika boyunca geri kazanın.
- Bir santrifüjde hızlı bir şekilde döndürüldükten sonra, etanol tamamen çıkarın ve MPS üzerindeki boncukları daha da kurutun.
NOT: Alkol tamamen buharlaşana kadar kurutun. Pelet çatlamadan koyu çikolata gibi görünmelidir (~ 10 dakika sürebilir). - Her iki fraksiyonu da 50 μL 1x TLE arabelleğinde yeniden askıya alın. Oda sıcaklığında 10 dakika boyunca inkübe edin ve karıştırma ve elüsyonu teşvik etmek için tüplere her iki dakikada bir dokunun veya hafifçe vurun.
- Boncukları, her iki fraksiyon için de 5 dakika boyunca MPS üzerindeki süpernatanttan ayırın.
- Süpernatantı her numuneden saklayın. Süpernatantı 1.7 mL'lik düşük bağlayıcı bir tüpe pipetin.
NOT: Numuneler birkaç gün boyunca 4 °C'de veya uzun süre -20 °C'de tutulabilir. - Numune kalitesini ve miktarını belirlemek için Tablo 4'te olduğu gibi% 2'lik bir agaroz jeli çalıştırın. Böyle bir jel örneği için Şekil 3'e bakınız.
NOT: Deneyimden, sonikasyon yüksek oranda tekrarlanabilirse, biri bu jeli atlayabilir ve derhal onarımı sona erdirmeye devam edebilir. Kullanıcıların titrasyon PCR'sinden sonraya kadar Üst Fraksiyonları tutmaları önerilir. Çok fazla PCR amplifikasyonu gerektiren yetersiz DNA miktarları, Üst Fraksiyondaki materyalden kurtarılabilir. - Bilinen DNA merdiven girişinden standart bir eğri oluşturduktan sonra veya bir Qubit veya Nanodrop kullanarak jelden DNA miktarını doğrudan ölçün.
- Son onarım
- Son onarım karışımını Tablo 7'deki gibi hazırlayın (verilen reaksiyon başına miktar).
- Kalan 46 μL salınımlı DNA'yı Alt Fraksiyondan PCR tüplerine aktarın ve hazırlanan son onarım karışımının 24 μL'sini ekleyin. Tablo 7'de önerildiği gibi bir PCR makinesinde inkübe edin.
- Program tamamlandıktan sonra, numuneleri aşağı çekilene kadar 4 ° C'de tutun.
- Streptavidin kaplı boncuklu biyotinillenmiş ligasyon ürünlerinin aşağı çekilmesi
- Niceliklendirilmiş boyut seçiminden her kütüphane için streptavidin kaplı boncuk miktarını belirleyin (adım 3.3.19).
NOT: Bu streptavidin kaplı boncuklar (10 mg / mL çözeltisi), mg boncuklar başına 20 μg çift sarmallı DNA'yı bağlayabilir (= 20 μg / 100 μL boncuklar). Her 1 μg Hi-C DNA için 2 μL kullanın, ancak 10 μL'den az kullanmayın. - Streptavidin kaplı boncukları karıştırın ve her kütüphane için gereken boncuk hacmini (önceki adımda hesaplanan) ayrı ayrı 1,7 mL düşük bağlama tüplerine pipetleyin.
- Boncukları 400 μL Ara yıkama tamponunda (TWB; Ek Tablo S1'deki tarife bakın) yeniden askıya alın ve bir rotatörde oda sıcaklığında ~ 3 dakika kuluçkaya yatın (adım 3.3.4'teki talimatlara bakın).
- Boncukları MPS üzerindeki süpernatanttan 1 dakika boyunca ayırın ve süpernatanı çıkarın.
- Boncukları başka bir 400 μL TWB pipetleyerek yıkayın.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika boyunca ayırın ve süpernatanı çıkarın.
- Boncuklara 400 μL 2x Bağlayıcı Arabellek (BB) ( Ek Tablo S1'deki tarif) ekleyin ve tekrar askıya alın. Ek olarak, 330 μL 1x TLE ve çözümü Son onarımdan (adım 3.4.3'ten) ekleyin.
- Bir rotatorda karıştırırken numuneleri oda sıcaklığında 15 dakika boyunca inkübe edin.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika boyunca ayırın ve süpernatanı çıkarın.
- Boncuklara 400 μL 1x BB ekleyin ve tekrar askıya alın.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika boyunca ayırın ve süpernatanı çıkarın.
- Boncukları yıkamak için 100 μL 1x TLE ekleyin.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika boyunca ayırın ve süpernatanı çıkarın.
- Son olarak, boncukları yeniden askıya almak için 41 μL 1x TLE ekleyin.
- Niceliklendirilmiş boyut seçiminden her kütüphane için streptavidin kaplı boncuk miktarını belirleyin (adım 3.3.19).
- A-kuyruklama
- A-tailing karışımını Tablo 8'deki gibi hazırlayın.
- Reaksiyonları PCR tüplerine pipetleyin ve Tablo 8'deki gibi inkübe edin.
- PCR tüplerini termosiklerden çıkarıldıktan hemen sonra buzun üzerine yerleştirin ve içeriği 1.7 mL düşük bağlayıcı tüplere aktarın.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika ayırın ve süpernatanı atın.
- Ultra saf su ile 5x T4 DNA ligaz tamponundan seyreltilmiş 400 μL 1x ligasyon tamponu ekleyin.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika boyunca ayırın ve ardından süpernatanı atın.
- 40 μL'lik son hacme 1x ligasyon tamponu ekleyin.
- Tavlama adaptörü oligoları
- 100 μM'lik adaptör oligo stokları hazırlayın (Tablo 9).
NOT: HPLC saflaştırılmış oligoların 250 nmolünü sipariş edin. - Adaptörleri PCR tüplerinde Tablo 9'da açıklandığı gibi tavlayın.
- Sıcaklığı 0,5 ° C / s'de kademeli olarak 97,5 ° C'ye yükseltmek için bir PCR termosikler kullanın. 97,5 °C'de 2,5 dakika bekletin.
- 775 döngü (20 ° C'ye ulaşan) için sıcaklığı 0,1 ° C / s'de kademeli olarak yükseltmek için bir PCR termosikler kullanın. Daha fazla kullanana kadar sıcaklığı 4 ° C'de tutun.
- Adaptörleri 15 μM'ye seyreltmek için 83 μL 1x Tavlama Arabelleği (Ek Tablo S1'deki tarif) ekleyin.
- 100 μM'lik adaptör oligo stokları hazırlayın (Tablo 9).
- Sıralama adaptörü ligasyonu
- Adaptör ligasyon karışımını 1,7 mL'lik düşük bağlayıcı bir tüpte hazırlayın (Tablo 10).
- Oda sıcaklığında 2 saat boyunca bağlayın.
- Boncukları MPS üzerindeki süpernatanttan 1 dakika ayırın ve süpernatanı atın.
- 400 μL TWB ekleyin ve oda sıcaklığında 5 dakika boyunca rotatörde inkübasyondan önce boncukları dikkatlice yukarı ve aşağı pipetleyin. Boncukları MPS üzerindeki süpernatanttan ayırın ve bu adımı bir kez daha tekrarlayın.
- Boncukları MPS üzerindeki süpernatanttan ayırın (~1 dakika), süpernatanı atın ve 200 μL 1x BB ekleyin.
- Boncukları MPS üzerindeki süpernatanttan ayırın (~1 dk) ve süpernatanı atın.
- 200 μL 1x PCR öncesi Tampon ekleyin (10x'ten; Ek Tablo S1'deki tarif) ve yeni bir 1,7 mL düşük bağlayıcı tüpe aktarın.
- Boncukları MPS üzerindeki süpernatanttan ayırın (~1 dk) ve süpernatanı atın.
- 20 μL 1x PCR öncesi Arabellek ekleyin ve pipetleme ile karıştırın.
- Tüpleri kullanım sırasında buz üzerinde tutun veya 4 ° C'de saklayın.
- Titrasyonla PCR çevrim numarasının optimizasyonu
- Tablo 11'de olduğu gibi numune başına 30 μL ana karışım reaksiyonu ayarlayın (verilen reaksiyon başına miktar).
- En düşük döngü sayısını çalıştırın ve 5 μL aliquot alın. Bir sonraki 5 μL aliquot'u almadan önce kalan reaksiyon üzerinde ek 2-3 döngü çalıştırın. Dört aliquot toplamak için tekrarlayın.
- Her aliquot için Tablo 11'deki PCR parametrelerini kullanın.
- Her 5 μL numuneye 5 μL su ve 2 μL 6x boya ekleyin. 25-150 ng Düşük Moleküler ağırlıklı merdiven ile% 2'lik bir agaroz TBE jeli ( Ek Tablo S1'deki tarif) üzerinde çalıştırın. Beklenen sonuçlar için Şekil 4'e bakın.
NOT: Son kütüphane PCR amplifikasyonu için en uygun döngü sayısı [adım 3.10], jel eksi bir döngü üzerinde görünür ürün elde etmek için en düşük döngü sayısıdır.
- Son kütüphane PCR amplifikasyonu
- Tablo 11'de olduğu gibi sıralama için her bir son kitaplığı yükseltmek üzere 12 x 30 μL reaksiyonları ayarlayın.
- PCR titrasyonundan sonraki döngü sayısını belirledikten sonra PCR reaksiyonlarını Tablo 11'e göre çevrimlendirin (adım 3.9.3).
- PCR tamamlandıktan sonra, çoğaltılan numuneleri 1.7 mL'lik düşük bağlayıcı bir mikrofüj tüpünde toplayın.
- Tüpleri MPS'ye yerleştirin ve süpernatantı yeni bir 1,7 mL düşük bağlayıcı mikrofüj tüpüne aktarın.
- Artık streptavidin kaplı boncukları 20 μL 1x PCR öncesi Arabellekte yeniden askıya alın.
NOT: Bu şablon, 4 °C'de günlerce haftalarca veya -20 °C'de uzun süreli olarak saklandığında yeniden kullanılabilir.
- Astarların manyetik boncuk karışımı ile çıkarılması
- Ses seviyesini adım 3.10.4'ten tam olarak 360 μL'ye ayarlamak için 1x TLE arabelleği ( Ek Tablo S1'deki tarif) kullanın.
- Her numuneye, karıştırmak için 360 μL manyetik boncuk karışımı ve pipeti yukarı ve aşağı ekleyin.
- Bir rotatorda, numuneleri oda sıcaklığında 10 dakika karıştırın.
- Boncukları, oda sıcaklığında (3-5 dakika) MPS üzerindeki süpernatanttan ayırın.
- Boncukları 200 μL %70 etanol kullanarak iki kez yıkayın ve boncukları her seferinde MPS'de 5 dakika boyunca geri kazanın.
- Bir santrifüjde hızlı döndürün ve etanolden tamamen pipet çekin. Etanolün daha da buharlaştırılması için boncukları MPS üzerinde havada kurutun.
NOT: Pelet çatlamadan bitter çikolata gibi görünmelidir (~ 10 dakika sürebilir). - 30 μL ultra saf su ekleyin ve DNA'yı oda sıcaklığında 10 dakika boyunca süzmek için yeniden askıya alın. Karıştırmaya yardımcı olmak için tüpleri her 2 dakikada bir hafifçe kaydırın.
- Boncukları MPS üzerindeki süpernatanttan 5 dakika boyunca ayırın.
- Her numuneden süpernatantı taze bir 1,7 mL tüpte toplayın.
- Bir parça boyutu dağılımı elde etmek ve son kütüphaneyi ölçmek için kütüphanenin 1 μL'sini %2'lik bir agaroz TBE ( Ek Tablo S1'deki tarif) jeli üzerinde çalıştırın (Şekil 5).
NOT: ClaI sindirimi yalnızca DpnII-DpnII kavşakları için gerçekleşebilir ve son kütüphane için daha düşük bir parça boyutu dağılımı ile sonuçlanması gereken pozitif bir ligasyon kontrolü görevi görür. Son kütüphaneler 4 °C'de birkaç gün, -20 °C'de uzun süreli saklanabilir veya hemen seyreltilip sıralama için gönderilebilir.
Tablo 5: Biotin giderim reaktifleri ve sıcaklıkları Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 6: Sonikasyon için parametreler. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 7: Son onarım reaktifleri ve sıcaklıkları. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 8: A-tailing reaktifleri ve sıcaklıkları. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 9: PCR Primer'lar ve Çift-Uç-adaptör oligoları, tavlama için reaktif tavlamalı. Kısaltma: 5PHOS = 5' fosfat. Yıldız işaretleri fosforothioated DNA bazlarını gösterir. # Dizinlenmiş bir oligoyu, dizinlenmiş bir adaptöre tavlamak için Evrensel oligo ile birleştirin. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 10: Adaptör ligasyon reaktifleri. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 11: PCR reaktifleri ve döngü parametreleri. Bu tabloyu indirmek için lütfen tıklayınız.

Şekil 3: Tipik boyut sonrası seçim sonuçlarını gösteren agarose jeli. DpnII-DdeI Hi-C'nin dört örneği (1-4 numaralı) için Üst ve Alt Fraksiyonlar gösterilmiştir. Her numune için ilk şerit, 0.8x manyetik boncuk karışımından türetilen Üst fraksiyonu içerir ve ikinci ve üçüncü şeritler, 1.1x manyetik boncuk karışımından türetilen Alt Fraksiyonun seyreltilmesini içerir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 4: PCR titrasyon sonuçları olan agaroz jeli. 5 döngü PCR'den başlayarak, dört kütüphanenin her biri için her 2 döngüden (5, 7, 9 ve 11 döngü) sonra örnekler alınır. Bu şekle dayanarak, her numune için en uygun döngü olarak 6 döngü seçildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
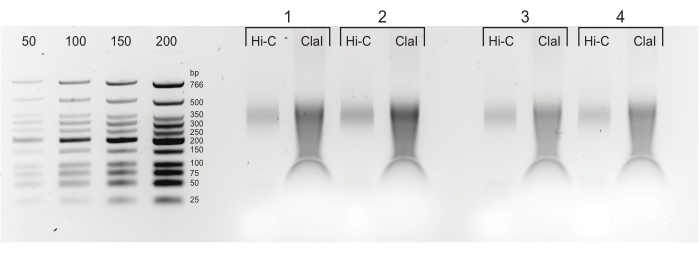
Şekil 5: Son PCR ürünleri. Temizlik ve boyut seçiminden sonra, PCR ürünleri (Hi-C), aynı kütüphanenin (ClaI) ClaI sindirilmiş bir fraksiyonunun yanına yüklendi. ClaI sindirilmiş fragmanlar, aranan DpnII-DpnII ligasyonlarının varlığını gösterir. ClaI'nin DpnII-DdeI kavşaklarını sindirmediğini ve bu nedenle tüm ligasyonların bu kısıtlamadan kaynaklanan boyut küçülmesine katkıda bulunmayacağını unutmayın. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bu makaledeki rakamlar, daha önce Lafontaine ve ark.21 tarafından yayınlanmış olanın ayrı, tekrarlanan bir deneyinden oluşturulmuştur. Yüksek verimli sıralama verileri elde edildikten sonra, Hi-C verilerini işlemek için Open Chromatin Collective (Open2C: https://github.com/open2c) kullanıldı. Benzer bir boru hattı, 4D Nucleome projesinin veri portalında bulunabilir (https://data.4dnucleome.org/resources/data-analysis/hi_c-processing-pipeline). Kısaca, Nextflow boru hattı damıtıcısı (https://github.com/open2c/distiller-nf), (1) Hi-C moleküllerinin dizilerini referans genoma hizalamak, (2) .sam hizalamasını ayrıştırmak ve Hi-C çiftleriyle dosyaları oluşturmak, (3) PCR kopyalarını filtrelemek ve (4) çiftleri Hi-C etkileşimlerinin bağlanmış matrislerine toplamak için uygulanmıştır. Soğutucular olarak adlandırılan bu HDF5 formatlı matrisler daha sonra (1) bir HiGlass sunucusunda (https://higlass.io/) görüntülenebilir ve (2) bölmeler, TAD'lar ve döngüler gibi katlanma özelliklerini çıkarmak ve ölçmek için Open Chromatin Collective (https://github.com/open2c/cooltools) tarafından tutulan "cooltools" koleksiyonunda bulunan çok sayıda açık kaynaklı hesaplama aracı kullanılarak analiz edilebilir.
Hi-C3.0 kütüphanelerinin bazı kalite göstergeleri, okuma çiftlerini birkaç basit metrik/gösterge kullanılarak bir referans genomla eşleştirdikten hemen sonra değerlendirilebilir. İlk olarak, sıralı okuma çiftlerinin tipik olarak ~% 50'si insan hücreleri için benzersiz bir şekilde eşlenebilir. Kromozomların polimerik doğası nedeniyle, bu haritalanmış okumaların çoğu (~% 60-% 90), bir kromozom (cis) içindeki etkileşimleri temsil eder ve etkileşim frekansları artan genomik mesafe (mesafeye bağlı bozunma) ile hızla bozunur. Mesafeye bağlı bozunum, genomik mesafenin bir fonksiyonu olarak temas olasılığını (kromozom kolu başına) gösteren bir "ölçekleme grafiğinde" en iyi şekilde görselleştirilebilir. Farklı çapraz bağlayıcıların ve enzimlerin kullanılmasının, uzun ve kısa menzilli mesafelerde mesafeye bağlı bozunmayı değiştirebileceğinibulduk17. DSG çapraz bağlamanın eklenmesi, Mnase gibi enzimler ve daha küçük parçalar üreten DpnII-DdeI kombinasyonları ile birleştirildiğinde kısa mesafelerdeki etkileşimlerin tespit edilebilirliğini arttırır (Şekil 6A).
Mesafeye bağlı bozunma doğrudan 2B etkileşim matrislerinden de gözlemlenebilir: etkileşimler merkezi diyagonalden daha uzağa yerleştirildiğinde daha seyrek hale gelir (Şekil 6B). Ek olarak, bölmeler, TAD'lar ve döngüler gibi genomik katlama özellikleri, Hi-C matrislerinden ve ölçekleme grafiklerinden genel genom çapında ortalama mesafeye bağlı bozunumdan sapmalar olarak tanımlanabilir. Önemli olarak, FA'ya ek olarak DSG ile çapraz bağlanma, kromozomların polimer doğası nedeniyle sınırsız olan rastgele ligasyonları azaltır ve bu nedenle kromozomlar arasında (trans halinde) meydana gelme olasılığı daha yüksektir (Şekil 6C). Rastgele ligasyonun azaltılması, özellikle kromozomaller arası ve çok uzun menzilli (>10-50 Mb) kromozomal etkileşimler için sinyal-gürültü oranlarının artmasına neden olur.

Şekil 6: Haritalanmış ve filtrelenmiş Hi-C kütüphanelerinin temsili sonuçları . (A) Parça uzunluğuna (üstte) göre sıralanmış ve FA veya FA + DSG (altta) ile çapraz bağlanan çeşitli enzimler için temas olasılığı ve türevi olan ölçekleme grafikleri. MNAse (microC) veya DpnII-DdeI (Hi-C 3.0) ile sindirim, DSG'nin FA'ya (altta) eklenmesiyle birlikte kısa menzilli temasları (üstte) önemli ölçüde artırır. (B) Sütunlar, sadece FA çapraz bağlamadan sonra DpnII sindiriminin ve FA + DSG çapraz bağlamadan sonra DpnII veya DdeI sindiriminin Hi-C ısı haritalarını gösterir. Beyaz oklar, DSG çapraz bağlama ve DdeI sindiriminden sonra "noktaların" artan gücünü gösterir ve DNA döngülerinin daha iyi tespit edilmesini sağlar. Satırlar, C paneliyle hizalanarak artan çözünürlükte kromozom 3'ün farklı kısımlarını gösterir: üst sıra: tüm kromozom 3 (0-198.295.559 Mb); orta sıra: 186-196 Mb; alt satır: 191,0-191,5 Mb. (C) A'da gösterilen bölgeler için kapsama grafikleri. Siyah oklar, yalnızca FA çapraz bağlama için daha düşük kapsama alanını (%cis okumaları) gösterir. Kısaltmalar: FA = formaldehit; DSG = dissüksinimidil glutarat; chr = kromozom. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Eşlenen tüm okumalar yararlı değildir. İkinci bir kalite göstergesi, PCR kopyalarının sayısıdır. Tam yinelenen okumaların, ligasyon ve sonikasyondan sonra tesadüfen gerçekleşmesi pek olası değildir. Bu nedenle, bu tür okumalar muhtemelen PCR amplifikasyonundan kaynaklanmıştır ve filtrelenmesi gerekir. Kopyalar genellikle düşük karmaşıklıktaki kütüphaneleri büyütmek için çok fazla PCR döngüsü gerektiğinde ortaya çıkar. Genel olarak, Hi-C için, çoğu kütüphanenin titrasyon PCR tarafından belirlendiği gibi yalnızca 5-8 döngü nihai PCR amplifikasyonuna ihtiyacı vardır (bkz. adım 3.9; Şekil 4). Bununla birlikte, yeterli karmaşıklığa sahip kütüphaneler, 14 döngü PCR amplifikasyonundan sonra bile elde edilebilir.
Optik kopyalar olarak adlandırılan başka bir yinelenen okuma kategorisi, desenli akış hücreleri (HiSeq4000 gibi) kullanan Illumina dizileme platformlarındaki amplifikasyon işleminden kaynaklanabilir. Optik kopyalar, akış hücresinin aşırı yüklenmesinden, (büyük) kümelerin iki ayrı küme olarak adlandırılmasına neden olmasından veya PCR'nin ilk turundan sonra orijinal çift uçlu molekülün yerel olarak yeniden kümelenmesinden bulunur. Her iki optik kopya türü de yerel olduğundan, akış hücresindeki konumlarına göre PCR kopyalarından tanımlanabilir ve ayırt edilebilirler. %15 > PCR kopyalarına sahip kütüphanelerin yenilenmesi gerekirken, optik kopyalara sahip kütüphaneler yükleme işlemini optimize ettikten sonra yeniden yüklenebilir.
Ek Tablo S1: Tamponlar ve çözeltiler. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Hücre işleme için kritik adımlar
Daha az sayıda giriş hücresi kullanmak mümkün olsa da, bu protokol, derin sıralamadan sonra uygun karmaşıklığı sağlamak için sıralama şeridi başına ~ 5 × 106 hücre (~ 400 M okuma) için optimize edilmiştir. Hücreler en iyi fiksasyondan önce sayılır. Ultra derin kütüphanelerin oluşturulması için, genellikle istenen okuma derinliğine ulaşılana kadar şerit (ve hücre) sayısını çoğaltırız. Optimal fiksasyon için, FA fiksasyonundan önce serum içeren ortam PBS ile değiştirilmeli ve fiksatif çözeltiler derhal ve konsantrasyon gradyanları15,22 olmadan eklenmelidir. Hücre hasadı için, tripsinizasyona göre kazıma tercih edilir, çünkü tripsinizasyondan sonra daha düz bir şekilden küresel bir şekle geçiş, nükleer konformasyonu etkileyebilir. DSG ilavesinden sonra, gevşek ve topaklanmış hücre peletleri kolayca kaybolur. Bu aşamada hücreleri kullanırken dikkatli olun ve kümelenmeyi azaltmak için% 0.05'e kadar BSA ekleyin.
Yöntemdeki değişiklikler
Bu protokol insan hücreleri kullanılarak geliştirilmiştir17. Yine de, kromozom konformasyonu yakalama deneyimine dayanarak, bu protokol çoğu ökaryotik hücre için çalışmalıdır. Önemli ölçüde daha düşük bir giriş için (~ 1 × 106 hücre), lizis ve konformasyon yakalama prosedürleri için hacimlerin yarısını kullanmanızı öneririz [adım 2.1-2.4]. Bu aynı zamanda DNA izolasyonunun [adım 2.5] 1.7 mL tüplere sahip bir masa üstü santrifüjde gerçekleştirilmesine izin verecek ve bu da düşük DNA konsantrasyonları için peletlemeyi iyileştirebilecektir. DNA'nın nicelleştirilmesi (adım 2.6.6) nasıl ilerleneceğini gösterecektir. Düşük miktarlarda izole DNA (1-5 μg) için, boyut seçimini atlamanızı (adım 3.3) ve hacmi bir CFU ile 130 μL'den ~ 45 μL'ye düşürdükten sonra biyotin çıkarılmasına devam etmenizi öneririz.
Bu protokol, FA ve DSG ile daha sonra çapraz bağlandıktan ve DpnII ve DdeI ile sindirimden sonra yüksek kaliteli veriler sağlamak için özel olarak geliştirilmiştir. Bununla birlikte, ChIP-seq23 ve ChIA-PET24'te de kullanılan FA ve ardından EGS (etilen glikol bis (süksinimidil süksinat)) gibi alternatif çapraz bağlama stratejileri eşit derecede iyi çalışabilir17. Benzer şekilde, sindirim için DpnII ve HinfI18 veya MboI, MseI ve NlaIII19 gibi farklı enzim kombinasyonları kullanılabilir. Enzim kombinasyonlarını uyarlarken, spesifik 5' çıkıntıları doldurabilen ve her kokteyl için en uygun tamponları kullanabilen biyotinile nükleotidleri kullandığınızdan emin olun. DpnII kendi tamponu ile birlikte gelir ve enzim üreticisi DdeI sindirimi için özel bir tampon önerir. Bununla birlikte, bu protokolde DpnII ve DdeI ile çift sindirim için, Kısıtlama Tamponu önerilir, çünkü her iki enzim için% 100 aktivitede derecelendirilmiştir.
Konformasyon yakalama sorunlarını giderme
Kromozom konformasyonu yakalamadaki üç temel adım: çapraz bağlama, sindirim ve religasyon, sonuçlar jel üzerinde görselleştirilmeden önce gerçekleştirilmiştir. Bu üç adımın her birinin kalitesini belirlemek ve sorunların nerede ortaya çıkmış olabileceğini ayırt etmek için, sindirimden önce (CI) ve sonra (DC) alikotlar alınır ve bağlı Hi-C örneği ile birlikte jel üzerine yüklenir (Şekil 2). Bu jel, Hi-C örneğinin kalitesini ve protokole devam etmeye değip değmeyeceğini belirlemek için kullanılır. CI ve DC olmadan, potansiyel suboptimal adım (lar) ı belirlemek zordur. Suboptimal ligasyonun, ligasyonun kendisindeki bir sorundan, doldurmadan veya çapraz bağlama ile ilgili bir problemden kaynaklanabileceğini belirtmek gerekir. Çapraz bağlama sorunlarını gidermek için, kütüphane başına 1 × 107 hücreden fazlasını kullanmadığınızdan ve yeni çapraz bağlama reaktifleri ve temiz hücrelerle (yani, PBS ile durulanır) başlamadığınızdan emin olun. Ligasyon için, hücrelerin ve ligasyon karışımının buz üzerinde tutulduğundan emin olun. 16 ° C'de 4 saatlik inkübasyondan hemen önce T4 DNA ligazını ekleyin ve iyice karıştırın.
Sorun giderme kitaplığı hazırlığı
PCR titrasyonundan sonra jel üzerinde 10'dan fazla PCR döngüsüne ihtiyaç duyuluyorsa veya PCR ürünü görülmüyorsa (Şekil 4), Hi-C numunesini kaydetmek için birkaç seçenek vardır. PCR titrasyonundan geri döndüğünüzde, ilk seçenek PCR'yi tekrar denemektir. Hala yeterli ürün yoksa, boncukları 1x TLE tamponuyla iki kez yıkadıktan sonra başka bir A-tailing ve adaptör ligasyonu (adım 3.6) denemesi mümkündür. Bu ek A-tailing ve adaptör ligasyonundan sonra, daha önce olduğu gibi PCR titrasyonuna geçilebilir. Hala bir ürün yoksa, son seçenek adım 3.3'ten 0.8x fraksiyonunu seslendirmek ve oradan devam etmektir.
Hi-C3.0'ın sınırlamaları ve avantajları
Hi-C'nin, hücre popülasyonundaki lokus çiftleri arasındaki etkileşimlerin ortalama sıklığını yakalayan popülasyon tabanlı bir yöntem olduğunu anlamak önemlidir. Bazı hesaplamalı analizler, bir popülasyon25'ten konformasyon kombinasyonlarını çözmek için tasarlanmıştır, ancak prensip olarak, Hi-C hücreler arasındaki farklılıklara kördür. Tek hücreli Hi-C 26,27 yapmak mümkün olsa da ve hesaplamalı çıkarımlar 28 yapılabilse de, tek hücreli Hi-C ultra yüksek çözünürlüklü 3C bilgisi elde etmek için uygun değildir. Hi-C'nin ek bir sınırlaması, yalnızca çift yönlü etkileşimleri algılamasıdır. Çok temaslı etkileşimleri tespit etmek için, kısa okuma dizilimi (Illumina)16 ile birlikte sık kesiciler kullanılabilir veya PacBio veya Oxford Nanopore platformlarından uzun okuma dizilemesi kullanarak çok temaslı 3C29 veya 4C30 gerçekleştirilebilir. Kardeş kromatitler arasındaki ve boyunca temasları özel olarak tespit etmek için Hi-C türevleri de geliştirilmiştir31,32.
Hi-C19 ve Micro-C33, kilobaz altı çözünürlüklerde temas haritaları oluşturmak için kullanılabilse de, her ikisi de büyük miktarda sıralama okuması gerektirir ve bu maliyetli bir girişim haline gelebilir. Maliyet olmadan benzer veya daha yüksek çözünürlüğe ulaşmak için, spesifik genomik bölgeler (capture-C 34) veya spesifik protein etkileşimleri (ChiA-PET 35, PLAC-seq36, Hi-ChIP37) için zenginleştirme uygulanabilir. Bu zenginleştirme uygulamalarının gücü ve dezavantajı, yalnızca sınırlı sayıda etkileşimin örneklenmesidir. Bu tür zenginleştirmelerle, Hi-C'nin küresel yönü (ve küresel normalleşme seçeneği) kaybolur.
Hi-C3.0'ın önemi ve potansiyel uygulamaları
Bu protokol, yüksek çözünürlüklü, ultra derin 3C'yi mümkün kılarken aynı zamanda TAD'ler ve bölmeler17 gibi büyük ölçekli katlama özelliklerini de algılamak için tasarlanmıştır (Şekil 6). Bu protokol, her Hi-C kütüphanesi için tüp başına 5 × 106 hücre ile başlar; bu, 1 milyara kadar çift uçlu okuma elde etmek için bir akış hücresi üzerinde bir veya iki şeridi sıralamak için fazlasıyla yeterli malzeme olmalıdır. Ultra derin dizileme için, haritalanan okumaların ve PCR kopyalarının sayısına bağlı olarak 5 × 106 hücreli çoklu tüpler hazırlanmalıdır. En yüksek çözünürlükte (<1 kb), döngüsel etkileşimler çoğunlukla CTCF bölgeleri arasında bulunur, ancak destekleyici-arttırıcı etkileşimler de tespit edilebilir. Okuyucular, veri analizinin ayrıntılı bir açıklaması için Akgöl Oksuz ve ark.17'ye başvurabilirler.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Protokol geliştirme için Denis Lafontaine'e ve Biyoinformatik yardım için Sergey Venev'e teşekkür ederiz. Bu çalışma, Ulusal Sağlık Enstitüleri Ortak Fonu 4D Nükleom Programı'ndan J.D.'ye (U54-DK107980, UM1-HG011536) verilen bir hibe ile desteklenmiştir. J.D., Howard Hughes Tıp Enstitüsü'nün bir araştırmacısıdır.
Bu makale HHMI'nın Yayınlara Açık Erişim politikasına tabidir. HHMI laboratuvar başkanları daha önce kamuya münhasır olmayan bir CC BY 4.0 lisansı ve araştırma makalelerinde HHMI'ya alt lisanslanabilir bir lisans vermiştir. Bu lisanslar uyarınca, bu makalenin yazar tarafından kabul edilen makalesi, yayınlandıktan hemen sonra CC BY 4.0 lisansı altında serbestçe kullanılabilir hale getirilebilir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 kb Ladder | New England Biolabs | N3232L | |
| Agarose | Invitrogen | 16500100 | |
| Agencourt AMPure XP magnetic beads , 60 mL | Beckman Coulter | A63881 | |
| Amicon Ultra-0.5 Centrifugal Filter Unit (CFU) | EMD Millipore | UFC500396 | |
| Annealing Buffer (5x) | See recipe in supplemental materials | ||
| ATP 10 mM | ThermoFisher | R0441 | |
| Avanti J-25i High Speed Refrigerated ultra-centrifuge | Beckman Coulter | ||
| beckman ultracentrifuge tube 35 mL | Beckman Coulter | 357002 | |
| Binding Buffer (2x) | See recipe in supplemental materials | ||
| biotin-14-dATP 0.4 mM | Invitrogen | 19524-016 | |
| BSA 10 mg/mL | New England Biolabs | B9000S | dilute from 20 mg/mL |
| Cell scraper | Falcon | 353089 | |
| Cell scraper | Corning | 3008 | |
| Conical polypropylene tubes 50 mL | Denville | C1062-P | |
| Conical tube 15 mL | Denville | C1017-P | |
| Covaris micro tube AFA fiber with snap-cap 130 µL | Covaris | 520045/520077 | |
| Covaris Sonicator | Covaris | E220/E220evolution/M220 | |
| Culture flask 175 cm2 | Falcon | 353112 | |
| Culture plates 150 mm x 25 mm | Corning | 430599 | |
| dATP 1 mM | Invitrogen | 56172 | |
| dATP 10 mM | Invitrogen | 56172 | |
| dCTP 10 mM | Invitrogen | 56173 | |
| DdeI | New England Biolabs | R0175L | |
| dGTP 10 mM | Invitrogen | 56174 | |
| DMSO | Sigma | D2650-5x10ML | |
| dNTP mix 25 mM | Invitrogen | 10297117 | |
| Dounce homogenizer | DWK Life Sciences | 8853010002/8853030002 | |
| DPBS | Gibco | 14190-144 | |
| DpnII | New England Biolabs | R0543M | |
| DSG | ThermoScientific | 20593 | |
| dTTP 10 mM | Invitrogen | 56175 | |
| Ethanol 70% | Fisher | A409-4 | Diluted from 100% |
| Ethidium Bromide | Fisher | BP1302-10 | |
| Formaldehyde (37%) | Fisher | BP531-500 | |
| Gel loading dye (6x ) | New England Biolabs | B7024S | |
| Glycine in ultrapure water 2.5 M | Sigma | G8898-1KG | |
| HBSS | Gibco | 14025-092 | |
| Igepal CA-630 detergent | MP Biomedicals | 198596 | |
| Klenow DNA polymerase 5 U/µL | New England Biolabs | M0210L | |
| Klenow Fragment 3-->5’ exo-, 5 U/µL | New England Biolabs | M0212L | |
| ligation buffer (10x) | New England Biolabs | B7203S | |
| Liquid nitrogen | |||
| LoBind microcentrifuge tube 1.7 mL | Eppendorf | 22431021 | |
| Low Molecular Weight DNA Ladder | New England Biolabs | N3233L | |
| Lysis buffer | See recipe in supplemental materials | ||
| Magnetic Particle separator | ThermoFisher | 12321D | |
| Microfuge tubes 1.7 mL | Axygen | MCT-175-C | |
| MyOne Streptavidin C1 beads | Invitrogen | 65001 | |
| NEBuffer 2.1 (10x) | New England Biolabs | B7002S | |
| NEBuffer 3.1 (10x) | New England Biolabs | B7203S | |
| PBS | Gibco | 70013-032 | |
| PCR (strip) tubes | Biorad | TBS0201/ TCS0803 | |
| PCR thermocycler | Biorad | T100 | |
| Pfu Ultra II Buffer (10x) | Agilent | Comes with Pfu Ultra | |
| PfuUltra II Fusion HS DNA Polymerase | Agilent | 600674 | |
| Phase lock tube 15 mL | Qiagen | 129065 | |
| Phase lock tubes 2 mL | Qiagen | 129056 | |
| Phenol:chloroform:isoamyl alcohol | Invitrogen | 15593-049 | |
| Protease inhibitor cocktail | ThermoFisher | 78440 | |
| Proteinase K in ultrapure water 10 mg/mL | Invitrogen | 25530-031 | |
| Refrigerated Centrifuge | Eppendorf | 5810R | |
| RNase A, DNase and protease-free 10 mg/mL | Thermo Scientific | EN0531 | |
| Rotator | Argos technologies | EW-04397-40 or rocking platform | |
| SDS 1% | Fisher | BP13111 | |
| Sodium acetate pH = 5.2, 3 M | Sigma | ||
| Sub-Cell GT Horizontal Electrophoresis System | Biorad | 1704401 | |
| T4 DNA ligase 1 U/µL | Invitrogen | 100004817 | |
| T4 DNA polymerase | New England Biolabs | M0203L | |
| T4 DNA polymerase | New England Biolabs | M0203L | |
| T4 DNA polymerase 3 U/µL | New England Biolabs | M0203L | |
| T4 ligation buffer (5x) | Invitrogen | Y90001 | |
| T4 polynucleotide kinase 10 U/µL | New England Biolabs | M0201L | |
| Tabletop centrifuge | Eppendorf | 5425 | |
| TBE buffer | See recipe in supplemental materials | ||
| Tris Low EDTA Buffer (TLE) | See recipe in supplemental materials | ||
| Triton X-100 (10%) | Sigma | 93443 | |
| Truseq adapter oligos | Integrated DNA Technologies (IDT)) | https://www.idtdna.com/site/order/oligoentry | 250 nmole and HPLC purified |
| Tween 20 detergent | Fisher | 9005-64-5 | |
| Tween Wash Buffer | See recipe in supplemental materials | ||
| Vortex | Scientific Industries | (G560)SI-0236 |
Referanslar
- Dekker, J., Rippe, K., Dekker, M., Kleckner, N. Capturing chromosome conformation. Science. 295 (5558), 1306-1311 (2002).
- Simonis, M., et al. Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture-on-chip (4C). Nature Genetics. 38 (11), 1348-1354 (2006).
- Dostie, J., et al. Chromosome Conformation Capture Carbon Copy (5C): a massively parallel solution for mapping interactions between genomic elements. Genome Research. 16 (10), 1299-1309 (2006).
- Lieberman-Aiden, E., et al. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science. 326 (5950), 289-293 (2009).
- Stadhouders, R., et al. Multiplexed chromosome conformation capture sequencing for rapid genome-scale high-resolution detection of long-range chromatin interactions. Nature Protocols. 8 (3), 509-524 (2013).
- Kalhor, R., Tjong, H., Jayathilaka, N., Alber, F., Chen, L. Genome architectures revealed by tethered chromosome conformation capture and population-based modeling. Nature Biotechnology. 30 (1), 90-98 (2012).
- Hsieh, T. H., et al. Mapping nucleosome resolution chromosome folding in yeast by micro-C. Cell. 162 (1), 108-119 (2015).
- Hsieh, T. -. H. S., Fudenberg, G., Goloborodko, A., Rando, O. J. Micro-C XL: assaying chromosome conformation from the nucleosome to the entire genome. Nature Methods. 13 (12), 1009-1011 (2016).
- Denker, A., de Laat, W. The second decade of 3C technologies: detailed insights into nuclear organization. Genes & Development. 30 (12), 1357-1382 (2016).
- Rodley, C. D., Bertels, F., Jones, B., O’Sullivan, J. M. Global identification of yeast chromosome interactions using Genome conformation capture. Fungal Genetics and Biology. 46 (11), 879-886 (2009).
- Rao, S. S., et al. A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell. 159 (7), 1665-1680 (2014).
- Alipour, E., Marko, J. F. Self-organization of domain structures by DNA-loop-extruding enzymes. Nucleic Acids Research. 40 (22), 11202-11212 (2012).
- Lajoie, B. R., Dekker, J., Kaplan, N. The Hitchhiker’s guide to Hi-C analysis: Practical guidelines. Methods. 72, 65-75 (2015).
- Belaghzal, H., Dekker, J., Gibcus, J. H. Hi-C 2.0: An optimized Hi-C procedure for high-resolution genome-wide mapping of chromosome conformation. Methods. 123, 56-65 (2017).
- Golloshi, R., Sanders, J. T., McCord, R. P. Iteratively improving Hi-C experiments one step at a time. Methods. 142, 47-58 (2018).
- Darrow, E. M., et al. Deletion of DXZ4 on the human inactive X chromosome alters higher-order genome architecture. Proceedings of the National Academy of Sciences of the United States of America. 113 (31), 4504-4512 (2016).
- Akgol Oksuz, B., et al. Systematic evaluation of chromosome conformation capture assays. Nature Methods. 18 (9), 1046-1055 (2021).
- Ghuryeid, J., et al. Integrating Hi-C links with assembly graphs for chromosome-scale assembly. PLoS Computational Biology. 15 (8), 1007273 (2019).
- Gu, H., et al. Fine-mapping of nuclear compartments using ultra-deep Hi-C shows that active promoter and enhancer elements localize in the active A compartment even when adjacent sequences do not. bioRxiv. , (2021).
- Ramani, V., et al. Mapping 3D genome architecture through in situ DNase Hi-C. Nature Protocols. 11 (11), 2104-2121 (2016).
- Lafontaine, D. L., Yang, L., Dekker, J., Gibcus, J. H. Hi-C 3.0: Improved Protocol for Genome-Wide Chromosome Conformation Capture. Current Protocols. 1 (7), 198 (2021).
- Belton, J. -. M. M., et al. Hi-C: A comprehensive technique to capture the conformation of genomes. Methods. 58 (3), 268-276 (2012).
- Truch, J., Telenius, J., Higgs, D. R., Gibbons, R. J. How to tackle challenging ChIP-Seq, with long-range cross-linking, Using ATRX as an example. Methods in Molecular Biology. 1832, 105-130 (2018).
- Wang, P., et al. In situ chromatin interaction analysis using paired-end tag sequencing. Current Protocols. 1 (8), 174 (2021).
- Tjong, H., et al. Population-based 3D genome structure analysis reveals driving forces in spatial genome organization. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 1663-1672 (2016).
- Nagano, T., et al. Cell-cycle dynamics of chromosomal organization at single-cell resolution. Nature. 547 (7661), 61-67 (2017).
- Ramani, V., et al. Massively multiplex single-cell Hi-C. Nature Methods. 14 (3), 263-266 (2017).
- Meng, L., Wang, C., Shi, Y., Luo, Q. Si-C is a method for inferring super-resolution intact genome structure from single-cell Hi-C data. Nature Communications. 12 (1), 4369 (2021).
- Tavares-Cadete, F., Norouzi, D., Dekker, B., Liu, Y., Dekker, J. Multi-contact 3C reveals that the human genome during interphase is largely not entangled. Nature Structural & Molecular Biology. 27 (12), 1105-1114 (2020).
- Vermeulen, C., et al. Multi-contact 4C: long-molecule sequencing of complex proximity ligation products to uncover local cooperative and competitive chromatin topologies. Nature Protocols. 15 (2), 364-397 (2020).
- Oomen, M. E., Hedger, A. K., Watts, J. K., Dekker, J. Detecting chromatin interactions between and along sister chromatids with SisterC. Nature Methods. 17 (10), 1002-1009 (2020).
- Mitter, M., et al. Conformation of sister chromatids in the replicated human genome. Nature. 586 (7827), 139-144 (2020).
- Krietenstein, N., et al. Ultrastructural Details of Mammalian Chromosome Architecture. Molecular Cell. 78 (3), 554-565 (2020).
- Hughes, J. R., et al. Analysis of hundreds of cis-regulatory landscapes at high resolution in a single, high-throughput experiment. Nature Genetics. 46 (2), 205-212 (2014).
- Fullwood, M. J., et al. An oestrogen-receptor-alpha-bound human chromatin interactome. Nature. 462 (7269), 58-64 (2009).
- Fang, R., et al. Mapping of long-range chromatin interactions by proximity ligation-assisted ChIP-seq. Cell Research. 26 (12), 1345-1348 (2016).
- Mumbach, M. R., et al. HiChIP: efficient and sensitive analysis of protein-directed genome architecture. Nature Methods. 13 (11), 919-922 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır