Method Article
שילוב של מיקרוסקופיית ניקוי ופלואורסצנציה להדמיית שינויים בביטוי גנים ותגובות פיזיולוגיות לפלסמודיופורה brassicae
In This Article
Summary
הפרוטוקול הנוכחי מתאר שיטה אופטימלית לתצפית היסטולוגית של גלים המושרים על ידי פלזמודיופורה brassicae. מקטעי ויברטומים של היפוקוטיל מנוקים לפני הדמיה פלואורסצנטית כדי לחקור את המעורבות של גורמי שעתוק ופיטוהורמונים במהלך התקדמות המחלה. פרוטוקול זה מתגבר על מגבלות הטמעת הרגם, ומאפשר הדמיה של חלבונים פלואורסצנטיים בצמחים.
Abstract
זיהום של גידולי Brassica על ידי פרוטיסט Plasmodiophora brassicae הנישא בקרקע מוביל להיווצרות כיס על האיברים התת-קרקעיים. היווצרות כיס המרה דורשת תכנות מחדש של התאים ושינויים בחילוף החומרים של הצמח הנגוע. זה הכרחי כדי להקים כיור פיזיולוגי מוכוון פתוגנים שאליו מנותבים חומרי המזון המארחים. להבנה מלאה של האינטראקציה המסוימת הזו בין צמח לפתוגן ואת המנגנונים שבאמצעותם הצמיחה וההתפתחות של המארח מתערערים ומתחדשים, חיוני לעקוב ולבחון את השינויים הפנימיים המלווים את היווצרות הכיס ברזולוציה תאית. שיטות המשלבות כתמים פלואורסצנטיים וחלבונים פלואורסצנטיים משמשות לעתים קרובות לחקר תגובות אנטומיות ופיזיולוגיות בצמחים. למרבה הצער, גודלם הגדול של הגלים ושקיפותם הנמוכה משמשים מכשולים עיקריים בביצוע תצפיות שלמות מתחת למיקרוסקופ. יתר על כן, שקיפות נמוכה מגבילה את השימוש במיקרוסקופיה פלואורסצנטית כדי לחקור את התקדמות המחלה ואת היווצרות כיס המרה. מאמר זה מציג שיטה אופטימלית לתיקון וניקוי כיס המרה כדי להקל על אפיפלואורסצנציה ומיקרוסקופיה קונפוקלית לבדיקת גלים נגועים ב- P. brassicae. נעשה שימוש בפרוטוקול ניקוי רקמות לניקוי אופטי מהיר ואחריו חתך ויברטום כדי לזהות שינויים אנטומיים ולמקם ביטוי גנים עם היתוך מקדם וקווי דיווח המתויגים בחלבונים פלואורסצנטיים. שיטה זו תוכיח את עצמה כיעילה לחקר תגובות תאיות ופיזיולוגיות במבנים אחרים המופעלים על ידי פתוגנים בצמחים, כגון סינקטיה הנגרמת על ידי נמטודה וקשרי שורשים, כמו גם גלי עלים ועיוותים הנגרמים על ידי חרקים.
Introduction
צמחים המושפעים מפתוגנים או מחרקים עלולים לפתח מבנים לא תקינים (עיוותי איברים או כיס מרה), המאפשרים לפולש לבלוע חומרי מזון ולהתרבות1. כאן, ננקטה גישה היסטופתולוגית יעילה כדי לחקור את השינויים המתרחשים בכיסים המתפתחים בחלקים התת-קרקעיים של צמחים הנגועים ב-Plasmodiophora brassicae (איור 1). החוט הקטין הקשור לפתוגן זה נובע מהעובדה כי נבגי מנוחה P. brassicae יכולים לשמור על יכולתם לפלוש לצמחים במשך שנים רבות. במקרה של גידול בקנה מידה גדול של אונס זרעי שמן (Brassica napus), זוהי בעיה רצינית שכן גורמים כלכליים להגביל את סיבוב היבול, מה שמוביל הצטברות נבגים מנוחהבקרקע 2. עמידותו של אונס זרעי שמן למחלת קלאברוט הנגרמת על ידי P. brassicae נקבעת גנטית. למרבה הצער, הפתוגן לעתים קרובות מתעלה על ההתנגדות בגלל הביולוגיה שלו והמאגר הגנטי הצר שממנו מקורו של אונס זרעי שמן. לכן, זה הפך להיות רלוונטי לחקור את התגובות שלאחר ההדבקה בצמחים המארחים ואת יכולתם להאט את התקדמות המחלה או למנוע התפתחות תסמינים מסוימים.
במחלת קלאברוט, החומרה מוערכת בדרך כלל על סמך התפתחות כיס המרה ומידת הנזק למערכת השורשים. זה ידוע בשם מדד המחלה-DI3. עם זאת, הוא אינו לוכד באופן מלא את ההערכה האמיתית של אינטראקציה זו בין צמח לפתוגן. בפרט, הוא אינו מתייחס לאופן שבו הפתוגן מופץ בתוך השורשים ואם הצמח יכול לרסן P. brassicae תנועה בתוך הרקמות שלה. יתר על כן, לא קל לצפות באיזו מידה P. brassicae מתכנת מחדש אנטומיה של איברים תת קרקעיים. מחקרים על צמח המודל Arabidopsis thaliana הראו כי P. brassicae זיהום מוביל לעיכוב של קסילוגנזה (הן שלבי ההתחלה והן שלבי ההבשלה) ולהגברת התמיינות הפלום בתוך כיס המרה4,5. יתר על כן, בשורשים ובהיפוקוטיל של צמחים נגועים, צאצאי התאים הקמביאליים אינם עוזבים את המצב המיטוטי ומתרבים זמן רב יותר מאשר בצמחים בריאים.6. תהליך זה קובע את הגודל הסופי של כיס המרה וקובע את מספר נבגי המנוחה הפתוגנים המיוצרים בתוך הצמח הנגוע. P. brassicae-תכנות מחדש התפתחותי, מטבולי ופיזיולוגי מונע בפונדקאי הוא מורכב מאוד7; לכן, היישום של כלים המאפשרים בדיקה של שינויים פנימיים בתוך galls הוא חיוני להערכה נכונה של אינטראקציה זו. התקדמות מחזור החיים של P. brassicae מלווה בתכנות מחדש של חילוף החומרים של התא המארח, אשר ניתן לראות כמו עמילן או תצהיר שומנים7,8. המכשול העיקרי למיקרוסקופיה המוצלחת של כיסים נובע מהשקיפות הנמוכה שלהם. בשל כך, רוב הדגימות ההיסטולוגיות המציגות שינויים מונחי-קלאברוט בתוך גאלים מקורן בטכניקות של הטמעת קיבוע (שעווה או שרף) ולאחר מכן חיתוך מיקרוטום. גישות כאלה שימשו בהצלחה לאיתור פעילות המקדם של גנים רבים הפעילים ב-clubroot galls4,5 או טכניקות צביעה שונות המקלות על התצפית של P. brassicae התקדמות מחזור החיים9. עם זאת, יש לציין כי שלבי התיקון וההטבעה גוזלים זמן רב וגורמים לשטיפה חלקית או מלאה של ביומולקולות חשובות (למשל, שומנים), מה שמעכב באופן משמעותי תצפיות מסוימות. לאחרונה P. brassicae התקדמות מחזור החיים בפונדקאי הודגמה בעזרת הכלאה פלואורסצנטית באתרה (FISH), שבה מתיל-טרנספראז מסוג SABATH (PbBSMT) בדיקה ספציפית לגן שימשה לסימון היווצרות נבגים במנוחה10. חלופה טובה היא השימוש בשיטות אחרות המבוססות על פלואורסצנציה, שבהן ניתן לראות את ה-autofluorescence של חלק מרכיבי התא, את הפעילות של 5'- אזורים רגולטוריים במעלה הזרם של גנים שהתמזגו לסמני חלבון פלואורסצנטיים, ואת הצטברות של חלבונים מסוימים המתויגים באופן פלואורסצנטי. עם זאת, בנוסף לשקיפות הנמוכה של הדגימות, חסרון גדול הקשור לאובייקטים כאלה הוא עבודה עם דגימות unfixed, אשר מקטין באופן משמעותי את הזמן שבו תמונות באיכות טובה ניתן לתעד. בשנת 2015, Kurihara et al.11 פיתח ריאגנט ניקוי, המאפשר שימור של חלבונים פלואורסצנטיים ומגביר את השקיפות של דגימות רקמת הצמח. בנוסף, הוא תואם כתמים היסטולוגיים רבים. לאחרונה, אותה טכניקה יושמה בהצלחה כדי לדמיין רכיבים שונים של דופן התא ברקמות הצמח12,13. כאן, פרוטוקול זה שימש לניתוח היבטים שונים של פיתוח גל. תהליך העבודה מתחיל בקיבוע של כיס מרה, חיתוך ויברטום, ניקוי רקמות, צביעה והדמיה פלואורסצנטית. בהתאם לצרכים של אחד, ישירות או לאחר צביעה מסוימת, החלקים המתקבלים יכולים להיות נתונים לבדיקה תחת אפיפלואורסצנציה או מיקרוסקופ קונפוקלי. שיטה זו מספקת פתרון יעיל לחקר שינויים מקומיים בביטוי גנים ובתגובות פיזיולוגיות, כולל איזון ואיתות פיטוהורמון. ניתן לעקוב אחר התקדמות המחלה על ידי התבוננות בדפוס ההתפלגות של נבגי מנוחה ודינמיקת ההבשלה. יתר על כן, ניתן ליישם את הפרוטוקול בקלות עבור שינויים אופייניים להדמיה בתוך P. brassicae צמחים נגועים, כולל עיכוב של קסילוגנזה או תגובות ההגנה של הצמח המארח הנראות כגניציה מקומית בגנוטיפים עמידים. דוגמאות בפרוטוקול זה מגיעות מהדמיה שנערכה על Arabidopsis thaliana מודל; עם זאת, ניתן להחיל את הפרוטוקול גם על מיני יבולים אחרים השייכים ל Brassicaceae משפחה. השיטה המתוארת להלן תאפשר מחקרים מפורטים עתידיים של מבנים תאיים ושינויים מולקולריים המלווים היווצרות כיס המרה ב P. brassicae-צמחים נגועים.
זרימת העבודה הכללית של הפרוטוקול היא פשוטה למדי, וניתן לדמות ולאפיין בקלות את כל שלבי הפיתוח (איור 2). מאז P. brassicae הוא פתוגן המועבר, כל הניסויים חייבים להתבצע במערכות מבוססות קרקע. הפתוגן מעדיף תנאים חומציים; לכן, יש להשתמש במצעי קרקע שאינם מטופלים בסיד. למרות P. brassicae אינו מהווה איום על בני אדם, זה בהחלט פתוגן צמחי שיכול להתפשט דרך הקרקע והמים. לכן, כל החלקים של הצמח נגוע, כמו גם את הקרקע, צריך להיהרס לאחר הניסוי על ידי autoclaving או על ידי טיפול עם אקונומיקה.
Protocol
1. תנאי גידול הצמח
- לגדל צמחי Arabidopsis thaliana במשטר אור של יום קצר עם 9 שעות של אור ב-22 °C ו-15 שעות של חושך ב-20 °C והקרנה של 120 μmol·m−2s−1 (נמדדת כקרינה פעילה פוטוסינתטית, PAR ברמת החופה, ראו טבלת חומרים).
2. הכנת נבגים אינוקולום
הערה: לפרטים, ראו פוקס ואח'.
- הומוגניות של שניים עד שלושה כיסים קפואים מצמחי כרוב סיניים (Brassica rapa var. pekinensis cultivar "Granaat") בבלנדר המכיל 300 מ"ל של מים מזוקקים אוטומטיים ומסנן דרך ארבע שכבות של גזה סטרילית.
- צנטריפוגה של התסנין (ב 6,000 x גרם, במשך 5 דקות, וב 4 מעלות צלזיוס) ולהסיר מכנית את שכבת העמילן מן גלולת הנבג באמצעות מרית. חזור על תהליך זה עד שרוב העמילן יוסר.
- קבע את ריכוז הנבגים באמצעות המוציטומטר13 על ידי ספירת מספר הנבגים ב -20 אזורי שדה שונים.
- ודא כי הריכוז הסופי של תרחיף נבגים המשמש לחיסון הוא 1 x 106 נבגים·mL−1 עבור Arabidopsis thaliana. לחסן כל צמח 20 יום לאחר הנביטה עם 2 מ"ל של תרחיף נבגים מכויל.
3. הכנת רקמות וקיבוע
- הכינו את רקמת הצמח.
- בזהירות להסיר אדמה ממערכות השורשים של צמחים נגועים clubroot ולא נגועים. נקו היטב עם מים ואספו היפוקוטיל וגללים (אורך בין 0.5-2 ס"מ) לצינורות מיקרוצנטריפוגה.
- בצע קיבוע PFA (4% פרפורמלדהיד, PFA ב- 1x PBS + 0.01% Triton X-100) בהתאם לשלבים הבאים.
- הוסיפו 4 גרם של אבקת PFA (ראו טבלת חומרים) ל-100 מ"ל של PBS (תמיסת מלח עם אגירת פוספטים, pH 7.4, טבלה 1) על ידי ערבוב בטמפרטורה של 65°C (אין להרתיח). השתמש ב-KOH (10 M ו-1M) באופן טיפה כדי לקבל פתרון ברור עם pH של כ-11.
- כוונן את ה-pH עם H2SO4 כדי להוריד אותו ל-6.9 ולהוסיף 0.01% (v/v) Triton X-100 כדי לשפר את הקיבוע. Aliquot את הפתרון לאחסון ב -20 °C (אין להקפיא מחדש) או לאחסן ב -4 °C.
- בצע קיבוע רקמות.
- תקן את הדגימות ב- 200-500 μL של PFA מקובע למשך שעה אחת בטמפרטורת החדר על ידי הפעלת ואקום קבוע (700 mbar) באמצעות משאבת ואקום. ודא שהאובייקט שקוע לחלוטין בתמיסת PFA.
הערה: ניתן לאחסן דוגמאות במשך מספר שבועות בטמפרטורה של 4 מעלות צלזיוס (מקרר) ולהשתמש בהן מאוחר יותר לחתך.
- תקן את הדגימות ב- 200-500 μL של PFA מקובע למשך שעה אחת בטמפרטורת החדר על ידי הפעלת ואקום קבוע (700 mbar) באמצעות משאבת ואקום. ודא שהאובייקט שקוע לחלוטין בתמיסת PFA.
4. הטמעת רקמות וחיתוך
- יש להשתמש ב-4% w/v agarose להטמעת אגרוז של היפוקוטלים שאינם נגועים וגלים נגועים. מרתיחים את התמיסה כדי להמיס agarose ושופכים אותו כאשר הוא מתקרר בזמן שהוא עדיין צמיג.
- יבש את האובייקט מעט על רקמה למשך מספר שניות כדי להסיר PFA עודף.
- השתמש בקיסמים/מלקחיים כדי להטמיע ולכוון בזהירות את חפץ הצמח באגרוז. כדי למנוע מקטעים אלכסוניים, ודא שהעצם מכוון ומעוצב כראוי כך שצירו ניצב למישור להב הוויברטום (למקטעים רדיאליים).
- כדי להאיץ את התמצקות האגרוז, הניחו את צלחת הפטרי או המולטי-תרבית בטמפרטורה של 4 מעלות צלזיוס למשך 10 דקות.
הערה: אם האובייקט גדול מדי (כמו במקרה של גלים גדולים יותר של ערבידופסיס ב-21 יום לאחר החיסון [DPI]), ניתן לחתוך את האובייקט גם ללא הטבעה באגרוז.
5. חתך ויברטום
הערה: הוויברטום מצויד בסכין גילוח רוטטת כדי לחתוך דרך איברים / רקמות צמחיים. מהירות הרטט, המשרעת, זווית הלהב ועובי המקטע הם כולם פרמטרים הניתנים להתאמה (ראו טבלת חומרים).
- באמצעות להב, בזהירות לחתוך ולעצב את האובייקט בתוך בלוק agarose, וציין את הכיוון המועדף עבור חתך.
- הדביקו את גוש האגרוז/הגל הגדול כדי להרכיב אותו כראוי על מחזיק הדגימה באמצעות ציאנואקרילט/דבק מיידי וסרט מיסוך (ראו טבלת חומרים).
- עבור Arabidopsis hypocotyls ו galls (שלבים מוקדמים), לשמור על עובי של קטעים בין 30-40 מיקרומטר לקבלת תמונות באיכות טובה.
הערה: לניתוח השלבים המאוחרים יותר של התקדמות המרה, עובי המקטעים יכול להיות בין 50-80 מיקרומטר. - הימנעו מחיתוך מקטעים דקים יותר מכיוון שהוא יכול להרוס את דגימת המרה עקב התנודות של הלהב הנע.
- התאם את העובי למקטעים, מהירות ומשרעת רעידות בהתאם לעובי וגודל הגל (40 מיקרומטר או 60 מיקרומטר).
- מוסיפים מים מזוקקים לאמבטיית המים ומתחילים בחתך.
- אספו בזהירות חלקים באמצעות מלקחיים או מברשת והעבירו אותם לצינור מיקרוצנטריפוגה המכיל 1 מ"ל של חיץ PBS 1x (pH 7.4).
הערה: בדרך כלל, ככל שמשרעת הרטט גבוהה יותר, כך איכות החלוקה טובה יותר. עבור היפוקוטיל שאינם נגועים או כיס המרה שאינם מכילים נבגי מנוחה בוגרים, משרעת הרטט יכולה להישמר על 1.2 מ"מ עם מהירות 0.60 מ"מ·s−1 . במקרה של גלים גדולים עם אובדן חלקי של שלמות התא וסימנים גלויים של הבשלת נבגים, יש להפחית את משרעת הרטט ל -0.55 מ"מ עם מהירות 0.45 מ"מ·s−1 .
6. ניקוי דגימות
- הסר PBS אחד מצינור המיקרוצנטריפוגה והוסף 200-500 μL של תמיסת ניקוי (טבלה 1).
- מעתה והלאה, אחסנו את הדגימות בטמפרטורת החדר בחושך. ודא שהאובייקטים שקועים תמיד בפתרון הניקוי בכל עת.
- החלף את פתרון הניקוי בחדש אם צבעו משתנה לאחר זמן מה במהלך עיבוד הדגימה.
הערה: צבע תמיסת הניקוי יכול להפוך צהבהב עקב עיבוד הדגימה. במקרה כזה, החלפת הפתרון מומלץ לשפר את ניקוי הרקמות.
7. הליך צביעה
- עבור צביעה לבנה של Calcofluor עבור דפנות התא (עבור פיטורי תאי צמחים), הכינו 5% v/v של כתם לבן של Calcofluor (ראו טבלת חומרים) בתמיסת הסליקה. כתם לפחות 5 דקות בחושך.
- לצביעת שומנים באדום הנילוס (לצביעת נבגי מנוחה וטיפות שמן בתאים נגועים), הכינו 1 מ"ג/מ"ל מהציר (ראו טבלת חומרים) בתמיסת ניקוי. לדלל אותו עוד יותר כדי להשיג 1:99. כתם לפחות 10 דקות בחושך.
- לצביעת ליגנין בסיסית של פוקסין, יש להכין 0.2% מהכתם (ראו טבלת חומרים) בתמיסת ניקוי. כתם לפחות 10 דקות בחושך.
הערה: במהלך צביעה כפולה, הדגימות מוכתמות תחילה באדום הנילוס למשך 10 דקות לפני מריחת Calcofluor לבנה. תמיסות הכתמים העודפות הוסרו לאחר כל שלב. אם החפץ נראה מוגזם, הסירו את הכתם העודף על ידי שטיפה עם תמיסת הפינוי. יש לדלל כתמים באמצעות תמיסת הסליקה, במידת הצורך. יש להכתים תמיד את הדגימה באדום הנילוס/פוקסין בסיסי לפני הכתמת הקלקופלאור. צביעה ראשונה עם Calcofluor יכולה למנוע צביעה נכונה של הנבגים על ידי אדום הנילוס.
8. מיקרוסקופיה
- הרם קטעים מנוקים על מגלשת המיקרוסקופיה והתבונן תחת אפיפלואורסצנציה או מיקרוסקופ קונפוקלי (ראו טבלת חומרים). השתמש בתמיסת ניקוי כאמצעי הרכבה כדי למנוע ייבוש של הדגימה.
- השתמש במצבי רכישה מרובים להדמיית יותר מספקטרום פלואורסצנטי אחד בו-זמנית.
הערה: ספקטרום העירור/פליטה המשמש בפרוטוקול המוצג הוא כדלקמן: עבור הנילוס האדום 553/636 ננומטר, עבור xylem autofluorescence 380/475 nm, עבור פוקסין בסיסי 561/650 ננומטר, עבור Calcofluor לבן 405/475 ננומטר, עבור erRFP 585/608 ננומטר, ועבור GFP 488/509 ננומטר (טבלה 2).
תוצאות
עם אדום הנילוס שמכתים שומנים וסוברין, אפשר לראות את הפתוגן שנח נבגים המכילים שומנים (איור 3A,B). לפיכך, באמצעות צביעה כפולה, ניתן להשיג תמונות חדות כדי להסתכל על התבנית של התפלגות פתוגנים בתוך כיס המרה. צביעה נגדית עם לבן Calcofluor יוצרת ניגודיות ועוזרת לעקוב בו-זמנית אחר התפתחות הקסילם עם התבגרות P. brassicae (איור 3B).
ניתן גם לבדוק את היווצרותו והתפתחותו של קסילם על-ידי התבוננות ב-autofluorescence בדגימות לא מוכתמות (איור 4A) או על-ידי שימוש בכתמים כגון Basic Fuchsin שמאפשרים הדמיה מבוססת פלואורסצנציה של ליגנין (איור 4B).
על ידי שימוש בשיטה זו, ניתן לעקוב אחר שינויים בביטוי גנים או תגובות לווסתי גדילה. דוגמה מושלמת היא המקום שבו צמחי ערבידופסיס בעלי מבנה pHCA2:erRFP נוצלו כדי להמחיש את ביטוי הגנים של פעילות קמביאלית גבוהה 2 (HCA2) ברקמת פלום בתוך גלגלי הים. פעילות גנים של HCA2 נמצאה בעבר בתאי קמביום פעילים במריסטמטיקה ובתאי שושלת פלום15. כאן, הוא מתמקם יחד עם הפלום בשלבים המאוחרים של התפתחות גליל מונחה P. brassicae, ופעילותו משקפת את האופן שבו P. brassicae מגדיל את מורכבות הפלום (איור 5). התמונה המתקבלת מראה התפשטות פלום בשלב מאוחר של התפתחות כיס המרה כאשר הקמביום מקוטע. איור 5A מראה מקטע יד לא ברור של הגל, ואילו איור 5B מראה אותות פלואורסצנטיים חדים ומקומיים יותר המתקבלים על-ידי חתך ויברטום ולאחר מכן ניקוי רקמות. החפצים הוכתמו בלבן קלקופלור. איור 6 משווה את התמונה הזו (איור 6B) עם אזור דומה המתואר בגלים משובצי שרף ומיקרוטום (איור 6A) ברזולוציה של 21 DPI. תגובות ציטוקינין דיפרנציאליות בין צמחים נגועים לצמחים שאינם נגועים הוערכו על-ידי בדיקת הביטוי של סמן TCS:GFP (איתות דו-רכיבי)16 בגלים מתפתחים (איור 7). בעת הדמיית אותות GFP חלשים בכיסים וברקמות עם עיבוי משני, חשוב לציין כי אות רקע נוסף עקב autofluorescence של תאי xylem בוגרים נלכד גם במהלך ההדמיה.

איור 1: תסמיני מחלת קלאברוט על אונס זרעי שמן (B. napus) ו-Arabidopsis thaliana (קולומביה-0) ב-26 DPI עם נבגי פלזמודיופורה brassicae . במהלך המחלה, גלים גדולים להתפתח על כל מערכת השורשים, מה שהופך אותו שביר מאוד. הוא מסתיים בשחרור נבגים לאדמה שמסביב כדי לקדם זיהומים עתידיים. החלקים העליונים של גוף הצמח מראים גם סימנים של צמיחה והתפתחות לקויה. לבסוף, הצמחים הנגועים נכנעים להשפעות ההרסניות על חילוף החומרים וההתפתחות של הגדילה ברגע שמערכת השורשים נפגעת לחלוטין והצמח כבר לא יכול להתמודד עם המחלה. סרגל קנה המידה מייצג 1 ס"מ. ה- -INF מייצג צמחים מחוסנים מדומים, ואילו +INF מייצג צמחים מחוסנים ב- P. brassicae. בהזדמנות זו, תמונה של צמחי אונס זרעי שמן מסופקת לפני הסרת הקרקע כדי להציג מערכות שורשים בריאות. לאחר שטיפה, רק hypocotyl ואת החלק העליון של השורש נאספים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: זרימת העבודה הכללית. מערכות שורשי ערבידופסיס שטופות הן (A) מנותחות, (B) קבועות, (C) אגרוז מוטבעות, (D) מורכבות, ו-(E) נחתכות על הוויברטומה. האובייקטים המתקבלים נתונים לניקוי רקמות (3 ימים עד מספר שבועות ב- RT בחושך, בהתאם לסוג הרקמה ועוביה). (F) לאחר מכן ניתן להכתים עצמים מנוקים ולבדוק אותם תחת המיקרוסקופ. (ז) סיכום זרימת העבודה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
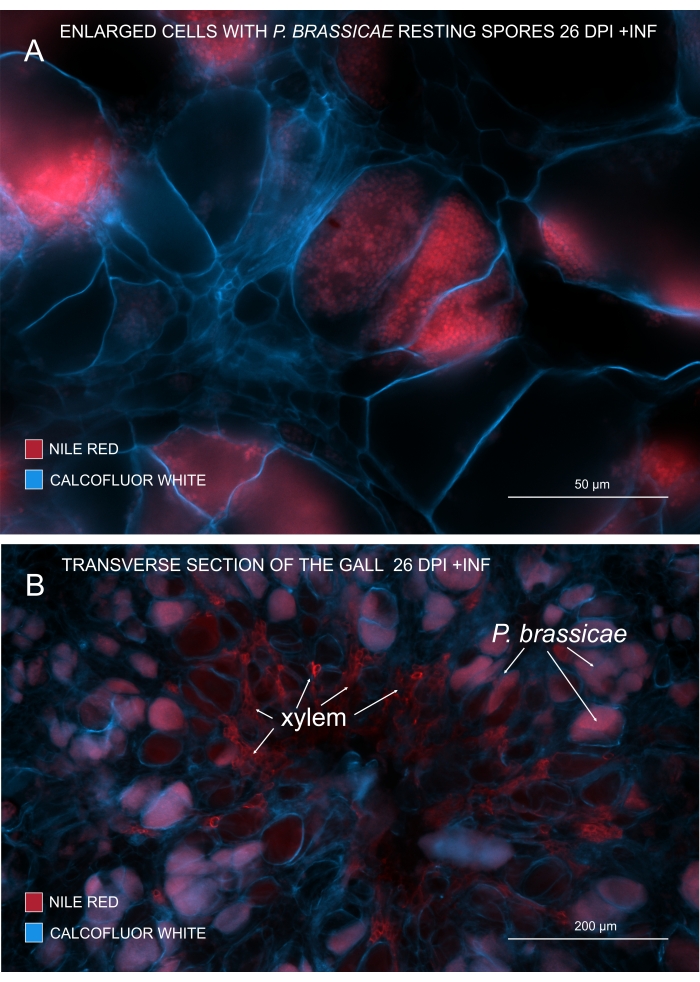
איור 3: סימון נבגי פתוגן בכתם אדום הנילוס. (A,B) צבע נילוס אדום מכתים שומנים בנבגי מנוחה, מה שעובד בצורה מושלמת כדי לעקוב אחר הבשלת P. brassicae. (A) תאים מוגדלים המתיישבים על ידי P. brassicae ומלאים בנבגי פתוגנים. (B) גם תאי קסילם בוגרים מוכתמים על ידי אדום הנילוס. החלק הוכתם בלבן Calcofluor כדי לראות את ההוצאה של תאים מארחים (A: עדשה אובייקטיבית = 20x ועובי מקטע = 60 מיקרומטר; B: עדשה אובייקטיבית = 5x ועובי מקטע = 60 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
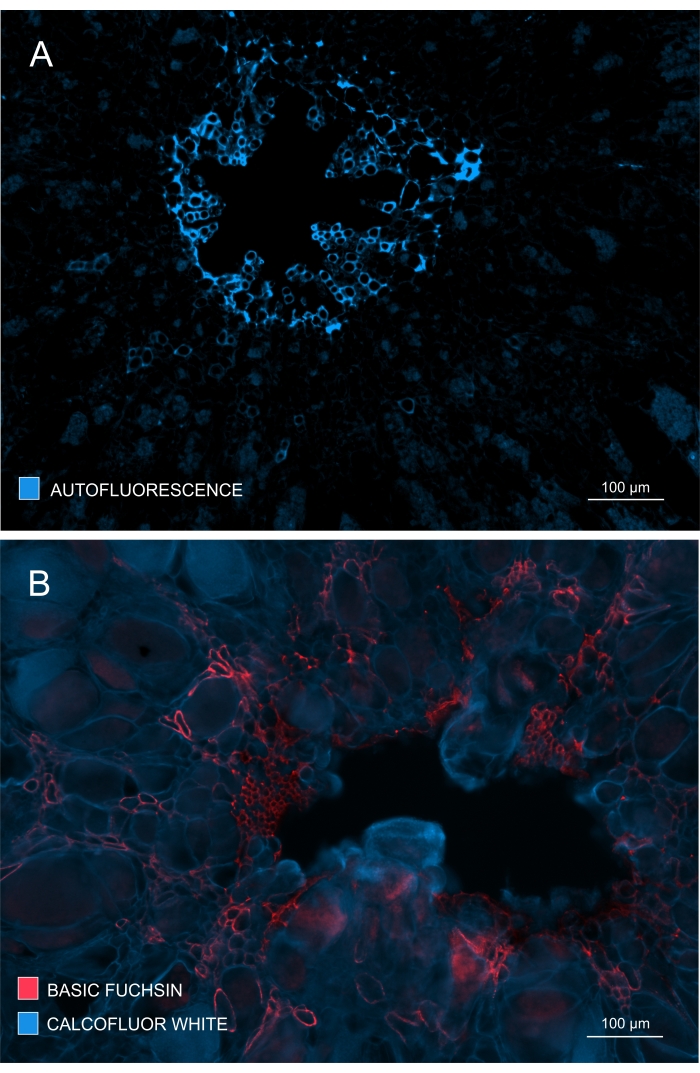
איור 4: מעקב אחר מידת ההתפתחות וההבשלה של הקסילם. (A) ליגנין נותן אוטופלואורסצנטיות חזקה בעת עירור עם UV; לכן, Xylem בוגר ניתן להפלות בקלות יחסית. (B) צביעה כפולה עם בוקסין בסיסי וקלקופלאור נותנת תוצאות טובות יותר מכיוון שכל התאים מוכתמים על ידי הצבע האחרון, בעוד שקסילם בוגר מוכתם באופן מובהק בפוקסין בסיסי. בדרך זו, צביעה כפולה מספקת לתמונות ניגודיות משופרת המתארת עיכוב ניכר של קסילוגנזה (A: עדשה אובייקטיבית = 10x ועובי מקטע = 60 מיקרומטר; B: עדשה אובייקטיבית = 10x ועובי מקטע = 60 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
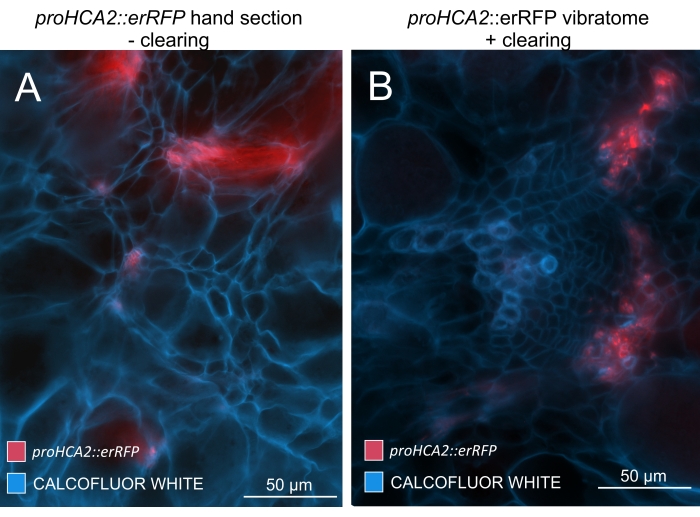
איור 5: אות ספציפי לפלום עבור הגן HCA2 בהיפוקוטיל של צמחים נגועים ב-P. brassicae ב-21 DPI. ניתן לראות פעילות מקדמת עבור proHCA2::erRFP המכילה ערבידופסיס תליאנה מהונדסת ב-(A) וב-(B). ניתן להבחין בהבדלים בין מקטע יד שאינו מנוקה בלוח (A) שבו אות ה-erRFP נראה מפוזר עקב סופר-אימפוזיציה ושכבות תאים חופפות, במיוחד בקטעי יד לא אחידים. מצד שני, (B) מראה קטע ויברטום לאחר ניקוי רקמות שבו אות erRFP מסמן במדויק את תאי הפלום בצרור כלי דם בוגר (עדשה אובייקטיבית = 20x ועובי מקטע = 60 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
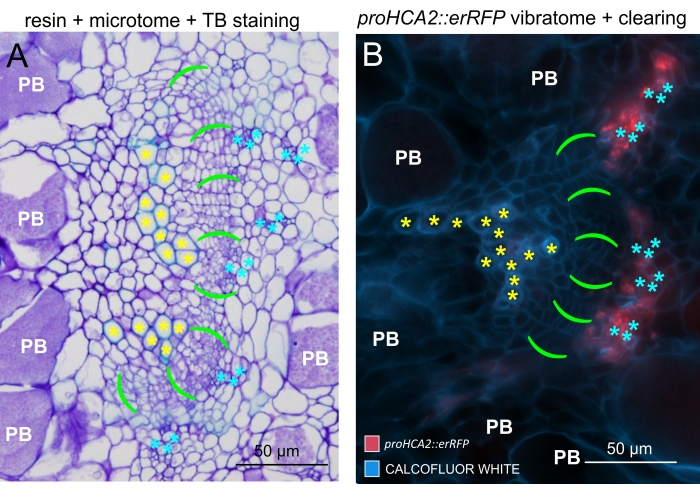
איור 6: השוואה בין גללים מוטמעים בשחפת, מוטמעים בשרף ומיקרוטום בעזרת פלואורסצנציה. (A) השוואה בין תמונות של גלי טולוידין כחולים (שחפת), מוטמעים בשרף ומיקרוטום, לבין (B) עצם מייצג (מוצג גם באיור 5B) שנרכש בעזרת פלואורסצנציה. תאי Xylem מסומנים בכוכביות צהובות, האזור הקמביאלי עם סוגריים ירוקים עזים, פלום עם כוכביות ציאן, ותאים מיושבים בפלזמה עם סמל PB לבן. מקטעים משובצים בשרף (A) מספקים רזולוציה טובה לחקר התפלגות נבגי המנוחה באיברים היפרטרופיים, מידת התקדמות המחלה ותהליכים אחרים כגון ליטוף מקומי בצמחים עמידים. עם זאת, הפרוטוקול המתואר כאן (B) מאפשר תצפית רגישה של ביטוי גנים או הצטברות חלבונים והדמיה של שינויים פיזיולוגיים אחרים ומולקולות חשובות כגון שומנים (בנבגים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
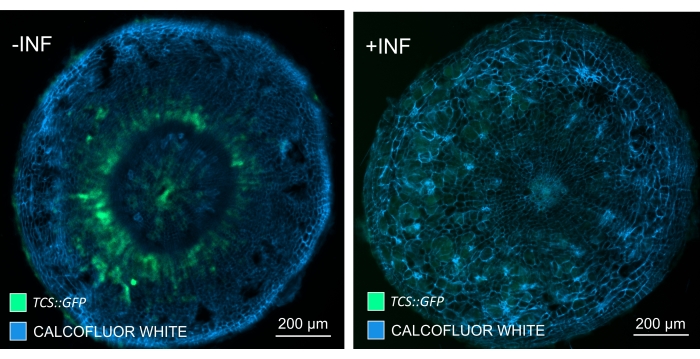
איור 7: מעקב אחר תגובות איתות של ציטוקינין בהיפוקוטיל של צמחים לא נגועים (-INF) ו-P. נגועים בbrassicae (+INF) Arabidopsis ב-16 DPI. TCS::סמן GFP שימש לאפיון בתגובות ציטוקינין של פלנטה . מקטעי הוויברטום עברו טיפול ניקוי ואחריו הכתמה בלבן קלקופלור. על פי התמונה, ברזולוציה של 16 DPI, נראה כי תגובות הציטוקינין פוחתות במידה רבה בגלים נגועים (פאנל ימני), בעוד שהם נשארים חזקים, במיוחד במאגר הפלום (תאים שבסופו של דבר יתמיינו ליצירת רקמת פלום), בצמחים שאינם נגועים (פאנל שמאלי) (עדשה אובייקטיבית = 5x ועובי = 30 מיקרומטר). ניתן גם לראות רמות מסוימות של פלואורסצנציה אוטומטית של קסילם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| תמיסת סליקה (רעילה) | ||
| רכיבים | אחוז (%) | ב-100 מ"ל מים מזוקקים |
| קסיליטול | 10% | 10 גרם |
| נתרן דאוקסיכולאט | 15% | 15 גרם |
| אוריאה | 25% | 25 גרם |
| 10x PBS (מלח עם מאגר פוספטים) | 1x PBS (100 מ"ל) | |
| נאקל | 8 גרם | 10 מ"ל 10x PBS + 90 מ"ל מים מזוקקים |
| KCl | 0.2 גרם | |
| ח"כ2ת.ד.4 | 0.24 גרם | |
| נה2HPO4 · 2H2O | 1.81 גרם | |
| מים מזוקקים | 100 מ"ל | |
| pH | pH מותאם ל-7.4 באמצעות HCl | |
| אוטוקלאב ולאחסן ב-4 מעלות צלזיוס. | ||
טבלה 1: הרכב תמיסת הסליקה ותמיסת המלח החצובה בפוספט (PBS).
| כתם פלואורסצנטי/ תג | אורכי גל עירור/פליטה | ערכת מסנן מיקרוסקופ בשימוש |
| אדום הנילוס | 553/636 ניוטון מטר | סט מסננים 43 |
| קסילם אוטופלואורסצנציה | 380/475 ניוטון מטר | ערכת מסננים 49 |
| קלקופלאור לבן | 405/475 ניוטון מטר | ערכת מסננים 49 |
| פוקסין בסיסי | 561/650 ניוטון מטר | סט מסננים 43 |
| erRFP | 585/608 ניוטון מטר | סט מסננים 43 |
| GFP | 488/509 ניוטון מטר | ערכת מסננים 38 |
טבלה 2: ספקטרום עירור/פליטה שנבחר למחקר הנוכחי.
Discussion
יישום תמיסת הניקוי על מקטעים חתוכים ברטט של כיס המרה בוודאי משפר את היכולת לחקור את האינטראקציה הביוטרופית בין P. brassicae לבין הצמח המארח. למרות שפרוטוקול הניקוי חל אפילו על מקטעי ידיים, הוא עובד טוב יותר עם קטעי ויברטום. תיקון דגימות בקיבוע PFA פועל כשלב קריטי בפרוטוקול מכיוון שניתן לאחסן דגימות בטמפרטורה של 4 מעלות צלזיוס למשך מספר ימים לפני שתמשיך בחתך. זה מספק גמישות לאחסון דגימות לתקופה מוגבלת מבלי להתפשר על הביטוי והשימור של חלבונים פלואורסצנטיים במהלך הקיבוע.
אדום הנילוס (ב-DMSO או במתנול) אינו תואם למקטעי שרף בשל ההידרופוביות שלו, הממיסה שרף והורסת את החלקים17 המשובצים בשרף. לפיכך, מקטעי ויברטום מוכיחים את עצמם כמסייעים לחקר התפלגות הפתוגן ומחזור החיים שלו בתוך כיסים מתפתחים, שבהם ניתן להשתמש בקלות בכתמים של אדום הנילוס.
תמיסת הניקוי המשמשת בפרוטוקול זה היא רב-תכליתיתביותר 12, ומאפשרת שימוש במגוון כתמי פלואורסצנציה בשילובים שונים כדי להכתים ביומולקולות/רכיבים שונים של דפנות התא (סוברין, ליגנין, תאית וכיטין באינטראקציות פטרייתיות). ניתן גם לנטרל קטעים של קווי סמן GFP פלואורסצנטיים ובכך לתאם את פעילות המקדם או דפוס הצטברות החלבון עם נוכחות הפתוגן בתאים או באזורים מסוימים של כיס המרה. עם זאת, לא ניתן היה לבטל את ה-autofluorescence של הרקע מ-xylem ותאי ענק מלאים בפתוגנים גם לאחר פרוטוקול הסליקה. זה מציג מגבלה להתבוננות בסמנים פלואורסצנטיים בשלבים מאוחרים יותר של היווצרות כיס מרה, במיוחד בעת שימוש במיקרוסקופ אפיפלואורסצנטי והדמיית אותות חלשים.
בשל רמות נמוכות של ביטוי / הצטברות של אותות פלואורסצנטיים, גורמי שעתוק קשה לזהות, אבל, עם טכניקה זו, ניתן להשיג תמונות משביעות רצון עבורם. באופן כללי, שילוב של חיתוך ויברטום עם גישת ניקוי הרקמות מרחיב את ארגז הכלים לתצפיות היסטולוגיות של רקמות מרה מורכבות. הגמישות של פרוטוקול זה מקלה על תהליך קיבוע הרקמות ומפחיתה את הזמן הדרוש לחיתוך והדמיה של דגימות רקמה טריות כדי לצפות בחלבונים פלואורסצנטיים ולקדם פעילויות. עם שיפורים נוספים ועל ידי שימוש בצבעים פלואורסצנטיים אחרים הספציפיים לביומולקולות שונות, שיטה זו תסמן התקדמות גדולה יותר במחקרים היסטולוגיים ובניתוח תמונה של רקמות צפופות ואטומות עם ארגון רקמות מורכב. בתקופה האחרונה, שיטת ניקוי הרקמות המוצגת התגלתה כפרוטוקול פופולרי ונפוץ לשילוב ולאפשר רכישה בו זמנית של אותות פלואורסצנטיים שונים11,12,13. פיתוח ושינויים עתידיים בטכניקות כאלה ישפרו מאוד את רזולוציית התמונה לצפייה באינטראקציות בין צמחים לפתוגנים ברמה התאית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
העבודה נתמכה על ידי מרכז המדע הלאומי פולין OPUS17 מענק מס '2019/33/B/NZ9/00751 "תיאום כלי דם למרחקים ארוכים בצמחים נגועים על ידי פלזמודיופורה brassicae". אנו מודים לפרופ' Yrjö Helariutta (מעבדת סיינסבורי, אוניברסיטת קיימברידג') על שיתוף קו proHCA2::erRFP .
Materials
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
References
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved