Method Article
Combinaison de la microscopie de compensation et de fluorescence pour visualiser les changements dans l’expression génique et les réponses physiologiques à Plasmodiophora brassicae
Dans cet article
Résumé
Le présent protocole décrit une méthode optimisée pour l’observation histologique des galles induites par Plasmodiophora brassicae. Les sections de vibratomes d’hypocotyles sont éliminées avant l’imagerie par fluorescence pour étudier l’implication des facteurs de transcription et des phytohormones au cours de la progression de la maladie. Ce protocole surmonte les limitations d’incorporation de résine, permettant la visualisation in planta de protéines fluorescentes.
Résumé
L’infection des cultures de Brassica par le protiste terricole Plasmodiophora brassicae entraîne la formation de galles sur les organes souterrains. La formation de galles nécessite une reprogrammation cellulaire et des changements dans le métabolisme de la plante infectée. Ceci est nécessaire pour établir un puits physiologique axé sur les agents pathogènes vers lequel les nutriments de l’hôte sont redirigés. Pour une compréhension complète de cette interaction phytopathogène particulière et des mécanismes par lesquels la croissance et le développement de l’hôte sont subvertis et remodelés, il est essentiel de suivre et d’observer les changements internes accompagnant la formation de la galle avec une résolution cellulaire. Des méthodes combinant des colorations fluorescentes et des protéines fluorescentes sont souvent utilisées pour étudier les réponses anatomiques et physiologiques chez les plantes. Malheureusement, la grande taille des galles et leur faible transparence constituent des obstacles majeurs à la réalisation d’observations complètes au microscope. De plus, la faible transparence limite l’utilisation de la microscopie à fluorescence pour étudier la progression de la hernie et la formation de galles. Cet article présente une méthode optimisée pour fixer et éliminer les galles afin de faciliter l’épifluorescence et la microscopie confocale pour l’inspection des galles infectées par P. brassicae. Un protocole de nettoyage tissulaire pour une clairance optique rapide a été utilisé, suivi d’une section de vibratomes pour détecter les changements anatomiques et localiser l’expression génique avec des fusions de promoteurs et des lignes rapporteures marquées avec des protéines fluorescentes. Cette méthode s’avérera utile pour étudier les réponses cellulaires et physiologiques dans d’autres structures déclenchées par des agents pathogènes chez les plantes, telles que les syncyties induites par les nématodes et les nœuds racinaires, ainsi que les galles des feuilles et les déformations causées par les insectes.
Introduction
Les plantes touchées par des agents pathogènes ou des insectes peuvent développer des structures anormales (déformations d’organes ou galles), qui permettent à l’envahisseur d’ingérer des nutriments et de se reproduire1. Ici, une approche histopathologique efficace a été entreprise pour étudier les changements qui se produisent dans les galles qui se développent sur les parties souterraines des plantes infectées par le protiste Plasmodiophora brassicae (Figure 1). Le fil mineur associé à cet agent pathogène provient du fait que les spores au repos de P. brassicae peuvent conserver leur capacité à envahir les plantes pendant de nombreuses années. Dans le cas de la culture à grande échelle du colza (Brassica napus), il s’agit d’un problème grave car des facteurs économiques limitent la rotation des cultures, ce qui entraîne une accumulation de spores au repos dans le sol2. La résistance du colza à la hernie causée par P. brassicae est déterminée génétiquement. Malheureusement, l’agent pathogène surpasse souvent la résistance en raison de sa biologie et du pool génétique étroit d’où provient le colza. Par conséquent, il est devenu pertinent d’étudier les réponses post-infection chez les plantes hôtes et leur capacité à ralentir la progression de la maladie ou à prévenir l’apparition de certains symptômes.
Dans la hernie de la maladie de la hernie, la gravité est généralement évaluée en fonction du développement de galles et du degré de lésion du système racinaire. C’est ce qu’on appelle l’indice de maladie-DI3. Cependant, il ne saisit pas entièrement la véritable évaluation de cette interaction phytopathogène. En particulier, il n’aborde pas la façon dont l’agent pathogène est distribué dans les racines et si la plante peut se retenir P. brassicae mouvement à l’intérieur de ses tissus. De plus, il n’est pas facile de prévoir dans quelle mesure P. brassicae reprogramme l’anatomie des organes souterrains. Études sur la plante modèle Arabidopsis thaliana ont montré que P. brassicae L’infection conduit à l’inhibition de la xylogenèse (à la fois les étapes d’initiation et de maturation) et l’amélioration de la différenciation du phloème dans les galles4,5. De plus, dans les racines et les hypocotyles des plantes infectées, la descendance des cellules cambiales ne quitte pas l’état mitotique et prolifère plus longtemps que chez les plantes saines6. Ce processus régit la taille finale de la galle et détermine le nombre de spores pathogènes au repos produites dans la plante infectée. P. brassicaeLa reprogrammation développementale, métabolique et physiologique chez l’hôte est très complexe7; Par conséquent, l’application d’outils permettant l’inspection des changements internes dans les GALL est cruciale pour évaluer correctement cette interaction. La progression du cycle de vie de P. brassicae s’accompagne d’une reprogrammation du métabolisme de la cellule hôte, qui peut être observée sous forme de dépôt d’amidon ou de lipides7,8. Le principal obstacle à la réussite de la microscopie des galles provient de leur faible transparence. Pour cette raison, la majorité des spécimens histologiques présentant des changements induits par la hernie dans les galles proviennent de techniques de fixation-enrobage (cire ou résine) suivies d’une section microtome. De telles approches ont été utilisées avec succès pour localiser l’activité promotrice de nombreux gènes actifs dans les galles de la hernie4,5 ou diverses techniques de coloration facilitant l’observation de P. brassicae Progression du cycle de vie9. Cependant, il faut noter que les étapes de fixation et d’encastrement prennent beaucoup de temps et entraînent un lavage partiel ou complet de biomolécules importantes (p. ex. lipides), ce qui entrave considérablement certaines observations. Récemment P. brassicae La progression du cycle de vie chez l’hôte a été visualisée à l’aide de l’hybridation fluorescente in situ (FISH), dans laquelle une méthyltransférase de type SABATH (PbBSMT) a été utilisée pour marquer la formation de spores au repos10. Une bonne alternative est l’utilisation d’autres méthodes basées sur la fluorescence où l’autofluorescence de certains composants cellulaires, l’activité des régions régulatrices 5'- en amont des gènes fusionnés à des marqueurs protéiques fluorescents et l’accumulation de protéines marquées par fluorescence particulières peuvent être observées. Cependant, en plus de la faible transparence des échantillons, un inconvénient majeur associé à de tels objets est de travailler avec des spécimens non fixés, ce qui réduit considérablement le temps pendant lequel des images de bonne qualité peuvent être documentées. En 2015, Kurihara et al.11 Développement d’un réactif de nettoyage, qui permet la préservation des protéines fluorescentes et augmente la transparence des échantillons de tissus végétaux. De plus, il est compatible avec de nombreuses taches histologiques. Récemment, la même technique a été appliquée avec succès pour visualiser différents composants de la paroi cellulaire dans les tissus végétaux.12,13. Ici, ce protocole a été utilisé pour analyser divers aspects du développement de la galle de la hernie. Le flux de travail commence par la fixation des galles, la section des vibratomes, l’élimination des tissus, la coloration et l’imagerie par fluorescence. Selon les besoins, directement ou après coloration particulière, les coupes résultantes peuvent être soumises à une inspection sous épifluorescence ou microscope confocale. Cette méthode fournit une solution efficace pour étudier les changements locaux dans l’expression des gènes et les réponses physiologiques, y compris l’équilibre et la signalisation phytohormonale. La progression de la maladie peut être suivie en examinant le modèle de distribution des spores au repos et la dynamique de maturation. En outre, le protocole peut être facilement appliqué pour les changements de caractéristiques d’imagerie dans P. brassicae plantes infectées, y compris l’inhibition de la xylogenèse ou les réponses de défense de la plante hôte visibles sous forme de lignification locale dans les génotypes résistants. Les exemples de ce protocole proviennent de l’imagerie effectuée sur le Arabidopsis thaliana modèle; Toutefois, le protocole peut également s’appliquer à d’autres espèces cultivées appartenant à la Brassicaceae Famille. La méthode décrite ci-dessous facilitera les futures études détaillées des structures cellulaires et des changements moléculaires accompagnant la formation de galles chez les P. brassicae-plantes infectées.
Le flux de travail général du protocole est assez simple et toutes les étapes du développement de la galle peuvent être facilement imagées et caractérisées (Figure 2). Étant donné que P. brassicae est un agent pathogène transmis par le sol, toutes les expériences doivent être effectuées dans des systèmes basés sur le sol. L’agent pathogène préfère les conditions acides; Par conséquent, des substrats de sol non traités à la chaux doivent être utilisés. Bien que P. brassicae ne constitue pas une menace pour les humains, il s’agit strictement d’un phytopathogène qui peut se propager dans le sol et l’eau. Par conséquent, toutes les parties de la plante infectée, ainsi que le sol, doivent être détruits après l’expérience par autoclavage ou par traitement à l’eau de Javel.
Protocole
1. Conditions de croissance des plantes
- Cultiver des plantes d’Arabidopsis thaliana dans un régime lumineux de jour court avec 9 h de lumière à 22 °C et 15 h d’obscurité à 20 °C et un éclairement énergétique de 120 μmol·m−2s−1 (mesuré comme le rayonnement photosynthétiquement actif, PAR au niveau de la canopée, voir le tableau des matériaux).
2. Préparation de l’inoculum de spores
REMARQUE : Pour plus de détails, voir Fuchs et coll.14.
- Homogénéiser deux à trois galles congelées provenant de plants de chou chinois (cultivar de Brassica rapa var. pekinensis « Granaat ») dans un mélangeur contenant 300 ml d’eau distillée autoclavée et filtrer à travers quatre couches de gaze stérile.
- Centrifuger le filtrat (à 6 000 x g, pendant 5 min, et à 4 °C) et retirer mécaniquement la couche d’amidon de la pastille de spores à l’aide d’une spatule. Répétez ce processus jusqu’à ce que la majeure partie de l’amidon soit éliminée.
- Déterminer la concentration de spores à l’aide d’un hémocytomètre13 en comptant le nombre de spores dans 20 zones de champ différentes.
- S’assurer que la concentration finale de la suspension de spores utilisée pour l’inoculation est de 1 x 106 spores·mL−1 pour Arabidopsis thaliana. Inoculer chaque plante 20 jours après la germination avec 2 mL de suspension de spores calibrée.
3. Préparation et fixation des tissus
- Préparez le tissu végétal.
- Enlevez soigneusement la terre des systèmes racinaires des plantes infectées et non infectées par la hernie. Nettoyez soigneusement avec de l’eau et recueillez les hypocotyles et les galles (longueur comprise entre 0,5 et 2 cm) dans des tubes microcentrifugés.
- Effectuez la fixation du PFA (4% de paraformaldéhyde, PFA dans 1x PBS + 0,01% Triton X-100) en suivant les étapes ci-dessous.
- Ajouter 4 g de poudre de PFA (voir le tableau des matières) à 100 mL de PBS (solution saline tamponnée au phosphate, pH 7,4, tableau 1) en agitant à 65 °C (ne pas faire bouillir). Utilisez KOH (10 M et 1M) goutte à goutte pour obtenir une solution limpide avec un pH d’environ 11.
- Ajustez le pH avec H2SO4 pour le ramener à 6,9 et ajoutez 0,01% (v/v) de Triton X-100 pour améliorer la fixation. Aliquote la solution à conserver à −20 °C (ne pas recongeler) ou à conserver à 4 °C.
- Effectuer la fixation des tissus.
- Fixer les échantillons dans 200-500 μL de fixateur PFA pendant 1 h à température ambiante en appliquant un vide constant (700 mbar) à l’aide d’une pompe à vide. Assurez-vous que l’objet est complètement immergé dans la solution PFA.
REMARQUE : Les échantillons peuvent être conservés pendant quelques semaines à 4 °C (réfrigérateur) et utilisés plus tard pour la section.
- Fixer les échantillons dans 200-500 μL de fixateur PFA pendant 1 h à température ambiante en appliquant un vide constant (700 mbar) à l’aide d’une pompe à vide. Assurez-vous que l’objet est complètement immergé dans la solution PFA.
4. Encastrement et sectionnement des tissus
- Utiliser de l’agarose à 4 % p/v pour l’enrobage d’agarose d’hypocotyles non infectés et de galles infectées. Faites bouillir la solution pour dissoudre l’agarose et versez-la quand elle refroidit alors qu’elle est encore visqueuse.
- Sécher légèrement l’objet sur un mouchoir en papier pendant quelques secondes pour éliminer l’excès de PFA.
- Utilisez des cure-dents ou des pinces pour incorporer et orienter soigneusement l’objet végétal dans l’agarose. Pour éviter les sections obliques, assurez-vous que l’objet est orienté et moulé correctement afin que son axe soit perpendiculaire au plan de la lame du vibratome (pour les sections radiales).
- Pour accélérer la solidification de l’agarose, placer la plaque de Petri ou la plaque multiculture à 4 °C pendant 10 min.
REMARQUE: Si l’objet est trop grand (comme dans le cas de galles plus grandes d’Arabidopsis 21 jours après l’inoculation [DPI]), l’objet peut être sectionné même sans incorporation dans l’agarose.
5. Sectionnement du vibratome
REMARQUE: Le vibratome est équipé d’une lame de rasoir vibrante pour couper à travers les organes / tissus végétaux. La vitesse de vibration, l’amplitude, l’angle de la lame et l’épaisseur de la section sont tous des paramètres qui peuvent être ajustés (voir le tableau des matériaux).
- À l’aide d’une lame, coupez et moulez soigneusement l’objet dans un bloc d’agarose, en notant l’orientation préférée pour la section.
- Collez le bloc d’agarose/la grosse galle pour le monter correctement sur le porte-échantillon à l’aide de cyanoacrylate/colle instantanée et de ruban de masquage (voir le tableau des matériaux).
- Pour les hypocotyles et les galles d’Arabidopsis (stades précoces), conserver l’épaisseur des sections entre 30 et 40 μm pour obtenir des images de bonne qualité.
REMARQUE: Pour analyser les étapes ultérieures de la progression de la galle, l’épaisseur des sections peut être comprise entre 50 et 80 μm. - Abstenez-vous de couper des sections plus minces car cela peut détruire l’échantillon de galle en raison des vibrations de la lame en mouvement.
- Ajustez l’épaisseur des sections, la vitesse et l’amplitude des vibrations en fonction de l’épaisseur et de la taille de la galle (40 μm ou 60 μm).
- Ajouter de l’eau distillée au bain-marie et commencer par la section.
- Prélever soigneusement les sections à l’aide d’une pince ou d’une brosse et les transférer dans un tube à microcentrifugation contenant 1 ml de 1x tampon PBS (pH 7,4).
REMARQUE: En règle générale, plus l’amplitude de vibration est élevée, meilleure est la qualité du sectionnement. Pour les hypocotyles ou les galles non infectés qui ne contiennent pas de spores matures au repos, l’amplitude de vibration peut être maintenue à 1,2 mm avec une vitesse de 0,60 mm·s−1 . En cas de grandes galles avec perte partielle de l’intégrité cellulaire et signes visibles de maturation des spores, l’amplitude vibratoire doit être réduite à 0,55 mm avec une vitesse de 0,45 mm·s−1 .
6. Enlèvement des échantillons
- Retirer 1x PBS du tube microcentrifuge et ajouter 200 à 500 μL de solution de dégagement (tableau 1).
- Désormais, conservez les échantillons à température ambiante dans l’obscurité. Assurez-vous que les objets sont toujours immergés dans la solution de nettoyage à tout moment.
- Remplacez la solution de nettoyage par la nouvelle si sa couleur change après un certain temps pendant le traitement de l’échantillon.
REMARQUE: La couleur de la solution de nettoyage peut devenir jaunâtre en raison du traitement de l’échantillon. Dans un tel cas, le remplacement de la solution est recommandé pour améliorer l’élimination des tissus.
7. Procédure de coloration
- Pour la coloration blanche au calcofluor pour les parois cellulaires (pour les cellules végétales en exposition), préparer 5 % v/v de coloration blanche de calcofluor (voir le tableau des matériaux) dans la solution de nettoyage. Colorer pendant au moins 5 minutes dans l’obscurité.
- Pour colorer les lipides avec du rouge du Nil (pour colorer les spores au repos et les gouttelettes d’huile dans les cellules infectées), préparer 1 mg/mL du stock (voir le tableau des matières) dans une solution de nettoyage. Diluez-le davantage pour obtenir 1:99. Colorer pendant au moins 10 minutes dans l’obscurité.
- Pour la coloration basique à la lignine de Fuchsine, préparer 0,2 % p/v de la coloration (voir le tableau des matières) dans une solution de nettoyage. Colorer pendant au moins 10 minutes dans l’obscurité.
REMARQUE: Pendant la double coloration, les échantillons sont d’abord colorés avec du rouge du Nil pendant 10 minutes avant l’application de blanc de calcofluor. Les solutions de coloration excédentaires ont été éliminées après chaque étape. Si l’objet semble trop taché, enlevez l’excès de tache en lavant avec la solution nettoyante. Diluer les taches à l’aide de la solution de dégagement, si nécessaire. Toujours colorer l’échantillon avec du rouge du Nil/Fuchsine basique avant la coloration au calcofluor. La coloration d’abord avec le calcofluor peut empêcher une coloration correcte des spores par le rouge du Nil.
8. Microscopie
- Montez les sections dégagées sur la lame de microscopie et observez-les sous épifluorescence ou au microscope confocal (voir le tableau des matériaux). Utilisez une solution de nettoyage comme support de montage pour éviter le séchage de l’échantillon.
- Utilisez plusieurs modes d’acquisition pour imager plus d’un spectre de fluorescence simultanément.
NOTE: Les spectres d’excitation/émission utilisés dans le protocole présenté sont les suivants: pour le rouge du Nil 553/636 nm, pour l’autofluorescence du xylème 380/475 nm, pour le fuchsine basique 561/650 nm, pour le blanc de calcofluor 405/475 nm, pour l’erRFP 585/608 nm et pour la GFP 488/509 nm (tableau 2).
Résultats
Avec le rouge du Nil qui colore les lipides et la subérine, il est possible de voir les spores pathogènes au repos contenant des lipides (Figure 3A,B). Par conséquent, en utilisant une double coloration, des images nettes peuvent être obtenues pour examiner le modèle de distribution des agents pathogènes dans les galles. La contre-coloration avec du blanc de calcofluor crée un contraste et aide à suivre simultanément le développement du xylème avec la maturation de P. brassicae (Figure 3B).
La formation et le développement du xylème pourraient également être vérifiés en observant l’autofluorescence dans des échantillons non colorés (figure 4A) ou en utilisant des colorants tels que la fuchsine basique qui permettent une imagerie de la lignine basée sur la fluorescence (figure 4B).
En utilisant cette méthode, on pourrait suivre les changements d’expression génique ou les réponses aux régulateurs de croissance. Un exemple parfait est celui où les plantes d’Arabidopsis hébergeant la construction pHCA2:erRFP ont été utilisées pour visualiser l’expression du gène HIGH CAMBIAL ACTIVITY 2 (HCA2) dans le tissu phloème dans les galles de la hernie. L’activité du gène HCA2 a déjà été trouvée dans les cellules de la lignée du cambium et du phloème15 actifs sur le méristisme. Ici, il co-localise avec le phloème dans les derniers stades du développement de la galle induite par P. brassicae, et son activité reflète comment P. brassicae augmente la complexité du phloème (Figure 5). L’image résultante montre la prolifération du phloème à un stade avancé du développement de la galle, lorsque le cambium se fragmente. La figure 5A montre une section de la galle non dégagée, tandis que la figure 5B montre des signaux fluorescents plus nets et localisés obtenus par sectionnement du vibratome suivi d’un dégagement tissulaire. Les objets ont été contre-colorés avec du blanc de calcofluor. La figure 6 compare cette image (figure 6B) avec une région similaire représentée dans les galles incorporées de résine et sectionnées en microtome (figure 6A) à 21 DPI. Les réponses cytokinines différentielles entre les plantes infectées et non infectées ont été évaluées en vérifiant l’expression du marqueur TCS:GFP (Two Component Signalling)16 dans les galles en développement (Figure 7). Lors de l’imagerie des signaux GFP faibles dans les galles et les tissus avec épaississement secondaire, il est important de noter que le signal de fond supplémentaire dû à l’autofluorescence des cellules xylèmes matures est également capturé pendant l’imagerie.

Figure 1 : Symptômes de la hernie sur le colza (B. napus) et Arabidopsis thaliana (Columbia-0) à 26 DPI avec des spores de Plasmodiophora brassicae. Au cours de la maladie, de grosses galles se développent sur l’ensemble du système racinaire, le rendant extrêmement fragile. Il se termine par la libération de spores dans le sol environnant pour favoriser les infections futures. Les parties supérieures du corps de la plante montrent également des signes de croissance et de développement médiocres. Enfin, les plantes infectées succombent aux effets dévastateurs sur le métabolisme et le développement de la croissance une fois que le système racinaire est complètement endommagé et que la plante ne peut plus faire face à la maladie. La barre d’échelle représente 1 cm. Le -INF signifie mock-inoculated, tandis que +INF signifie P. brassicae-inoculated plants. À cette occasion, une photo de colza oléagineux est fournie avant l’enlèvement du sol pour présenter des systèmes racinaires sains. Après le lavage, seuls l’hypocotyle et la partie supérieure de la racine sont recueillis. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Flux de travail général. Les systèmes racinaires d’Arabidopsis lavés sont (A) disséqués, (B) fixes, (C) encastrés dans l’agarose, (D) montés et (E) sectionnés sur le vibratome. Les objets résultants sont soumis à un nettoyage tissulaire (3 jours à plusieurs semaines à RT dans l’obscurité, selon le type de tissu et l’épaisseur). (F) Les objets dégagés peuvent ensuite être colorés et inspectés au microscope. G) Résumé de l’exécution du travail. Veuillez cliquer ici pour voir une version agrandie de cette figure.
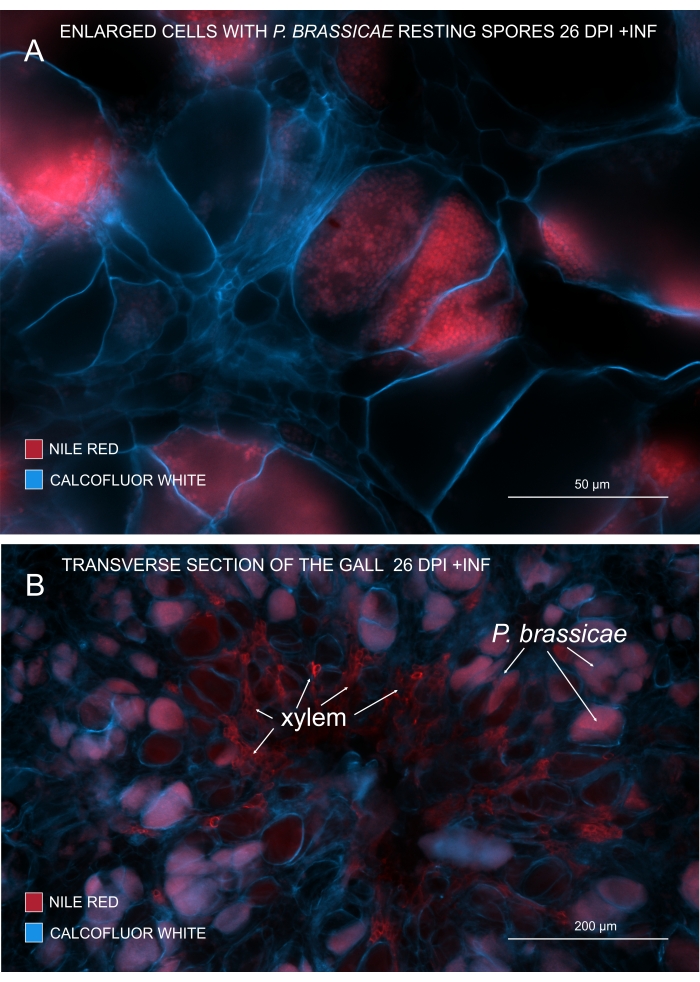
Figure 3 : Marquage des spores pathogènes avec une coloration rouge du Nil. (A,B) Le rouge du Nil colore les lipides dans les spores au repos, ce qui fonctionne parfaitement pour suivre la maturation de P. brassicae. (A) Cellules élargies colonisées par P. brassicae et remplies de spores pathogènes. (B) Les cellules matures du xylème sont également colorées par le rouge du Nil. La section a été contre-colorée avec du blanc de calcofluor pour voir la dépense des cellules hôtes (A: lentille d’objectif = 20x et épaisseur de section = 60 μm; B : Lentille d’objectif = 5x et épaisseur de coupe = 60 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
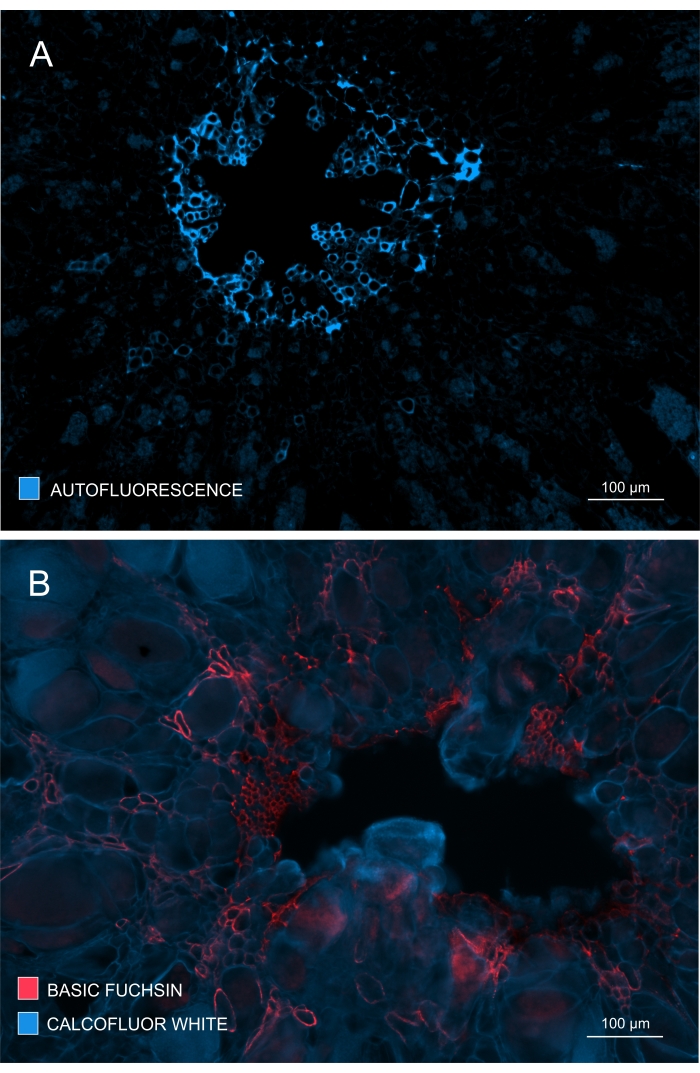
Figure 4 : Suivi de l’étendue du développement et de la maturation du xylème. (A) La lignine donne une forte autofluorescence lors de l’excitation par UV; Par conséquent, le xylème mature peut être discriminé relativement facilement. (B) La double coloration avec la fuchsine basique et le calcofluor donne de meilleurs résultats puisque toutes les cellules sont colorées par ce dernier colorant, tandis que le xylème mature est nettement coloré avec la fuchsine basique. De cette façon, la double coloration fournit des images avec un contraste amélioré illustrant une inhibition notable de la xylogenèse (A: lentille d’objectif = 10x et épaisseur de section = 60 μm; B : Lentille d’objectif = 10x et épaisseur de section = 60 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
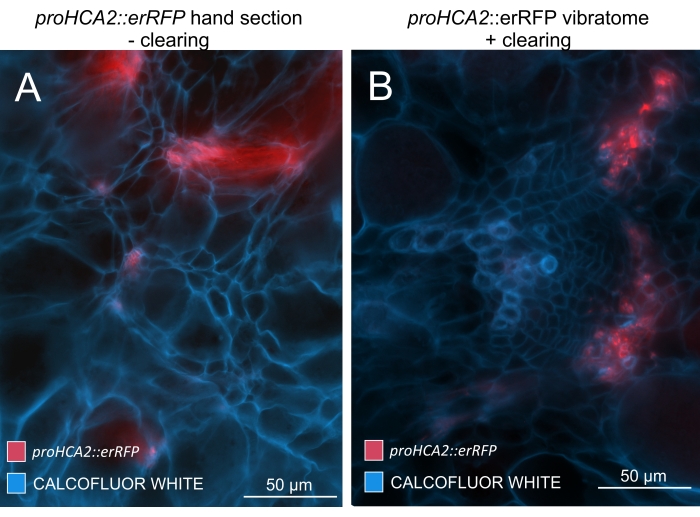
Figure 5 : Signal spécifique au phloème pour le gène HCA2 dans les hypocotyles des plantes infectées par P. brassicae à 21 DPI. L’activité promotrice de proHCA2::erRFP hébergeant Arabidopsis thaliana transgénique peut être observée dans (A) et (B). Des différences peuvent être observées entre une section de main non dégagée dans le panneau (A) où le signal erRFP semble diffusé en raison de la superposition et du chevauchement des couches cellulaires, en particulier dans les sections de main inégales. D’autre part, (B) montre une section de vibratome post-nettoyage tissulaire où le signal erRFP marque précisément les cellules du phloème dans un faisceau vasculaire mature (lentille objectif = 20x et épaisseur de section = 60 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
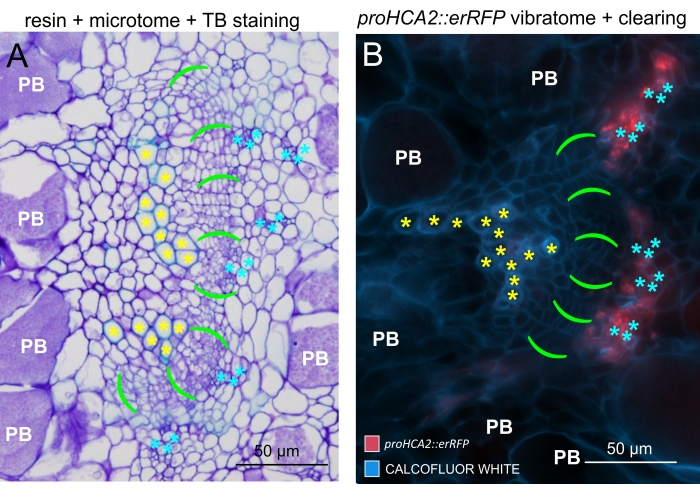
Figure 6 : Comparaison entre les galles TB, incorporées de résine et sectionnées en microtome à l’aide de la fluorescence. (A) Une comparaison entre des images de bleu de toluidine (TB), de résine incorporée et de galles sectionnées en microtomes, et (B) un objet représentatif (également présenté à la figure 5B) acquis à l’aide de la fluorescence. Les cellules du xylème sont marquées avec des astérisques jaunes, la zone cambiale avec des crochets vert vif, le phloème avec des astérisques cyan et les cellules colonisées par Plasmodiophora brassicae avec un symbole PB blanc. Les sections incorporées de résine (A) fournissent une bonne résolution pour étudier la distribution des spores au repos dans les organes hypertrophiés, le degré de progression de la maladie et d’autres processus tels que la lignification locale dans les plantes résistantes. Cependant, le protocole décrit ici (B) permet l’observation sensible de l’expression génique ou de l’accumulation de protéines et la visualisation d’autres changements physiologiques et de molécules importantes telles que les lipides (dans les spores). Veuillez cliquer ici pour voir une version agrandie de cette figure.
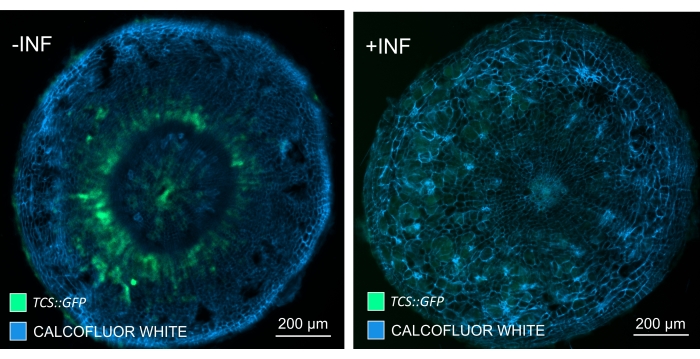
Figure 7 : Suivi des réponses de signalisation de cytokinine dans les hypocotyles des plantes Arabidopsis non infectées (-INF) et infectées par P. brassicae (+INF) à 16 DPI. Le marqueur TCS::GFP a été utilisé pour caractériser les réponses aux cytokinines in planta. Les sections de vibratomes ont été soumises à un traitement de dégagement suivi d’une coloration au blanc de calcofluor. Sur la base de l’image, à 16 DPI, les réponses cytokinines semblent être largement diminuées dans les galles infectées (panneau de droite), alors qu’elles restent fortes, en particulier dans le bassin de phloèmes (cellules qui finiront par se différencier pour former du tissu phloème), chez les plantes non infectées (panneau de gauche) (lentille d’objectif = 5x et épaisseur = 30 μm). Certains niveaux d’autofluorescence du xylème peuvent également être visibles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Solution de nettoyage (toxique) | ||
| Composants | Pourcentage (%) | dans 100 mL d’eau distillée |
| Xylitol | 10% | 10g |
| Désoxycholate de sodium | 15% | 15g |
| Urée | 25% | 25g |
| 10x PBS (solution saline tamponnée au phosphate) | 1x PBS (100 mL) | |
| NaCl | 8 g | 10 mL 10x PBS + 90 mL d’eau distillée |
| Kcl | 0,2 g | |
| KH2PO4 | 0,24 g | |
| Na2HPO4 · 2H2O | 1,81 g | |
| eau distillée | 100 mL | |
| pH | pH ajusté à 7,4 à l’aide de HCl | |
| Autoclave et conserver à 4 °C. | ||
Tableau 1 : Composition de la solution de compensation et de la solution saline tamponnée au phosphate (PBS).
| Teinture fluorescente / Tag | Longueurs d’onde d’excitation/émission | Jeu de filtres de microscope utilisé |
| Rouge du Nil | 553/636 nm | jeu de filtres 43 |
| Autofluorescence du xylème | 380/475 nm | jeu de filtres 49 |
| Calcofluor Blanc | 405/475 nm | jeu de filtres 49 |
| Fuchsin de base | 561/650 nm | jeu de filtres 43 |
| erRFP | 585/608 nm | jeu de filtres 43 |
| GFP | 488/509 nm | jeu de filtres 38 |
Tableau 2 : Spectres d’excitation/émission sélectionnés pour la présente étude.
Discussion
L’application de la solution de nettoyage sur des sections de galles coupées par vibratome améliore certainement la capacité d’étudier l’interaction biotrophique entre P. brassicae et la plante hôte. Bien que le protocole de dégagement s’applique même aux sections de main, il fonctionne mieux avec les sections de vibratome. La fixation des échantillons dans un fixateur PFA constitue une étape critique du protocole, car les échantillons peuvent ensuite être conservés à 4 °C pendant quelques jours avant de procéder à la section. Cela offre la flexibilité nécessaire pour stocker les échantillons pendant une période limitée sans compromettre l’expression et la préservation des protéines fluorescentes pendant la fixation.
Le rouge du Nil (dans le DMSO ou le méthanol) est incompatible avec les sections de résine en raison de son hydrophobicité, qui dissout la résine et détruit les sections incorporées dans la résine17. Ainsi, les sections de vibratomes s’avèrent essentielles pour étudier la distribution des agents pathogènes et leur cycle de vie dans les galles en développement, dans lesquelles la coloration rouge du Nil peut être facilement utilisée.
La solution de compensation utilisée dans ce protocole est très polyvalente12, permettant d’utiliser une variété de colorants de fluorescence dans différentes combinaisons pour colorer diverses biomolécules / composants des parois cellulaires (subérine, lignine, cellulose et chitine dans les interactions fongiques). Il est également possible de contre-colorer des sections de lignées marqueurs fluorescentes de la GFP et de corréler ainsi l’activité promotrice ou le schéma d’accumulation de protéines avec la présence de l’agent pathogène dans des cellules ou des régions particulières de la galle. Cependant, l’autofluorescence de fond du xylème et des cellules géantes remplies d’agents pathogènes n’a pas pu être éliminée même après le protocole de nettoyage. Cela présente une limite pour l’examen des marqueurs fluorescents au cours des dernières étapes de la formation de la galle, en particulier lors de l’utilisation d’un microscope à épifluorescence et de l’imagerie des signaux faibles.
En raison des faibles niveaux d’expression / accumulation de signaux fluorescents, les facteurs de transcription sont difficiles à détecter, mais, avec cette technique, il est possible d’obtenir des images satisfaisantes pour eux. Dans l’ensemble, la combinaison de la section des vibratomes avec l’approche de nettoyage des tissus élargit la boîte à outils pour les observations histologiques des tissus biliaires complexes. La flexibilité de ce protocole facilite le processus de fixation des tissus et réduit le temps nécessaire à la découpe et à l’imagerie des échantillons de tissus frais pour observer les protéines fluorescentes et les activités de promotion. Avec d’autres améliorations et en utilisant d’autres colorants fluorescents spécifiques à diverses biomolécules, cette méthode marquera de plus grands progrès dans les études histologiques et l’analyse d’images de tissus denses et opaques avec une organisation tissulaire complexe. Ces derniers temps, la méthode de nettoyage tissulaire présentée est devenue un protocole populaire et largement utilisé pour combiner et permettre l’acquisition simultanée de différents signaux fluorescents11,12,13. Le développement et les modifications futurs de ces techniques amélioreront considérablement la résolution de l’image pour observer les interactions plantes-pathogènes au niveau cellulaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le travail a été soutenu par la subvention OPUS17 du Centre national des sciences de Pologne n ° 2019/33 / B / NZ9 / 00751 « Coordination vasculaire à longue distance chez les plantes infectées par Plasmodiophora brassicae ». Nous remercions le professeur Yrjö Helariutta (Sainsbury Laboratory, Université de Cambridge) d’avoir partagé la ligne proHCA2::erRFP .
matériels
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
Références
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon