Method Article
Combinazione di microscopia a compensazione e fluorescenza per visualizzare i cambiamenti nell'espressione genica e le risposte fisiologiche a Plasmodiophora brassicae
In questo articolo
Riepilogo
Il presente protocollo descrive un metodo ottimizzato per l'osservazione istologica delle galle indotta da Plasmodiophora brassicae. Le sezioni vibratomo degli ipocotili vengono eliminate prima dell'imaging a fluorescenza per studiare il coinvolgimento dei fattori di trascrizione e dei fitormoni durante la progressione della malattia. Questo protocollo supera i limiti di incorporamento della resina, consentendo la visualizzazione nelle piante di proteine fluorescenti.
Abstract
L'infezione delle colture di Brassica da parte del protista del suolo Plasmodiophora brassicae porta alla formazione di fiele sugli organi sotterranei. La formazione delle galle richiede la riprogrammazione cellulare e cambiamenti nel metabolismo della pianta infetta. Ciò è necessario per stabilire un pozzo fisiologico orientato ai patogeni verso il quale i nutrienti dell'ospite vengono reindirizzati. Per una comprensione completa di questa particolare interazione pianta-patogeno e dei meccanismi attraverso i quali la crescita e lo sviluppo dell'ospite vengono sovvertiti e rimodellati, è essenziale tracciare e osservare i cambiamenti interni che accompagnano la formazione della gallina con risoluzione cellulare. I metodi che combinano coloranti fluorescenti e proteine fluorescenti sono spesso impiegati per studiare le risposte anatomiche e fisiologiche nelle piante. Sfortunatamente, le grandi dimensioni delle galle e la loro bassa trasparenza agiscono come ostacoli principali nell'esecuzione di osservazioni a montaggio intero al microscopio. Inoltre, la bassa trasparenza limita l'impiego della microscopia a fluorescenza per studiare la progressione della malattia clubroot e la formazione di bili. Questo articolo presenta un metodo ottimizzato per fissare e pulire le galle per facilitare l'epifluorescenza e la microscopia confocale per ispezionare le galle infette da P. brassicae. È stato utilizzato un protocollo di pulizia dei tessuti per una rapida pulizia ottica seguito dal sezionamento del vibratomo per rilevare i cambiamenti anatomici e localizzare l'espressione genica con fusioni di promotori e linee reporter etichettate con proteine fluorescenti. Questo metodo si rivelerà utile per studiare le risposte cellulari e fisiologiche in altre strutture innescate da patogeni nelle piante, come la sincizia indotta da nematodi e i nodi radicali, nonché le galle fogliari e le deformazioni causate dagli insetti.
Introduzione
Le piante colpite da agenti patogeni o insetti possono sviluppare strutture anomale (deformazioni d'organo o galle), che consentono all'invasore di ingerire sostanze nutritive e riprodursi1. Qui, è stato intrapreso un efficiente approccio istopatologico per studiare i cambiamenti in atto nelle galle che si sviluppano sulle parti sotterranee delle piante infettate dal protista Plasmodiophora brassicae (Figura 1). Il filo minore associato a questo patogeno emerge dal fatto che le spore a riposo di P. brassicae possono mantenere la loro capacità di invadere le piante per molti anni. Nel caso della coltivazione su larga scala di colza (Brassica napus), questo è un problema serio poiché i fattori economici limitano la rotazione delle colture, portando all'accumulo di spore a riposo nel terreno2. La resistenza della colza alla malattia della radice di clava causata da P. brassicae è geneticamente determinata. Purtroppo, l'agente patogeno spesso supera in astuzia la resistenza a causa della sua biologia e dello stretto pool genetico da cui ha avuto origine la colza. Pertanto, è diventato importante studiare le risposte post-infezione nelle piante ospiti e la loro capacità di rallentare la progressione della malattia o prevenire lo sviluppo di determinati sintomi.
Nella malattia di clubroot, la gravità viene generalmente valutata in base allo sviluppo delle galle e al grado di danno al sistema radicale. Questo è noto come Disease Index-DI3. Tuttavia, non cattura pienamente la vera valutazione di questa interazione pianta-patogeno. In particolare, non affronta il modo in cui l'agente patogeno è distribuito all'interno delle radici e se la pianta può trattenere P. brassicae movimento all'interno dei suoi tessuti. Inoltre, non è facile prevedere fino a che punto P. brassicae riprogramma l'anatomia degli organi sotterranei. Studi sulla pianta modello Arabidopsis thaliana hanno dimostrato che P. brassicae L'infezione porta all'inibizione della xilogenesi (sia la fase di iniziazione che di maturazione) e al miglioramento della differenziazione del floema all'interno delle galle4,5. Inoltre, nelle radici e negli ipocotili delle piante infette, la progenie delle cellule cambiali non abbandona lo stato mitotico e prolifera più a lungo che nelle piante sane.6. Questo processo governa la dimensione finale del fiele e determina il numero di spore patogene a riposo prodotte all'interno della pianta infetta. P. brassicae-la riprogrammazione evolutiva, metabolica e fisiologica nell'ospite è molto complessa7; Pertanto, l'applicazione di strumenti che consentano l'ispezione dei cambiamenti interni all'interno delle galle è fondamentale per valutare correttamente questa interazione. La progressione del ciclo di vita di P. brassicae è accompagnato dalla riprogrammazione del metabolismo delle cellule ospiti, che può essere osservato come deposizione di amido o lipidi7,8. Il principale ostacolo al successo della microscopia delle galle deriva dalla loro bassa trasparenza. A causa di ciò, la maggior parte dei campioni istologici che presentano cambiamenti guidati da clave all'interno delle galle provengono da tecniche di fissazione-incorporazione (cera o resina) seguite da sezionamento di microtomi. Tali approcci sono stati utilizzati con successo per localizzare l'attività del promotore per numerosi geni attivi nelle galle clubroot4,5 o varie tecniche di colorazione che facilitano l'osservazione di P. brassicae Progressione del ciclo di vita9. Tuttavia, va notato che le fasi di fissaggio e incorporamento richiedono molto tempo e comportano il lavaggio parziale o completo di importanti biomolecole (ad esempio, lipidi), ostacolando significativamente alcune osservazioni. Recentemente P. brassicae La progressione del ciclo vitale nell'ospite è stata visualizzata con l'aiuto dell'ibridazione fluorescente in situ (FISH), in cui una metiltransferasi di tipo SABATH (PbBSMT) la sonda gene-specifica è stata utilizzata per marcare la formazione di spore a riposo10. Una buona alternativa è l'uso di altri metodi basati sulla fluorescenza in cui si può vedere l'autofluorescenza di alcuni componenti cellulari, l'attività delle regioni regolatrici 5'- a monte dei geni fusi con marcatori proteici fluorescenti e l'accumulo di particolari proteine marcate con fluorescenza. Tuttavia, oltre alla bassa trasparenza dei campioni, uno dei principali svantaggi associati a tali oggetti è lavorare con campioni non fissi, che riduce significativamente il tempo in cui le immagini di buona qualità possono essere documentate. Nel 2015, Kurihara et al.11 sviluppato un reagente di clearing, che consente la conservazione delle proteine fluorescenti e aumenta la trasparenza dei campioni di tessuto vegetale. Inoltre, è compatibile con numerose macchie istologiche. Recentemente, la stessa tecnica è stata applicata con successo per visualizzare diversi componenti della parete cellulare nei tessuti vegetali.12,13. Qui, questo protocollo è stato utilizzato per analizzare vari aspetti dello sviluppo del fiele clubroot. Il flusso di lavoro inizia con la fissazione delle galle, il sezionamento della vibratomia, la pulizia dei tessuti, la colorazione e l'imaging a fluorescenza. A seconda delle proprie esigenze, direttamente o dopo una particolare colorazione, le sezioni risultanti possono essere sottoposte a ispezione al microscopio epifluorescenza o confocale. Questo metodo fornisce una soluzione efficace per studiare i cambiamenti locali nell'espressione genica e nelle risposte fisiologiche, compreso l'equilibrio e la segnalazione dei fitoormoni. La progressione della malattia può essere monitorata osservando il modello di distribuzione delle spore a riposo e le dinamiche di maturazione. Inoltre, il protocollo può essere facilmente applicato per i cambiamenti caratteristici dell'imaging all'interno P. brassicae piante infette, compresa l'inibizione della xilogenesi o le risposte di difesa della pianta ospite visibili come lignificazione locale in genotipi resistenti. Esempi in questo protocollo provengono dall'imaging condotto sul Arabidopsis thaliana modello; Tuttavia, il protocollo può essere applicato anche ad altre specie di colture appartenenti al Brassicaceae famiglia. Il metodo descritto di seguito faciliterà futuri studi dettagliati delle strutture cellulari e dei cambiamenti molecolari che accompagnano la formazione di fiele in P. brassicae-piante infette.
Il flusso di lavoro generale del protocollo è abbastanza semplice e tutte le fasi dello sviluppo del galle possono essere facilmente visualizzate e caratterizzate (Figura 2). Poiché P. brassicae è un agente patogeno trasmesso dal suolo, tutti gli esperimenti devono essere condotti in sistemi basati sul suolo. L'agente patogeno preferisce condizioni acide; Pertanto, devono essere utilizzati substrati di terreno non trattati con calce. Sebbene P. brassicae non rappresenti una minaccia per l'uomo, è strettamente un patogeno vegetale che può diffondersi attraverso il suolo e l'acqua. Pertanto, tutte le parti della pianta infetta, così come il terreno, devono essere distrutte dopo l'esperimento mediante autoclave o trattamento con candeggina.
Protocollo
1. Condizioni di crescita delle piante
- Coltivare piante di Arabidopsis thaliana in un regime di luce a breve giorno con 9 ore di luce a 22 °C e 15 ore di buio a 20 °C e un'irradianza di 120 μmol·m−2s−1 (misurata come radiazione fotosinteticamente attiva, PAR a livello della chioma, vedi Tabella dei materiali).
2. Preparazione dell'inoculo di spore
NOTA: Per i dettagli, vedere Fuchs et al.14.
- Omogeneizzare da due a tre galle congelate da piante di cavolo cinese (Brassica rapa var. pekinensis cultivar "Granaat") in un frullatore contenente 300 ml di acqua distillata autoclavata e filtrare attraverso quattro strati di garza sterile.
- Centrifugare il filtrato (a 6.000 x g, per 5 minuti e a 4 °C) e rimuovere meccanicamente lo strato di amido dal pellet di spore usando una spatola. Ripetere questo processo fino a quando la maggior parte dell'amido viene rimosso.
- Determinare la concentrazione di spore utilizzando un emocitometro13 contando il numero di spore in 20 diverse aree di campo.
- Assicurarsi che la concentrazione finale della sospensione di spore utilizzata per l'inoculazione sia 1 x 106 spore·mL−1 per Arabidopsis thaliana. Inoculare ogni pianta 20 giorni dopo la germinazione con 2 ml di sospensione di spore calibrata.
3. Preparazione e fissazione dei tessuti
- Preparare il tessuto vegetale.
- Rimuovere con cura il terreno dai sistemi radicali delle piante infette e non infette da clubroot. Pulire accuratamente con acqua e raccogliere ipocotili e galle (lunghezza tra 0,5-2 cm) in provette da microcentrifuga.
- Eseguire la fissazione PFA (4% paraformaldeide, PFA in 1x PBS + 0,01% Triton X-100) seguendo i passaggi seguenti.
- Aggiungere 4 g di polvere di PFA (vedere tabella dei materiali) a 100 mL di PBS (soluzione salina tamponata con fosfato, pH 7,4, tabella 1) agitando a 65 °C (non far bollire). Utilizzare KOH (10 M e 1M) a goccia per ottenere una soluzione limpida con un pH di circa 11.
- Regolare il pH con H2SO4 per portarlo a 6,9 e aggiungere lo 0,01% (v / v) Triton X-100 per migliorare la fissazione. Aliquot la soluzione da conservare a -20 °C (non ricongelare) o conservare a 4 °C.
- Eseguire la fissazione dei tessuti.
- Fissare i campioni in 200-500 μL di fissativo PFA per 1 ora a temperatura ambiente applicando un vuoto costante (700 mbar) utilizzando una pompa per vuoto. Assicurarsi che l'oggetto sia completamente immerso nella soluzione PFA.
NOTA: I campioni possono essere conservati per alcune settimane a 4 °C (frigorifero) e utilizzati successivamente per il sezionamento.
- Fissare i campioni in 200-500 μL di fissativo PFA per 1 ora a temperatura ambiente applicando un vuoto costante (700 mbar) utilizzando una pompa per vuoto. Assicurarsi che l'oggetto sia completamente immerso nella soluzione PFA.
4. Incorporamento e sezionamento dei tessuti
- Utilizzare il 4% p/v di agarosio per l'incorporazione di agarosio di ipocotili non infetti e galle infette. Far bollire la soluzione per sciogliere l'agarosio e versarla quando si raffredda mentre è ancora viscosa.
- Asciugare leggermente l'oggetto su un fazzoletto per alcuni secondi per rimuovere l'eccesso di PFA.
- Utilizzare stuzzicadenti / pinze per incorporare e orientare con cura l'oggetto vegetale nell'agarosio. Per evitare sezioni oblique, assicurarsi che l'oggetto sia orientato e modellato correttamente in modo che il suo asse sia perpendicolare al piano della lama del vibratomo (per le sezioni radiali).
- Per accelerare la solidificazione dell'agarosio, posizionare la piastra di Petri o multicoltura a 4 °C per 10 minuti.
NOTA: Se l'oggetto è troppo grande (come nel caso di galle più grandi di Arabidopsis a 21 giorni dopo l'inoculazione [DPI]), l'oggetto può essere sezionato anche senza incorporamento nell'agarosio.
5. Sezionamento della vibratoma
NOTA: Il vibratomo è dotato di una lama vibrante per tagliare organi / tessuti vegetali. La velocità di vibrazione, l'ampiezza, l'angolo della lama e lo spessore della sezione sono tutti parametri che possono essere regolati (vedere Tabella dei materiali).
- Utilizzando una lama, tagliare e modellare con cura l'oggetto all'interno di un blocco di agarosio, notando l'orientamento preferito per il sezionamento.
- Attaccare il blocco di agarosio / fiele grande per montarlo correttamente sul supporto del campione usando cianoacrilato / colla istantanea e nastro adesivo (vedi Tabella dei materiali).
- Per gli ipocotili e le galle di Arabidopsis (fasi iniziali), mantenere lo spessore delle sezioni tra 30-40 μm per ottenere immagini di buona qualità.
NOTA: Per analizzare le fasi successive della progressione della gallina, lo spessore delle sezioni può essere compreso tra 50-80 μm. - Astenersi dal tagliare sezioni più sottili in quanto può distruggere il campione di fiele a causa delle vibrazioni della lama in movimento.
- Regolare lo spessore per le sezioni, la velocità e l'ampiezza della vibrazione in base allo spessore e alle dimensioni della galla (40 μm o 60 μm).
- Aggiungere acqua distillata al bagnomaria e iniziare con il sezionamento.
- Raccogliere con cura le sezioni con una pinza o un pennello e trasferirle in una provetta da microcentrifuga contenente 1 ml di tampone PBS 1x (pH 7,4).
NOTA: in genere, maggiore è l'ampiezza della vibrazione, migliore è la qualità del sezionamento. Per ipocotili o galle non infetti che non contengono spore mature a riposo, l'ampiezza della vibrazione può essere mantenuta a 1,2 mm con una velocità di 0,60 mm·s−1 . In caso di grandi galle con parziale perdita di integrità cellulare e segni visibili di maturazione delle spore, l'ampiezza della vibrazione deve essere ridotta a 0,55 mm con una velocità di 0,45 mm·s−1 .
6. Rimozione dei campioni
- Rimuovere 1x PBS dal tubo della microcentrifuga e aggiungere 200-500 μL di soluzione di pulizia (Tabella 1).
- D'ora in poi, conservare i campioni a temperatura ambiente al buio. Assicurarsi che gli oggetti siano sempre immersi nella soluzione di clearing.
- Sostituire la soluzione di compensazione con quella nuova se il suo colore cambia dopo un po 'di tempo durante l'elaborazione del campione.
NOTA: il colore della soluzione di compensazione può diventare giallastro a causa dell'elaborazione del campione. In tal caso, si consiglia di sostituire la soluzione per migliorare la pulizia dei tessuti.
7. Procedura di colorazione
- Per la colorazione bianca Calcofluor per le pareti cellulari (per l'esborso di cellule vegetali), preparare il 5% v / v di colorazione bianca Calcofluor (vedi Tabella dei materiali) nella soluzione di pulizia. Macchiare per almeno 5 minuti al buio.
- Per colorare i lipidi con rosso del Nilo (per colorare le spore a riposo e le goccioline di olio nelle cellule infette), preparare 1 mg/ml del materiale madre (vedere la tabella dei materiali) in una soluzione di pulizia. Diluirlo ulteriormente per ottenere 1:99. Macchiare per almeno 10 minuti al buio.
- Per la colorazione con lignina Fuchsin basica, preparare lo 0,2% p/v della macchia (vedere Tabella dei materiali) in una soluzione limpida. Macchiare per almeno 10 minuti al buio.
NOTA: Durante la doppia colorazione, i campioni vengono prima colorati con Nilo Red per 10 minuti prima dell'applicazione del Calcofluor white. Le soluzioni coloranti in eccesso sono state rimosse dopo ogni passaggio. Se l'oggetto sembra sovramacchiato, rimuovere la macchia in eccesso lavando con la soluzione trasparente. Diluire le macchie usando la soluzione di pulizia, se necessario. Colorare sempre il campione con Nile Red/Basic Fuchsin prima della colorazione Calcofluor. La colorazione prima con Calcofluor può impedire la corretta colorazione delle spore da parte del rosso del Nilo.
8. Microscopia
- Montare le sezioni cancellate sul vetrino da microscopia e osservarle sotto un'epifluorescenza o un microscopio confocale (vedi Tabella dei materiali). Utilizzare la soluzione di pulizia come mezzo di montaggio per evitare l'essiccazione del campione.
- Utilizzare più modalità di acquisizione per l'imaging simultaneo di più di uno spettro di fluorescenza.
NOTA: Gli spettri di eccitazione/emissione utilizzati nel protocollo presentato sono i seguenti: per Nilo Red 553/636 nm, per xilematica autofluorescenza 380/475 nm, per Basic Fuchsin 561/650 nm, per Calcofluor white 405/475 nm, per erRFP 585/608 nm e per GFP 488/509 nm (Tabella 2).
Risultati
Con il rosso del Nilo che colora i lipidi e la suberina, è possibile visualizzare le spore a riposo dell'agente patogeno contenenti lipidi (Figura 3A,B). Quindi, utilizzando la doppia colorazione, è possibile ottenere immagini nitide per osservare il modello di distribuzione dei patogeni all'interno delle galle. La controcolorazione con Calcofluor white crea contrasto e aiuta a monitorare simultaneamente lo sviluppo dello xilema con la maturazione di P. brassicae (Figura 3B).
La formazione e lo sviluppo dello xilema potrebbero anche essere controllati osservando l'autofluorescenza in campioni non colorati (Figura 4A) o utilizzando coloranti come Fuchsin basico che consentono l'imaging basato sulla fluorescenza della lignina (Figura 4B).
Utilizzando questo metodo, si potrebbero tenere traccia dei cambiamenti di espressione genica o delle risposte ai regolatori della crescita. Un esempio perfetto è dove le piante di Arabidopsis che ospitano il costrutto pHCA2:erRFP sono state utilizzate per visualizzare l'espressione genica HIGH CAMBIAL ACTIVITY 2 (HCA2) nel tessuto floematico all'interno delle galle clubroot. L'attività del gene HCA2 è stata precedentemente trovata in cellule del cambio e del floema meristematicamente attive15. Qui, co-localizza con il floema nelle ultime fasi dello sviluppo della gallina guidata da P. brassicae e la sua attività riflette come P. brassicae aumenti la complessità del floema (Figura 5). L'immagine risultante mostra la proliferazione del floema nella fase avanzata dello sviluppo della gallina quando il cambio si frammenta. La Figura 5A mostra una sezione della mano non ripulita della fiele, mentre la Figura 5B mostra segnali fluorescenti più nitidi e localizzati ottenuti mediante sezionamento di vibratomo seguito da pulizia dei tessuti. Gli oggetti sono stati controcolorati con Calcofluor bianco. La Figura 6 confronta questa immagine (Figura 6B) con una regione simile raffigurata in galle incorporate in resina e sezioni di microtomo (Figura 6A) a 21 DPI. Le risposte differenziali della citochirina tra piante infette e non infette sono state valutate controllando l'espressione del marcatore TCS:GFP (Two Component Signalling)16 nelle galle in via di sviluppo (Figura 7). Durante l'imaging di segnali GFP deboli in galle e tessuti con ispessimenti secondari, è importante notare che durante l'imaging viene catturato anche un segnale di fondo aggiuntivo dovuto all'autofluorescenza delle cellule xilematiche mature.

Figura 1: Sintomi della malattia di Clubroot sulla colza (B. napus) e Arabidopsis thaliana (Columbia-0) a 26 DPI con spore di Plasmodiophora brassicae . Durante il corso della malattia, grandi galle si sviluppano sull'intero apparato radicale, rendendolo estremamente fragile. Si conclude rilasciando spore nel terreno circostante per promuovere future infezioni. Anche le parti superiori del corpo della pianta mostrano segni di scarsa crescita e sviluppo. Infine, le piante infette soccombono agli effetti devastanti sul metabolismo della crescita e sullo sviluppo una volta che il sistema radicale viene completamente danneggiato e la pianta non può più far fronte alla malattia. La barra della scala rappresenta 1 cm. -INF sta per finto-inoculato, mentre +INF sta per P. brassicae-inoculated plants. In questa occasione, viene fornita un'immagine delle piante di colza prima della rimozione del suolo per presentare sistemi di radici sani. Dopo il lavaggio, vengono raccolti solo l'ipocotile e la parte superiore della radice. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: flusso di lavoro generale. I sistemi di radici di Arabidopsis lavati sono (A) sezionati, (B) fissi, (C) agarosio incorporati, (D) montati e (E) sezionati sul vibratomo. Gli oggetti risultanti vengono sottoposti a pulizia dei tessuti (da 3 giorni a diverse settimane a RT al buio, a seconda del tipo e dello spessore del tessuto). (F) Gli oggetti cancellati possono quindi essere colorati e ispezionati al microscopio. (G) Riepilogo del flusso di lavoro. Fare clic qui per visualizzare una versione ingrandita di questa figura.
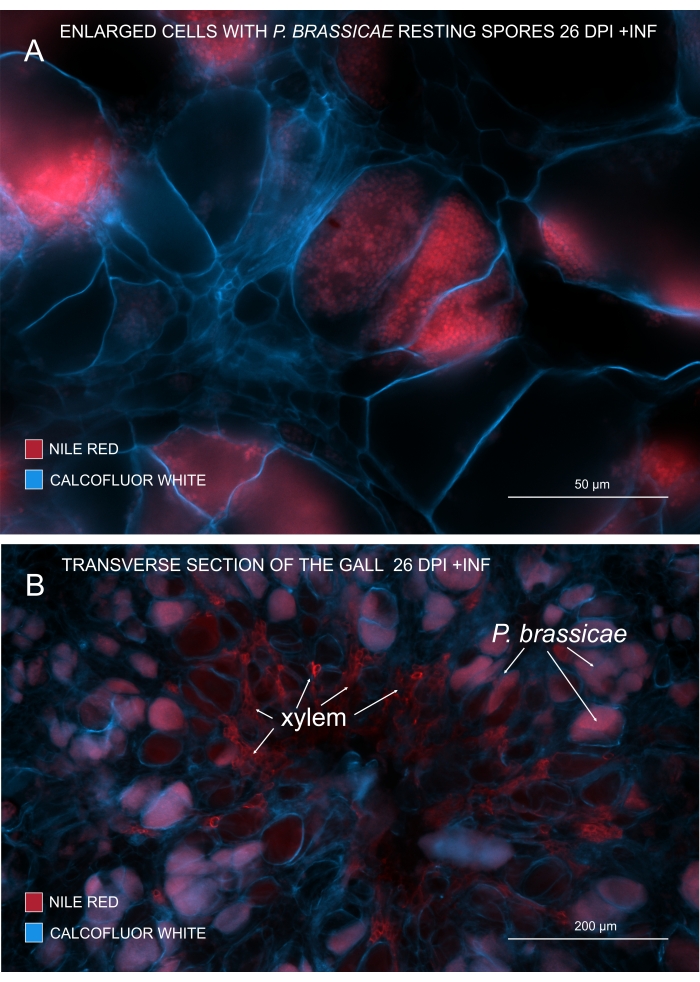
Figura 3: Marcatura delle spore patogene con macchia rosso Nilo. (A,B) Il rosso del Nilo colora i lipidi nelle spore a riposo, che funziona perfettamente per tracciare la maturazione di P. brassicae. (A) Cellule ingrossate colonizzate da P. brassicae e riempite con spore patogene. (B) Anche le cellule xilematiche mature vengono colorate dal rosso del Nilo. La sezione è stata controcolorata con Calcofluor bianco per vedere l'esborso delle cellule ospiti (A: Lente obiettiva = 20x e spessore della sezione = 60 μm; B: Lente obiettivo = 5x e spessore della sezione = 60 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
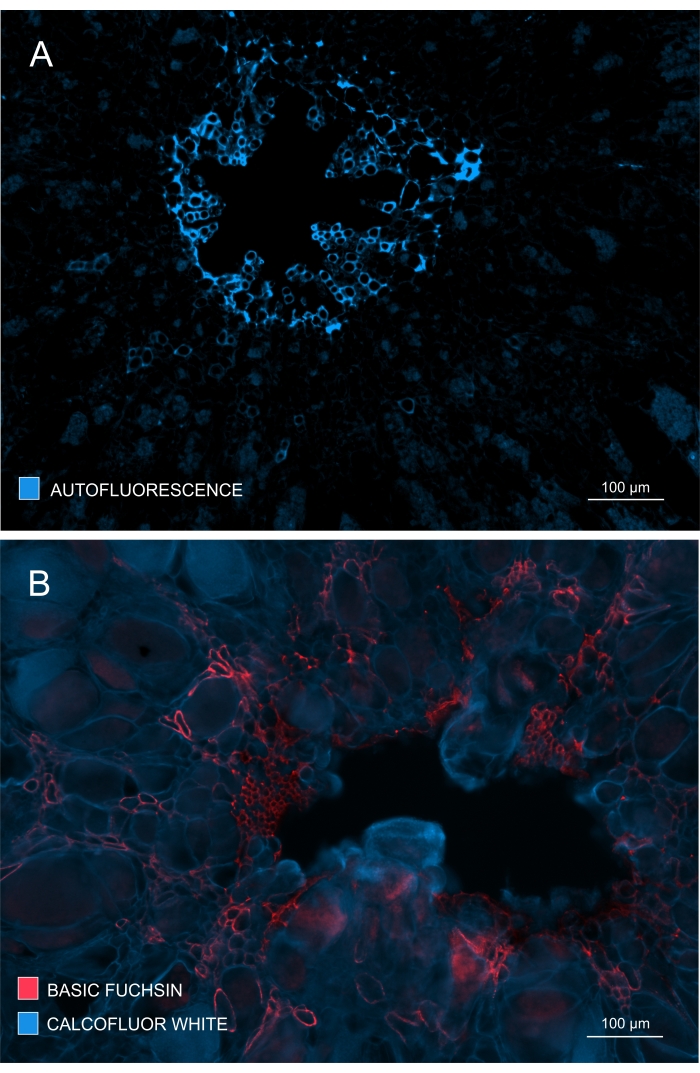
Figura 4: Monitoraggio dell'entità dello sviluppo e della maturazione dello xilema. (A) La lignina dà una forte autofluorescenza dopo eccitazione con UV; Pertanto, lo xilema maturo può essere discriminato relativamente facilmente. (B) La doppia colorazione con Fuchsin basico e Calcofluor dà risultati migliori poiché tutte le cellule vengono colorate da quest'ultimo colorante, mentre lo xilema maturo è distintamente colorato con Fuchsin basico. In questo modo, la doppia colorazione fornisce immagini con un contrasto migliorato che rappresenta una notevole inibizione della xilogenesi (A: Lente obiettivo = 10x e spessore della sezione = 60 μm; B: Lente obiettivo = 10x e spessore della sezione = 60 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
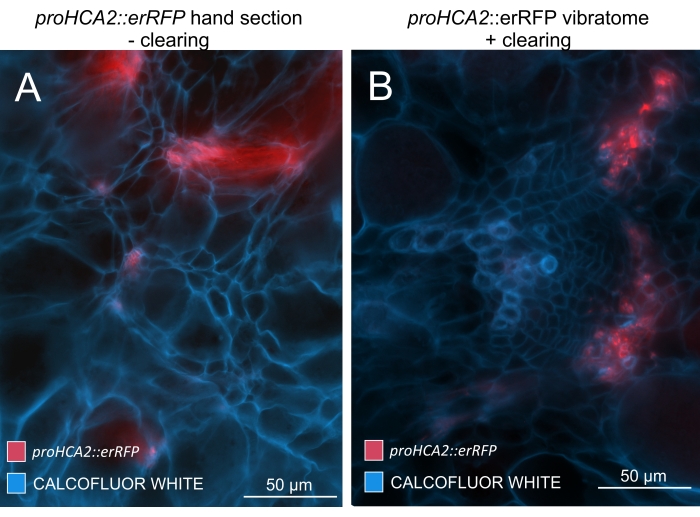
Figura 5: Segnale floema-specifico per il gene HCA2 negli ipocotili di piante infette da P. brassicae a 21 DPI. L'attività del promotore per proHCA2::erRFP che ospita Arabidopsis thaliana transgenica può essere osservata in (A) e (B). Si possono osservare differenze tra una sezione della mano non cancellata nel pannello (A) in cui il segnale erRFP appare diffuso a causa della sovrapposizione e della sovrapposizione di strati cellulari, specialmente nelle sezioni irregolari della mano. D'altra parte, (B) mostra una sezione vibratoma post-pulizia del tessuto in cui il segnale erRFP segna con precisione le cellule del floema in un fascio vascolare maturo (lente obiettivo = 20x e spessore della sezione = 60 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
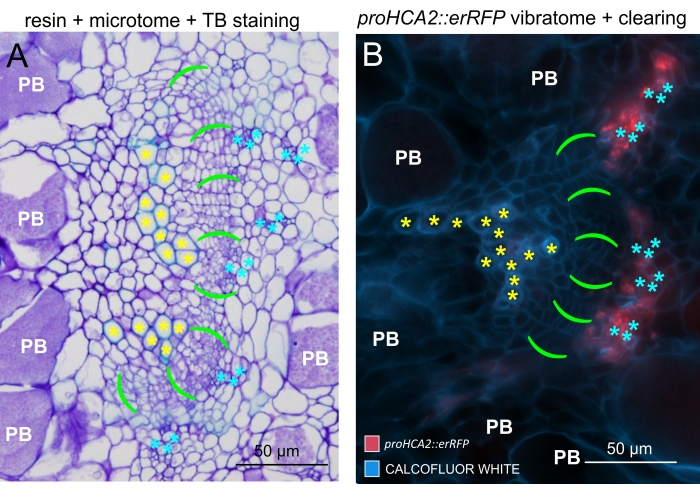
Figura 6: Confronto tra TB, galle incorporate in resina e galle sezionate con microtomo con l'aiuto della fluorescenza. (A) Un confronto tra immagini di blu di toluidina (TB), galle incorporate in resina e sezionate in microtomo, e (B) un oggetto rappresentativo (presentato anche nella Figura 5B) acquisito con l'aiuto della fluorescenza. Le cellule xilematiche sono etichettate con asterischi gialli, l'area cambiale con parentesi verdi vivaci, floema con asterischi ciano e cellule colonizzate da Plasmodiophora brassicae con un simbolo PB bianco. Le sezioni incorporate in resina (A) forniscono una buona risoluzione per studiare la distribuzione delle spore a riposo negli organi ipertrofici, il grado di progressione della malattia e altri processi come la lignificazione locale nelle piante resistenti. Tuttavia, il protocollo qui descritto (B) consente l'osservazione sensibile dell'espressione genica o dell'accumulo proteico e la visualizzazione di altri cambiamenti fisiologici e molecole importanti come i lipidi (nelle spore). Fare clic qui per visualizzare una versione ingrandita di questa figura.
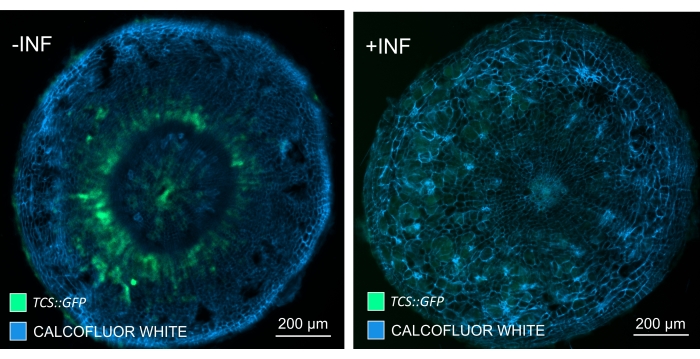
Figura 7: Monitoraggio delle risposte di segnalazione della citochinina negli ipocotili di piante di Arabidopsis non infette (-INF) e infette da P. brassicae (+INF) a 16 DPI. TCS::Il marcatore GFP è stato utilizzato per caratterizzare le risposte delle citochinine planta. Le sezioni di vibratome sono state sottoposte a trattamento di pulizia seguito da colorazione con Calcofluor bianco. Sulla base dell'immagine, a 16 DPI, le risposte delle citochinine sembrano essere ampiamente diminuite nelle galle infette (pannello di destra), mentre rimangono forti, specialmente nel pool di floemi (cellule che alla fine si differenziano per formare tessuto floematico), nelle piante non infette (pannello di sinistra) (lente obiettivo = 5x e spessore = 30 μm). Alcuni livelli di autofluorescenza xilematica possono anche essere visibili. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Soluzione di compensazione (tossica) | ||
| Componenti | Percentuale (%) | in 100 mL di acqua distillata |
| Xilitolo | 10% | 10g |
| Deossicolato di sodio | 15% | 15g |
| Urea | 25% | 25g |
| 10x PBS (soluzione salina tamponata con fosfato) | 1x PBS (100 ml) | |
| NaCl | 8 g | 10 mL 10x PBS + 90 mL di acqua distillata |
| Kcl | 0,2 g | |
| KH2PO4 | 0,24 g | |
| Na2HPO4 · 2H2O | 1,81 g | |
| acqua distillata | 100 ml | |
| ph | pH regolato a 7,4 utilizzando HCl | |
| Autoclave e conservare a 4 °C. | ||
Tabella 1: Composizione della soluzione di compensazione e della soluzione salina tamponata con fosfato (PBS).
| Colorazione fluorescente/ Tag | Lunghezze d'onda di eccitazione/emissione | Set di filtri per microscopio utilizzato |
| Rosso Nilo | 553/636 nm | Set di filtri 43 |
| Autofluorescenza xilematica | 380/475 nm | Set di filtri 49 |
| Calcofluor Bianco | 405/475 nm | Set di filtri 49 |
| Fucsina di base | 561/650 nm | Set di filtri 43 |
| erRFP | 585/608 nm | Set di filtri 43 |
| GFP | 488/509 nm | Set di filtri 38 |
Tabella 2: Spettri di eccitazione/emissione selezionati per il presente studio.
Discussione
L'applicazione della soluzione di clearing su sezioni di galle tagliate a vibratomo migliora sicuramente la capacità di studiare l'interazione biotrofica tra P. brassicae e la pianta ospite. Sebbene il protocollo di compensazione si applichi anche alle sezioni della mano, funziona meglio con le sezioni vibratomo. Il fissaggio dei campioni nel fissativo PFA funge da passaggio critico nel protocollo in quanto i campioni possono essere conservati a 4 °C per alcuni giorni prima di procedere con il sezionamento. Ciò offre la flessibilità di conservare i campioni per un periodo limitato senza compromettere l'espressione e la conservazione delle proteine fluorescenti durante la fissazione.
Il rosso Nilo (in DMSO o metanolo) è incompatibile con le sezioni di resina a causa della sua idrofobicità, che dissolve la resina e distrugge le sezioni incorporate nella resina17. Pertanto, le sezioni di vibratomo si rivelano strumentali per studiare la distribuzione dei patogeni e il suo ciclo di vita all'interno delle galle in via di sviluppo, in cui la colorazione rosso Nilo può essere facilmente utilizzata.
La soluzione di clearing utilizzata in questo protocollo è altamente versatile12, consentendo di utilizzare una varietà di coloranti di fluorescenza in diverse combinazioni per colorare varie biomolecole / componenti delle pareti cellulari (suberina, lignina, cellulosa e chitina nelle interazioni fungine). È anche possibile contrastare sezioni di linee marcatrici fluorescenti GFP e quindi correlare l'attività del promotore o il modello di accumulo proteico con la presenza del patogeno in particolari cellule o regioni del fiele. Tuttavia, l'autofluorescenza di fondo da xilema e cellule giganti piene di agenti patogeni non poteva essere eliminata anche dopo il protocollo di compensazione. Ciò presenta una limitazione per l'osservazione dei marcatori fluorescenti durante le fasi successive della formazione della gallina, specialmente quando si utilizza un microscopio a epifluorescenza e si visualizzano segnali deboli.
A causa dei bassi livelli di espressione/accumulo di segnali fluorescenti, i fattori di trascrizione sono difficili da rilevare, ma, con questa tecnica, è possibile ottenere immagini soddisfacenti per essi. Nel complesso, la combinazione del sezionamento del vibratomo con l'approccio di pulizia dei tessuti espande il toolkit per le osservazioni istologiche di tessuti biliari complessi. La flessibilità di questo protocollo facilita il processo di fissazione dei tessuti e riduce il tempo necessario per il taglio e l'imaging di campioni di tessuto fresco per osservare le proteine fluorescenti e le attività del promotore. Con ulteriori miglioramenti e utilizzando altri coloranti fluorescenti specifici per varie biomolecole, questo metodo segnerà maggiori progressi negli studi istologici e nell'analisi delle immagini di tessuti densi e opachi con un'organizzazione tissutale complessa. In tempi recenti, il metodo di pulizia dei tessuti presentato è emerso come un protocollo popolare e ampiamente utilizzato per combinare e consentire l'acquisizione simultanea di diversi segnali fluorescenti11,12,13. Lo sviluppo futuro e le modifiche in tali tecniche miglioreranno notevolmente la risoluzione dell'immagine per l'osservazione delle interazioni pianta-patogeno a livello cellulare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il lavoro è stato sostenuto dalla sovvenzione OPUS17 del National Science Centre Poland No. 2019/33/B/NZ9/00751 "Long distance Vascular Coordination in Plants Infected by Plasmodiophora brassicae". Ringraziamo il Prof. Yrjö Helariutta (Sainsbury Laboratory, Università di Cambridge) per aver condiviso la linea proHCA2::erRFP .
Materiali
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
Riferimenti
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon