Method Article
Combinando Microscopia de Limpeza e Fluorescência para Visualização de Mudanças na Expressão Gênica e Respostas Fisiológicas a Plasmodiophora brassicae
Neste Artigo
Resumo
O presente protocolo descreve um método otimizado para a observação histológica de galhas induzidas por Plasmodiophora brassicae. Seções vibratórias de hipocótilos são limpas antes da imagem de fluorescência para estudar o envolvimento de fatores de transcrição e fitohormônios durante a progressão da doença. Este protocolo supera as limitações de incorporação de resina, possibilitando na planta a visualização de proteínas fluorescentes.
Resumo
A infecção de culturas de Brassica pelo protista Plasmodiophora brassicae leva à formação de galhas nos órgãos subterrâneos. A formação de galhas requer reprogramação celular e mudanças no metabolismo da planta infectada. Isso é necessário para estabelecer um sumidouro fisiológico orientado a patógenos para o qual os nutrientes do hospedeiro são redirecionados. Para uma compreensão completa dessa interação planta-patógeno particular e dos mecanismos pelos quais o crescimento e o desenvolvimento do hospedeiro são subvertidos e repadronizados, é essencial rastrear e observar as mudanças internas que acompanham a formação de galhas com resolução celular. Métodos que combinam corantes fluorescentes e proteínas fluorescentes são frequentemente empregados para estudar respostas anatômicas e fisiológicas em plantas. Infelizmente, o grande tamanho das galhas e sua baixa transparência atuam como grandes obstáculos na realização de observações de montagem inteira sob o microscópio. Além disso, a baixa transparência limita o emprego de microscopia de fluorescência para estudar a progressão da doença clubroot e a formação de galhas. Este artigo apresenta um método otimizado para fixação e limpeza de galhas para facilitar a epifluorescência e a microscopia confocal para inspeção de galhas infectadas por P. brassicae. Um protocolo de limpeza tecidual para limpeza óptica rápida foi usado seguido de secção vibratomática para detectar alterações anatômicas e localizar a expressão gênica com fusões promotoras e linhas repórteres marcadas com proteínas fluorescentes. Este método será útil para o estudo de respostas celulares e fisiológicas em outras estruturas desencadeadas por patógenos em plantas, como sincítias induzidas por nematoides e nós radiculares, bem como galhas foliares e deformações causadas por insetos.
Introdução
Plantas afetadas por patógenos ou insetos podem desenvolver estruturas anormais (deformações de órgãos ou galhas), que permitem ao invasor ingerir nutrientes e se reproduzir1. Aqui, uma abordagem histopatológica eficiente foi realizada para estudar as mudanças que ocorrem nas galhas que se desenvolvem nas partes subterrâneas de plantas infectadas com o protista Plasmodiophora brassicae (Figura 1). O fio menor associado a este patógeno emerge do fato de que os esporos em repouso de P. brassicae podem manter sua capacidade de invadir plantas por muitos anos. No caso do cultivo em larga escala de colza (Brassica napus), este é um problema grave, uma vez que fatores econômicos restringem a rotação de culturas, levando ao acúmulo de esporos em repouso no solo2. A resistência da colza à doença clubroot causada por P. brassicae é geneticamente determinada. Infelizmente, o patógeno muitas vezes supera a resistência por causa de sua biologia e do estreito pool genético do qual a colza se originou. Portanto, tornou-se relevante estudar as respostas pós-infecção em plantas hospedeiras e sua capacidade de retardar a progressão da doença ou prevenir o desenvolvimento de certos sintomas.
Na doença clubroot, a gravidade é geralmente avaliada com base no desenvolvimento de galhas e no grau de dano ao sistema radicular. Isso é conhecido como o Índice de Doença-DI3. No entanto, não captura totalmente a verdadeira avaliação dessa interação planta-patógeno. Em particular, não aborda como o patógeno é distribuído dentro das raízes e se a planta pode se conter. P. brassicae movimento dentro de seus tecidos. Além disso, não é fácil antecipar até que ponto P. brassicae reprograma a anatomia dos órgãos subterrâneos. Estudos sobre a planta modelo Arabidopsis thaliana demonstraram que P. brassicae a infecção leva à inibição da xilogênese (tanto as etapas de iniciação quanto de maturação) e ao aumento da diferenciação do floema dentro das galhas4,5. Além disso, em raízes e hipocótilos de plantas infectadas, a progênie de células cambiais não abandona o estado mitótico e prolifera por mais tempo do que em plantas saudáveis.6. Este processo governa o tamanho final da galha e determina o número de esporos de repouso de patógenos produzidos dentro da planta infectada. P. brassicaeA reprogramação do desenvolvimento, metabólica e fisiológica no hospedeiro é muito complexa7; portanto, a aplicação de ferramentas que permitam a inspeção de alterações internas dentro das galhas é crucial para a avaliação adequada dessa interação. A progressão do ciclo de vida de P. brassicae é acompanhada por reprogramação do metabolismo da célula hospedeira, que pode ser observada como deposição de amido ou lipídios7,8. O principal obstáculo para a microscopia bem-sucedida das galhas vem de sua baixa transparência. Devido a isso, a maioria dos espécimes histológicos que apresentam alterações impulsionadas por raiz de clube dentro das galhas origina-se de técnicas de fixação (cera ou resina) seguidas de corte de micrótomos. Tais abordagens foram usadas com sucesso para localizar a atividade promotora de numerosos genes ativos em galhas de raiz de clube.4,5 ou várias técnicas de coloração que facilitam a observação de P. brassicae progressão do ciclo de vida9. No entanto, deve-se notar que os estágios de fixação e incorporação são demorados e resultam em lavagem parcial ou completa de biomoléculas importantes (por exemplo, lipídios), dificultando significativamente certas observações. Recentemente P. brassicae a progressão do ciclo de vida no hospedeiro foi visualizada com o auxílio da Hibridização In Situ Fluorescente (FISH), na qual uma metiltransferase do tipo SABATH (PbBSMT) sonda gene-específica foi utilizada para marcar a formação de esporos em repouso10. Uma boa alternativa é o uso de outros métodos baseados em fluorescência, onde a autofluorescência de alguns componentes celulares, a atividade de regiões reguladoras a montante de 5'- de genes fundidos a marcadores de proteínas fluorescentes e o acúmulo de proteínas específicas marcadas fluorescentemente podem ser vistos. No entanto, além da baixa transparência das amostras, uma grande desvantagem associada a esses objetos é trabalhar com espécimes não fixos, o que diminui significativamente o tempo em que imagens de boa qualidade podem ser documentadas. Em 2015, Kurihara et al.11 desenvolveu um reagente de limpeza, que permite a preservação de proteínas fluorescentes e aumenta a transparência dos espécimes de tecido vegetal. Além disso, é compatível com inúmeras colorações histológicas. Recentemente, a mesma técnica foi aplicada com sucesso para visualizar diferentes componentes da parede celular em tecidos vegetais.12,13. Aqui, este protocolo tem sido usado para analisar vários aspectos do desenvolvimento da galha clubroot. O fluxo de trabalho começa com a fixação de galhas, secção de vibratome, limpeza de tecidos, coloração e imagens de fluorescência. Dependendo das necessidades, diretamente ou após uma coloração específica, as seções resultantes podem ser submetidas a inspeção sob um microscópio de epifluorescência ou confocal. Este método fornece uma solução eficaz para estudar as mudanças locais na expressão gênica e respostas fisiológicas, incluindo o equilíbrio e a sinalização de fitohormônios. A progressão da doença pode ser rastreada observando o padrão de distribuição dos esporos em repouso e a dinâmica de maturação. Além disso, o protocolo pode ser facilmente aplicado para alterações de características de imagem dentro P. brassicae plantas infectadas, incluindo a inibição da xilogênese ou as respostas de defesa da planta hospedeira visíveis como lignificação local em genótipos resistentes. Exemplos neste protocolo vêm de imagens realizadas no Arabidopsis thaliana modelo; no entanto, o protocolo também pode ser aplicado a outras espécies de culturas pertencentes à Brassicaceae família. O método descrito abaixo facilitará futuros estudos detalhados das estruturas celulares e das alterações moleculares que acompanham a formação de galhas em P. brassicae-plantas infectadas.
O fluxo de trabalho geral do protocolo é bastante simples, e todos os estágios do desenvolvimento da vesícula podem ser facilmente visualizados e caracterizados (Figura 2). Como P. brassicae é um patógeno transmitido pelo solo, todos os experimentos devem ser realizados em sistemas baseados no solo. O patógeno prefere condições ácidas; por conseguinte, devem ser utilizados substratos de solo não tratados com cal. Embora P. brassicae não represente uma ameaça para os seres humanos, é estritamente um patógeno vegetal que pode se espalhar através do solo e da água. Portanto, todas as partes da planta infectada, bem como o solo, precisam ser destruídos após o experimento por autoclave ou por tratamento com água sanitária.
Protocolo
1. Condições de crescimento das plantas
- Cultivar plantas de Arabidopsis thaliana em regime de luz de dia curto com 9 h de luz a 22 °C e 15 h de escuridão a 20 °C e uma irradiância de 120 μmol·m−2s−1 (medida como a radiação fotossinteticamente ativa, PAR ao nível do dossel, ver Tabela de Materiais).
2. Preparação do inóculo dos esporos
NOTA: Para mais detalhes, ver Fuchs et al.14.
- Homogeneizar duas a três galhas congeladas de plantas de repolho chinês (Brassica rapa var. cultivar pekinensis "Granaat") em um liquidificador contendo 300 mL de água destilada autoclavada e filtrar através de quatro camadas de gaze estéril.
- Centrifugar o filtrado (a 6.000 x g, durante 5 minutos e a 4 °C) e remover mecanicamente a camada de amido do pellet de esporos utilizando uma espátula. Repita este processo até que a maior parte do amido seja removida.
- Determine a concentração de esporos usando um hemocitômetro13 contando o número de esporos em 20 áreas de campo diferentes.
- Certifique-se de que a concentração final de suspensão de esporos utilizada para a inoculação é de 1 x 106 esporos·mL−1 para Arabidopsis thaliana. Inocular cada planta 20 dias após a germinação com 2 mL de suspensão de esporos calibrada.
3. Preparação e fixação dos tecidos
- Prepare o tecido vegetal.
- Remova cuidadosamente o solo dos sistemas radiculares de plantas infectadas e não infectadas por raiz de clube. Limpe bem com água e colete hipocótilos e galhas (comprimento entre 0,5-2 cm) em tubos de microcentrífuga.
- Realizar a fixação do PFA (4% de paraformaldeído, PFA em 1x PBS + 0,01% de Triton X-100) seguindo os passos abaixo.
- Adicionar 4 g de pó de PFA (ver Tabela de Materiais) a 100 ml de PBS (solução salina tamponada com fosfato, pH 7,4, Tabela 1) agitando a 65 °C (não ferver). Use KOH (10 M e 1M) gota a gota para obter uma solução clara com um pH de cerca de 11.
- Ajuste o pH com H2SO4 para reduzi-lo a 6,9 e adicione 0,01% (v/v) de Triton X-100 para melhorar a fixação. Aliquotar a solução a conservar a -20 °C (não voltar a congelar) ou conservar a 4 °C.
- Realizar fixação tecidual.
- Fixar as amostras em 200-500 μL de fixador PFA durante 1 h à temperatura ambiente, aplicando um vácuo constante (700 mbar) utilizando uma bomba de vácuo. Certifique-se de que o objeto esteja completamente imerso na solução PFA.
NOTA: As amostras podem ser armazenadas durante algumas semanas a 4 °C (frigorífico) e utilizadas posteriormente para seccionamento.
- Fixar as amostras em 200-500 μL de fixador PFA durante 1 h à temperatura ambiente, aplicando um vácuo constante (700 mbar) utilizando uma bomba de vácuo. Certifique-se de que o objeto esteja completamente imerso na solução PFA.
4. Incorporação e seccionamento de tecidos
- Use 4% w / v agarose para a incorporação de agarose de hipocótilos não infectados e galhas infectadas. Ferva a solução para dissolver a agarose e despeje-a quando esfriar enquanto ainda estiver viscosa.
- Seque o objeto ligeiramente em um tecido por alguns segundos para remover o excesso de PFA.
- Use palitos de dente / pinça para incorporar e orientar cuidadosamente o objeto da planta em agarose. Para evitar seções oblíquas, certifique-se de que o objeto esteja orientado e moldado corretamente de modo que seu eixo seja perpendicular ao plano da lâmina do vibratome (para seções radiais).
- Para acelerar a solidificação da agarose, coloque a Petri ou a placa multicultural a 4 °C durante 10 min.
NOTA: Se o objeto for muito grande (como no caso de galhas maiores de Arabidopsis em 21 dias após a inoculação [DPI]), o objeto pode ser seccionado mesmo sem incorporação em agarose.
5. Seccionamento do vibratome
NOTA: O vibratome é equipado com uma lâmina de barbear vibratória para cortar os órgãos / tecidos da planta. A velocidade de vibração, a amplitude, o ângulo da lâmina e a espessura da seção são todos os parâmetros que podem ser ajustados (consulte Tabela de materiais).
- Usando uma lâmina, corte e molde cuidadosamente o objeto dentro de um bloco de agarose, observando a orientação preferida para o seccionamento.
- Cole o bloco de agarose/fel grande para montá-lo corretamente no suporte do espécime usando cianoacrilato/cola instantânea e fita adesiva (consulte Tabela de Materiais).
- Para Arabidopsis hypocotyls e galhas (estágios iniciais), mantenha a espessura das seções entre 30-40 μm para obtenção de imagens de boa qualidade.
NOTA: Para analisar os estágios posteriores da progressão da vesícula, a espessura das seções pode estar entre 50-80 μm. - Abster-se de cortar seções mais finas, pois pode destruir a amostra de fel devido às vibrações da lâmina em movimento.
- Ajuste a espessura para seções, velocidade e amplitude de vibração de acordo com a espessura e o tamanho da galha (40 μm ou 60 μm).
- Adicione água destilada ao banho-maria e comece com a secção.
- Recolha cuidadosamente as secções com pinça ou escova e transfira-as para um tubo de microcentrífuga contendo 1ml de 1x tampão PBS (pH 7,4).
NOTA: Normalmente, quanto maior a amplitude de vibração, melhor a qualidade do seccionamento. Para hipocótilos ou galhas não infectados que não contenham esporos de repouso maduros, a amplitude de vibração pode ser mantida em 1,2 mm com velocidade de 0,60 mm·s−1 . No caso de galhas grandes com perda parcial da integridade celular e sinais visíveis de maturação dos esporos, a amplitude de vibração deve ser reduzida para 0,55 mm com velocidade de 0,45 mm·s−1 .
6. Limpeza de espécimes
- Remover 1x PBS do tubo de microcentrífuga e adicionar 200-500 μL de solução de limpeza (Tabela 1).
- A partir de agora, armazene as amostras à temperatura ambiente no escuro. Certifique-se de que os objetos estejam sempre submersos na solução de limpeza em todos os momentos.
- Substitua a solução de limpeza pela nova se a sua cor mudar após algum tempo durante o processamento da amostra.
NOTA: A cor da solução de limpeza pode ficar amarelada devido ao processamento da amostra. Nesse caso, recomenda-se a substituição da solução para melhorar a limpeza dos tecidos.
7. Procedimento de coloração
- Para a coloração branca de Calcofluor para as paredes celulares (para o desembolso de células vegetais), prepare 5% v/v de coloração branca de Calcofluor (ver Tabela de Materiais) na solução de limpeza. Manchar por pelo menos 5 min no escuro.
- Para coloração de lipídios com Vermelho Nilo (para coloração de esporos em repouso e gotículas de óleo em células infectadas), preparar 1 mg/mL do estoque (ver Tabela de Materiais) em solução de limpeza. Dilua-o ainda mais para obter 1:99. Manchar por pelo menos 10 min no escuro.
- Para a coloração básica de lignina Fuchsin, prepare 0,2% p/v da mancha (ver Tabela de Materiais) em solução de limpeza. Manchar por pelo menos 10 min no escuro.
NOTA: Durante a coloração dupla, as amostras são primeiro coradas com Vermelho Nilo por 10 minutos antes da aplicação do Calcofluor branco. As soluções de coloração em excesso foram removidas após cada etapa. Se o objeto parecer manchado demais, remova o excesso de mancha lavando com a solução de limpeza. Diluir as manchas utilizando a solução de limpeza, se necessário. Coloração sempre da amostra com Fuchsina Vermelha do Nilo/Básica antes da coloração Calcofluor. Manchar primeiro com Calcofluor pode impedir a coloração adequada dos esporos por Nile Red.
8. Microscopia
- Monte seções limpas na lâmina de microscopia e observe sob uma epifluorescência ou um microscópio confocal (ver Tabela de Materiais). Use a solução de limpeza como meio de montagem para evitar a secagem da amostra.
- Use vários modos de aquisição para obter imagens de mais de um espectro de fluorescência simultaneamente.
NOTA: Os espectros de excitação/emissão utilizados no protocolo apresentado são os seguintes: para o Nilo Vermelho 553/636 nm, para a autofluorescência do xilema 380/475 nm, para a Fuchsina Básica 561/650 nm, para o branco Calcofluor 405/475 nm, para a RFPer 585/608 nm e para a GFP 488/509 nm (Tabela 2).
Resultados
Com o Nilo Vermelho que mancha lipídios e suberina, é possível visualizar os esporos em repouso do patógeno contendo lipídios (Figura 3A,B). Assim, usando dupla coloração, imagens nítidas podem ser obtidas para observar o padrão de distribuição de patógenos dentro das galhas. A contracoloração com Calcofluor branco cria contraste e ajuda a rastrear simultaneamente o desenvolvimento do xilema com a maturação de P. brassicae (Figura 3B).
A formação e o desenvolvimento do xilema também podem ser verificados observando a autofluorescência em amostras não coradas (Figura 4A) ou usando colorações como a Fuchsina Básica, que permitem a imagem da lignina baseada em fluorescência (Figura 4B).
Usando este método, pode-se rastrear mudanças na expressão gênica ou respostas aos reguladores de crescimento. Um exemplo perfeito é onde plantas Arabidopsis que abrigam o construto pHCA2:erRFP foram utilizadas para visualizar a expressão gênica de ALTA ATIVIDADE CAMBIAL 2 (HCA2) no tecido floema dentro de galhas de raiz de clube. A atividade do gene HCA2 foi previamente encontrada em células meristematicamente ativas do cambio e da linhagem floema15. Aqui, ele co-localiza com o floema nos estágios finais do desenvolvimento da galha impulsionada por P. brassicae, e sua atividade reflete como P. brassicae aumenta a complexidade do floema (Figura 5). A imagem resultante mostra a proliferação de floemas no estágio final do desenvolvimento da vesícula, quando o câmbio fica fragmentado. A Figura 5A mostra uma seção da mão não limpa da galha, enquanto a Figura 5B mostra sinais fluorescentes mais nítidos e localizados obtidos por secção vibratomática seguida de limpeza tecidual. Os objetos foram contracorados com Calcofluor branco. A Figura 6 compara essa imagem (Figura 6B) com uma região semelhante representada em galhas embutidas em resina e seccionadas por micrótomos (Figura 6A) a 21 DPI. As respostas diferenciais de citocinina entre plantas infectadas e não infectadas foram avaliadas por meio da verificação da expressão do marcador TCS:GFP (Two Component Signalling)16 em galhas em desenvolvimento (Figura 7). Ao fotografar sinais fracos de GFP em galhas e tecidos com espessamentos secundários, é importante notar que o sinal de fundo adicional devido à autofluorescência de células xilema maduras também é capturado durante a imagem.

Figura 1: Sintomas da doença de Clubroot na colza (B. napus) e Arabidopsis thaliana (Columbia-0) a 26 DPI com esporos de Plasmodiophora brassicae . Durante o curso da doença, grandes galhas se desenvolvem em todo o sistema radicular, tornando-o extremamente frágil. Conclui liberando esporos no solo circundante para promover futuras infecções. As partes superiores do corpo da planta também mostram sinais de baixo crescimento e desenvolvimento. Finalmente, as plantas infectadas sucumbem aos efeitos devastadores no metabolismo e desenvolvimento do crescimento, uma vez que o sistema radicular fica completamente danificado e a planta não pode mais lidar com a doença. A barra de escala representa 1 cm. O -INF significa simulados inoculados, enquanto +INF significa plantas inoculadas por P. brassicae. Nesta ocasião, uma imagem de plantas de colza oleaginosa é fornecida antes da remoção do solo para apresentar sistemas radiculares saudáveis. Após a lavagem, apenas o hipocótilo e a parte superior da raiz são coletados. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: O fluxo de trabalho geral. Os sistemas radiculares de Arabidopsis lavados são (A) dissecados, (B) fixos, (C) agarose incorporados, (D) montados e (E) seccionados no vibratome. Os objetos resultantes são submetidos a limpeza de tecido (3 dias a várias semanas no RT no escuro, dependendo do tipo de tecido e espessura). (F) Os objetos limpos podem então ser corados e inspecionados ao microscópio. (G) Resumo do fluxo de trabalho. Por favor, clique aqui para ver uma versão maior desta figura.
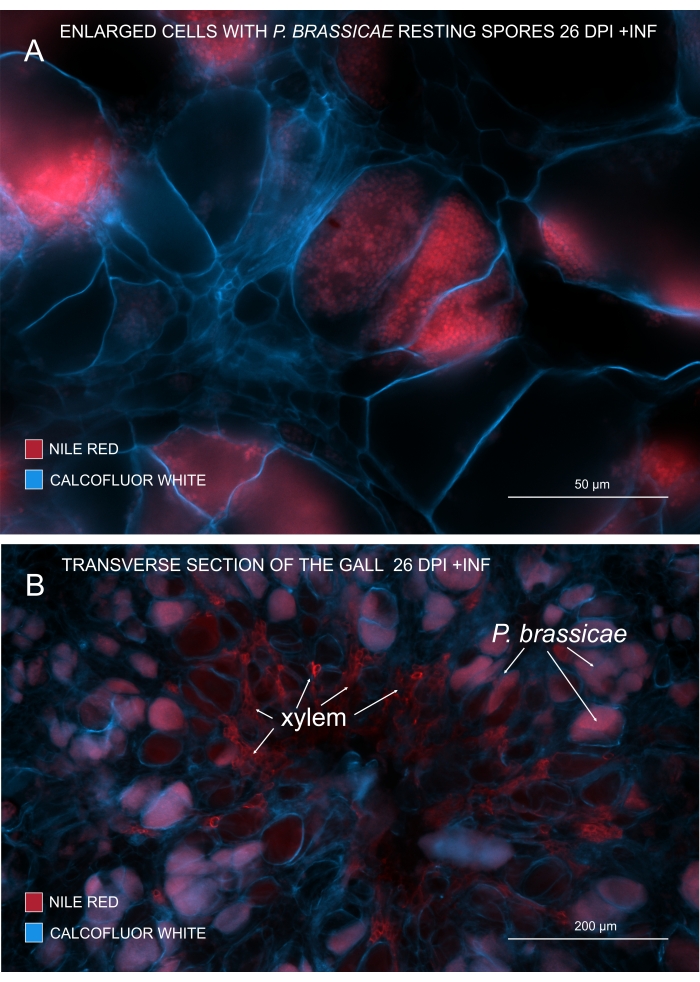
Figura 3: Marcação de esporos de patógenos com coloração Vermelha do Nilo. (A,B) Coloração Vermelha do Nilo em lipídios em repouso, o que funciona perfeitamente para rastrear a maturação de P. brassicae. (A) Células aumentadas colonizadas por P. brassicae e cheias de esporos patogênicos. (B) As células xilemáticas maduras também são coradas pelo Vermelho do Nilo. A seção foi contracorada com Calcofluor branco para ver o desembolso das células hospedeiras (A: Lente objetiva = 20x e espessura da seção = 60 μm; B: Lente objetiva = 5x e espessura da seção = 60 μm). Por favor, clique aqui para ver uma versão maior desta figura.
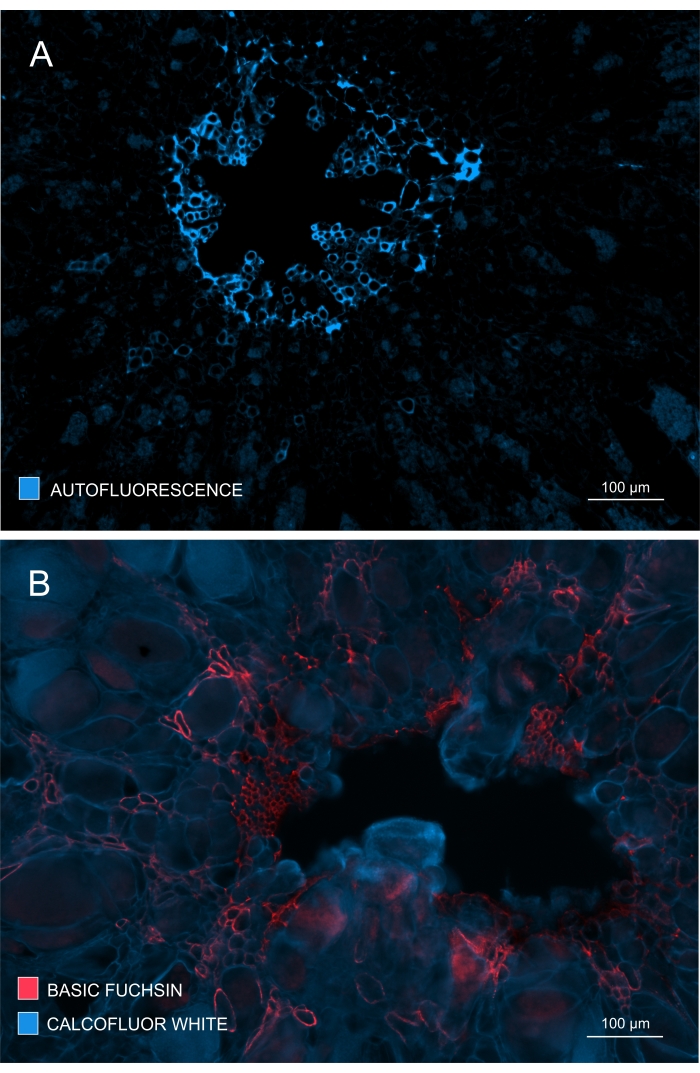
Figura 4: Rastreando a extensão do desenvolvimento e maturação do xilema. (A) A lignina fornece forte autofluorescência após a excitação com UV; portanto, o xilema maduro pode ser discriminado com relativa facilidade. (B) A dupla coloração com Fuchsina Básica e Calcofluor dá melhores resultados, uma vez que todas as células são coradas pelo último corante, enquanto o xilema maduro é distintamente corado com Fuchsin Básico. Desta forma, a coloração dupla fornece imagens com contraste melhorado, descrevendo a inibição perceptível da xilogênese (A: Lente objetiva = 10x e espessura da seção = 60 μm; B: Lente objetiva = 10x e espessura da seção = 60 μm). Por favor, clique aqui para ver uma versão maior desta figura.
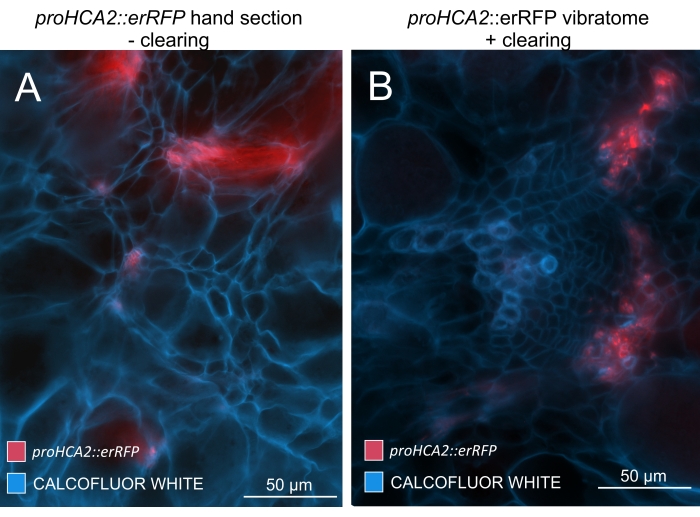
Figura 5: Sinal específico de floema para o gene HCA2 em hipocótilos de plantas infectadas por P. brassicae a 21 DPI. A atividade promotora de proHCA2::erRFP abrigando Arabidopsis thaliana transgênica pode ser vista em (A) e (B). Diferenças podem ser observadas entre uma seção de mão não limpa no painel (A), onde o sinal erRFP parece difuso devido à sobreposição e sobreposição de camadas celulares, especialmente em seções de mão irregulares. Por outro lado, (B) mostra uma seção de vibratome pós-limpeza de tecido, onde o sinal erRFP marca precisamente as células floemas em um feixe vascular maduro (lente objetiva = 20x e espessura da seção = 60 μm). Por favor, clique aqui para ver uma versão maior desta figura.
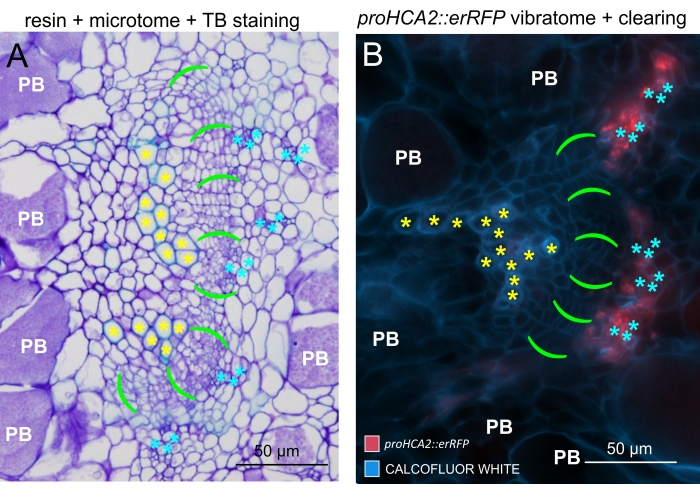
Figura 6: Comparação entre as galhas TB, embutidas em resina e seccionadas por micrótomos com a ajuda da fluorescência. (A) Uma comparação entre imagens de galhas de Azul de Toluidina (TB), embutidas em resina e seccionadas por micrótomos, e (B) um objeto representativo (também apresentado na Figura 5B) adquirido com a ajuda da fluorescência. As células xilemáticas são marcadas com asteriscos amarelos, a área cambial com colchetes verdes vívidos, o floema com asteriscos cianos e as células colonizadas por Plasmodiophora brassicae com um símbolo PB branco. As seções embutidas em resina (A) fornecem uma boa resolução para estudar a distribuição de esporos em repouso em órgãos hipertrofiados, o grau de progressão da doença e outros processos, como a lignificação local em plantas resistentes. No entanto, o protocolo aqui descrito (B) possibilita a observação sensível da expressão gênica ou do acúmulo de proteínas e a visualização de outras alterações fisiológicas e moléculas importantes, como lipídios (em esporos). Por favor, clique aqui para ver uma versão maior desta figura.
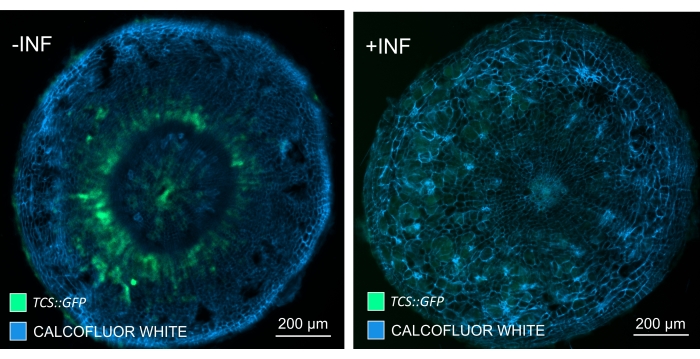
Figura 7: Rastreamento das respostas de sinalização de citocinina em hipocótilos de plantas Arabidopsis não infectadas (-INF) e infectadas por P. brassicae (+INF) a 16 DPI. O marcador TCS::GFP foi utilizado para caracterizar as respostas da citocinina da planta. Os cortes de vibratome foram submetidos a tratamento de limpeza seguido de coloração com Calcofluor branco. Com base na imagem, a 16 DPI, as respostas de citocininas parecem estar amplamente diminuídas em galhas infectadas (painel direito), enquanto permanecem fortes, especialmente no pool de floemas (células que eventualmente se diferenciarão para formar tecido de floema), em plantas não infectadas (painel esquerdo) (lente objetiva = 5x e espessura = 30 μm). Certos níveis de autofluorescência do xilema também podem ser visíveis. Por favor, clique aqui para ver uma versão maior desta figura.
| Solução de limpeza (tóxica) | ||
| Componentes | Percentual (%) | em 100 mL de água destilada |
| Xilitol | 10% | 10g |
| Desoxicolato de sódio | 15% | 15g |
| Ureia | 25% | 25g |
| 10x PBS (solução salina tamponada com fosfato) | 1x PBS (100 mL) | |
| NaCl | 8 g | 10 mL 10x PBS + 90 mL de água destilada |
| Kcl | 0,2 g | |
| KH2PO4 | 0,24 gr | |
| Na2HPO4 · 2H2O | 1,81 gr | |
| água destilada | 100 mL | |
| ph | pH ajustado para 7,4 usando HCl | |
| Autoclave e conservar a 4 °C. | ||
Tabela 1: Composição da solução de limpeza e solução salina tamponada com fosfato (PBS).
| Mancha fluorescente/ Tag | Comprimentos de onda de excitação/emissão | Conjunto de filtros do microscópio usado |
| Nilo Vermelho | 553/636 nm | conjunto de filtros 43 |
| Autofluorescência do xilema | 380/475 nm | conjunto de filtros 49 |
| Calcofluor Branco | 405/475 nm | conjunto de filtros 49 |
| Fuchsin Básico | 561/650 nm | conjunto de filtros 43 |
| erRFP | 585/608 nm | conjunto de filtros 43 |
| GFP | 488/509 nm | conjunto de filtros 38 |
Tabela 2: Espectros de excitação/emissão selecionados para o presente estudo.
Discussão
A aplicação da solução de limpeza em seções de galhas cortadas por vibratomo certamente aumenta a capacidade de estudar a interação biotrófica entre P. brassicae e a planta hospedeira. Embora o protocolo de limpeza se aplique até mesmo a seções manuais, ele funciona melhor com seções de vibratome. A fixação de amostras no fixador de PFA atua como uma etapa crítica no protocolo, pois as amostras podem ser armazenadas a 4 °C por alguns dias antes de prosseguir com a secção. Isso proporciona flexibilidade para armazenar amostras por um período limitado sem comprometer a expressão e a preservação de proteínas fluorescentes durante a fixação.
O Vermelho do Nilo (em DMSO ou metanol) é incompatível com seções de resina devido à sua hidrofobicidade, que dissolve a resina e destrói as seções embutidas em resina17. Assim, as seções de vibratomo mostram-se fundamentais para estudar a distribuição do patógeno e seu ciclo de vida dentro das galhas em desenvolvimento, em que a coloração Vermelho do Nilo pode ser facilmente usada.
A solução de limpeza utilizada neste protocolo é altamente versátil12, permitindo que uma variedade de manchas de fluorescência seja usada em diferentes combinações para corar várias biomoléculas/componentes das paredes celulares (suberina, lignina, celulose e quitina em interações fúngicas). Também é possível contra-manchar seções de linhas de marcadores de GFP fluorescentes e, assim, correlacionar a atividade promotora ou o padrão de acúmulo de proteínas com a presença do patógeno em células ou regiões específicas da galha. No entanto, a autofluorescência de fundo do xilema e das células gigantes cheias de patógenos não pôde ser eliminada mesmo após o protocolo de limpeza. Isso apresenta uma limitação para a observação de marcadores fluorescentes durante os estágios posteriores da formação da galha, especialmente ao usar um microscópio de epifluorescência e a imagem de sinais fracos.
Devido aos baixos níveis de expressão/acúmulo de sinais fluorescentes, os fatores de transcrição são de difícil detecção, mas, com essa técnica, é possível obter imagens satisfatórias para eles. No geral, a combinação da secção do vibratome com a abordagem de limpeza de tecidos expande o kit de ferramentas para observações histológicas de tecidos galares complexos. A flexibilidade deste protocolo facilita o processo de fixação tecidual e reduz o tempo necessário para o corte e a imagem de amostras de tecido fresco para observar proteínas fluorescentes e atividades promotoras. Com novas melhorias e utilizando outros corantes fluorescentes específicos para várias biomoléculas, este método marcará maiores avanços nos estudos histológicos e na análise de imagens de tecidos densos e opacos com organização tecidual complexa. Nos últimos tempos, o método de clareamento tecidual apresentado tem emergido como um protocolo popular e amplamente utilizado para combinar e possibilitar a aquisição simultânea de diferentes sinais fluorescentes 11,12,13. O desenvolvimento futuro e as modificações em tais técnicas melhorarão muito a resolução da imagem para observar as interações planta-patógeno no nível celular.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O trabalho foi apoiado pelo Centro Nacional de Ciência da Polónia OPUS17 subvenção No. 2019/33/B/NZ9/00751 "Coordenação Vascular de Longa Distância em Plantas Infectadas por Plasmodiophora brassicae". Agradecemos ao Prof. Yrjö Helariutta (Sainsbury Laboratory, Universidade de Cambridge) por compartilhar a linha proHCA2::erRFP .
Materiais
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
Referências
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados