Method Article
透明化顕微鏡と蛍光顕微鏡を組み合わせて、アブラナ原虫に対する遺伝子発現の変化と生理学的応答を視覚化
要約
本プロトコルは、 Plasmodiophora brassicae によって誘導されるゴールの組織学的観察のための最適化された方法を記載する。胚軸のビブラトーム切片は、蛍光イメージングの前に除去され、疾患進行中の転写因子と植物ホルモンの関与を研究します。このプロトコルは、樹脂包埋の制限を克服し、蛍光タンパク質の プランタ 可視化を可能にします。
要約
土壌媒介原生生物 Plasmodiophora brassicae によるアブラナ属作物の感染は、地下器官の胆汁形成につながります。ゴールの形成には、細胞のリプログラミングと感染した植物の代謝の変化が必要です。これは、宿主栄養素がリダイレクトされる病原体指向の生理学的シンクを確立するために必要です。この特定の植物と病原体の相互作用と、宿主の成長と発達が破壊され、再パターン化されるメカニズムを完全に理解するためには、細胞分解能で胆汁形成に伴う内部変化を追跡および観察することが不可欠です。蛍光染色と蛍光タンパク質を組み合わせた方法は、植物の解剖学的および生理学的応答を研究するためによく使用されます。残念ながら、ゴールのサイズが大きく、透明度が低いことが、顕微鏡下でのホールマウント観察を行う際の大きなハードルとなっています。さらに、透明度が低いため、根管疾患の進行と胆汁形成を研究するための蛍光顕微鏡の使用が制限されます。この記事では、P . brassicaeに感染したゴールを検査するための落射蛍光と共焦点顕微鏡を容易にするために、ゴールを固定および除去するための最適化された方法を紹介します。迅速な光学的透明化のための組織透明化プロトコルを使用し、続いてビブラトーム切片を使用して解剖学的変化を検出し、プロモーター融合体および蛍光タンパク質でタグ付けされたレポーター株で遺伝子発現を局在化しました。この方法は、線虫誘発性シンシチアやネコブ、葉のこぶや昆虫によって引き起こされる変形など、植物の他の病原体誘発構造における細胞および生理学的応答の研究に役立つことが証明されています。
概要
病原体や昆虫の影響を受けた植物は、異常な構造(臓器の変形やゴール)を発達させる可能性があり、侵入者は栄養素を摂取して繁殖することができます1。ここでは、原生生物である マラリア属のアブラナ原 虫に感染した植物の地下部に発生するゴールの変化を調べるために、効率的な組織病理学的アプローチが行われました(図1)。この病原体に関連するマイナースレッドは、 P.アブラナ科 の安静胞子が長年にわたって植物に侵入する能力を保持できるという事実から生じます。アブラナ属の大規模栽培の場合、経済的要因が輪作を制限し、土壌中の休眠胞子の蓄積につながるため、これは深刻な問題です2。アブラナ科による内反根病に対するセイヨウ ア ブラナの抵抗性は遺伝的に決定されています。悲しいことに、病原体は、その生物学とナタネの起源である狭い遺伝子プールのために、しばしば耐性を凌駕します。したがって、宿主植物における感染後の反応と、病気の進行を遅らせたり、特定の症状の発症を予防したりするそれらの能力を研究することが重要になっています。
クラブルート病では、重症度は一般にゴールの発生と根系損傷の程度に基づいて評価されます。これは、疾患指数-DIとして知られています。3.しかし、それはこの植物と病原体の相互作用の真の評価を完全には捉えていません。特に、病原体が根内にどのように分布しているか、そして植物が抑制できるかどうかについては言及していません。 P. brassicae その組織内の動き。さらに、どの程度まで予測することは容易ではありません P. brassicae 地下臓器解剖学を再プログラムします。モデルプラントに関する研究 Arabidopsis thaliana それを示しています P. brassicae 感染は、木生の阻害(開始ステップと成熟ステップの両方)とゴール内の師部分化の促進につながります4,5.さらに、感染した植物の根および胚軸では、形成層細胞の子孫は有糸分裂状態を辞めず、健康な植物よりも長く増殖します。6.このプロセスは、胆汁の最終的なサイズを制御し、感染した植物内で生成される病原体の休止胞子の数を決定します。 P. brassicae-宿主における発生的、代謝的、生理学的リプログラミングは非常に複雑です7;したがって、GALLS内の内部変化を検査できるツールの適用は、この相互作用を適切に評価するために重要です。のライフサイクルの進行 P. brassicae 宿主細胞代謝の再プログラミングを伴い、これはデンプンまたは脂質沈着として観察することができる7,8.ゴールの顕微鏡検査を成功させるための主な障害は、透明度が低いことです。このため、ゴール内のクラブルート主導の変化を示す組織学的標本の大部分は、固定包埋(ワックスまたは樹脂)技術とそれに続くミクロトーム切片化に由来します。このようなアプローチは、クラブルートゴールで活性な多数の遺伝子のプロモーター活性を見つけるために首尾よく使用されました4,5 または観察を容易にするさまざまな染色技術 P. brassicae ライフサイクルの進行9.ただし、固定および埋め込みの段階には時間がかかり、重要な生体分子(脂質など)が部分的または完全に洗い流され、特定の観察が著しく妨げられることに注意する必要があります。最近 P. brassicae 宿主におけるライフサイクルの進行は、SABATH型メチルトランスフェラーゼ(PbBSMT)遺伝子特異的プローブを使用して、休止胞子形成をマークしました10.良い代替案は、いくつかの細胞成分の自己蛍光、蛍光タンパク質マーカーに融合した遺伝子の5'-上流調節領域の活性、および特定の蛍光タグ付きタンパク質の蓄積が見られる他の蛍光ベースの方法の使用である。ただし、サンプルの透明度が低いことに加えて、このようなオブジェクトに関連する主な欠点は、未固定の標本での作業であり、これにより、高品質の画像を文書化できる時間が大幅に短縮されます。2015年、栗原ら。11 蛍光タンパク質の保存を可能にし、植物組織標本の透明性を高める透明化試薬を開発しました。さらに、それは多数の組織学的染色と互換性があります。最近、同じ技術を適用して、植物組織のさまざまな細胞壁成分を視覚化することに成功しました。12,13.ここでは、このプロトコルは、さまざまなクラブルートゴールの発達の側面を分析するために使用されています。ワークフローは、ゴールの固定、ビブラトーム切片作成、組織透明化、染色、および蛍光イメージングから始まります。必要に応じて、直接または特定の染色後に、得られた切片を落射蛍光顕微鏡または共焦点顕微鏡で検査することができます。この方法は、植物ホルモンのバランスやシグナル伝達など、遺伝子発現や生理学的応答の局所的な変化を研究するための効果的なソリューションを提供します。病気の進行は、安静胞子の分布パターンと成熟ダイナミクスを調べることで追跡できます。さらに、このプロトコルは、内のイメージング特性変化に簡単に適用できます。 P. brassicae 感染した植物は、耐性遺伝子型における局所的な木化として見える木質形成または宿主植物の防御応答の阻害を含む。このプロトコルの例は、 Arabidopsis thaliana モデル;ただし、このプロトコルは、に属する他の作物種にも適用できます。 Brassicaceae 家族。以下に説明する方法は、細胞構造と胆汁形成に伴う分子変化の将来の詳細な研究を容易にします。 P. brassicae-感染した植物。
プロトコルの一般的なワークフローは非常に単純であり、胆汁発生のすべての段階を簡単に画像化して特徴付けることができます(図2)。 P. brassicae は土壌伝染性病原体であるため、すべての実験は土壌ベースのシステムで実行する必要があります。病原体は酸性条件を好む。したがって、石灰処理されていない土壌基質を使用する必要があります。 P. brassicae は人間に脅威を与えませんが、それは厳密に土壌や水を介して広がることができる植物病原体です。したがって、感染した植物のすべての部分、および土壌は、実験後にオートクレーブまたは漂白剤による処理によって破壊する必要があります。
プロトコル
1.植物の生育条件
- シロイヌナズナの植物を、22°Cで9時間の光と20°Cで15時間の暗光、120μmol・m−2s−1の放射照度(光合成活性放射として測定、樹冠レベルでのPAR、材料表を参照)の短日光領域で育てます。
2.胞子接種材料の調製
注: 詳細については、Fuchs et al.14 を参照してください。
- 白菜植物(アブラ ナ属)の冷凍こぶ2〜3個を、300 mLのオートクレーブ蒸留水を含むブレンダーで均質化し、4層の滅菌ガーゼでろ過します。
- ろ液を遠心分離し(6,000 x g、5分間、4°C)、スパチュラを使用して胞子ペレットからデンプン層を機械的に除去します。でんぷんの大部分が除去されるまで、このプロセスを繰り返します。
- 血球計算盤13 を用いて胞子濃度を求め、20の異なる視野領域における胞子の数をカウントする。
- 接種に使用する胞子懸濁液の最終濃度がシロイヌナズナの場合は1 x 106胞子・mL−1であることを確認してください。発芽の20日後に各植物に2 mLの較正された胞子懸濁液を接種します。
3.組織の準備と固定
- 植物組織を準備します。
- クラブルートに感染した植物と感染していない植物の根系から土壌を慎重に取り除きます。水で徹底的に洗浄し、胚軸とゴール(長さ0.5〜2 cm)を微量遠心チューブに集めます。
- 以下の手順に従って、PFA固定(4%パラホルムアルデヒド、1x PBS中のPFA + 0.01%トリトンX-100)を実行します。
- 65°Cで攪拌することにより、4 gのPFA粉末( 材料の表を参照)を100 mLのPBS(リン酸緩衝生理食塩水、pH 7.4、 表1)に加えます(沸騰させないでください)。KOH(10Mおよび1M)を滴下して、pH約11の透明な溶液を得ます。
- pH2SO4 でpHを調整して6.9に下げ、0.01%(v / v)のTriton X-100を加えて固定を改善します。溶液を分注して-20°Cで保存するか(再凍結しないでください)、4°Cで保存します。
- 組織固定を行います。
- 真空ポンプを使用して一定の真空(700 mbar)を適用することにより、室温で1時間、200〜500 μLのPFA固定液にサンプルを固定します。オブジェクトがPFA溶液に完全に浸されていることを確認してください。
注:サンプルは4°C(冷蔵庫)で数週間保存し、後で切片作成に使用できます。
- 真空ポンプを使用して一定の真空(700 mbar)を適用することにより、室温で1時間、200〜500 μLのPFA固定液にサンプルを固定します。オブジェクトがPFA溶液に完全に浸されていることを確認してください。
4.組織の埋め込みと切片作成
- 非感染胚軸および感染したゴールのアガロース包埋には、4%w / vアガロースを使用します。溶液を沸騰させてアガロースを溶かし、粘性のあるうちに冷めたら注ぎます。
- ティッシュの上でオブジェクトを数秒間わずかに乾燥させて、余分なPFAを取り除きます。
- つまようじ/鉗子を使用して、植物オブジェクトをアガロースに注意深く埋め込み、方向付けます。斜め部分を防ぐには、オブジェクトの軸がビブラトームブレードの平面に垂直になるように、オブジェクトが正しく方向付けられ、成形されていることを確認してください(放射状断面の場合)。
- アガロースの固化を促進するには、ペトリまたはマルチカルチャープレートを4°Cで10分間置きます。
注:対象物が大きすぎる場合(接種後21日目の シロイヌ ナズナのゴール数が大きい場合[DPI]のように)、アガロースを埋め込まなくても対象物を切片化できます。
5.ビブラトーム切片
注意: ビブラトームには、植物の臓器/組織を切断するための振動かみそりの刃が装備されています。振動速度、振幅、ブレードの角度、断面の厚さはすべて調整可能なパラメータです(材料表を参照)。
- ブレードを使用して、アガロースブロック内のオブジェクトを慎重に切断して成形し、切片作成の好ましい方向に注意してください。
- アガロースブロック/大きなゴールを貼り付け、シアノアクリレート/瞬間接着剤とマスキングテープを使用して試料ホルダーに正しく取り付けます(材料の表を参照)。
- シロイヌナズナの胚軸とゴール(初期段階)の場合、高品質の画像を得るために切片の厚さを30〜40μmの間に保ちます。
注:胆汁進行の後期を分析するために、切片の厚さは50〜80μmにすることができます。 - 薄い部分は、可動ブレードの振動によりゴールサンプルを破壊する可能性があるため、切断は控えてください。
- ギャルの厚さとサイズ(40 μmまたは60 μm)に応じて、セクションの厚さ、速度、および振動振幅を調整します。
- 蒸留水を水浴に加え、切片化から始めます。
- 鉗子またはブラシを使用して切片を注意深く収集し、1mLの1x PBSバッファー(pH 7.4)を含む微量遠心チューブに移します。
注:通常、振動振幅が大きいほど、セクショニング品質は向上します。成熟した静止胞子を含まない非感染胚軸またはゴールの場合、振動振幅は0.60mm・s−1 の速度で1.2mmに保つことができます。細胞の完全性が部分的に失われ、胞子の成熟が目に見える兆候を示す大きなゴールの場合、振動振幅は0.45 mm・s-1 の速度で0.55 mmに減少する必要があります。
6.標本のクリア
- マイクロ遠心チューブから1x PBSを取り出し、200〜500 μLの透明化溶液を加えます(表1)。
- 今後は、サンプルを室温で暗所に保管してください。オブジェクトが常にクリアリングソリューションに沈んでいることを確認してください。
- サンプル処理中にしばらくしてから色が変わった場合は、透明溶液を新しいものと交換してください。
注意: 透明化溶液の色は、サンプル処理により黄色がかった色に変わることがあります。そのような場合、組織の透明化を改善するために溶液を交換することをお勧めします。
7.染色手順
- 細胞壁のカルコフルオール白色染色(植物細胞を発芽させるため)の場合、透明化溶液に5%v/vのカルコフルオール白色染色剤( 材料表を参照)を調製します。暗闇の中で少なくとも5分間染色します。
- ナイルレッドで脂質を染色する場合(感染細胞の休止胞子および油滴を染色する場合)、透明化溶液で1 mg/mLのストック( 材料の表を参照)を準備します。さらに希釈して1:99にします。暗闇の中で少なくとも10分間染色します。
- 塩基性フクシンリグニン染色の場合、透明化溶液で0.2%w / vの染色剤( 材料の表を参照)を準備します。暗闇の中で少なくとも10分間染色します。
注:二重染色中、サンプルはまずナイルレッドで10分間染色されてから、カルコフルーアホワイトが適用されます。余分な染色溶液は、各ステップの後に除去した。対象物が汚れすぎていると思われる場合は、透明溶液で洗って余分な汚れを取り除きます。必要に応じて、透明溶液を使用して汚れを希釈します。カルコフルーア染色の前に、必ずサンプルをナイルレッド/塩基性フクシンで染色してください。最初にカルコフルーアで染色すると、ナイルレッドによる胞子の適切な染色を妨げる可能性があります。
8. 顕微鏡検査
- 透明な切片を顕微鏡スライドに取り付け、落射蛍光顕微鏡または共焦点顕微鏡で観察します( 材料表を参照)。サンプルの乾燥を防ぐために、封入剤として透明化液を使用してください。
- 複数の蛍光スペクトルを同時にイメージングするには、複数の取得モードを使用します。
注:提示されたプロトコルで使用される励起/発光スペクトルは次のとおりです:ナイルレッド553/636 nm、木部自家蛍光380/475 nm、塩基性フクシン561/650 nm、カルコフルーアホワイト405/475 nm、erRFP 585/608 nm、およびGFP 488/509 nm(表2)。
結果
脂質とスベリンを染色するナイルレッドでは、脂質を含む病原体の休止胞子を見ることができます(図3A、B)。したがって、二重染色を使用して、鮮明な画像を取得して、ゴール内の病原体分布のパターンを見ることができます。カルコフルーア白による対比染色はコントラストを生み出し、 P. brassicae の成熟と同時に木部の発達を追跡するのに役立ちます(図3B)。
木部の形成と発達は、染色されていないサンプルの自家蛍光を観察することによっても確認でき(図4A)、またはリグニンの蛍光ベースのイメージングを可能にする塩基性フクシンなどの染色を使用して(図4B)。
この方法を使用することにより、遺伝子発現の変化または成長調節因子に対する応答を追跡することができます。完璧な例は、pHCA2:erRFPコンストラクトを持つシロイヌナズナ植物を利用して、クラブルートゴール内の師部組織における高形成層活性2(HCA2)遺伝子発現を視覚化したものです。HCA2遺伝子活性は、分裂組織的に活性な形成層および師部系譜細胞において以前に見出されている15。ここでは、アブラナ属の胆汁発生の後期に師部と共局在し、その活動は、アブラナ属の師部が師部を複雑にする方法を反映しています(図5)。結果の画像は、形成層が断片化するゴール発生の後期段階での師部増殖を示しています。図5Aは胆汁の透明化されていない手の切片を示していますが、図5Bは、ビブラトーム切片とそれに続く組織の透明化によって得られた、より鮮明で局在的な蛍光シグナルを示しています。物体はカルコフルーアホワイトで対比染色された。図6は、この画像(図6B)を、21DPIでの樹脂包埋およびミクロトーム切片のゴール(図6A)に描かれた同様の領域と比較したものです。感染植物と非感染植物の間の異なるサイトカイニン応答は、発育中のゴールにおけるTCS:GFP(二成分シグナル伝達)マーカー16の発現をチェックすることによって評価されました(図7)。二次肥厚を伴う胆汁および組織における弱いGFPシグナルをイメージングする際に、成熟木部細胞の自己蛍光による追加のバックグラウンドシグナルもイメージング中にキャプチャされることに注意することが重要です。

図1:アブラナナ属(B. napus)および シロイヌナズナ( Columbia-0)の26 DPIにおけるクラブルート病の症状とマラリア属ア ブラナ科 胞子。 病気の経過中に、大きなゴールが根系全体に発生し、非常に脆くなります。それは、将来の感染を促進するために周囲の土壌に胞子を放出することによって結論を下します。植物体の上部も成長と発達が悪い兆候を示しています。最後に、感染した植物は、根系が完全に損傷し、植物が病気に対処できなくなると、成長代謝と発達に壊滅的な影響を及ぼします。縮尺記号は 1 cm を表します。-INFは模擬接種の略で、+ INFは アブラナ科接種植物を表します。この機会に、健康な根系を提示するために、土壌除去の前にナタネ植物の写真が提供されます。洗浄後、胚軸と根の上部のみが収集されます。 この図の拡大版を表示するには、ここをクリックしてください。

図 2: 一般的なワークフロー。 洗浄された シロイヌ ナズナの根系は、(A)解剖され、(B)固定され、(C)アガロースが埋め込まれ、(D)マウントされ、(E)ビブラトム上に切片化される。得られた物体は、組織透明化(組織の種類および厚さに応じて、暗所のRTで3日から数週間)を受ける。(F)除去された物体は、顕微鏡下で染色および検査することができる。(G) ワークフローの概要。 この図の拡大版を表示するには、ここをクリックしてください。
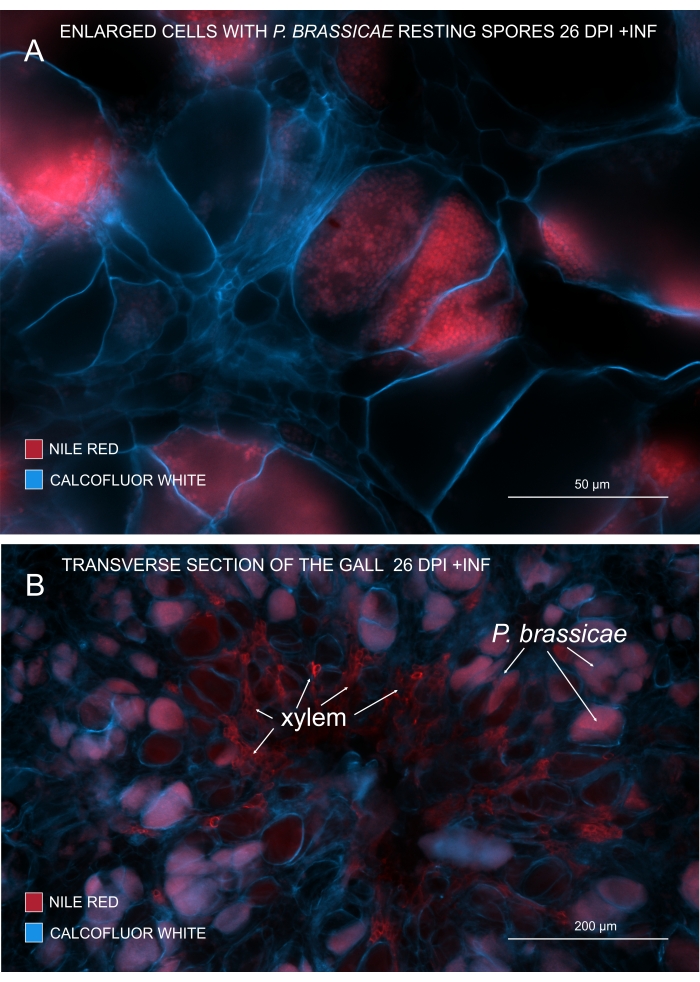
図3:ナイルレッド染色による病原体胞子のマーキング。 (A,B)ナイルレッドは、休止胞子の脂質を染色し、これはP.アブラナ属の成熟を追跡するのに完全に機能します。(A)P. brassicaeによってコロニーを形成し、病原体胞子で満たされた拡大細胞。(B)成熟木部細胞もナイルレッドによって染色されます。切片をカルコフルオール白色で対比染色し、宿主細胞の支出を確認しました(A:対物レンズ= 20倍、断面の厚さ= 60 μm;B:対物レンズ=5倍、断面厚=60μm)。この図の拡大版を表示するには、ここをクリックしてください。
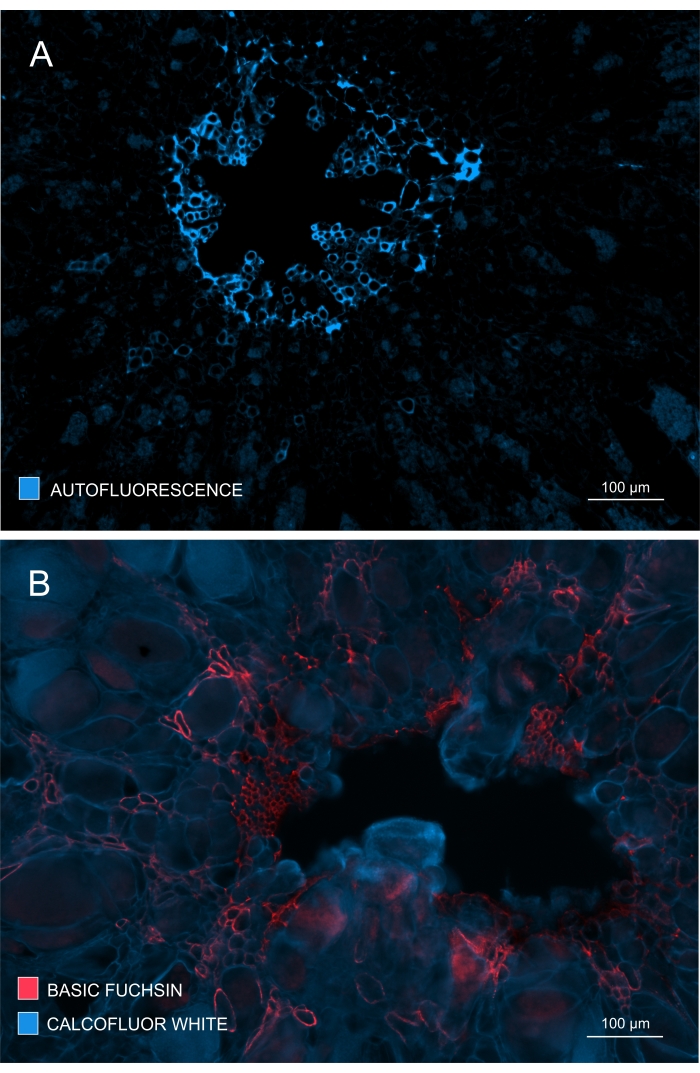
図4:木部の発達と成熟の程度を追跡 します。 (A)リグニンはUVで励起すると強い自家蛍光を示します。したがって、成熟木部は比較的容易に識別することができる。(B)塩基性フクシンとカルコフルオールによる二重染色は、すべての細胞が後者の色素で染色されるのに対し、成熟木部は塩基性フクシンで明確に染色されるため、より良い結果が得られます。このように、二重染色は、木生の顕著な阻害を示すコントラストが改善された画像を提供します(A:対物レンズ= 10倍および切片の厚さ= 60μm; B:対物レンズ=10倍、断面厚=60μm)。 この図の拡大版を表示するには、ここをクリックしてください。
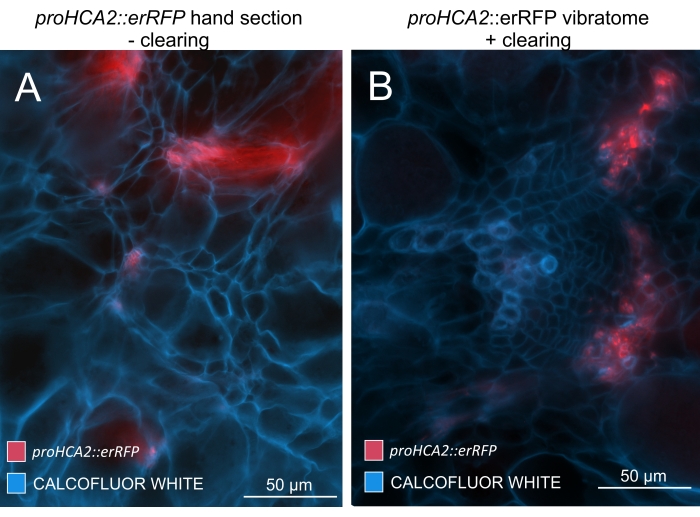
図5:21DPIにおけるアブラナ科植物の胚軸におけるHCA2遺伝子の師部特異的シグナル。 トランスジェニックシロイヌナズナを保有するproHCA2::erRFPに対するプロモーター活性は、(A)および(B)に見ることができる。パネル(A)のクリアされていない手の部分では、特に不均一な手の部分で、重ね合わせと重なり合うセル層のためにerRFP信号が拡散しているように見えます。一方、(B)は、erRFP信号が成熟血管束の師部細胞を正確にマークするビブラトーム切片の組織透明化を示しています(対物レンズ= 20倍、断面の厚さ= 60μm)。この図の拡大版を表示するには、ここをクリックしてください。
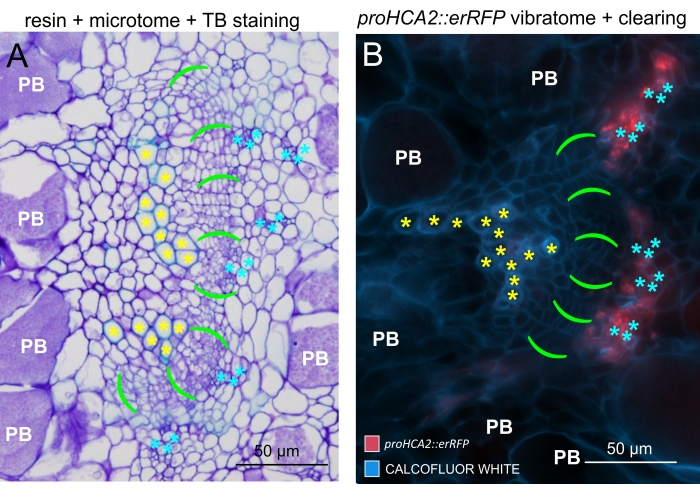
図6:蛍光を用いたTB、樹脂包埋、ミクロトーム切片のゴールの比較。 (A)トルイジンブルー(TB)、樹脂包埋、ミクロトーム切片のゴールの画像の比較、および(B)蛍光の助けを借りて取得した代表的なオブジェクト( 図5Bにも示されています)。木部細胞は黄色のアスタリスクで、形成層部は鮮やかな緑色の括弧で、師部はシアンのアスタリスクで、プラス モディオフォラ属のアブラナ属コロニー化細胞は白色のPB記号で標識されています。樹脂埋め込み切片(A)は、肥大した器官における休止胞子の分布、病害の進行の程度、および抵抗性植物の局所木質化などの他のプロセスを研究するための優れた解像度を提供します。しかし、ここで説明するプロトコル(B)は、遺伝子発現またはタンパク質蓄積の高感度観察、および他の生理学的変化および脂質などの重要な分子(胞子中)の視覚化を可能にする。 この図の拡大版を表示するには、ここをクリックしてください。
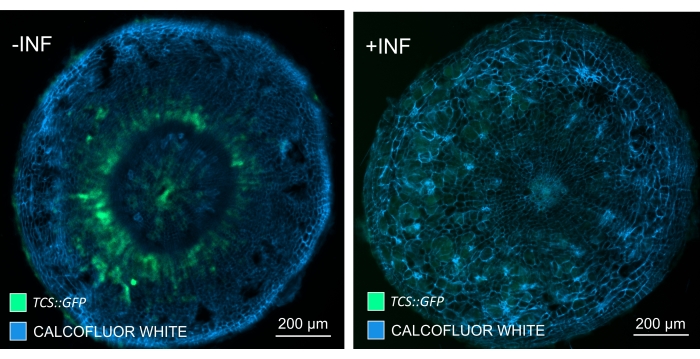
図7:非感染(-INF)およびアブラナ科(P .アブラナ科)感染(+INF)シ ロイヌナ ズナの胚軸におけるサイトカイニンシグナル伝達応答を16DPIで追跡 。TCS::GFPマーカーは、 プランタ サイトカイニン応答の特性評価に使用されました。ビブラトーム切片を透明化処理に供し、続いてカルコフルオールホワイトで染色した。画像に基づくと、16 DPIでは、サイトカイニン応答は感染したゴール(右パネル)で大幅に減少しているように見えますが、特に師部プール(最終的に分化して師部組織を形成する細胞)、非感染植物(左パネル)では強いままです(対物レンズ= 5倍、厚さ= 30μm)。特定のレベルの木部自己蛍光も見ることができます。 この図の拡大版を表示するには、ここをクリックしてください。
| 清算液(有毒) | ||
| コンポーネント | 割合(%) | 100mLの蒸留水中 |
| キシリトール | 10% | 10グラム |
| デオキシコール酸ナトリウム | 15% | 15グラム |
| 尿素 | 25% | 25グラム |
| 10x PBS(リン酸緩衝生理食塩水) | 1x PBS (100 mL) | |
| ナトリウム | 8グラム | 10 mL 10x PBS + 90 mL 蒸留水 |
| KCl | 0.2 グラム | |
| KH2PO4 | 0.24 グラム | |
| Na2HPO4 ·2H2O | 1.81 グラム | |
| 蒸留水 | 100ミリリットル | |
| ティッカー | HClを使用してpHを7.4に調整 | |
| オートクレーブし、4°Cで保存します。 | ||
表1:透明化溶液およびリン酸緩衝生理食塩水(PBS)の組成。
| 蛍光染色/タグ | 励起/発光波長 | 顕微鏡フィルターセット使用 |
| ナイルレッド | 553/636 nm | フィルターセット 43 |
| 木部自家蛍光 | 380/475 nm | フィルターセット 49 |
| カルコフルーアホワイト | 405/475 nm | フィルターセット 49 |
| 基本的なフクシン | 561/650 nm | フィルターセット 43 |
| erRFP | 585/608 nm | フィルターセット 43 |
| ティッカー | 488/509 nm | フィルターセット 38 |
表2:本研究のために選択された励起/発光スペクトル。
ディスカッション
ゴールのビブラトームカット切片に透明化溶液を適用すると、 アブラナ属菌と 宿主植物との間の生物栄養相互作用を研究する能力が確実に向上します。クリアリングプロトコルはハンドセクションにも適用されますが、ビブラトームセクションでより適切に機能します。PFA固定液でサンプルを固定することは、サンプルを切片作成に進む前に4°Cで数日間保存できるため、プロトコルの重要なステップとして機能します。これにより、固定中の蛍光タンパク質の発現と保存を損なうことなく、限られた期間サンプルを保存する柔軟性が得られます。
ナイルレッド(DMSOまたはメタノール中)は、樹脂を溶解し、樹脂が埋め込まれた切片を破壊する疎水性のため、樹脂切片と相溶性がありません17。したがって、ビブラトーム切片は、発生中のゴール内の病原体分布とそのライフサイクルを研究するのに役立つことが証明されており、ナイルレッド染色を簡単に使用できます。
このプロトコルで使用される透明化溶液は非常に汎用性が高く12、さまざまな蛍光染色をさまざまな組み合わせで使用して、細胞壁のさまざまな生体分子/成分(真菌相互作用におけるスベリン、リグニン、セルロース、およびキチン)を染色することができます。蛍光GFPマーカー株の切片を対比染色し、それによってプロモーター活性またはタンパク質蓄積パターンを、特定の細胞または胆汁の領域における病原体の存在と相関させることも可能である。しかし、木部および病原体で満たされた巨細胞からのバックグラウンド自己蛍光は、クリアリングプロトコルの後でも排除できませんでした。これは、胆汁形成の後期、特に落射蛍光顕微鏡を使用して弱いシグナルをイメージングする場合に、蛍光マーカーを見る上で制限を提示します。
蛍光シグナルの発現・蓄積が少ないため、転写因子の検出は困難ですが、この手法では満足のいく画像を得ることができます。全体として、ビブラトーム切片作成と組織クリアリングアプローチを組み合わせることで、複雑な胆汁組織の組織学的観察のためのツールキットが拡張されます。このプロトコルの柔軟性により、組織固定のプロセスが容易になり、蛍光タンパク質とプロモーター活性を観察するための新鮮な組織サンプルの切断とイメージングに必要な時間が短縮されます。さらなる改良と、さまざまな生体分子に特異的な他の蛍光色素を利用することにより、この方法は、複雑な組織組織を持つ高密度で不透明な組織の組織学的研究と画像解析においてより大きな進歩を遂げるでしょう。最近、提示された組織透明化法は、異なる蛍光シグナル11、12、13を組み合わせて同時取得を可能にするための一般的で広く使用されているプロトコルとして浮上している。このような技術の将来の開発と改変は、細胞レベルで植物と病原体の相互作用を観察するための画像解像度を大幅に向上させます。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、ポーランド国立科学センターOPUS17助成金番号2019/33 / B / NZ9 / 00751「 マラリアブラナ原虫に感染した植物における長距離血管協調」によってサポートされました。 ProHCA2::erRFP ラインを共有してくれたYrjö Helariutta教授(ケンブリッジ大学セインズベリー研究所)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
参考文献
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved