Method Article
Сочетание клиринговой и флуоресцентной микроскопии для визуализации изменений экспрессии генов и физиологических реакций на Plasmodiophora brassicae
В этой статье
Резюме
Настоящий протокол описывает оптимизированный метод гистологического наблюдения галлов, индуцированных Plasmodiophora brassicae. Вибратомные участки гипокотилов очищаются перед флуоресцентной визуализацией для изучения участия факторов транскрипции и фитогормонов во время прогрессирования заболевания. Этот протокол преодолевает ограничения по встраиванию смолы, позволяя в растении визуализировать флуоресцентные белки.
Аннотация
Заражение культур Brassica почвенным протистом Plasmodiophora brassicae приводит к образованию галла на подземных органах. Образование галлов требует клеточного перепрограммирования и изменения метаболизма зараженного растения. Это необходимо для установления патогенно-ориентированного физиологического поглотителя, к которому перенаправляются питательные вещества хозяина. Для полного понимания этого конкретного взаимодействия растений и патогенов и механизмов, с помощью которых рост и развитие хозяина подрываются и перестраиваются, важно отслеживать и наблюдать внутренние изменения, сопровождающие образование желчи с клеточным разрешением. Методы, сочетающие флуоресцентные пятна и флуоресцентные белки, часто используются для изучения анатомических и физиологических реакций у растений. К сожалению, большой размер галлов и их низкая прозрачность действуют как основные препятствия при выполнении наблюдений под микроскопом. Кроме того, низкая прозрачность ограничивает использование флуоресцентной микроскопии для изучения прогрессирования клубневого заболевания и образования желчи. В этой статье представлен оптимизированный метод фиксации и очистки галлов для облегчения эпифлуоресценции и конфокальной микроскопии для осмотра P. brassicae-инфицированных галлов. Был использован протокол очистки тканей для быстрой оптической очистки с последующим вибратомным сечением для обнаружения анатомических изменений и локализации экспрессии генов с помощью промоторных слияний и репортерных линий, помеченных флуоресцентными белками. Этот метод окажется полезным для изучения клеточных и физиологических реакций в других патогенных структурах растений, таких как нематода-индуцированная синцития и корневые узлы, а также галлы листьев и деформации, вызванные насекомыми.
Введение
Растения, пораженные патогенами или насекомыми, могут развивать аномальные структуры (деформации органов или галлы), которые позволяют захватчику глотать питательные вещества иразмножаться 1. Здесь был предпринят эффективный гистопатологический подход для изучения изменений, происходящих в галлах, которые развиваются на подземных частях растений, зараженных протистом Plasmodiophora brassicae (рисунок 1). Незначительная нить, связанная с этим патогеном, возникает из того факта, что споры покоя P. brassicae могут сохранять свою способность вторгаться в растения в течение многих лет. В случае масштабного выращивания масличного рапса (Brassica napus) это серьезная проблема, поскольку экономические факторы ограничивают севооборот, приводя к накоплению спор в почве2. Устойчивость масличного рапса к булавой болезни, вызванной P. brassicae , генетически детерминирована. К сожалению, патоген часто перехитрил резистентность из-за своей биологии и узкого генетического пула, из которого произошел рапс. Поэтому стало актуальным изучение постинфекционных реакций у растений-хозяев и их способности замедлять прогрессирование заболевания или предотвращать развитие определенных симптомов.
При клубневых заболеваниях тяжесть обычно оценивается на основе развития галлов и степени повреждения корневой системы. Это называется индексом заболеваний-DI3. Однако он не в полной мере отражает истинную оценку этого взаимодействия растений и патогенов. В частности, в нем не рассматривается, как патоген распределяется внутри корней и может ли растение сдерживать P. brassicae движение внутри его тканей. Кроме того, нелегко предвидеть, в какой степени P. brassicae перепрограммирует подземную анатомию органа. Исследования на модельном заводе Arabidopsis thaliana показали, что P. brassicae инфекция приводит к ингибированию ксилогенеза (как на стадии инициации, так и на стадии созревания) и усилению дифференцировки флоэмы в галлах4,5. Более того, в корнях и гипокотилах зараженных растений потомство камбиальных клеток не выходит из митотического состояния и размножается дольше, чем у здоровых растений.6. Этот процесс управляет конечным размером галла и определяет количество спор патогена, находящихся в состоянии покоя, продуцируемых внутри зараженного растения. P. brassicae-управляемое развитие, метаболическое и физиологическое перепрограммирование у хозяина очень сложно7; поэтому применение инструментов, позволяющих контролировать внутренние изменения в галлах, имеет решающее значение для правильной оценки этого взаимодействия. Прогрессия жизненного цикла P. brassicae сопровождается перепрограммированием клеточного метаболизма хозяина, который может наблюдаться в виде крахмала или липидного отложения7,8. Основным препятствием для успешной микроскопии галлов является их низкая прозрачность. Из-за этого большинство гистологических образцов, представляющих клубневые изменения в галлах, происходят от методов фиксации-встраивания (воск или смола) с последующим сечением микротомов. Такие подходы были успешно использованы для определения активности промотора для многочисленных генов, активных в клубневых галлах.4,5 или различные методы окрашивания, облегчающие наблюдение P. brassicae прогрессирование жизненного цикла9. Однако следует отметить, что этапы фиксации и встраивания являются трудоемкими и приводят к частичному или полному вымыванию важных биомолекул (например, липидов), что значительно затрудняет некоторые наблюдения. Недавно P. brassicae прогрессирование жизненного цикла у хозяина визуализировали с помощью флуоресцентной гибридизации in situ (FISH), в которой метилтрансфераза типа SABATH (PbBSMT) генно-специфический зонд был использован для маркировки образования спор в состоянии покоя10. Хорошей альтернативой является использование других методов на основе флуоресценции, где можно увидеть автофлуоресценцию некоторых клеточных компонентов, активность 5'-восходящих регуляторных областей генов, слитых с флуоресцентными белковыми маркерами, и накопление определенных флуоресцентно помеченных белков. Однако, помимо низкой прозрачности образцов, основным недостатком, связанным с такими объектами, является работа с нефиксированными образцами, что значительно сокращает время, в течение которого изображения хорошего качества могут быть задокументированы. В 2015 году Курихара и др.11 разработан очищающий реагент, который позволяет сохранять флуоресцентные белки и повышает прозрачность образцов растительной ткани. Кроме того, он совместим с многочисленными гистологическими пятнами. Недавно эта же методика была успешно применена для визуализации различных компонентов клеточной стенки в тканях растений.12,13. Здесь этот протокол был использован для анализа различных аспектов развития булавой желчи. Рабочий процесс начинается с фиксации галлов, сечения вибратома, очистки тканей, окрашивания и флуоресцентной визуализации. В зависимости от потребностей, непосредственно или после конкретного окрашивания, полученные участки могут быть подвергнуты осмотру под эпифлуоресцентным или конфокальным микроскопом. Этот метод обеспечивает эффективное решение для изучения локальных изменений экспрессии генов и физиологических реакций, включая фитогормональный баланс и передачу сигналов. Прогрессирование заболевания можно отследить, посмотрев на структуру распределения спор покоя и динамику созревания. Кроме того, протокол может быть легко применен для визуализации изменений характеристик в пределах P. brassicae зараженные растения, включая ингибирование ксилогенеза или защитные реакции растений-хозяев, видимых как локальная лигнификация в резистентных генотипах. Примеры в этом протоколе взяты из изображений, проведенных на Arabidopsis thaliana модель; однако протокол может также применяться к другим видам сельскохозяйственных культур, принадлежащим к Brassicaceae семья. Метод, описанный ниже, облегчит будущие детальные исследования клеточных структур и молекулярных изменений, сопровождающих образование желчи в P. brassicae-зараженные растения.
Общий рабочий процесс протокола довольно прост, и все этапы развития желчи можно легко сфотографировать и охарактеризовать (рисунок 2). Поскольку P. brassicae является почвенным патогеном, все эксперименты должны проводиться в почвенных системах. Возбудитель предпочитает кислые условия; поэтому необходимо использовать почвенные субстраты, не обработанные известью. Хотя P. brassicae не представляет угрозы для человека, он является строго растительным патогеном, который может распространяться через почву и воду. Поэтому все части зараженного растения, а также почву нужно уничтожить после эксперимента автоклавированием или обработкой отбеливателем.
протокол
1. Условия роста растений
- Выращивают растения Arabidopsis thaliana в режиме короткого светового дня с 9 ч света при 22 °C и 15 ч темноты при 20 °C и излучением 120 мкмоль·м−2с−1 (измеряется как фотосинтетически активное излучение, PAR на уровне полога, см. Таблицу материалов).
2. Приготовление спорового инокулята
ПРИМЕЧАНИЕ: Подробную информацию см. в Fuchs et al.14.
- Гомогенизируйте два-три замороженных галла из китайских капустных растений (Brassica rapa var. pekinensis сорт «Гранат») в блендере, содержащем 300 мл автоклавной дистиллированной воды, и процедите через четыре слоя стерильной марли.
- Центрифугируют фильтрат (при 6000 х г, в течение 5 мин и при 4 °C) и механически удаляют слой крахмала из споровой гранулы с помощью шпателя. Повторяйте этот процесс до тех пор, пока большая часть крахмала не будет удалена.
- Определяют концентрацию спор с помощью гемоцитометра13 путем подсчета количества спор в 20 различных областях поля.
- Убедитесь, что конечная концентрация споровой суспензии, используемой для инокуляции, составляет 1 х 106 спор·мл−1 для Arabidopsis thaliana. Прививайте каждое растение через 20 дней после прорастания 2 мл калиброванной споровой суспензии.
3. Подготовка и фиксация тканей
- Подготовьте растительную ткань.
- Осторожно удаляйте почву из корневой системы клубне-инфицированных и неинфицированных растений. Тщательно очистите водой и соберите гипокотилы и галлы (длиной от 0,5 до 2 см) в микроцентрифужные трубки.
- Выполните фиксацию PFA (4% параформальдегида, PFA в 1x PBS + 0,01% Triton X-100), следуя приведенным ниже шагам.
- Добавьте 4 г порошка ПФА (см. Таблицу материалов) к 100 мл ПБС (фосфатно-буферный физиологический раствор, рН 7,4, Таблица 1) путем перемешивания при 65 °C (не кипятить). Используйте KOH (10 M и 1M) по каплям для получения прозрачного раствора с рН около 11.
- Отрегулируйте pH с H2SO4 , чтобы снизить его до 6,9 и добавить 0,01% (v/v) Triton X-100 для улучшения фиксации. Аликвот раствор хранить при −20 °C (не замораживать повторно) или хранить при 4 °C.
- Выполните фиксацию тканей.
- Зафиксируйте образцы в 200-500 мкл фиксатора PFA в течение 1 ч при комнатной температуре путем применения постоянного вакуума (700 мбар) с помощью вакуумного насоса. Убедитесь, что объект полностью погружен в решение PFA.
ПРИМЕЧАНИЕ: Образцы могут храниться в течение нескольких недель при температуре 4 °C (холодильник) и использоваться позже для секционирования.
- Зафиксируйте образцы в 200-500 мкл фиксатора PFA в течение 1 ч при комнатной температуре путем применения постоянного вакуума (700 мбар) с помощью вакуумного насоса. Убедитесь, что объект полностью погружен в решение PFA.
4. Встраивание и сечение тканей
- Используйте 4% мас./об.агарозы для встраивания агарозы неинфицированных гипокотилов и инфицированных галлов. Вскипятите раствор, чтобы растворить агарозу, и влейте его, когда он остынет, пока он еще вязкий.
- Слегка высушите предмет на ткани в течение нескольких секунд, чтобы удалить избыток PFA.
- Используйте зубочистки/щипцы, чтобы аккуратно встроить и сориентировать растительный объект в агарозе. Чтобы предотвратить косые участки, убедитесь, что объект ориентирован и отлит правильно так, чтобы его ось была перпендикулярна плоскости лезвия вибратома (для радиальных секций).
- Чтобы ускорить затвердевание агарозы, поместите пластину Петри или мультикультурную пластину при 4 °C в течение 10 мин.
ПРИМЕЧАНИЕ: Если объект слишком большой (как в случае больших галлов Arabidopsis через 21 день после посева [DPI]), объект может быть разделен даже без встраивания в агарозу.
5. Вибратомное секционирование
ПРИМЕЧАНИЕ: Вибратом оснащен вибрирующим лезвием бритвы для разрезания органов / тканей растений. Скорость вибрации, амплитуда, угол наклона лезвия и толщина сечения — все это параметры, которые можно регулировать (см. Таблицу материалов).
- Используя лезвие, аккуратно вырежьте и отформуйте объект внутри блока агарозы, отметив предпочтительную ориентацию для секционирования.
- Наклейте блок агарозы/большую желчь, чтобы правильно закрепить его на держателе образца с помощью цианоакрилата/мгновенного клея и маскировочной ленты (см. Таблицу материалов).
- Для гипокотилов и галлов Arabidopsis (ранние стадии) держите толщину срезов между 30-40 мкм для получения изображений хорошего качества.
ПРИМЕЧАНИЕ: Для анализа более поздних стадий прогрессирования желчи толщина срезов может составлять от 50 до 80 мкм. - Воздержитесь от резки более тонких участков, так как это может разрушить образец желчи из-за вибраций движущегося лезвия.
- Отрегулируйте толщину сечений, скорость и амплитуду вибрации в соответствии с толщиной и размером галла (40 мкм или 60 мкм).
- Добавьте дистиллированную воду на водяную баню и начните с секционирования.
- Тщательно соберите срезы с помощью щипцов или щетки и переложите их в микроцентрифужную трубку, содержащую 1 мл 1x буфера PBS (pH 7,4).
ПРИМЕЧАНИЕ: Как правило, чем выше амплитуда вибрации, тем лучше качество сечения. Для неинфицированных гипокотилов или галлов, не содержащих зрелых спор покоя, амплитуда вибрации может поддерживаться на уровне 1,2 мм со скоростью 0,60 мм·с−1 . При крупных галлах с частичной потерей клеточной целостности и видимыми признаками созревания спор амплитуда вибрации должна быть уменьшена до 0,55 мм со скоростью 0,45 мм·с−1 .
6. Очистка образцов
- Извлеките 1x PBS из трубки микроцентрифуги и добавьте 200-500 мкл очищающего раствора (таблица 1).
- Отныне храните образцы при комнатной температуре в темноте. Убедитесь, что объекты всегда погружены в очищающее решение в любое время.
- Замените очищающий раствор на новый, если его цвет изменится через некоторое время во время обработки образца.
ПРИМЕЧАНИЕ: Цвет очищающего раствора может стать желтоватым из-за обработки образца. В таком случае рекомендуется замена раствора для улучшения очистки тканей.
7. Процедура окрашивания
- Для окрашивания кальцифторовым белым цветом клеточных стенок (для укладки растительных клеток) готовят 5% v/v белого пятна Calcofluor (см. Таблицу материалов) в очищающем растворе. Окрашивание не менее 5 мин в темноте.
- Для окрашивания липидов красным нилом (для окрашивания спор покоя и капель масла в инфицированные клетки) готовят 1 мг/мл запаса (см. Таблицу материалов) в очищающем растворе. Разбавьте его дальше, чтобы получить 1:99. Окрашивание не менее 10 мин в темноте.
- Для окрашивания лигнином Basic Fuchsin приготовьте 0,2% мас./об.пятна (см. Таблицу материалов) в очищающем растворе. Окрашивание не менее 10 мин в темноте.
ПРИМЕЧАНИЕ: Во время двойного окрашивания образцы сначала окрашиваются красным нилом в течение 10 минут перед нанесением белого калькофтора. Излишки окрашивающих растворов удаляли после каждого этапа. Если предмет кажется чрезмерно загрязненным, удалите лишнее пятно, промыв его очищающим раствором. При необходимости разбавьте пятна с помощью очищающего раствора. Всегда окрашивайте образец nile Red/Basic Fuchsin перед окрашиванием Calcofluor. Окрашивание сначала Calcofluor может предотвратить правильное окрашивание спор Nile Red.
8. Микроскопия
- Установите очищенные участки на слайд микроскопии и наблюдайте под эпифлуоресценцией или конфокальным микроскопом (см. Таблицу материалов). Используйте очищающий раствор в качестве монтажной среды для предотвращения высыхания образца.
- Используйте несколько режимов съемки для одновременной визуализации более чем одного флуоресцентного спектра.
ПРИМЕЧАНИЕ: Спектры возбуждения/излучения, используемые в представленном протоколе, являются следующими: для Nile Red 553/636 нм, для ксилемной автофлуоресценции 380/475 нм, для Basic Fuchsin 561/650 нм, для Calcofluor white 405/475 нм, для erRFP 585/608 нм и для GFP 488/509 нм (таблица 2).
Результаты
С nile Red, который окрашивает липиды и суберины, можно увидеть возбудителя покоящиеся споры, содержащие липиды (рисунок 3A, B). Следовательно, используя двойное окрашивание, можно получить четкие изображения, чтобы посмотреть на картину распространения патогенов в галлах. Контрокрашивание с помощью Calcofluor white создает контраст и помогает одновременно отслеживать развитие ксилемы с созреванием P. brassicae (рисунок 3B).
Образование и развитие ксилемы также может быть проверено путем наблюдения автофлуоресценции в незапятнанных образцах (рисунок 4A) или с использованием пятен, таких как Базовый фуксин, которые позволяют флуоресцентную визуализацию лигнина (рисунок 4B).
Используя этот метод, можно отслеживать изменения экспрессии генов или реакции на регуляторы роста. Прекрасным примером является то, что растения Arabidopsis с конструкцией pHCA2: erRFP были использованы для визуализации экспрессии гена HIGH CAMBIAL ACTIVITY 2 (HCA2) в ткани флоэмы в клубневых галлах. Активность гена HCA2 ранее была обнаружена в меристематически активных клетках камбия и флоэмы15. Здесь он совместно локализуется с флоэмой на поздних стадиях развития галла, управляемого P. brassicae, и его активность отражает то, как P. brassicae увеличивает сложность флоэмы (рисунок 5). Полученное изображение показывает пролиферацию флоэмы на поздней стадии развития желчи, когда камбий фрагментируется. На рисунке 5A показан неочищенный участок желчи, тогда как на рисунке 5B показаны более четкие и локализованные флуоресцентные сигналы, полученные путем сечения вибратома с последующим очищением тканей. Объекты были увлажнены калькофторовым белым цветом. На рисунке 6 сравнивается это изображение (рисунок 6B) с аналогичной областью, изображенной в галлах, встроенных в смолу и микротомов (рисунок 6A) при 21 DPI. Дифференциальные реакции цитокинина между инфицированными и неинфицированными растениями оценивали путем проверки экспрессии маркера TCS:GFP (Two Component Signalling)16 у развивающихся галлов (рисунок 7). При визуализации слабых сигналов GFP в галлах и тканях с вторичными утолщениями важно отметить, что дополнительный фоновый сигнал за счет автофлуоресценции зрелых клеток ксилемы также фиксируется во время визуализации.

Рисунок 1: Симптомы клубневой болезни на масличных культурах рапса (B. napus) и Arabidopsis thaliana (Columbia-0) при 26 DPI со спорами Plasmodiophora brassicae . Во время течения болезни на всей корневой системе развиваются крупные галлы, что делает ее крайне хрупкой. Он завершается высвобождением спор в окружающую почву для стимулирования будущих инфекций. Верхние части тела растения также показывают признаки плохого роста и развития. Наконец, зараженные растения поддаются разрушительному воздействию на метаболизм и развитие роста, как только корневая система полностью повреждается, и растение больше не может справиться с болезнью. Шкала представляет собой 1 см. -INF расшифровывается как имитация-инокулированная, тогда как +INF расшифровывается как P. brassicae-inoculateed plants. По этому случаю перед удалением почвы дается фотография растений масличного рапса, чтобы представить здоровую корневую систему. После промывки собирают только гипокотил и верхнюю часть корня. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Общий рабочий процесс. Промытые корневые системы Arabidopsis (A) рассечены, (B) фиксированы, (C) агароза встроены, (D) установлены и (E) разделены на вибратоме. Полученные предметы подвергают очистке тканей (от 3 дней до нескольких недель при РТ в темное время суток, в зависимости от типа и толщины ткани). (F) Очищенные объекты затем могут быть окрашены и проверены под микроскопом. G) Резюме рабочего процесса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
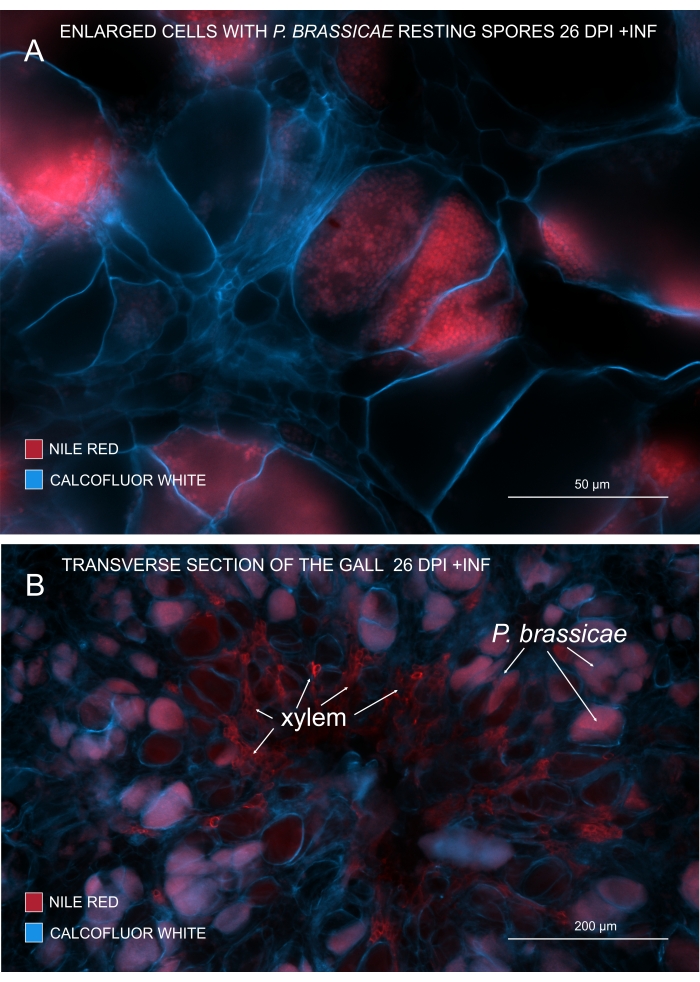
Рисунок 3: Маркировка спор патогена пятном Nile Red. (A,B) Nile Red окрашивает липиды в покоящихся спорах, что отлично работает для отслеживания созревания P. brassicae. (A) Увеличенные клетки, колонизированные P. brassicae и заполненные спорами патогенов. (B) Зрелые клетки ксилемы также окрашиваются Красным Нилом. Секция была покрыта calcofluor белым цветом, чтобы увидеть расходы клеток-хозяев (A: объектив = 20x и толщина секции = 60 мкм; B: Объектив = 5x и толщина сечения = 60 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
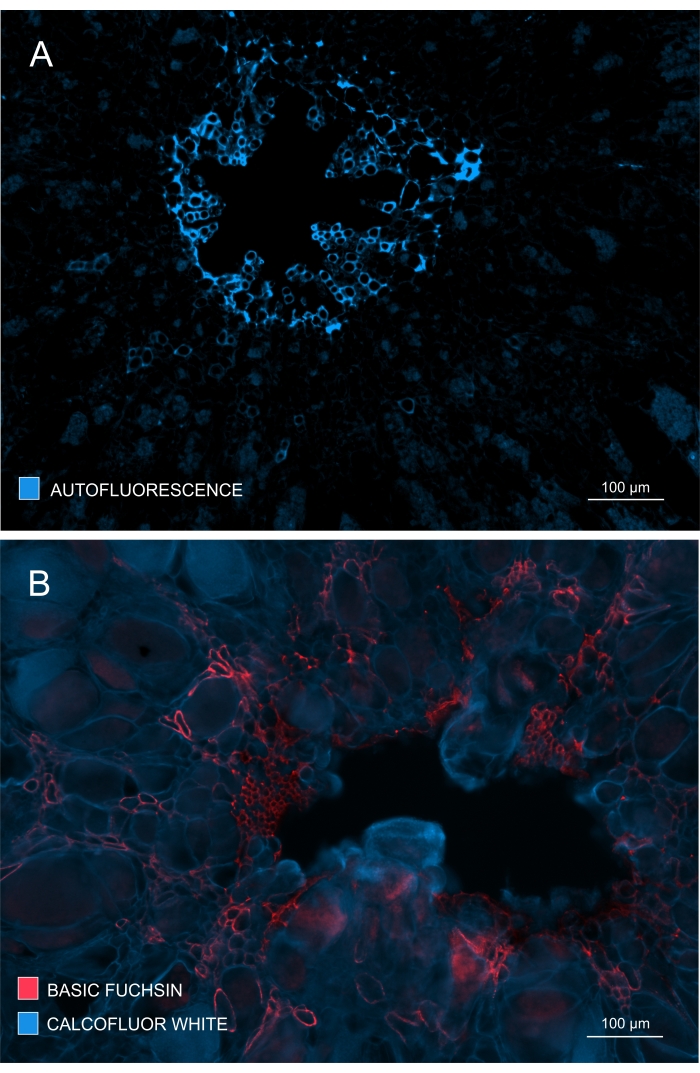
Рисунок 4: Отслеживание степени развития и созревания ксилемы. (А) Лигнин дает сильную автофлуоресценцию при возбуждении УФ-излучением; поэтому зрелую ксилему можно относительно легко дискриминировать. (B) Двойное окрашивание базовым фуксином и калькофтором дает лучшие результаты, поскольку все клетки окрашиваются последним красителем, в то время как зрелая ксилема отчетливо окрашивается основным фуксином. Таким образом, двойное окрашивание обеспечивает изображениям улучшенную контрастность, изображая заметное ингибирование ксилогенеза (A: объектив = 10x и толщина сечения = 60 мкм; B: Объектив = 10x и толщина сечения = 60 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
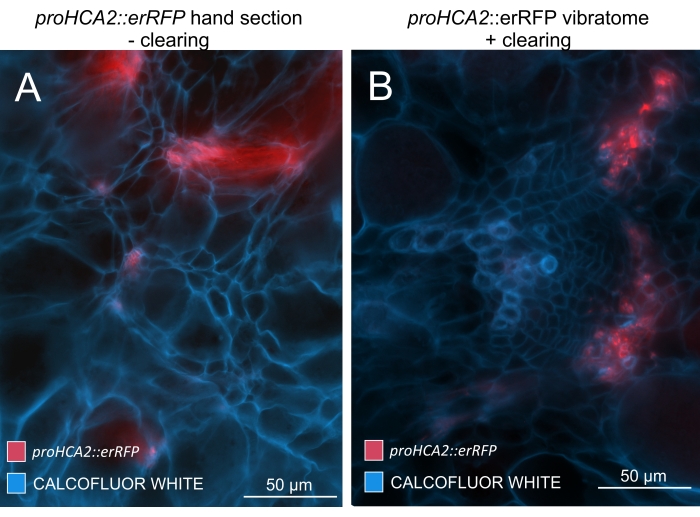
Рисунок 5: Флоэм-специфический сигнал для гена HCA2 в гипокотилах растений, инфицированных P. brassicae, при 21 DPI. Промоутерная активность для proHCA2::erRFP , укрывающая трансгенный Arabidopsis thaliana , может быть замечена в (A) и (B). Различия можно наблюдать между неочищенной секцией руки на панели (A), где сигнал erRFP кажется рассеянным из-за наложения и перекрывающихся слоев ячеек, особенно в неровных секциях рук. С другой стороны, (B) показывает вибратомный участок после очистки тканей, где сигнал эрРФП точно отмечает клетки флоэмы в зрелом сосудистом пучке (объектив = 20x и толщина сечения = 60 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
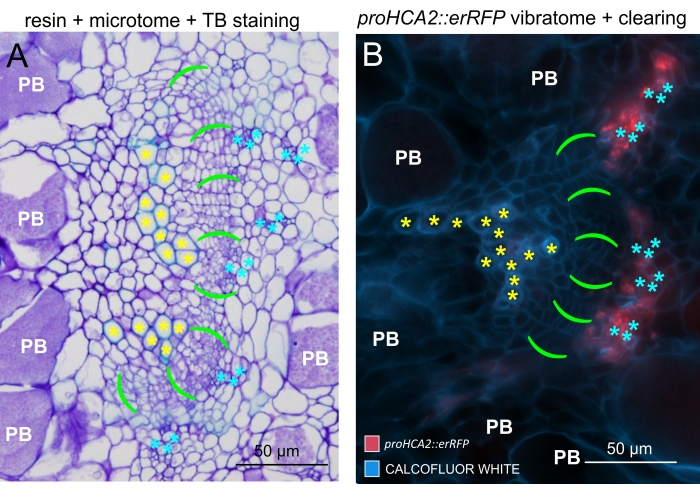
Рисунок 6: Сравнение туберкулеза, смоляных и микротомовых рассеченных галлов с помощью флуоресценции. (A) Сравнение изображений толуидиновых голубых (TB), смоляных и микротомовых рассеченных галлов и (B) репрезентативного объекта (также представленного на рисунке 5B), полученного с помощью флуоресценции. Клетки ксилемы помечены желтыми звездочками, камбиальная область — ярко-зелеными скобками, флоэма — голубыми звездочками, а клетки Plasmodiophora brassicae — белым символом PB. Покрытые смолой срезы (А) обеспечивают хорошее разрешение для изучения распределения спор покоя в гипертрофированных органах, степени прогрессирования заболевания и других процессов, таких как локальное одреценение у резистентных растений. Однако протокол, описанный здесь (B), позволяет чувствительно наблюдать экспрессию генов или накопление белка и визуализировать другие физиологические изменения и важные молекулы, такие как липиды (в спорах). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
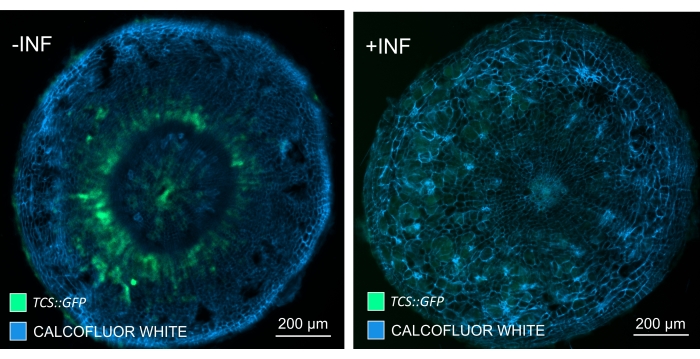
Рисунок 7: Отслеживание сигнальных реакций цитокинина в гипокотилах неинфицированных (-INF) и P. brassicae-инфицированных (+INF) растений Arabidopsis при 16 DPI. Маркер TCS::GFP использовался для характеристики реакций на цитокинин растений. Вибратомные срезы подвергались очищающей обработке с последующим окрашиванием калькофторовым белым цветом. Основываясь на изображении, при 16 DPI реакции цитокинина, по-видимому, в значительной степени уменьшаются в инфицированных галлах (правая панель), в то время как они остаются сильными, особенно в пуле флоэм (клетки, которые в конечном итоге дифференцируются с образованием ткани флоэмы), в неинфицированных растениях (левая панель) (объективная линза = 5x и толщина = 30 мкм). Также могут быть видны определенные уровни автофлуоресценции ксилемы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Очищающий раствор (токсичный) | ||
| Компоненты | Процент (%) | в дистиллированной воде 100 мл |
| Ксилит | 10% | 10г |
| Дезоксихолат натрия | 15% | 15г |
| Мочевина | 25% | 25г |
| 10x PBS (фосфатно-буферный физиологический раствор) | 1x PBS (100 мл) | |
| НаКл | 8 г | 10 мл 10x PBS + 90 мл дистиллированной воды |
| ККл | 0.2 г | |
| KH2PO4 | 0,24 г | |
| На2ХПО4 · 2Ч2О | 1,81 г | |
| дистиллированная вода | 100 мл | |
| рН | pH, скорректированный до 7,4 с использованием HCl | |
| Автоклав и хранить при 4 °C. | ||
Таблица 1: Состав клирингового раствора и фосфатно-буферного физиологического раствора (PBS).
| Флуоресцентное пятно/ Тег | Длины волн возбуждения/излучения | Используемый набор фильтров микроскопа |
| Красный Нил | 553/636 морских миль | набор фильтров 43 |
| Ксилема Автофлуоресценция | 380/475 нм | набор фильтров 49 |
| Кальцифтор Белый | 405/475 нм | набор фильтров 49 |
| Базовый Фуксин | 561/650 нм | набор фильтров 43 |
| эрРФП | 585/608 морских миль | набор фильтров 43 |
| ГФП | 488/509 морских миль | набор фильтров 38 |
Таблица 2: Спектры возбуждения/излучения, отобранные для настоящего исследования.
Обсуждение
Нанесение очищающего раствора на вибратомные срезы галлов, безусловно, повышает способность изучать биотрофное взаимодействие между P. brassicae и растением-хозяином. Хотя протокол очистки применяется даже к ручным секциям, он лучше работает с секциями вибратома. Фиксация образцов в фиксаторе PFA действует как критический шаг в протоколе, поскольку образцы затем могут храниться при 4 ° C в течение нескольких дней, прежде чем приступить к разделению. Это обеспечивает гибкость для хранения образцов в течение ограниченного периода времени без ущерба для экспрессии и сохранения флуоресцентных белков во время фиксации.
Красный нил (в ДМСО или метаноле) несовместим со смоляными срезами из-за своей гидрофобности, которая растворяет смолу и разрушает встроенные в смолу участки17. Таким образом, вибратомные участки оказываются полезными для изучения распространения патогена и его жизненного цикла в развивающихся галлах, при этом окрашивание в красный нил может быть легко использовано.
Очищающий раствор, используемый в этом протоколе, является очень универсальным12, что позволяет использовать различные флуоресцентные пятна в различных комбинациях для окрашивания различных биомолекул / компонентов клеточных стенок (суберин, лигнин, целлюлоза и хитин в грибковых взаимодействиях). Также можно противодействовать участкам флуоресцентных маркерных линий GFP и тем самым коррелировать промоторную активность или паттерн накопления белка с присутствием патогена в конкретных клетках или областях желчи. Однако фоновая автофлуоресценция от ксилемы и заполненных патогенами гигантских клеток не могла быть устранена даже после протокола очистки. Это представляет собой ограничение для изучения флуоресцентных маркеров на более поздних стадиях образования желчи, особенно при использовании эпифлуоресцентного микроскопа и визуализации слабых сигналов.
Из-за низкого уровня экспрессии/накопления флуоресцентных сигналов факторы транскрипции трудно обнаружить, но с помощью этого метода можно получить удовлетворительные изображения для них. В целом, сочетание вибратомного сечения с подходом очистки тканей расширяет инструментарий для гистологических наблюдений сложных желчных тканей. Гибкость этого протокола облегчает процесс фиксации тканей и сокращает время, необходимое для разрезания и визуализации свежих образцов тканей для наблюдения флуоресцентных белков и промоторной активности. С дальнейшими улучшениями и использованием других флуоресцентных красителей, специфичных для различных биомолекул, этот метод будет означать большие успехи в гистологических исследованиях и анализе изображений плотных, непрозрачных тканей со сложной организацией тканей. В последнее время представленный метод очистки тканей стал популярным и широко используемым протоколом для объединения и обеспечения возможности одновременного получения различных флуоресцентных сигналов 11,12,13. Будущее развитие и модификации таких методов значительно улучшат разрешение изображения для наблюдения за взаимодействиями растений и патогенов на клеточном уровне.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Работа была поддержана грантом Национального научного центра Польши OPUS17 No 2019/33/B/NZ9/00751 «Междугородняя сосудистая координация у растений, инфицированных Plasmodiophora brassicae». Мы благодарим профессора Юрьо Хелариутту (Sainsbury Laboratory, Кембриджский университет) за то, что он поделился линией proHCA2::erRFP .
Материалы
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
Ссылки
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены