Method Article
Gen İfadesindeki Değişiklikleri ve Plasmodiophora brassicae'ye Fizyolojik Yanıtları Görselleştirmek için Temizleme ve Floresan Mikroskopisinin Birleştirilmesi
Bu Makalede
Özet
Mevcut protokol, Plasmodiophora brassicae tarafından indüklenen safra kesesi histolojik gözlemi için optimize edilmiş bir yöntemi tanımlamaktadır. Hipokotillerin vibratom kesitleri, hastalığın ilerlemesi sırasında transkripsiyon faktörlerinin ve fitohormonların tutulumunu incelemek için floresan görüntülemeden önce temizlenir. Bu protokol, reçine gömme sınırlamalarının üstesinden gelerek floresan proteinlerinin planta görselleştirmesini sağlar.
Özet
Brassica bitkilerinin topraktaki protist Plasmodiophora brassicae tarafından enfeksiyonu, yeraltı organlarında safra oluşumuna yol açar. Safra kesesi oluşumu, hücresel yeniden programlama ve enfekte olmuş bitkinin metabolizmasındaki değişiklikleri gerektirir. Bu, konakçı besinlerin yönlendirildiği patojen odaklı bir fizyolojik lavabo oluşturmak için gereklidir. Bu özel bitki-patojen etkileşiminin ve konakçı büyümesinin ve gelişiminin altüst edildiği ve yeniden şekillendirildiği mekanizmaların tam olarak anlaşılması için, safra oluşumuna eşlik eden iç değişikliklerin hücresel çözünürlükle izlenmesi ve gözlemlenmesi esastır. Floresan lekeleri ve floresan proteinleri birleştiren yöntemler, bitkilerdeki anatomik ve fizyolojik tepkileri incelemek için sıklıkla kullanılır. Ne yazık ki, safra keselerinin büyüklüğü ve düşük şeffaflıkları, mikroskop altında bütüne monte gözlemlerin gerçekleştirilmesinde büyük engeller olarak hareket eder. Ayrıca, düşük şeffaflık, kulüp hastalığı progresyonunu ve safra oluşumunu incelemek için floresan mikroskobunun kullanılmasını sınırlar. Bu makalede, P. brassicae ile enfekte olmuş safraların incelenmesi için epifloresan ve konfokal mikroskopiyi kolaylaştırmak için safra keselerinin sabitlenmesi ve temizlenmesi için optimize edilmiş bir yöntem sunulmaktadır. Hızlı optik temizleme için bir doku temizleme protokolü kullanıldı, ardından anatomik değişiklikleri tespit etmek ve promotör füzyonları ve floresan proteinleri ile etiketlenmiş muhabir çizgileri ile gen ekspresyonunu lokalize etmek için vibratom kesitleme yapıldı. Bu yöntem, nematod kaynaklı sinsiti ve kök düğümleri gibi bitkilerde patojen tarafından tetiklenen diğer yapılarda hücresel ve fizyolojik tepkilerin yanı sıra yaprak safraları ve böceklerin neden olduğu deformasyonları incelemek için yararlı olacaktır.
Giriş
Patojenlerden veya böceklerden etkilenen bitkiler, istilacının besinleri almasına ve üremesine izin veren anormal yapılar (organ deformasyonları veya safralar) geliştirebilir1. Burada, protist Plasmodiophora brassicae ile enfekte olmuş bitkilerin yeraltı kısımlarında gelişen safra keselerinde meydana gelen değişiklikleri incelemek için etkili bir histopatolojik yaklaşım benimsenmiştir (Şekil 1). Bu patojenle ilişkili küçük iplik, P. brassicae dinlenme sporlarının bitkileri yıllarca istila etme yeteneklerini koruyabilmeleri gerçeğinden kaynaklanmaktadır. Yağlı tohumlu kolza (Brassica napus) büyük ölçekli yetiştiriciliği durumunda, ekonomik faktörler mahsul rotasyonunu kısıtladığı ve toprakta dinlenme sporu birikimine yol açtığı için bu ciddi bir sorundur2. Yağlı tohumlu kolzanın P. brassicae'nin neden olduğu clubroot hastalığına karşı direnci genetik olarak belirlenir. Ne yazık ki, patojen biyolojisi ve yağlı tohum kolzasının kaynaklandığı dar genetik havuz nedeniyle genellikle direnci aşar. Bu nedenle, konakçı bitkilerde enfeksiyon sonrası tepkileri ve hastalığın ilerlemesini yavaşlatma veya belirli semptomların gelişmesini önleme yeteneklerini incelemek uygun hale gelmiştir.
Clubroot hastalığında, şiddet genellikle safra keselerinin gelişimine ve kök sistemi hasarının derecesine göre değerlendirilir. Bu, Hastalık İndeksi-DI olarak bilinir.3. Bununla birlikte, bu bitki-patojen etkileşiminin gerçek değerlendirmesini tam olarak yakalamaz. Özellikle, patojenin kökler içinde nasıl dağıldığını ve bitkinin kısıtlanıp kısıtlanamayacağını ele almaz. P. brassicae dokuları içindeki hareket. Ayrıca, ne ölçüde tahmin etmek kolay değildir. P. brassicae yeraltı organ anatomisini yeniden programlar. Model tesis çalışmaları Arabidopsis thaliana göstermiştir ki P. brassicae enfeksiyon, ksilogenezin inhibisyonuna (hem başlatma hem de olgunlaşma basamakları) ve safra keselerinde floem farklılaşmasının artmasına yol açar.4,5. Dahası, enfekte olmuş bitkilerin köklerinde ve hipokotillerinde, kambiyal hücre soyu mitotik durumdan çıkmaz ve sağlıklı bitkilerden daha uzun süre çoğalır.6. Bu işlem safra kesesinin nihai boyutunu yönetir ve enfekte olmuş bitki içinde üretilen patojen dinlenme sporlarının sayısını belirler. P. brassicaeKonakçıda güdümlü gelişimsel, metabolik ve fizyolojik yeniden programlama çok karmaşıktır7; bu nedenle, safra keselerindeki iç değişikliklerin incelenmesine izin veren araçların uygulanması, bu etkileşimin doğru bir şekilde değerlendirilmesi için çok önemlidir. Yaşam döngüsü ilerlemesi P. brassicae nişasta veya lipit birikimi olarak gözlenebilen konakçı hücre metabolizmasının yeniden programlanması eşlik eder.7,8. Safra keselerinin başarılı mikroskopisinin önündeki en büyük engel, düşük şeffaflıklarından kaynaklanmaktadır. Bu nedenle, safra keselerinde kulüp kökü kaynaklı değişiklikler sunan histolojik örneklerin çoğu, fiksasyon-gömme (balmumu veya reçine) tekniklerinden ve ardından mikrotom kesitinden kaynaklanmaktadır. Bu tür yaklaşımlar, kulüp kökü safralarında aktif olan çok sayıda gen için promotör aktivitesini bulmak için başarıyla kullanılmıştır.4,5 veya gözlemini kolaylaştıran çeşitli boyama teknikleri P. brassicae yaşam döngüsü ilerlemesi9. Bununla birlikte, sabitleme ve gömme aşamalarının zaman alıcı olduğu ve önemli biyomoleküllerin (örneğin, lipitler) kısmen veya tamamen yıkanmasına neden olduğu ve belirli gözlemleri önemli ölçüde engellediği belirtilmelidir. Geçenlerde P. brassicae Konakçıdaki yaşam döngüsü ilerlemesi, içinde SABATH tipi metiltransferazın (PbBSMT) resting spor oluşumunu işaretlemek için gen-spesifik prob kullanıldı10. İyi bir alternatif, bazı hücresel bileşenlerin otofloresansı, floresan protein belirteçleriyle kaynaşmış genlerin 5'- yukarı akış düzenleyici bölgelerinin aktivitesi ve belirli floresan etiketli proteinlerin birikiminin görülebildiği diğer floresan bazlı yöntemlerin kullanılmasıdır. Bununla birlikte, numunelerin düşük şeffaflığına ek olarak, bu tür nesnelerle ilişkili büyük bir dezavantaj, sabitlenmemiş numunelerle çalışmaktır ve bu da kaliteli görüntülerin belgelenebileceği süreyi önemli ölçüde azaltır. 2015 yılında Kurihara ve ark.11 floresan proteinlerinin korunmasını sağlayan ve bitki dokusu örneklerinin şeffaflığını artıran bir temizleme reaktifi geliştirdi. Ek olarak, çok sayıda histolojik leke ile uyumludur. Son zamanlarda, aynı teknik, bitki dokularındaki farklı hücre duvarı bileşenlerini görselleştirmek için başarıyla uygulanmıştır.12,13. Burada, bu protokol çeşitli clubroot safra gelişim yönlerini analiz etmek için kullanılmıştır. İş akışı, safraların sabitlenmesi, vibratom kesitleme, doku temizleme, boyama ve floresan görüntüleme ile başlar. Kişinin ihtiyaçlarına bağlı olarak, doğrudan veya belirli bir boyama işleminden sonra, ortaya çıkan bölümler bir epifloresan veya konfokal mikroskop altında incelemeye tabi tutulabilir. Bu yöntem, fitohormon dengesi ve sinyalleme dahil olmak üzere gen ekspresyonundaki ve fizyolojik tepkilerdeki lokal değişiklikleri incelemek için etkili bir çözüm sunar. Hastalığın ilerlemesi, istirahat sporlarının dağılım paternine ve olgunlaşma dinamiklerine bakarak izlenebilir. Ayrıca, protokol içindeki karakteristik değişiklikleri görüntülemek için kolayca uygulanabilir. P. brassicae ksilogenezin inhibisyonu veya dirençli genotiplerde lokal lignifikasyon olarak görülebilen konakçı bitki savunma yanıtları da dahil olmak üzere enfekte olmuş bitkiler. Bu protokoldeki örnekler, Arabidopsis thaliana model; ancak protokol, Brassicaceae aile. Aşağıda açıklanan yöntem, safra oluşumuna eşlik eden hücresel yapılar ve moleküler değişiklikler hakkında gelecekteki ayrıntılı çalışmaları kolaylaştıracaktır. P. brassicae-enfekte olmuş bitkiler.
Protokolün genel iş akışı oldukça basittir ve safra gelişiminin tüm aşamaları kolayca görüntülenebilir ve karakterize edilebilir (Şekil 2). P. brassicae toprak kaynaklı bir patojen olduğundan, tüm deneyler toprak bazlı sistemlerde yapılmalıdır. Patojen asidik koşulları tercih eder; bu nedenle, kireçle muamele edilmemiş toprak substratları kullanılmalıdır. P. brassicae insanlar için bir tehdit oluşturmasa da, kesinlikle toprak ve su yoluyla yayılabilen bir bitki patojenidir. Bu nedenle, enfekte olmuş bitkinin tüm kısımlarının yanı sıra toprağın, deneyden sonra otoklavlama veya ağartıcı ile muamele edilerek tahrip edilmesi gerekir.
Protokol
1. Bitki büyüme koşulları
- Arabidopsis thaliana bitkilerini, 22 ° C'de 9 saat ışık ve 20 ° C'de 15 saat karanlık ve 120 μmol · m − 2s − 1 ışıma ile kısa bir gün ışık rejiminde yetiştirin (fotosentetik olarak aktif radyasyon olarak ölçülür, gölgelik seviyesinde PAR, bkz.
2. Spor inokulumunun hazırlanması
NOT: Ayrıntılar için Fuchs ve ark.14'e bakın.
- Çin lahana bitkilerinden (Brassica rapa var. pekinensis cultivar "Granaat") iki ila üç dondurulmuş safrayı 300 mL otoklavlanmış damıtılmış su içeren bir karıştırıcıda homojenize edin ve dört kat steril gazlı bezden süzün.
- Filtratın (6.000 x g'de, 5 dakika ve 4 ° C'de) santrifüj edilmesi ve bir spatula kullanarak nişasta tabakasını spor peletinden mekanik olarak çıkarın. Nişastanın çoğu çıkarılana kadar bu işlemi tekrarlayın.
- 20 farklı alan alanındaki spor sayısını sayarak bir hemositometre13 kullanarak spor konsantrasyonunu belirleyin.
- Arabidopsis thaliana için aşılama için kullanılan spor süspansiyonunun son konsantrasyonunun 1 x 106 spor · mL − 1 olduğundan emin olun. Her bitkiyi çimlenmeden 20 gün sonra 2 mL kalibre edilmiş spor süspansiyonu ile aşılayın.
3. Doku hazırlama ve fiksasyon
- Bitki dokusunu hazırlayın.
- Toprağı kulüp kökü ile enfekte olmuş ve enfekte olmayan bitkilerin kök sistemlerinden dikkatlice çıkarın. Su ile iyice temizleyin ve hipokotilleri ve safraları (uzunluğu 0,5-2 cm arasında) mikrosantrifüj tüplerine toplayın.
- Aşağıdaki adımları izleyerek PFA fiksasyonu (%4 paraformaldehit, 1x PBS + %0,01 Triton X-100'de PFA) gerçekleştirin.
- 65 °C'de karıştırarak 100 mL PBS'ye (fosfat tamponlu salin, pH 7.4, Tablo 1) 4 g PFA tozu ( Malzeme Tablosuna bakınız) ekleyin (kaynatmayın). PH'ı yaklaşık 11 olan berrak bir çözelti elde etmek için KOH (10 M ve 1M) damla damla kullanın.
- PH'ıH2S04 ile ayarlayarak 6,9'a düşürün ve fiksasyonu iyileştirmek için %0,01 (v/d) Triton X-100 ekleyin. Aliquot çözeltisi −20 ° C'de saklamak (yeniden dondurmayın) veya 4 ° C'de saklamak için.
- Doku fiksasyonu gerçekleştirin.
- Bir vakum pompası kullanarak sabit bir vakum (700 mbar) uygulayarak numuneleri oda sıcaklığında 1 saat boyunca 200-500 μL PFA fiksatif olarak sabitleyin. Nesnenin PFA çözeltisine tamamen daldırıldığından emin olun.
NOT: Numuneler 4 °C'de (buzdolabında) birkaç hafta saklanabilir ve daha sonra kesitleme için kullanılabilir.
- Bir vakum pompası kullanarak sabit bir vakum (700 mbar) uygulayarak numuneleri oda sıcaklığında 1 saat boyunca 200-500 μL PFA fiksatif olarak sabitleyin. Nesnenin PFA çözeltisine tamamen daldırıldığından emin olun.
4. Doku gömme ve bölümleme
- Enfekte olmayan hipokotillerin ve enfekte safraların agaroz gömülmesi için% 4 w / v agaroz kullanın. Agarozu çözmek için çözeltiyi kaynatın ve hala viskoz iken soğuduğunda dökün.
- Fazla PFA'yı çıkarmak için nesneyi birkaç saniye boyunca bir doku üzerinde hafifçe kurulayın.
- Bitki nesnesini agaroza dikkatlice yerleştirmek ve yönlendirmek için kürdan / forseps kullanın. Eğik kesitleri önlemek için, nesnenin doğru yönlendirildiğinden ve kalıplandığından emin olun, böylece ekseni vibratom bıçağının düzlemine dik olacaktır (radyal bölümler için).
- Agaroz katılaşmasını hızlandırmak için, Petri veya çok kültürlü plakayı 10 dakika boyunca 4 ° C'ye yerleştirin.
NOT: Nesne çok büyükse (aşılamadan sonraki 21 gün içinde Arabidopsis'in daha büyük safra keselerinde olduğu gibi [DPI]), nesne agaroza gömülmeden bile kesitlenebilir.
5. Vibratom kesitleme
NOT: Vibratom, bitki organlarını / dokusunu kesmek için titreşimli bir tıraş bıçağı ile donatılmıştır. Titreşim hızı, genlik, bıçağın açısı ve kesit kalınlığı ayarlanabilen parametrelerdir (bkz.
- Bir bıçak kullanarak, nesneyi bir agaroz bloğu içinde dikkatlice kesin ve kalıplayın, kesitleme için tercih edilen yönü not edin.
- Siyanoakrilat / anlık tutkal ve maskeleme bandı kullanarak numune tutucuya düzgün bir şekilde monte etmek için agaroz bloğunu / büyük safrayı yapıştırın (bkz.
- Arabidopsis hipokotilleri ve safra keseleri (erken aşamalar) için, kaliteli görüntüler elde etmek için bölümlerin kalınlığını 30-40 μm arasında tutun.
NOT: Safra ilerlemesinin sonraki aşamalarını analiz etmek için, kesitlerin kalınlığı 50-80 μm arasında olabilir. - Hareketli bıçağın titreşimleri nedeniyle safra numunesini tahrip edebileceğinden daha ince bölümleri kesmekten kaçının.
- Kesitlerin kalınlığını, hızını ve titreşim genliğini safra kesesinin kalınlığına ve boyutuna (40 μm veya 60 μm) göre ayarlayın.
- Su banyosuna damıtılmış su ekleyin ve bölümleme ile başlayın.
- Forseps veya fırça kullanarak bölümleri dikkatlice toplayın ve bunları 1mL 1x PBS tamponu (pH 7.4) içeren bir mikrosantrifüj tüpüne aktarın.
NOT: Tipik olarak, titreşim genliği ne kadar yüksek olursa, kesitleme kalitesi o kadar iyi olur. Olgun dinlenme sporları içermeyen enfekte olmayan hipokotiller veya safra keseleri için, titreşim genliği 0.60 mm · s − 1 hız ile 1.2 mm'de tutulabilir. Hücresel bütünlüğün kısmen kaybolduğu ve gözle görülür spor olgunlaşma belirtileri olan büyük safra keseleri durumunda, titreşim genliği 0,45 mm·s−1 hızla 0,55 mm'ye düşürülmelidir.
6. Numune temizleme
- Mikrosantrifüj tüpünden 1x PBS'yi çıkarın ve 200-500 μL temizleme çözeltisi ekleyin (Tablo 1).
- Şu andan itibaren, örnekleri karanlıkta oda sıcaklığında saklayın. Nesnelerin her zaman temizleme çözümüne batırıldığından emin olun.
- Numune işleme sırasında bir süre sonra rengi değişirse temizleme solüsyonunu yenisiyle değiştirin.
NOT: Temizleme çözeltisinin rengi, numune işleme nedeniyle sarımsı hale gelebilir. Böyle bir durumda, dokuların temizlenmesini iyileştirmek için çözeltinin değiştirilmesi önerilir.
7. Boyama prosedürü
- Hücre duvarları için Calcofluor beyaz boyama için (bitki hücrelerinin döşenmesi için), temizleme çözeltisinde% 5 v / v Calcofluor beyaz boyası hazırlayın (bkz. Karanlıkta en az 5 dakika bekletin.
- Lipitleri Nil Kırmızısı ile boyamak için (enfekte olmuş hücrelerde dinlenme sporlarını ve yağ damlacıklarını boyamak için), temizleme çözeltisinde stokun 1 mg / mL'sini hazırlayın (bkz. 1:99'u elde etmek için daha da seyreltin. Karanlıkta en az 10 dakika bekletin.
- Temel Fuchsin lignin boyama için, temizleme çözeltisinde lekenin %0,2'sini w/v ile hazırlayın (bkz. Karanlıkta en az 10 dakika bekletin.
NOT: Çift boyama sırasında, numuneler Calcofluor beyaz uygulamasından önce 10 dakika boyunca Nil Kırmızısı ile boyanır. Fazla boyama solüsyonları her adımdan sonra çıkarıldı. Nesne fazla boyanmış görünüyorsa, temizleme solüsyonu ile yıkayarak fazla lekeyi çıkarın. Gerekirse temizleme solüsyonunu kullanarak lekeleri seyreltin. Calcofluor boyamadan önce numuneyi daima Nil Kırmızısı/Temel Fuchsin ile boyayın. İlk önce Calcofluor ile boyanması, sporların Nil Kırmızısı ile düzgün boyanmasını önleyebilir.
8. Mikroskopi
- Temizlenmiş bölümleri mikroskopi slaytına monte edin ve bir epifloresan veya konfokal mikroskop altında gözlemleyin (bkz. Numunenin kurumasını önlemek için montaj ortamı olarak temizleme çözeltisi kullanın.
- Aynı anda birden fazla floresan spektrumunu görüntülemek için birden fazla yakalama modu kullanın.
NOT: Sunulan protokolde kullanılan uyarma/emisyon spektrumları aşağıdaki gibidir: Nil Kırmızısı 553/636 nm, ksilem otofloresans 380/475 nm, Temel Fuchsin 561/650 nm, Calcofluor beyaz 405/475 nm için, erRFP 585/608 nm ve GFP 488/509 nm için (Tablo 2).
Sonuçlar
Lipitleri ve suberini boyayan Nil Kırmızısı ile lipitler içeren patojen istirahat sporlarını görmek mümkündür (Şekil 3A,B). Bu nedenle, çift boyama kullanılarak, safralar içindeki patojen dağılımının modeline bakmak için net görüntüler elde edilebilir. Calcofluor beyazı ile karşı boyama kontrast oluşturur ve P. brassicae olgunlaşması ile aynı anda ksilem gelişimini izlemeye yardımcı olur (Şekil 3B).
Ksilem oluşumu ve gelişimi, lekesiz numunelerde otofloresan gözlemlenerek (Şekil 4A) veya ligninin floresan bazlı görüntülenmesini sağlayan Temel Fuchsin gibi lekeler kullanılarak da kontrol edilebilir (Şekil 4B).
Bu yöntemi kullanarak, gen ekspresyon değişikliklerini veya büyüme düzenleyicilerine verilen yanıtları izleyebiliriz. Mükemmel bir örnek, pHCA2: erRFP yapısını barındıran Arabidopsis bitkilerinin, clubroot safraları içindeki floem dokusunda HIGH CAMBIAL ACTIVITY 2 (HCA2) gen ekspresyonunu görselleştirmek için kullanıldığı yerdir. HCA2 gen aktivitesi daha önce meristematik olarak aktif kambiyum ve floem-soy hücrelerinde bulunmuştur15. Burada, P. brassicae güdümlü safra gelişiminin geç aşamalarında floem ile birlikte lokalize olur ve aktivitesi P. brassicae'nin floem karmaşıklığını nasıl arttırdığını yansıtır (Şekil 5). Ortaya çıkan görüntü, kambiyum parçalandığında safra gelişiminin geç aşamasında floem proliferasyonunu göstermektedir. Şekil 5A, safra kesesinin temizlenmemiş bir el bölümünü gösterirken, Şekil 5B, vibratom kesiti ve ardından doku temizliği ile elde edilen daha net ve lokalize floresan sinyalleri göstermektedir. Nesneler Calcofluor beyazı ile karşı lekelenmişti. Şekil 6, bu görüntüyü (Şekil 6B), 21 DPI'da reçineye gömülü ve mikrotom kesitli safra kesitlerinde (Şekil 6A) gösterilen benzer bir bölgeyle karşılaştırır. Enfekte ve enfekte olmayan bitkiler arasındaki diferansiyel sitokinin yanıtları, gelişmekte olan safra keselerinde TCS:GFP (İki Bileşenli Sinyalleşme) belirteci16'nın ekspresyonu kontrol edilerek değerlendirildi (Şekil 7). Sekonder kalınlaşmalarla safra ve dokulardaki zayıf GFP sinyallerini görüntülerken, olgun ksilem hücrelerinin otofloresansına bağlı ek arka plan sinyalinin de görüntüleme sırasında yakalandığını belirtmek önemlidir.

Şekil 1: Plasmodiophora brassicae sporları ile 26 DPI'da yağlı tohumlu kolza (B. napus) ve Arabidopsis thaliana (Columbia-0) üzerinde Clubroot hastalığı semptomları. Hastalığın seyri sırasında, tüm kök sisteminde büyük safra keseleri gelişir ve bu da onu son derece kırılgan hale getirir. Gelecekteki enfeksiyonları teşvik etmek için sporları çevreleyen toprağa bırakarak sonuçlanır. Bitki vücudunun üst kısımları da zayıf büyüme ve gelişme belirtileri gösterir. Son olarak, enfekte olmuş bitkiler, kök sistemi tamamen hasar gördüğünde ve bitki artık hastalıkla baş edemediğinde büyüme metabolizması ve gelişimi üzerindeki yıkıcı etkilere yenik düşer. Ölçek çubuğu 1 cm'yi temsil eder. -INF alay aşılanmış anlamına gelirken, +INF P. brassicae aşılanmış bitkiler anlamına gelir. Bu vesileyle, sağlıklı kök sistemleri sunmak için toprak sökümünden önce yağlı tohum kolza bitkilerinin bir resmi sağlanır. Yıkandıktan sonra, kökün sadece hipokotil ve üst kısmı toplanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Genel iş akışı. Yıkanmış Arabidopsis kök sistemleri (A) disseke edilmiş, (B) sabit, (C) agaroz gömülü, (D) monte edilmiş ve (E) vibratom üzerine kesitlidir. Elde edilen nesneler doku temizliğine tabi tutulur (doku tipine ve kalınlığına bağlı olarak karanlıkta RT'de 3 gün ila birkaç hafta). (F) Temizlenen nesneler daha sonra mikroskop altında boyanabilir ve incelenebilir. (G) İş akışının özeti. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
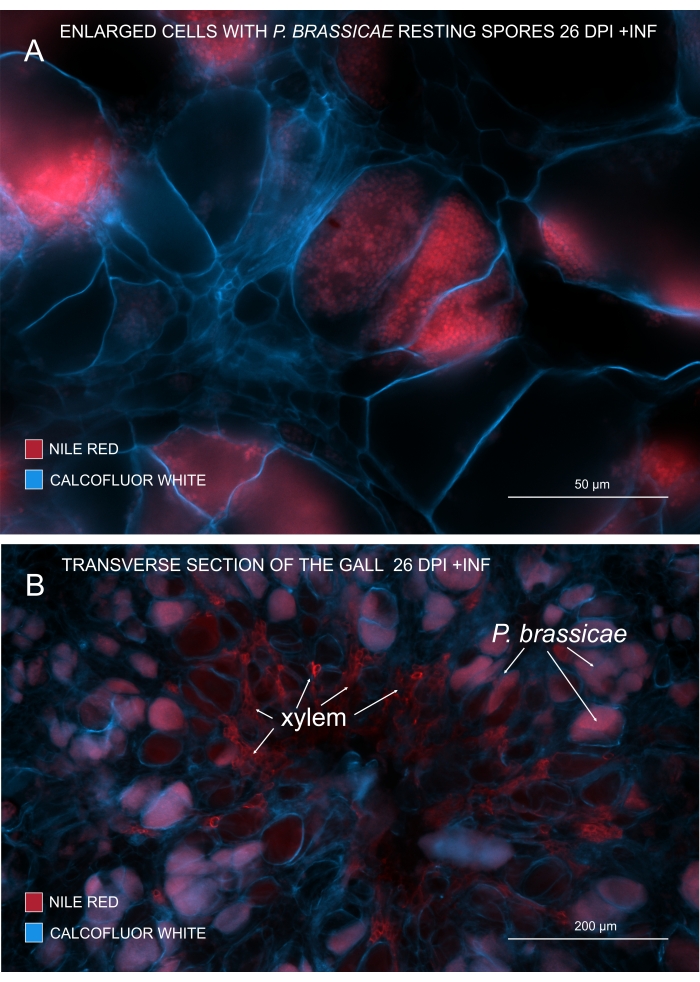
Şekil 3: Patojen sporların Nil Kırmızısı lekesi ile işaretlenmesi. (A,B) Nil Kırmızısı, dinlenme sporlarındaki lipitleri boyar, bu da P. brassicae olgunlaşmasını izlemek için mükemmel çalışır. (A) P. BRASSICAE tarafından kolonize edilen ve patojen sporlarla doldurulmuş genişlemiş hücreler. (B) Olgun ksilem hücreleri de Nil Kırmızısı tarafından lekelenir. Bölüm, konakçı hücrelerin harcamalarını görmek için Calcofluor beyazı ile karşı boyanmıştır (A: Objektif lens = 20x ve kesit kalınlığı = 60 μm; B: Objektif lens = 5x ve kesit kalınlığı = 60 μm). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
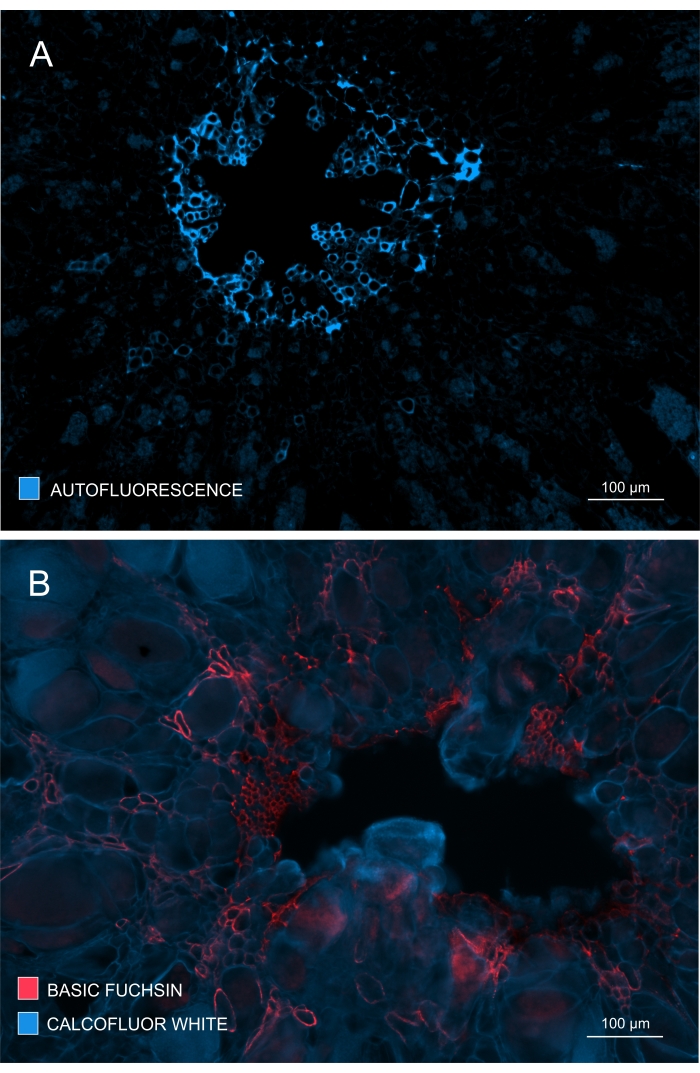
Şekil 4: Ksilem gelişiminin ve olgunlaşmasının kapsamının izlenmesi. (A) Lignin, UV ile uyarılması üzerine güçlü otofloresan verir; bu nedenle, olgun ksilem nispeten kolay bir şekilde ayırt edilebilir. (B) Temel Fuchsin ve Calcofluor ile çift boyama daha iyi sonuçlar verir, çünkü tüm hücreler ikinci boya ile boyanırken, olgun ksilem Temel Fuchsin ile belirgin bir şekilde boyanır. Bu şekilde, çift boyama, ksilogenezin gözle görülür şekilde inhibisyonunu gösteren gelişmiş kontrasta sahip görüntüler sağlar (A: Objektif lens = 10x ve kesit kalınlığı = 60 μm; B: Objektif lens = 10x ve kesit kalınlığı = 60 μm). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
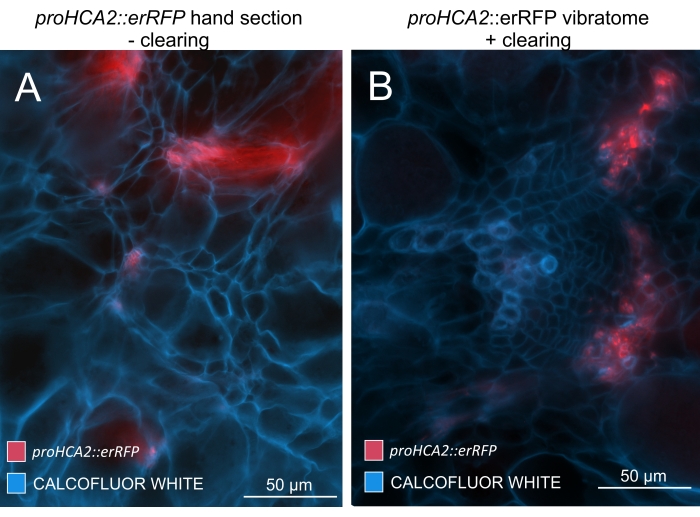
Şekil 5: 21 DPI'da P. brassicae ile enfekte olmuş bitkilerin hipokotillerinde HCA2 geni için Phloem'e özgü sinyal. Transgenik Arabidopsis thaliana'yı barındıran proHCA2::erRFP için promotör aktivite (A) ve (B)'de görülebilir. Özellikle düzensiz el bölümlerinde, üst üste binme ve üst üste binen hücre katmanları nedeniyle erRFP sinyalinin dağınık göründüğü (A) panelindeki temizlenmemiş bir el bölümü arasında farklılıklar gözlemlenebilir. Öte yandan, (B), erRFP sinyalinin olgun bir vasküler demetteki floem hücrelerini tam olarak işaretlediği doku temizleme sonrası bir vibratom bölümünü gösterir (Objektif lens = 20x ve kesit kalınlığı = 60 μm). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
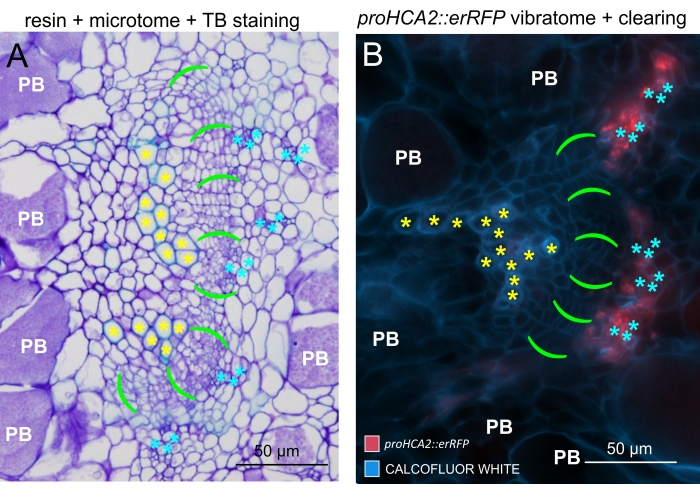
Şekil 6: Floresan yardımıyla TB, reçine gömülü ve mikrotom kesitli safra kesitleri arasındaki karşılaştırma. (A) Toluidin Mavisi (TB), reçine gömülü ve mikrotom kesitli safraların görüntüleri ile (B) floresan yardımıyla elde edilen temsili bir nesne (Şekil 5B'de de sunulmuştur) arasındaki karşılaştırma. Ksilem hücreleri sarı yıldızlarla, canlı yeşil parantezli kambiyal alanla, camgöbeği yıldızlarıyla floem ve beyaz PB sembolüne sahip Plasmodiophora brassicae-kolonize hücrelerle etiketlenir. Reçineye gömülü bölümler (A), hipertrofik organlarda dinlenme sporlarının dağılımını, hastalığın ilerleme derecesini ve dirençli bitkilerde lokal linyifikasyon gibi diğer süreçleri incelemek için iyi bir çözünürlük sağlar. Bununla birlikte, burada açıklanan protokol (B), gen ekspresyonunun veya protein birikiminin hassas bir şekilde gözlemlenmesini ve diğer fizyolojik değişikliklerin ve lipitler (sporlarda) gibi önemli moleküllerin görselleştirilmesini sağlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
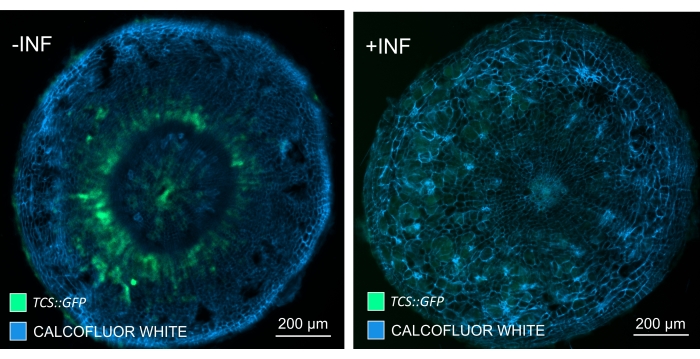
Şekil 7: Enfekte olmayan (-INF) ve P. brassicae ile enfekte (+INF) Arabidopsis bitkilerinin hipokotillerinde sitokinin sinyal yanıtlarının 16 DPI'da izlenmesi. TCS::GFP belirteci planta sitokinin yanıtlarında karakterizasyon için kullanıldı. Vibratom kesitleri temizleme işlemine tabi tutuldu, ardından Calcofluor beyazı ile boyandı. Görüntüye dayanarak, 16 DPI'da, sitokinin yanıtları enfekte safra keselerinde (sağ panel) büyük ölçüde azalırken, özellikle floem havuzunda (sonunda floem dokusunu oluşturmak için farklılaşacak hücreler), enfekte olmayan bitkilerde (sol panel) (Objektif lens = 5x ve kalınlık = 30 μm) güçlü kalmaktadır. Bazı ksilem otofloresan seviyeleri de görülebilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Temizleme Çözeltisi (toksik) | ||
| Bileşen | Yüzde (%) | 100 mL damıtılmış suda |
| Xylitol | 10% | 10gr |
| Sodyum Deoksikolat | 15% | 15gr |
| Üre | 25% | 25gr |
| 10x PBS (Fosfat tamponlu salin) | 1x PBS (100 mL) | |
| Arjantin | 8 gr | 10 mL 10x PBS + 90 mL damıtılmış su |
| Kartal | 0.2 gr | |
| KH2PO4 | 0.24 gr | |
| Na2HPO4 · 2H2O | 1.81 gr | |
| damıtılmış su | 100 mL | |
| Ph | HCl kullanılarak 7,4'e ayarlanan pH | |
| Otoklav yapın ve 4 °C'de saklayın. | ||
Tablo 1: Temizleme çözeltisi ve Fosfat tamponlu salin (PBS) bileşimi.
| Floresan boyası/ Etiketi | Uyarma/Emisyon Dalga Boyları | Kullanılan mikroskop filtre seti |
| Nil Kırmızısı | 553/636 mil | filtre seti 43 |
| Ksilem Otofloresan | 380/475 mil | filtre seti 49 |
| Calcofluor Beyazı | 405/475 mil | filtre seti 49 |
| Temel Fuchsin | 561/650 mil | filtre seti 43 |
| erRFP | 585/608 mil | filtre seti 43 |
| cesaret | 488/509 mil | filtre seti 38 |
Tablo 2: Bu çalışma için seçilen uyarma/emisyon spektrumları.
Tartışmalar
Temizleme çözeltisini safra kesiklerinin vibratom kesilmiş bölümlerine uygulamak, P. brassicae ve konakçı bitki arasındaki biyotrofik etkileşimi inceleme yeteneğini kesinlikle arttırır. Takas protokolü el bölümleri için bile geçerli olsa da, vibratom bölümleri ile daha iyi çalışır. PFA fiksatif numunelerin sabitlenmesi, protokolde kritik bir adım görevi görür, çünkü numuneler daha sonra kesitlemeye devam etmeden önce birkaç gün boyunca 4 ° C'de saklanabilir. Bu, fiksasyon sırasında floresan proteinlerinin ekspresyonundan ve korunmasından ödün vermeden numuneleri sınırlı bir süre saklamak için esneklik sağlar.
Nil Kırmızısı (DMSO veya metanol olarak), reçineyi çözen ve reçineye gömülü bölümleri yok eden hidrofobikliği nedeniyle reçine bölümleriyle uyumlu değildir17. Bu nedenle, vibratom bölümleri, Nil Kırmızısı boyamasının kolayca kullanılabileceği gelişmekte olan safralar içindeki patojen dağılımını ve yaşam döngüsünü incelemek için etkili olduğunu kanıtlamaktadır.
Bu protokolde kullanılan temizleme çözeltisi çok yönlü12'dir ve hücre duvarlarının çeşitli biyomoleküllerini / bileşenlerini (mantar etkileşimlerinde suberin, lignin, selüloz ve kitin) boyamak için farklı kombinasyonlarda çeşitli floresan lekelerinin kullanılmasına izin verir. Floresan GFP belirteç çizgilerinin kesitlerini karşı boyamak ve böylece promotör aktivitesini veya protein birikim paternini, safra kesesinin belirli hücrelerinde veya bölgelerinde patojenin varlığı ile ilişkilendirmek de mümkündür. Bununla birlikte, ksilem ve patojen dolu dev hücrelerden arka plan otofloresansı, temizleme protokolünden sonra bile elimine edilemedi. Bu, safra oluşumunun sonraki aşamalarında, özellikle bir epifloresan mikroskobu kullanırken ve zayıf sinyalleri görüntülerken, floresan belirteçlere bakmak için bir sınırlama sunar.
Floresan sinyallerin düşük ekspresyon/birikim seviyeleri nedeniyle, transkripsiyon faktörlerinin tespit edilmesi zordur, ancak bu teknikle onlar için tatmin edici görüntüler elde etmek mümkündür. Genel olarak, vibratom kesitini doku temizleme yaklaşımıyla birleştirmek, karmaşık safra dokularının histolojik gözlemleri için araç setini genişletir. Bu protokolün esnekliği, doku fiksasyonu sürecini kolaylaştırır ve floresan proteinleri ve promotör aktivitelerini gözlemlemek için taze doku örneklerinin kesilmesi ve görüntülenmesi için gereken süreyi azaltır. Daha fazla iyileştirme ve çeşitli biyomoleküllere özgü diğer floresan boyaları kullanarak, bu yöntem histolojik çalışmalarda ve karmaşık doku organizasyonuna sahip yoğun, opak dokuların görüntü analizinde daha büyük ilerlemelere işaret edecektir. Son zamanlarda, sunulan doku temizleme yöntemi, farklı floresan sinyallerinin11,12,13 eşzamanlı olarak elde edilmesini sağlamak ve birleştirmek için popüler ve yaygın olarak kullanılan bir protokol olarak ortaya çıkmıştır. Bu tür tekniklerdeki gelecekteki gelişmeler ve modifikasyonlar, bitki-patojen etkileşimlerini hücresel düzeyde gözlemlemek için görüntü çözünürlüğünü büyük ölçüde artıracaktır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Çalışma, Polonya Ulusal Bilim Merkezi OPUS17 hibe No. 2019/33/B/NZ9/00751 " Plasmodiophora brassicae Tarafından Enfekte Edilen Bitkilerde Uzun Mesafeli Vasküler Koordinasyon" tarafından desteklenmiştir. Prof. Yrjö Helariutta'ya (Sainsbury Laboratuvarı, Cambridge Üniversitesi) proHCA2::erRFP hattını paylaştığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2N Sulfuric acid (H2SO4) | Roth | UN2796 | pH adjustment |
| Agarose | PRONA | BGQT100 | Embedding |
| Basic Fuchsin | BIOSHOP | BSF410.5 | Fluorescent dye |
| Calcofluor White | Sigma Aldrich | 18909-100ML-F | Fluorescent dye |
| Commercial Bleach | Domestos | ||
| Cyanoacrylate/ Instant glue | Kropelka | Adhesive | |
| Dimethyl Sulfoxide (DMSO) | BIOSHOP | DMS555.500 | Solvent |
| Epifluorescence microscope | Carl Zeiss M2 automated epifluorescence microscope with Colibri LED system | Carl Zeiss M2 | Carl Zeiss Filter Set filter set 38, 43, 49 used |
| Fully automated Vibratome | Leica | VT1200 S | |
| Lightmeter /Photometer | LI-COR Biosciences | LI-250A + LI-190R quantum sensor | For measuring light intensity within the 400-700nm (PAR) waveband |
| Masking tape | For sticking agarose block on mould | ||
| Murashige & Skoog Medium (MS Medium) | Duchefa Biochemie | MO222.0050 | Plant Growth Medium |
| Nile Red | Sigma Aldrich | N3013-100MG | Fluorescent dye |
| Paraformaldehyde PFA | Sigma Aldrich | 158127-100G | Fixative |
| Potassium Chloride (KCl) | POCH | 739740114 | PBS component |
| Potassium Hydroxide (KOH) | Sigma Aldrich | P1767-250G | pH adjustment |
| Potassium Phosphate Monobasic (KH2PO4) | BIOSHOP | PPM302.500 | PBS component |
| Sodium chloride (NaCl) | BIOSHOP | SOD001.1 | PBS component |
| Sodium Deoxycholate | Sigma Aldrich | D6750-25G | Clearing Solution |
| Sodium Phosphate Dibasic (Na2HPO4 · 2H2O) | POCH | 799490116 | PBS component |
| Triton X-100 | BIOSHOP | TRX506.100 | Fixative |
| Urea | Sigma Aldrich | U5378-100G | Clearing Solution |
| Vacuum/Pressure pump and Dessicator | Welch by Gardner Denver | 2522C-02 | For Vacuum Infilteration |
| Xylitol | Sigma Aldrich | X3375-25G | Clearing Solution (componenet) |
Referanslar
- Harris, M. O., Pitzschke, A. Plants make galls to accommodate foreigners: Some are friends, most are foes. New Phytologist. 225 (5), 1852-1872 (2020).
- Peng, G., et al. Crop rotation, cultivar resistance, and fungicides/biofungicides for managing clubroot (Plasmodiophora brassicae) on canola. Canadian Journal of Plant Pathology. 36 (1), 99-112 (2014).
- Siemens, J., Nagel, M., Ludwig-Müller, J., Sacristán, M. D. The interaction of Plasmodiophora brassicae and Arabidopsis thaliana: Parameters for disease quantification and screening of mutant lines. Journal of Phytopathology. 150 (11-12), 592-605 (2002).
- Malinowski, R., Smith, J. A., Fleming, A. J., Scholes, J. D., Rolfe, S. A. Gall formation in clubroot-infected Arabidopsis results from an increase in existing meristematic activities of the host but is not essential for the completion of the pathogen life cycle. The Plant Journal. 71 (2), 226-238 (2012).
- Walerowski, P., et al. Clubroot disease stimulates early steps of phloem differentiation and recruits SWEET sucrose transporters within developing galls. The Plant Cell. 30 (12), 3058-3073 (2018).
- Olszak, M., et al. Transcriptional profiling identifies critical steps of cell cycle reprogramming necessary for Plasmodiophora brassicae-driven gall formation in Arabidopsis. Plant Journal. 97 (4), 715-729 (2019).
- Malinowski, R., Truman, W., Blicharz, S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen-oriented physiological sink. Molecular Plant-Microbe Interactions. 32 (10), 1259-1266 (2019).
- Bi, K., et al. Integrated omics study of lipid droplets from Plasmodiophora brassicae. Scientific Reports. 6, 36965 (2016).
- Schuller, A., Ludwig-Müller, J. Histological methods to detect the clubroot pathogen Plasmodiophora brassicae during its complex life cycle. Plant Pathology. 65 (8), 1223-1237 (2016).
- Badstöber, J., Gachon, C. M. M., Ludwig-Müller, J., Sandbichler, A. M., Neuhauser, S. Demystifying biotrophs: FISHing for mRNAs to decipher plant and algal pathogen-host interaction at the single cell level. Scientific Reports. 10, 14269 (2020).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Sexauer, M., Shen, D., Schön, M., Andersen, T. G., Markmann, K. Visualizing polymeric components that define distinct root barriers across plant lineages. Development. 148 (23), (2021).
- Fuchs, H., Sacristan, M. Identification of a gene in Arabidopsis thaliana controlling resistance to clubroot (Plasmodiophora brassicae) and characterization of the resistance response. Molecular Plant-Microbe Interactions. 9 (2), 91-97 (1996).
- Guo, Y., Qin, G., Gu, H., Qu, L. -JDof56HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis. The Plant Cell. 21 (11), 3518-3534 (2009).
- Liu, J., Müller, B., Kleine-Vehn, J., Sauer, M. Imaging TCSn::GFP, a Synthetic Cytokinin Reporter, in Arabidopsis thaliana. Plant Hormones: Methods and Protocols. , 81-90 (2017).
- Suzuki, M., Shinohara, Y., Fujimoto, T., Taatjes, D. J., Roth, J. Histochemical Detection of Lipid Droplets in Cultured Cells. Cell Imaging Techniques: Methods and Protocols. , 483-491 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır