Method Article
מיקרוקוסמוסים של קומפוסט כסביבות טבעיות מגוונות מיקרוביאלית לחקר המיקרוביום ב-Caenorhabditis elegans
In This Article
Summary
מיקרוקוסמוסים של קומפוסט מביאים את המגוון המיקרוביאלי שנמצא בטבע למעבדה כדי להקל על מחקר המיקרוביום ב-Caenorhabditis elegans. מובאים כאן פרוטוקולים להקמת ניסויי מיקרוקוסמוס, כאשר הניסויים מדגימים את היכולת לווסת את המגוון המיקרוביאלי הסביבתי כדי לחקור את הקשרים בין המגוון המיקרוביאלי הסביבתי לבין הרכב המיקרוביום של מעי התולעים.
Abstract
הנמטודה Caenorhabditis elegans מתגלה כמודל שימושי לחקר המנגנונים המולקולריים העומדים בבסיס יחסי הגומלין בין פונדקאים לבין המיקרוביום של המעיים שלהם. בעוד שניסויים עם חיידקים מאופיינים היטב או קהילות חיידקים מוגדרות יכולים להקל על ניתוח מנגנונים מולקולריים, חקר נמטודות בהקשר המיקרוביאלי הטבעי שלהן חיוני לחקר המגוון של מנגנונים כאלה. יחד עם זאת, בידוד התולעים מהטבע אינו תמיד אפשרי, וגם כאשר הדבר אפשרי, דגימה מהטבע מגבילה את השימוש בארגז הכלים הגנטי הזמין אחרת למחקר C. elegans. הפרוטוקול הבא מתאר שיטה למחקרי מיקרוביום המשתמשת במיקרוקוסמוס קומפוסט לגידול במעבדה בסביבות מיקרוביאליות מגוונות וטבעיות.
ניתן להעשיר אדמה מקומית בתוצרת חקלאית כדי לגוון את הקהילות המיקרוביאליות שבהן מגדלים תולעים ומהן הן נקטפות, נשטפות ומעוקרות על פני השטח לצורך ניתוחים עתידיים. ניסויים מייצגים מדגימים את היכולת לווסת את הקהילה המיקרוביאלית בקרקע משותפת על ידי העשרתה בתוצרת שונה, ומראים עוד יותר כי תולעים שגדלו בסביבות מובחנות אלה מרכיבות מיקרוביום מעיים דומה הנבדל מסביבותיהן השונות, מה שתומך ברעיון של מיקרוביום מעי מרכזי ספציפי למין. באופן כללי, מיקרוקוסמוסים של קומפוסט מספקים סביבות מעבדה טבעיות למחקר מיקרוביום כחלופה לקהילות מיקרוביאליות סינתטיות או לבידוד של נמטודות בר.
Introduction
הנמטודה Caenorhabditis elegans מתגלה כמודל שימושי לחקר אינטראקציות בין פונדקאים למיקרוביום המעייםשלהם 1,2. כמודל, הוא מציע מספר יתרונות. ראשית, קל להשיג ולתחזק בעלי חיים נטולי חיידקים או גנוטוביוטיים; ניתן להשתמש באקונומיקה כדי להרוג תולעים גרבידיות ומיקרואורגניזמים קשורים, ולהשאיר את הביצים העמידות לאקונומיקה שלהם ללא פגע כדי לגדול כאוכלוסיות מסונכרנות גיל שיכולות להיות מיושבות על ידי חיידקים בעלי עניין 3,4. בנוסף, כאשר גדל בנוכחות חיידקים, C. elegans, חיידק, לבלוע את החיידקים נתקל, עם מינים רגישים מתעכלים או מופרשים, בעוד מינים עמידים ומתמשכים ביציבות ליישב את המעיים תולעת. יתר על כן, C. elegans הם בעיקר הרמפרודיטיים, ומייצרים אוכלוסיות של צאצאים זהים גנטית, מה שמפחית את השונות הגנטית המבלבלת. יחד עם הזמינות של זני תולעים מוטנטיים ומהונדסים, העבודה עם C. elegans מציעה לחוקרים מודל גנוטוביוטי וניתן למתיחה גנטית כדי לחקור את היסודות המולקולריים של אינטראקציות בין חיידקים מארחים 5,6,7,8.
בעוד שניסויים עם חיידקים מאופיינים היטב יכולים להקל על ניתוח מנגנונים מולקולריים, זיהוי ולימוד החיידקים שהתולעים מתקשרות איתם בטבע חיוניים לחקר המגוון של מנגנונים כאלה, לחשיפת ההקשר הטבעי לתפקודם ולהבנת הכוחות הסלקטיביים שעיצבו את האבולוציה שלהם. מחוץ למעבדה, C. elegans נמצא ברחבי העולם באקלים ממוזג ולח, שבו אוכלוסיות נחשבות לעבור מחזור חיים "בום וחזה", המאופיין בגידול מהיר באוכלוסייה כאשר המשאבים שופעים, ולאחר מכן במעבר התפתחותי לדאוארים חלוציים וסובלניים ללחץ כאשר המשאבים מתרוקנים9. אף על פי שהן נחשבות לנמטודת אדמה, אוכלוסיות C. elegans המתרבות בטבע נמצאות לרוב ניזונות מחומרים אורגניים מתפרקים כגון פרחים נרקבים או פירות, שבהם אוכלוסיות החיידקים שופעות ומגוונות.
מחקרים על מיקרוביום המעי בנמטודות שבודדו מהטבע זיהו קהילות חיידקים מגוונות, אך אופייניות, 10,11, שהרכבן נתמך עוד יותר על ידי מחקרים שבוצעו עם תולעים שגודלו בסביבות מיקרוקוסמוס טבעיות 12,13. יחד, מחקרים כאלה אפשרו תיחום של מיקרוביום מעי תולעת ליבה2. בעוד שהדגימה של אוכלוסיות C. elegans בטבע מייצגת את הבדיקה הישירה ביותר של אינטראקציות טבעיות בין תולעים למיקרובים, היא אינה אפשרית בכל מקום ובכל זמן, מכיוון שהיא מוגבלת לאזורים ועונות עם משקעיםרבים 10,11. לחלופין, במקום לבודד את התולעים מבית הגידול הטבעי שלהן, ניסויים באמצעות מיקרוקוסמוס מביאים את בית הגידול הטבעי למעבדה 6,8,12,13,14,15. סביבות מיקרוקוסמוס מוכנות מאדמה המורכבת מפירות או ירקות שונים, מה שמאפשר גיוון נוסף של קהילת הקרקע ההתחלתית. הם מציעים שיטות ניסיוניות הניתנות למתיחה המשלבות את המגוון המיקרוביאלי ואת סביבת הקרקע הפראית התלת-ממדית עם היתרונות הניסיוניים של מתקן מעבדה מבוקר וזני תולעים מוגדרים גנטית. הפרוטוקול שלהלן מפרט את השלבים הכרוכים בעבודה עם מיקרוקוסמוסים של קומפוסט, ומדגים את השימוש בהם בהבנת ההרכבה של מיקרוביום מעיים אופייני של תולעים מסביבות מגוונות.
Protocol
1. הכנת קומפוסט
- השיגו קומפוסט או אדמת גינה מכל מקור נוח ואחסנו בתוך המעבדה מיכל פלסטיק סטנדרטי למטבח עם חורים שנחתכו במכסה כדי להכניס אוויר. סתמו את החורים עם צמר גפן כדי להרחיק זבובי פירות וחסרי חוליות אחרים (איור 1A).
הערה: חמש מאות גרם אדמה (מתאים למיכל של 1.5 גלון, מידות: 30 ס"מ x 20 ס"מ x 10 ס"מ) יספק מספיק חומר עבור 12 מיקרוקוסמוס. - להעשיר את הקומפוסט או האדמה בתוצרת קצוצה או בתערובת של תוצרת שונה ביחס מסה של 1:2 בין התוצרת לאדמה.
- דגירה במשך 7-14 ימים ב 20-25 מעלות צלזיוס, ערבוב פעם ביום והוספת M9 בינוני לפי הצורך כדי לשמור על לחות מבלי להפוך אותו בוצי.
הערה: קרקעות שאינן מועשרות בתוצרת בדרך כלל אינן תומכות בצמיחת C. elegans , אך התוצרת הספציפית שיש להשתמש בה תלויה בחוקר, עם סוגים ותערובות רבות המסוגלות לתמוך בצמיחת תולעים. העשרה בתוצרת שונה תקדם גיוון של קהילת החיידקים בדרכים שונות, ותאפשר לחקור את הרכב המיקרוביום של המעיים מנקודות התחלה שונות (ראו פרק הדיון).
2. הכנת מיקרוקוסמוס קומפוסט
- עבור כל מיקרוקוסמוס, הוסיפו 10 גרם של קומפוסט מועשר לכוס זכוכית בגודל 30 מ"ל המכוסה בנייר כסף ובאוטוקלאב (איור 1B).
- כדי להכין תמצית מיקרוביאלית לחידוש הקומפוסט האוטומטי, התחל על ידי הוספת 30 גרם של אותו קומפוסט המשמש בשלב 2.1 לכל אחד משלושה צינורות 50 מ"ל ומלא עם M9. מערבולת במשך דקה אחת (איור 1C).
הערה: זה אמור לספק מספיק חיידקים לתשעה מיקרוקוסמוסים, שכל אחד מהם תומך בהתפתחות של מאות נמטודות. - צנטריפוגה את הצינורות ב 560 × גרם במשך 5 דקות בטמפרטורת החדר (RT).
- לשים לב לא להפריע גלולה, להסיר את supernatants עם פיפטה סרולוגית ולשלב צינור חדש 50 מ"ל.
- רכז את תמצית החיידקים על ידי צנטריפוגה במהירות מקסימלית (2,000 × גרם) למשך 15 דקות ב-RT. השהה את הכדורים במספיק M9 כדי לקבל 200 μL עבור כל מיקרוקוסמוס ו-200 μL נוספים כדי להוסיף לצלחת שתשמש פרוקסי גלוי של התפתחות תולעים בתוך מיקרוקוסמוס.
הערה: לדוגמה, עבור תשעה מיקרוקוסמוסים, יש לתלות מחדש את הכדור המיקרוביאלי ב-2 מ"ל של M9. - הוסף 200 μL של תמצית מיקרוביאלית מרוכזת לכל של קומפוסט autoclaved, כמו גם לצלחת NGM שתשמש כצלחת הפרוקסי הנראית לעין.
- דגירה מיקרוקוסמוס וצלחת פרוקסי במשך 24 שעות ב 20-25 מעלות צלזיוס לפני תוספת של תולעים.
3. גידול תולעים במיקרוקוסמוס קומפוסט
- הוסיפו 500-1000 ביצים או זחלי L13 לכל מיקרוקוסמוס וללוחית הפרוקסי (שלב 2.7) כדי להתחיל בניסוי (איור 1D).
הערה: הניסויים המתוארים כאן משתמשים בתולעים מסוג N2. עם זאת, ניתן להשתמש בזני C. elegans אחרים (ואולי גם בנמטודות אחרות). - להעלות את התולעים לבגרות ב 20 מעלות צלזיוס (בדרך כלל 3 ימים).
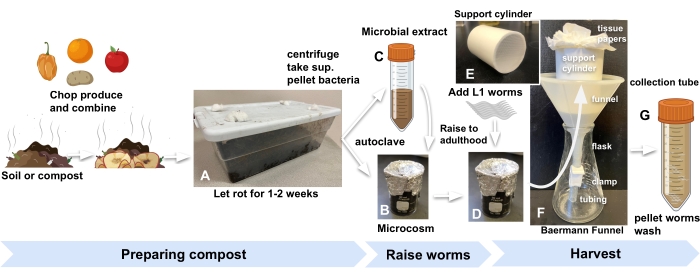
איור 1: הכנת מיקרוקוסמוס קומפוסט, גידול תולעים וקציר . (A) להעשיר את האדמה המקומית או הקומפוסט בתוצרת חקלאית ולדגור במשך שבועיים. שלבו (B) אדמה מועשרת אוטומטית עם (C) תמצית מיקרוביאלית ו-(D) דגירה במשך 24 שעות לפחות לפני הוספת תולעי L1s מסונכרנות למיקרוקוסמוס כדי להתחיל בניסוי. (ה, ו) כאשר הוא מוכן לקטיף, הוסיפו קומפוסט מהמיקרוקוסמוס לתוך גליל תמיכה במשפך בארמן וכסו ב-M9. (G) לאחר 15 דקות, שחררו את התסנין לצינור של 50 מ"ל. קיצור: sup. = supernatant. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. הכנת משפך בארמן לקציר תולעים
- הרכיבו משפך בארמן על ידי חיבור 5-8 ס"מ של צינורות גומי קשיחים לקצה משפך פלסטיק.
- החליקו מהדק על הצינור וסגרו אותו.
- הניחו במשפך צינור PVC גלילי באורך 7 ס"מ ובקוטר 5 ס"מ, עם רשת ניילון בקוטר 1 מ"מ המודבקת בתחתיתו (איור 1E). מרפדים את הגליל בשני גיליונות נייר טישו.
- הכניסו את משפך בארמן לתוך בקבוקון (איור 1F).
5. קצירת תולעים ממיקרוקוסמוס ואיסוף דגימות הקרקע המתאימות
- הוסיפו 20 מ"ל של M9 למיקרוקוסמוס שבו גידלו את התולעים, התסיסו את התערובת, ואז שפכו את התערובת מהכוס לתוך הגליל המרופד בנייר טישו במערך המשפך של Baermann. הוסיפו עוד M9 כדי להטביע לחלוטין את הקומפוסט במשפך.
הערה: אוכלוסיות C. elegans (N2) מגיעות לבגרות במיקרוקוסמוס קומפוסט בקצב דומה לזה שבצלחות אגר סטנדרטיות שנזרעו עם Escherichia coli. לקבלת דיוק נוסף בקצירת תולעים בשלב התפתחותי מסוים, עיין בלוח הפרוקסי משלב 3.3. - לאחר 30 דקות, שחררו את המהדק כדי לשחרר את התסנין המכיל את התולעים שנקטפו לתוך צינור של 50 מ"ל (איור 1G).
- מוסיפים עוד M9 לצילינדר וחוזרים על הפעולה לסיבוב שני כדי לקצור עוד תולעים, ופעם נוספת אם יש צורך בתולעים נוספות.
הערה: כשאתם חוזרים על סבבי קציר, היזהרו שלא לפגוע בשלמות נייר הטישו, מה שעלול לאפשר לחלקיקי אדמה לעבור דרכו. ארבעה סיבובי קציר לכל היותר צריכים לבודד לפחות 50% מהתולעים שנוספו במקור למיקרוקוסמוס מבלי לפגוע בשלמות נייר הטישו. - רכז את התולעים על ידי צנטריפוגה ב-560 × גרם למשך 2 דקות (RT). הסר 35 מ"ל של supernatant עם פיפטה סרולוגית.
- מעבירים את 15 המ"ל הנותרים לצינור של 15 מ"ל וצנטריפוגות שוב ב-560 × גרם למשך דקה אחת כדי לרכז עוד יותר את התולעים. הסר 14 מ"ל של supernatant עם פיפטה סרולוגית.
- במקביל, לאסוף 1 גרם של אדמת מיקרוקוסמוס הנותרים לתוך צינור 1.5 מ"ל. לעבד את דגימות הקרקע המכילות את קהילת החיידקים הסביבתית באופן מיידי או לאחסן אותן בטמפרטורה של −20 מעלות צלזיוס למיצוי מאוחר יותר של חומצות גרעין, כמתואר להלן עבור דגימות תולעים.
6. שטיפה ועיקור פני השטח של תולעים שנקטפו
- העבר 1 מ"ל של התולעים המרוכזות שנקטפו משלב 5.5 לצינור של 1.5 מ"ל באמצעות פיפטה זכוכית. דגירה במשך 2 דקות כדי לאפשר לתולעים להתיישב בתחתית הצינור. הסר את הסופרנטנט, והשאר את החלק התחתון של 100 μL ללא הפרעה.
- יש לשטוף 6x עם 1.5 מ"ל של M9+T (0.025% טריטון-X ב-M9), מה שמאפשר לתולעים להתיישב בתחתית בכל פעם.
- העבירו את התולעים השטופות בנפח של 100 μL לצינור חדש של 1.5 מ"ל באמצעות פיפטה מזכוכית.
הערה: בשלב זה בפרוטוקול, בערך 30 דקות היו אמורות לחלוף מאז הכביסה הראשונה (שלב 6.2). מתן אפשרות לתולעים להישאר ללא מזון לפחות 1 שעה לפני תוספת של levamisole מומלץ לאפשר הפרשת חיידקים חולפים ועיכול מלא של חיידקי מזון. - יש להוסיף 100 μL של 25 mM לבאמיזול הידרוכלוריד כדי לשתק את התולעים. דגירה במשך 5 דקות ב- RT.
- יש להוסיף 200 מיקרון ליטר של תמיסת אקונומיקה 4%. לדגור במשך 2 דקות.
- הסר את הסופרנטנט, השאר את ה-150 μL התחתונים ביותר ללא הפרעה, ושטוף פי 3 עם M9+T, כנ"ל.
הערה: כדי למזער את זיהום הדגימות, מומלץ להשתמש ב-M9+T מסונן (דרך מסנן של 0.2 מיקרומטר) וללבוש כפפות מנקודה זו ואילך. - לאחר הכביסה, יש ליטול 50 מיקרו-ליטר מתוך 150 המיקרו-ליטר הנותרים מהשטיפה האחרונה ולצלחת על צלחת LB, תוך דגירה בטמפרטורה של 25 מעלות צלזיוס למשך 48 שעות כדי לאשר הסרה יעילה של חיידקים חיצוניים.
הערה: התבוננות בעד 30 מושבות בשטיפה האחרונה (המייצגות 60 תאי חיידקים חיצוניים בסך הכל שנותרו בדגימה) מותרת וצפויה להיות תרומה שולית בלבד להרכב המיקרוביום המנותח, בהתחשב באלפי החיידקים שבדרך כלל מאכלסים כל תולעת בוגרת15. כאשר נצפים יותר, שלמות המדגם עלולה להיפגע. - השתמש בתולעים המעוקרות על פני השטח באופן מיידי (למשל, כדי לחלץ חיידקים חיים להתרבות [ספירת CFU]) או אחסן בטמפרטורה של 20 מעלות צלזיוס למיצוי הבא של חומצות גרעין.
7. מיצוי דנ"א
הערה: השלבים הבאים מתארים מיצוי דנ"א של התולעים שנקטפו באמצעות ערכה מסחרית המיועדת להפקת דנ"א מיקרוביאלי מהאדמה (ראה טבלת חומרים), עם שינויים המתוארים להלן כדי להקל על מיצוי דנ"א מיקרוביאלי מתולעים.
- מעבירים את הדגימה המכילה תולעים מעוקרות על פני השטח (מפשרות ב-RT במידת הצורך) לצינורות המסופקים על ידי הערכה, ומחליפה את חרוזי הזכוכית המסופקים בחרוזי זירקוניה בקוטר של כ-30-50 מ"מ (ראו טבלת חומרים).
הערה: תשואות הדנ"א שנצפו גבוהות יותר עם חרוזי זירקוניה מאשר עם חרוזי הזכוכית שמספקת הערכה. למרות שהסיבה מאחורי תצפית זו עדיין לא נקבעה, חרוזי זירקוניה עשויים לשבור את הקוטיקולה של הנמטודה בצורה יעילה יותר, ולשחרר יותר חיידקים. - עבור דגימות קומפוסט, יש להוסיף כ-250 מ"ג מהאדמה שנאספה לצינורות הערכה מבלי להחליף את חרוזי הזכוכית.
- לאחר הוספת תמיסת החיץ שמספקת הערכה לכל הדגימות, הומוגניות עם הומוגנייזר כוח ב-RT (ראו טבלת חומרים) לשני סיבובים של 2,000 סל"ד למשך 30 שניות כל אחד, תוך השהיה במשך 30 שניות בין לבין.
- השלם את שלבי טיהור הדנ"א הנותרים בהתאם לפרוטוקול הערכה. שטו את דגימות התולעת בלא יותר מ-50 μL של מאגר אלוציות כדי להבטיח ריכוזי דנ"א גבוהים מספיק לריצוף.
תוצאות
כדי לחקור את היכולת לגוון את קהילת המיקרוקוסמוסים של הקרקע, השווינו את הקהילות המיקרוביאליות במיקרוקוסמוסים של קומפוסט שהוכנו על ידי העשרת אותה אדמה ראשונית, קומפוסט ברמה תעשייתית הזמין מהעיר ברקלי, קליפורניה, עם תוצרת שונה: תפוחים, גמבה, תפוזים או תפוחי אדמה (כל אחד מהם משובץ במשולש). בנוסף, השווינו את הקהילות המיקרוביאליות של כל סביבת קומפוסט עם מיקרוביום המעיים של חיידקי בר מסוג C. elegans שגודלו במיקרוקוסמוס המתאים. הניתוח בוצע באמצעות דגימות דנ"א שחולצו מכ-500 מבוגרים מעוקרים על פני השטח למיקרוקוסמוס ומ-250 מ"ג דגימות קומפוסט של המיקרוקוסמוס בהתאמה.
אפיון המיקרוביום של הקרקע הסביבתית ומעי התולעים הסתמך על ריצוף הדור הבא של אזור ה-V4 של הגן החיידקי 16S rRNA. הכנת ספריית הריצוף הושגה באמצעות הערכות הסטנדרטיות ובוצעה על פי הוראות היצרן, כאשר הריצוף בוצע על גבי רצף מסחרי (ראו טבלת חומרים). רצפים שעברו דה-מולטיפלקס עובדו באמצעות DADA2, טקסונומיה שהוקצתה על בסיס מסד הנתונים של SILVA v132, ונותחו עם phyloseq16,17,18 (ראו קובץ משלים 1, איור משלים S1 , איור משלים S2, איור משלים S3, טבלה משלימה S1 וטבלה משלימה S2 לתיאור מפורט של הרצף והניתוח; הצינור החישובי המלא זמין ב- GitHub [https://github.com/kennytrang/CompostMicrocosms]). נתונים גולמיים זמינים בארכיון קריאת רצף NCBI (מזהה פרויקט ביולוגי PRJNA856419).
בממוצע, התקבלו 73,220 רצפים לכל מדגם. רצפים אלה מייצגים 15,027 גרסאות של רצפי אמפליקון (ASVs), המשתרעים על פני 27 phyla ו-216 משפחות, כולל משפחות הנחשבות לחלק מליבת מיקרוביום המעי C. elegans 13, כגון Rhizobiaceae, Burkholderiaceae ו-Bacillaceae. Enterobacteriaceae, ו- Pseudomonadaceae, שנמצאו בעבר כחברים דומיננטיים, היו מיעוט הפעם, אך עדיין היו מועשרים (פי 2-10) בהשוואה לסביבות הקרקע שלהם. השוואות שהתבססו על מרחקיUniFrac 19,20 לא משוקללים ומשוקללים הראו יכולת שכפול טובה בין מיקרוקוסמוס משולש מועשר באותה תוצרת, כפי שעולה מקיבוץ האותיות. לעומת זאת, מיקרוביום קרקע סביבתי מועשר בתוצרת שונה המקובצת הרחק זה מזה, ומדגים את היכולת לגוון קהילה מיקרוביאלית ראשונית באמצעות תוספת של תוצרת שונה (איור 2).
בהשוואות של מיקרוביום של מעי תולעים וקהילות סביבתיות, ניתוח קואורדינטות ראשי (PCoA) עם מרחקי UniFrac לא משוקללים או משוקללים הראה התקבצות שונה של מיקרוביום של מעי תולעים הרחק מזה של הסביבה המתאימה להן עבור כל סוג מיקרוקוסמוס (איור 2). בעוד ש-PCoA שהתבסס על מרחקי UniFrac שלא נשקלו לא הבחין בין מיקרוביום של אדמה למיקרוביום של תולעים (איור 2A), אשכולות המבוססים על מרחקים משוקללים חשפו הפרדה ברורה בין מיקרוביום של מעי תולעים ומיקרוביום של קומפוסט (איור 2B). תוצאות אלה תומכות בתהליך שבו סינון פונדקאים פועל על בסיס זמינות סביבתית כדי לעצב מיקרוביום מעיים שאינו שונה לחלוטין מהמקור הסביבתי שלו ביחס לנוכחות טקסה, אך מווסת את השפע שלהם על ידי העשרה לתת-קבוצה של הטקסה הזמינה, ובסופו של דבר התוצאה היא מיקרוביום מעיים של תולעים מרכזיות המשותף בין תולעים הגדלות בסביבות שונות.

איור 2: מיקרוביום של מעי תולעים מתרחק מהסביבה המיקרוביאלית המגוונת שלהן. הרכב המיקרוביום נקבע באמצעות ריצוף של 16S, וקהילות ממיקרוקוסמוסים שהועשרו בתוצרת המיועדת או מתולעים שגודלו בהן קובצו באשכולות באמצעות PCoA בהתבסס על (A) מרחקי UniFrac משוקללים או (B) משוקללים. הצירים המוצגים הם אלה המסבירים את השונות הגדולה ביותר בהרכב הקהילה בין דגימות (N = 3 עבור כל סוג מיקרוקוסמוס). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קובץ משלים 1: רצף וניתוח נתונים מהדור הבא. מוצגים כאן השלבים להכנת ספרייה, ריצוף במעבדה וניתוח נתונים. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S1: דוגמה לגרף בקרת איכות עבור קריאה הפוכה מדגימה אחת. ציר ה-X (מחזור) מראה את מיקום הנוקלאוטידים לאורך הרצף. ציר ה-Y השמאלי מציג את ציון האיכות. מפת החום בגווני אפור מייצגת את תדירות ציון האיכות בכל מיקום נוקלאוטיד; הקו הירוק מתאר את ציון האיכות החציוני בכל מיקום נוקלאוטיד; הקו הכתום העליון מתאר את הרבעונים של התפלגות ציוני האיכות; השורה האדומה התחתונה מתארת את אחוז קריאות הרצף שהרחיבו את מיקום הנוקלאוטידים (ציר Y ימני, כאן 100%). אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S2: שיעורי שגיאה עבור דגימות שונות. תדירות השגיאות בדגימות השונות (נקודות שחורות) אמורה לרדת עם הגדלת ציון האיכות עבור כל החלפה אפשרית של זוג בסיסים המתוארת, המשקפת את המגמה הצפויה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S3: דוגמה ל-PCoA המבוססת על מרחקי UniFrac משוקללים. שמות הקבוצות המוצגים במקרא מייצגים את התוצרת המשמשת להעשרת הקומפוסט המשמש במיקרוקוסמוסים השונים. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה S1: סינון רצף רציף. א מספר קריאות הרצף לפני הסינון. b-d כל עמודה מייצגת את מספר קריאות הרצף שנותרו לאחר שלב סינון: סינון קריאות באיכות נמוכה (שלב 2.5), סימון אלגוריתם שבוצע על-ידי dada() (שלב 2.8), מיזוג קריאות קדימה ואחורה (שלב 2.9) והסרת כימרות (שלב 2.11). אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה S2: טבלת מטה-נתונים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקול המוצג כאן מתאר שיטה לחקר מיקרוביום המעי של נמטודות הגדלות בסביבות דמויות טבע, ומציע גישה חלופית לבידוד תולעים מהטבע או לגידולן בקהילות סינתטיות.
אלפי מיני החיידקים הפוטנציאליים שנלכדו בניסוי המיקרוקוסמוס הייצוגי משקפים את המגוון המיקרוביאלי שהתולעים התפתחו איתו ומדגימים את יכולתו של צינור המיקרוקוסמוס לשלב את היתרונות של עבודה עם אורגניזם מארח מודל ואת אלה של עבודה עם קהילות מיקרוביות טבעיות ומגוונות.
התוצאות המייצגות מראות כי העשרת קרקע משותפת בסוגי תוצרת שונים מווסתת את המגוון המיקרוביאלי הסביבתי, ומדגישה את מגוון המגוון המיקרוביאלי הזמין למחקר באמצעות צינור זה. בחירת התוצרת אינה חשובה במיוחד. עבודות קודמות השתמשו בבננות, תפוחים, תפוזים, תותים, עלי תה ירוק ותפוחי אדמה כדי להעשיר את האדמה, וכתוצאה מכך תולעים דומות מעלים יעילות. כמו כן, נעשה שימוש יעיל בתוצרת מעורבת. התכונה העיקרית היא שתוצרת שונה תגוון קרקע נתונה בדרכים שונות.
למרות השונות הרחבה במגוון המיקרוביאלי הסביבתי, המיקרוביום של מעי התולעים משתנה הרבה פחות, מה שמחזיר את החשיבות של נישת מעי התולעת והסינון המארח להרכבת מיקרוביום ליבת המעיים השונה מזה של סביבת הקרקעשלו 13. דפוס זה נצפה בצורה הטובה ביותר עם ניתוח UniFrac PCoA משוקלל, המדגים כי ההבדלים בין המיקרוביום של הקרקע הסביבתית לבין המיקרוביום של מעי התולעים נובעים בעיקר מהבדלים בשפע היחסי של טקסונים מרכזיים.
למרות שהפרוטוקול המתואר כאן מתמקד בקצירת תולעים לריצוף 16S, ניתן להשתמש במיקרוקוסמוס כדי לחקור שאלות מעניינות נוספות. לדוגמה, תולעים שנקטפו ממיקרוקוסמוס יכולות להיבדק לאחר מכן כדי לבדוק את ההשפעה של מיקרוביום מעיים מגוון על עמידות המארח למצבים שליליים שונים, כולל פתוגנים או רעלנים. לחלופין, ניתן לבודד מינים וזני חיידקים חדשים ולתרבת אותם מתולעים שנקטפו באדמה, ובכך להרחיב את המגוון הטקסונומי והתפקודי של חיידקים הזמינים לביצוע ניסויים.
בעוד ששיטות מחקר במסגרות מעבדה מחפשות עקביות ויכולת שחזור, עבודה עם מיקרוקוסמוס מנצלת את השונות הטבעית כדי לחקור אינטראקציות בין מארחים למיקרובים בהקשר דמוי טבע. עם זאת, וריאציה זו מציבה גם כמה אתגרים. קרקעות מסוימות הכוללות רמות גבוהות של חסרי חוליות אנדוגניים עשויות לדרוש צנטריפוגה, סינון ושלבי בדיקה נוספים כדי לסלק ביעילות אורגניזמים לא רצויים מהכנת המיקרוקוסמוס. בנוסף, שפע מיקרוביאלי נמוך בקרקע עלול לגרום להיווצרות דאואר לא רצויה באוכלוסיות תולעים, מה שמחייב עלייה בתמצית המיקרוביאלית או העשרת הקרקע בכמות גדולה יותר של תוצרת. עם כל ניסוי מיקרוקוסמוס שבוצע, החוקרים ממשיכים לחקור את המגוון הטקסונומי והתפקודי המלא שמספק הטבע, ומאפשרים גילוי של טקסונים מיקרוביאליים חדשים ויכולות תפקודיות הנעות בין עמידות לזיהומים להגנה מפני קסנוביוטיקה סביבתית.
Disclosures
למחברים אין ניגודי עניינים להצהיר כי הם רלוונטיים לתוכן מאמר זה.
Acknowledgements
העבודה המתוארת בכתב יד זה נתמכה על ידי מענקי NIH R01OD024780 ו- R01AG061302. ק.ט. נתמך גם על ידי מלגת מחקר לתואר ראשון מאוניברסיטת קליפורניה בברקלי, במימון קרן רוז הילס. עיצובים מצוירים באיור 1 התקבלו מ-BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| AMPure XP Reagent, 60 mL | Beckman Coulter | A63881 | Supplementary File Step 1.3 |
| Bleach (Sodium Hypochlorite) | Sigma-Aldrich | 7681-52-9 | Step 6.5 |
| DNeasy PowerSoil Pro Kit | Qiagen | 47016 | Step 7 DNA extractions |
| dNTP set 10 mM | Invitrogen | 18427013 | Supplementary Step 1.2 |
| Easypet 3 Serological Pipette Controller | Eppendorf | 4430000018 | Used to remove supernatant when specified |
| Greiner Bio-One 25 mL Sterile Serological Pipets | Fisher Scientific | 07-000-368 | Used to remove supernatant when specified |
| KH2PO4 | Fisher Scientific | P285-500 | Used to make M9 |
| Levamisole Hydrochloride | Fisher Scientific | AC187870100 | Step 6.4 |
| M9 Minimal Media Solution | Prepared in-house | N/A | Recipe in wormbook.org |
| MgSO4 | Fisher Scientific | M63-500 | Used to make M9 |
| MiniSeq High Output Reagent Kit (150 cycles) | Illumina | FC-420-1002 | Supplementary Step 1.7 |
| MiniSeq System | Illumina | SY-420-1001 | Commercial sequencer used; Supplementary Step 1.7 |
| Na2HPO4 | Fisher Scientific | S374-500 | Used to make M9 |
| NaCl | Fisher Scientific | S271-3 | Used to make M9 |
| Nematode Growth Media (NGM) | Prepared in-house | N/A | Recipe in wormbook.org |
| Nextera XT DNA Library Preparation Kit (96 samples) | Illumina | FC-131-1096 | Library prep kit used; Supplementary Step 1.4 |
| PhiX Control v3 | Illumina | FC-110-3001 | Supplementary Step 1.7 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530L | Supplementary Step 1.2 |
| PowerLyzer 24 Homogenizer (110/220 V) | Qiagen | 13155 | Step 7.3 |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32851 | Supplementary Steps 1.1 & 1.6 |
| Qubit Fluorometer | Invitrogen | Q33238 | Supplementary Steps 1.1 & 1.6 |
| Triton X-100 | Fisher Scientific | BP-151 | Used to prepare M9+T |
| Zirconia/Silica Beads 1.0 mm diameter | Fisher Scientific | NC9847287 | Step 7.1 |
References
- Shapira, M. Host-microbiota interactions in Caenorhabditis elegans and their significance. Current Opinion in Microbiology. 38, 142-147 (2017).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 285 (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 7-8 (2006).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Ortiz, A., Vega, N. M., Ratzke, C., Gore, J. Interspecies bacterial competition regulates community assembly in the C. elegans intestine. ISME Journal. 15 (7), 2131-2145 (2021).
- Berg, M., et al. TGFβ/BMP immune signaling affects abundance and function of C. elegans gut commensals. Nature Communications. 10, 604 (2019).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Montalvo-Katz, S., Huang, H., Appel, M. D., Berg, M., Shapira, M. Association with soil bacteria enhances p38-dependent infection resistance in Caenorhabditis elegans. Infection and Immunity. 81 (2), 514-520 (2013).
- Frézal, L., Félix, M. A. C. elegans outside the Petri dish. eLife. 4, 05849 (2015).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: Gateway to a new host-microbiome model. BMC Biology. 14 (1), 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Berg, M., Zhou, X. Y., Shapira, M. Host-specific functional significance of Caenorhabditis gut commensals. Frontiers in Microbiology. 7, 1622 (2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. ISME Journal. 10 (8), 1998-2009 (2016).
- Slowinski, S., et al. Interactions with a complex microbiota mediate a trade-off between the host development rate and heat stress resistance. Microorganisms. 8 (11), 1-9 (2020).
- Pérez-Carrascal, O. M., et al. Host preference of beneficial commensals in a microbially-diverse environment. Frontiers in Cellular and Infection Microbiology. 12, 795343 (2022).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- Quast, C., et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools. Nucleic Acids Research. 41, 590-596 (2013).
- McMurdie, P. J., Holmes, S. phyloseq: An R package for reproducible interactive analysis and graphics of microbiome census data. PLoS One. 8 (4), 61217 (2013).
- Lozupone, C., Knight, R. UniFrac: A new phylogenetic method for comparing microbial communities. Applied and Environmental Microbiology. 71 (12), 8228-8235 (2005).
- Lozupone, C., Lladser, M. E., Knights, D., Stombaugh, J., Knight, R. UniFrac: An effective distance metric for microbial community comparison. ISME Journal. 5 (2), 169-172 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved