Method Article
Kompostmikrokosmen als mikrobiell vielfältige, naturähnliche Umgebungen für die Mikrobiomforschung bei Caenorhabditis elegans
In diesem Artikel
Zusammenfassung
Kompost-Mikrokosmen bringen die mikrobielle Vielfalt der Natur ins Labor, um die Mikrobiomforschung bei Caenorhabditis elegans zu erleichtern. Hier sind Protokolle für den Aufbau von Mikrokosmos-Experimenten, wobei die Experimente die Fähigkeit demonstrieren, die mikrobielle Vielfalt der Umwelt zu modulieren, um die Beziehungen zwischen der mikrobiellen Vielfalt der Umwelt und der Zusammensetzung des Mikrobioms des Wurmdarms zu untersuchen.
Zusammenfassung
Der Fadenwurm Caenorhabditis elegans entwickelt sich zu einem nützlichen Modell für die Untersuchung der molekularen Mechanismen, die den Interaktionen zwischen Wirten und ihren Darmmikrobiomen zugrunde liegen. Während Experimente mit gut charakterisierten Bakterien oder definierten Bakteriengemeinschaften die Analyse molekularer Mechanismen erleichtern können, ist die Untersuchung von Nematoden in ihrem natürlichen mikrobiellen Kontext unerlässlich, um die Vielfalt solcher Mechanismen zu erforschen. Gleichzeitig ist die Isolierung von Würmern aus der Wildnis nicht immer möglich, und selbst wenn möglich, schränkt die Probenahme aus der Wildnis die Verwendung des genetischen Werkzeugkastens ein, der sonst für die C. elegans-Forschung zur Verfügung steht. Das folgende Protokoll beschreibt eine Methode für Mikrobiomstudien unter Verwendung von Kompost-Mikrokosmen für das Wachstum im Labor in mikrobiell vielfältigen und naturähnlichen Umgebungen.
Lokal gewonnener Boden kann mit Produkten angereichert werden, um die mikrobiellen Gemeinschaften zu diversifizieren, in denen Würmer gezüchtet werden und aus denen sie geerntet, gewaschen und für nachfolgende Analysen oberflächensterilisiert werden. Repräsentative Experimente zeigen die Fähigkeit, die mikrobielle Gemeinschaft in einem gemeinsamen Boden zu modulieren, indem sie ihn mit verschiedenen Produkten anreichern, und zeigen weiter, dass Würmer, die in diesen unterschiedlichen Umgebungen aufgezogen werden, ähnliche Darmmikrobiome aufbauen, die sich von ihrer jeweiligen Umgebung unterscheiden, was die Vorstellung eines artspezifischen Kernmikrobioms des Darms unterstützt. Insgesamt bieten Kompost-Mikrokosmen natürliche Laborumgebungen für die Mikrobiomforschung als Alternative zu synthetischen mikrobiellen Gemeinschaften oder zur Isolierung wilder Nematoden.
Einleitung
Der Fadenwurm Caenorhabditis elegans entwickelt sich zu einem nützlichen Modell für die Untersuchung von Interaktionen zwischen Wirten und ihren Darmmikrobiomen 1,2. Als Modell bietet es mehrere Vorteile. Erstens sind keimfreie oder gnotobiotische Tiere leicht zu beschaffen und zu pflegen; Bleichmittel kann verwendet werden, um Gravidenwürmer und assoziierte Mikroben abzutöten, wobei ihre bleichresistenten Eier unversehrt bleiben, um als alterssynchronisierte Populationen zu wachsen, die von Bakterien von Interesse besiedelt werden können 3,4. Darüber hinaus nimmt C. elegans, ein Bakterivor, wenn es in Gegenwart von Bakterien gezüchtet wird, die angetroffenen Bakterien auf, wobei anfällige Arten verdaut oder ausgeschieden werden, während resistente und persistente Arten den Wurmdarm stabil besiedeln. Darüber hinaus sind C. elegans meist hermaphroditisch und produzieren Populationen genetisch identischer Nachkommen, was die verwirrende genetische Variation reduziert. In Verbindung mit der Verfügbarkeit mutierter und transgener Wurmstämme bietet die Arbeit mit C. elegans den Forschern ein gnotobiotisches und genetisch beherrschbares Modell, um die molekularen Grundlagen von Wirt-Mikroben-Interaktionen zu untersuchen 5,6,7,8.
Während Experimente mit gut charakterisierten Bakterien die Analyse molekularer Mechanismen erleichtern können, ist die Identifizierung und Untersuchung der Bakterien, mit denen Würmer in der Natur interagieren, unerlässlich, um die Vielfalt solcher Mechanismen zu erforschen, den natürlichen Kontext für ihre Funktion zu entschlüsseln und die selektiven Kräfte zu verstehen, die ihre Evolution geprägt haben. Außerhalb des Labors wird C. elegans weltweit in feuchten gemäßigten Klimazonen gefunden, in denen angenommen wird, dass Populationen einen "Boom-and-Bust" -Lebenszyklus durchlaufen, der durch ein schnelles Bevölkerungswachstum gekennzeichnet ist, wenn Ressourcen reichlich vorhanden sind, gefolgt von einer Entwicklungsverschiebung zu bahnbrechenden, stresstoleranten Dauers, wenn die Ressourcen erschöpft sind9. Obwohl sie als Bodennematode gelten, werden wild vermehrende C . elegans-Populationen am häufigsten gefunden, die sich von zersetzendem organischem Material wie verrottenden Blüten oder Früchten ernähren, wo Bakterienpopulationen reichlich vorhanden und vielfältig sind.
Untersuchungen des Darmmikrobioms in aus der Wildnis isolierten Nematoden haben verschiedene, aber charakteristische Bakteriengemeinschaften identifiziert 10,11, deren Zusammensetzung durch Studien mit Würmern, die in natürlichen Mikrokosmosumgebungen aufgezogen wurden, weiter unterstützt wurde 12,13. Zusammen ermöglichten solche Studien die Abgrenzung eines Kernwurm-Darmmikrobioms2. Während die Probenahme von C. elegans-Populationen in freier Wildbahn die direkteste Untersuchung natürlicher Wurm-Mikroben-Interaktionen darstellt, ist sie nicht überall und jederzeit durchführbar, da sie auf Regionen und Jahreszeiten mit reichlichem Niederschlag beschränkt ist10,11. Alternativ, anstatt Würmer von ihrem natürlichen Lebensraum zu isolieren, bringen Experimente mit Mikrokosmen den natürlichen Lebensraum ins Labor 6,8,12,13,14,15. Mikrokosmosumgebungen werden aus Erde hergestellt, die mit verschiedenen Obst- oder Gemüsesorten kompostiert wird, was eine weitere Diversifizierung der Ausgangsbodengemeinschaft ermöglicht. Sie bieten handhabbare experimentelle Methoden, die die mikrobielle Vielfalt und die dreidimensionale wilde Bodenumgebung mit den experimentellen Vorteilen einer kontrollierten Laboreinrichtung und genetisch definierten Wurmstämmen kombinieren. Das folgende Protokoll beschreibt die Schritte bei der Arbeit mit Kompostmikrokosmen und demonstriert ihre Verwendung zum Verständnis des Zusammenbaus eines charakteristischen Wurm-Darm-Mikrobioms aus verschiedenen Umgebungen.
Protokoll
1. Vorbereitung von Kompost
- Beziehen Sie Kompost oder Gartenerde aus jeder geeigneten Quelle und lagern Sie sie im Labor in einem Standard-Küchenkunststoffbehälter mit Löchern im Deckel, um Luft hereinzulassen. Verstopfen Sie die Löcher mit Watte, um Fruchtfliegen und andere wirbellose Tiere fernzuhalten (Abbildung 1A).
HINWEIS: Fünfhundert Gramm Erde (passend in einen 1,5-Gallonen-Behälter, Abmessungen: 30 cm x 20 cm x 10 cm) liefern genug Material für 12 Mikrokosmen. - Reichern Sie den Kompost oder die Erde mit gehackten Produkten oder einer Mischung verschiedener Produkte in einem Massenverhältnis von 1: 2 von Produkten zu Erde an.
- 7-14 Tage bei 20-25 °C inkubieren, einmal täglich mischen und M9-Medium nach Bedarf hinzufügen, um die Feuchtigkeit zu erhalten, ohne sie schlammig zu machen.
HINWEIS: Böden, die nicht mit Produkten angereichert sind, unterstützen normalerweise nicht das Wachstum von C. elegans , aber welche spezifischen Produkte zu verwenden sind, liegt beim Forscher, wobei viele Arten und Mischungen das Wurmwachstum unterstützen können. Die Anreicherung mit verschiedenen Produkten wird die Diversifizierung der Bakteriengemeinschaft auf unterschiedliche Weise fördern und die Untersuchung der Darmmikrobiom-Assemblierung von verschiedenen Ausgangspunkten aus ermöglichen (siehe den Diskussionsabschnitt).
2. Herstellung von Kompost-Mikrokosmen
- Für jeden Mikrokosmos 10 g angereicherten Kompost in ein 30-ml-Glasbecherglas geben, das mit Zinnfolie und Autoklav bedeckt ist (Abbildung 1B).
- Um mikrobiellen Extrakt zum Auffüllen des autoklavierten Komposts herzustellen, fügen Sie zunächst 30 g des gleichen in Schritt 2.1 verwendeten Komposts zu jedem der drei 50-ml-Röhrchen hinzu und füllen Sie es mit M9. Wirbel für 1 min (Abbildung 1C).
HINWEIS: Dies sollte genug Bakterien für neun Mikrokosmen liefern, die jeweils die Entwicklung von Hunderten von Nematoden unterstützen. - Zentrifugieren Sie die Röhrchen bei 560 × g für 5 min bei Raumtemperatur (RT).
- Achten Sie darauf, das Pellet nicht zu stören, entfernen Sie die Überstände mit einer serologischen Pipette und kombinieren Sie es in einem neuen 50-ml-Röhrchen.
- Konzentrieren Sie den Bakterienextrakt durch Zentrifugieren mit maximaler Geschwindigkeit (2.000 × g) für 15 min bei RT. Resuspendieren Sie die Pellets in genug M9, um 200 μL für jeden Mikrokosmos und 200 μL mehr zu erhalten, um eine Platte hinzuzufügen, die als sichtbarer Proxy für die Wurmentwicklung im Mikrokosmos dient.
HINWEIS: Resuspendieren Sie beispielsweise für neun Mikrokosmen das mikrobielle Pellet in 2 ml M9. - Fügen Sie 200 μL des konzentrierten mikrobiellen Extrakts zu jedem Becher mit autoklaviertem Kompost sowie zu einer NGM-Platte hinzu, die als sichtbare Proxy-Platte dient.
- Mikrokosmen und Proxyplatte für 24 h bei 20-25 °C inkubieren, bevor Würmer hinzugefügt werden.
3. Aufzucht von Würmern im Kompost-Mikrokosmos
- Fügen Sie 500-1000 Eier oder L1-Larven3 zu jedem Mikrokosmos und zur Proxy-Platte hinzu (Schritt 2.7), um das Experiment zu beginnen (Abbildung 1D).
HINWEIS: Die hier beschriebenen Experimente verwenden N2-Wildtyp-Würmer. Es können jedoch auch andere C. elegans-Stämme (und möglicherweise andere Nematoden) verwendet werden. - Heben Sie die Würmer bis zum Erwachsenenalter bei 20 ° C (typischerweise 3 Tage).
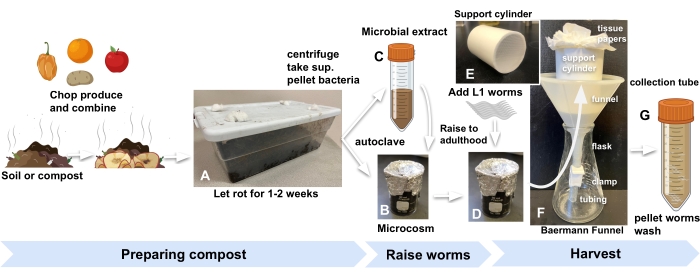
Abbildung 1: Vorbereitung von Kompost-Mikrokosmen, Aufzucht von Würmern und Ernte . (A) Lokalen Boden oder Kompost mit Produkten anreichern und 2 Wochen lang inkubieren. Kombinieren Sie (B) autoklavierten angereicherten Boden mit (C) mikrobiellem Extrakt und (D) inkubieren Sie für mindestens 24 Stunden, bevor Sie synchronisierte L1s-Würmer zu Mikrokosmen hinzufügen, um das Experiment zu beginnen. (E, F) Nach der Erntereife Kompost aus dem Mikrokosmos in einen Baermann Trichterträgerzylinder geben und mit M9 abdecken. (G) Nach 15 min wird das Filtrat in ein 50-ml-Röhrchen freigesetzt. Abkürzung: sup. = Überstand. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Vorbereitung eines Baermann-Trichters für die Würmertung
- Montieren Sie einen Baermann Trichter, indem Sie 5-8 cm starre Gummischläuche am Ende eines Kunststofftrichters befestigen.
- Schieben Sie eine Klemme auf den Schlauch und klemmen Sie ihn zu.
- In den Trichter legen Sie ein 7 cm langes, zylindrisches PVC-Rohr mit einem 1 mm langen zylindrischen PVC-Rohr mit einem 1 mm dicken Nylonnetz (Abbildung 1E). Legen Sie den Zylinder mit zwei Blättern Seidenpapier aus.
- Den Baermann Trichter in einen Kolben geben (Abbildung 1F).
5. Würmer aus Mikrokosmen ernten und entsprechende Bodenproben entnehmen
- Geben Sie 20 ml M9 in den Mikrokosmos, in dem die Würmer aufgezogen wurden, rühren Sie die Mischung und gießen Sie dann die Mischung aus dem Becherglas in den mit Seidenpapier ausgekleideten Zylinder im Baermann Trichteraufbau. Fügen Sie mehr M9 hinzu, um den Kompost vollständig in den Trichter zu tauchen.
HINWEIS: C. elegans (N2) -Populationen erreichen das Erwachsenenalter in Kompost-Mikrokosmen mit einer ähnlichen Rate wie auf Standard-Agarplatten, die mit Escherichia coli gesät wurden. Weitere Genauigkeit bei der Ernte von Würmern in einem bestimmten Entwicklungsstadium finden Sie auf der Proxy-Platte aus Schritt 3.3. - Lösen Sie nach 30 Minuten die Klemme, um das Filtrat mit den geernteten Würmern in ein 50-ml-Röhrchen freizugeben (Abbildung 1G).
- Fügen Sie dem Zylinder mehr M9 hinzu und wiederholen Sie dies für eine zweite Runde, um weitere Würmer zu ernten, und noch einmal, wenn zusätzliche Würmer benötigt werden.
HINWEIS: Achten Sie bei der Wiederholung von Ernterunden darauf, die Integrität des Seidenpapiers nicht zu beeinträchtigen, da sonst Bodenpartikel passieren können. Maximal vier Ernterunden sollten mindestens 50% der ursprünglich dem Mikrokosmos zugesetzten Würmer isolieren, ohne die Integrität des Seidenpapiers zu beeinträchtigen. - Die Würmer werden durch Zentrifugieren bei 560 × g für 2 min (RT) konzentriert. Entfernen Sie 35 ml des Überstands mit einer serologischen Pipette.
- Die restlichen 15 ml werden in ein 15-ml-Röhrchen gegeben und 1 min lang erneut bei 560 × g zentrifugiert, um die Würmer weiter zu konzentrieren. Entfernen Sie 14 ml des Überstands mit einer serologischen Pipette.
- Sammeln Sie parallel 1 g des verbleibenden Mikrokosmosbodens in einem 1,5-ml-Röhrchen. Verarbeiten Sie die Bodenproben, die die Umweltbakteriengemeinschaft enthalten, sofort oder lagern Sie sie bei −20 °C für die spätere Extraktion von Nukleinsäuren, wie unten für Wurmproben beschrieben.
6. Waschen und Oberflächensterilisation von geernteten Würmern
- 1 ml der konzentrierten, geernteten Würmer aus Schritt 5.5 mit einer Glaspipette in ein 1,5 ml Röhrchen überführen. Inkubieren Sie für 2 min, damit sich die Würmer am Boden des Röhrchens absetzen können. Entfernen Sie den Überstand und lassen Sie die unteren 100 μL ungestört.
- Waschen Sie 6x mit 1,5 ml M9+T (0,025% Triton-X in M9), damit sich die Würmer jedes Mal am Boden absetzen können.
- Die gewaschenen Würmer in einem Volumen von 100 μL mit einer Glaspipette in ein neues 1,5 ml Röhrchen überführen.
HINWEIS: An diesem Punkt des Protokolls sollten seit der ersten Wäsche (Schritt 6.2) etwa 30 Minuten vergangen sein. Es wird empfohlen, die Würmer mindestens 1 h vor der Zugabe von Levamisol ohne Nahrung zu lassen, um die Ausscheidung vorübergehender Bakterien und die vollständige Verdauung von Nahrungsbakterien zu ermöglichen. - Fügen Sie 100 μL 25 mM Levamisolhydrochlorid hinzu, um die Würmer zu lähmen. Inkubieren Sie für 5 min bei RT.
- Fügen Sie 200 μL 4%ige Bleichlösung hinzu. 2 min inkubieren.
- Entfernen Sie den Überstand, lassen Sie die untersten 150 μL ungestört, und waschen Sie 3x mit M9+T, wie oben.
HINWEIS: Um die Kontamination der Proben zu minimieren, wird empfohlen, gefiltertes M9+T (durch einen 0,2-μm-Filter) zu verwenden und ab diesem Zeitpunkt Handschuhe zu tragen. - Nach dem Waschen nehmen Sie 50 μL der restlichen 150 μL aus der letzten Wäsche und Platte auf eine LB-Platte und inkubieren bei 25 °C für 48 Stunden, um die effektive Entfernung externer Bakterien zu bestätigen.
HINWEIS: Die Beobachtung von bis zu 30 Kolonien in der letzten Wäsche (was insgesamt 60 externen Bakterienzellen entspricht, die in der Probe verbleiben) ist erlaubt und wird voraussichtlich nur einen marginalen Beitrag zur analysierten Mikrobiomzusammensetzung leisten, angesichts der Tausende von Bakterien, die typischerweise jeden erwachsenen Wurm besiedeln15. Wenn mehr beobachtet werden, kann die Probenintegrität beeinträchtigt werden. - Verwenden Sie die oberflächensterilisierten Würmer sofort (z. B. um lebende Bakterien für die Kultivierung zu extrahieren [KBE-Anzahl]) oder lagern Sie sie bei −20 °C für die anschließende Extraktion von Nukleinsäuren.
7. DNA-Extraktion
HINWEIS: Die folgenden Schritte beschreiben die DNA-Extraktion der geernteten Würmer mit einem kommerziellen Kit, das für die Extraktion mikrobieller DNA aus dem Boden entwickelt wurde (siehe Materialtabelle), mit unten beschriebenen Modifikationen, um die Extraktion mikrobieller DNA aus Würmern zu erleichtern.
- Die Probe, die oberflächensterilisierte Würmer enthält (ggf. bei RT auftauen), in die vom Kit bereitgestellten Röhrchen und ersetzen die mitgelieferten Glasperlen durch etwa 30-50 Zirkonoxidperlen mit einem Durchmesser von 1 mm (siehe Materialtabelle).
HINWEIS: Die beobachteten DNA-Ausbeuten sind bei Zirkonoxidperlen höher als bei den vom Kit bereitgestellten Glasperlen. Obwohl der Grund für diese Beobachtung unbestimmt bleibt, können Zirkonoxidperlen die Nematodenkutikula effizienter aufbrechen und mehr Bakterien freisetzen. - Für Kompostproben fügen Sie etwa 250 mg des gesammelten Bodens in die Röhrchen des Kits hinzu, ohne die Glasperlen zu ersetzen.
- Nach Zugabe der vom Kit bereitgestellten Pufferlösung zu allen Proben mit einem Leistungshomogenisator bei RT (siehe Materialtabelle) für zwei Runden von 2.000 U/min für jeweils 30 s homogenisieren und dazwischen 30 s pausieren.
- Führen Sie die verbleibenden DNA-Reinigungsschritte gemäß dem Kit-Protokoll aus. Eluieren Sie die Wurmproben in nicht mehr als 50 μL Elutionspuffer, um DNA-Konzentrationen sicherzustellen, die hoch genug für die Sequenzierung sind.
Ergebnisse
Um die Fähigkeit zu untersuchen, die Gemeinschaft der Bodenmikrokosmen zu diversifizieren, verglichen wir die mikrobiellen Gemeinschaften in Kompost-Mikrokosmen, die durch Anreicherung desselben Ausgangsbodens, eines industriellen Komposts, der aus der Stadt Berkeley, Kalifornien, mit verschiedenen Produkten hergestellt wurde: Äpfel, Paprika, Orangen oder Kartoffeln (jeweils dreifach gesetzt). Darüber hinaus verglichen wir die mikrobiellen Gemeinschaften jeder Kompostumgebung mit dem Darmmikrobiom von Wildtyp-C. elegans , die im jeweiligen Mikrokosmos aufgezogen wurden. Die Analyse wurde mit DNA-Proben durchgeführt, die von etwa 500 oberflächensterilisierten Erwachsenen pro Mikrokosmos und von 250 mg Kompostproben der jeweiligen Mikrokosmen extrahiert wurden.
Die Charakterisierung der Umweltboden- und Wurmdarmmikrobiome beruhte auf der Next-Generation-Sequenzierung der V4-Region des bakteriellen 16S-rRNA-Gens. Die Vorbereitung der Sequenzierungsbibliothek erfolgte unter Verwendung der Standardkits und wurde gemäß den Anweisungen des Herstellers durchgeführt, wobei die Sequenzierung auf einem kommerziellen Sequenzer durchgeführt wurde (siehe Materialtabelle). Demultiplex-Sequenzen wurden mit DADA2 verarbeitet, der Taxonomie basierend auf der SILVA v132-Referenzdatenbank zugeordnet und mit phyloseq16,17,18 analysiert (siehe Zusatzdatei 1, Zusatzfigur S1, Zusatzfigur S2, Zusatzfigur S3, Zusatztabelle S1 und Zusatztabelle S2 für eine detaillierte Beschreibung der Sequenzierung und Analyse; die vollständige Rechenpipeline ist in GitHub [https://github.com/kennytrang/CompostMicrocosms]) verfügbar. Rohdaten sind im NCBI Sequence Read Archive verfügbar (Bioproject ID PRJNA856419).
Pro Probe wurden durchschnittlich 73.220 Sequenzen erhalten. Diese Sequenzen repräsentieren 15.027 Amplikon-Sequenzvarianten (ASVs), die 27 Stämme und 216 Familien umfassen, einschließlich Familien, die als Teil des Kernmikrobioms C. elegans Darm13 gelten, wie Rhizobiaceae, Burkholderiaceae und Bacillaceae. Enterobacteriaceae und Pseudomonadaceae, die sich zuvor als dominante Mitglieder erwiesen hatten, waren diesmal eine Minderheit, waren aber im Vergleich zu ihren jeweiligen Bodenumgebungen immer noch angereichert (2-10-fach). Vergleiche, die sowohl auf ungewichteten als auch auf gewichteten UniFrac 19,20-Entfernungen basierten, zeigten eine gute Reproduzierbarkeit zwischen Mikrokosmos-Triplikaten, die mit den gleichen Produkten angereichert waren, wie durch enge Clusterbildung angezeigt wird. Im Gegensatz dazu gruppierten sich Umweltbodenmikrobiome, die mit verschiedenen Produkten angereichert waren, voneinander entfernt und zeigten die Fähigkeit, eine anfängliche mikrobielle Gemeinschaft durch die Zugabe verschiedener Produkte zu diversifizieren (Abbildung 2).
In Vergleichen von Wurm-Darm-Mikrobiomen und Umweltgemeinschaften zeigte die Hauptkoordinatenanalyse (PCoA) mit entweder ungewichteten oder gewichteten UniFrac-Abständen eine deutliche Clusterbildung von Wurm-Darm-Mikrobiomen weg von der ihrer jeweiligen Umgebung für jeden Mikrokosmostyp (Abbildung 2). Während PCoA basierend auf ungewichteten UniFrac-Abständen nicht zwischen Boden- und Wurmmikrobiomen unterschied (Abbildung 2A), zeigte die Clusterbildung basierend auf gewichteten Abständen eine klare Trennung von Wurmdarm- und Kompostmikrobiomen (Abbildung 2B). Diese Ergebnisse unterstützen einen Prozess, bei dem die Wirtsfilterung auf der Umweltverfügbarkeit arbeitet, um ein Darmmikrobiom zu formen, das sich in Bezug auf das Vorhandensein von Taxa nicht vollständig von seiner Umweltquelle unterscheidet, sondern deren Häufigkeit moduliert, indem es sich für eine Teilmenge der verfügbaren Taxa anreichert, was letztendlich zu einem Kernwurm-Darmmikrobiom führt, das von Würmern geteilt wird, die in verschiedenen Umgebungen aufgezogen werden.

Abbildung 2: Wurm-Darm-Mikrobiome, die sich von ihren jeweiligen produktdiversifizierten mikrobiellen Umgebungen entfernen. Die Zusammensetzung des Mikrobioms wurde mit 16S-Sequenzierung bestimmt, und Gemeinschaften aus Mikrokosmen, die mit den bezeichneten Produkten angereichert waren, oder aus Würmern, die in ihnen gezüchtet wurden, wurden unter Verwendung von PCoA basierend auf (A) ungewichteten oder (B) gewichteten UniFrac-Abständen gruppiert. Die gezeigten Achsen sind diejenigen, die die größte Variation in der Gemeinschaftszusammensetzung zwischen den Proben erklären (N = 3 für jeden Mikrokosmostyp). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Zusatzdatei 1: Next-Generation-Sequencing und Datenanalyse. Hier werden die Schritte für die Bibliotheksvorbereitung, die Sequenzierung im Labor und die Datenanalyse vorgestellt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S1: Beispiel für eine Qualitätskontrollkurve für die umgekehrten Lesevorgänge aus einer Probe. Die X-Achse (Zyklus) zeigt die Nukleotidposition entlang der gelesenen Sequenz. Die linke Y-Achse zeigt den Qualitätsfaktor an. Die Graustufen-Heatmap stellt die Häufigkeit des Qualitätsfaktors an jeder Nukleotidposition dar. Die grüne Linie stellt den mittleren Qualitätsfaktor an jeder Nukleotidposition dar; Die obere orangefarbene Linie zeigt die Quartile der Qualitätsfaktorverteilung. Die untere rote Linie zeigt den Prozentsatz der Sequenzlesevorgänge, die diese Nukleotidposition verlängert haben (rechte Y-Achse, hier 100%). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S2: Fehlerquoten für verschiedene Stichproben. Die Fehlerhäufigkeit in den verschiedenen Proben (schwarze Punkte) sollte mit steigender Qualitätsbewertung für jede mögliche Basenpaarsubstitution abnehmen, was den erwarteten Trend widerspiegelt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S3: Ein Beispiel für PCoA basierend auf gewichteten UniFrac-Abständen. Die in der Legende gezeigten Gruppennamen repräsentieren die Produkte, die zur Anreicherung des Komposts verwendet werden, der in den verschiedenen Mikrokosmen verwendet wird. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatztabelle S1: Sequentielle Sequenzfilterung. ein Anzahl der Sequenzlesevorgänge vor dem Filtern. b-d Jede Spalte stellt die Anzahl der Sequenzlesevorgänge dar, die nach einem Filterschritt verbleiben: Filtern von Lesevorgängen niedriger Qualität (Schritt 2.5), Rauschunterdrückungsalgorithmus von dada() (Schritt 2.8), Zusammenführen von Vorwärts- und Rückwärtslesevorgängen (Schritt 2.9) und Entfernen von Chimären (Schritt 2.11). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatztabelle S2: Metadatentabelle. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das hier vorgestellte Protokoll beschreibt eine Methode zur Untersuchung des Darmmikrobioms von Nematoden, die in natürlichen Umgebungen aufgezogen werden, und bietet einen alternativen Ansatz zur Isolierung von Würmern aus der Natur oder zur Aufzucht auf synthetischen Gemeinschaften.
Die Tausenden von potenziellen Bakterienarten, die im repräsentativen Mikrokosmos-Experiment erfasst wurden, spiegeln die mikrobielle Vielfalt wider, mit der sich die Würmer entwickelt haben, und demonstrieren die Fähigkeit der Mikrokosmos-Pipeline, die Vorteile der Arbeit mit einem Modell-Wirtsorganismus und die der Arbeit mit natürlichen, vielfältigen mikrobiellen Gemeinschaften zu kombinieren.
Die repräsentativen Ergebnisse zeigen, dass die Anreicherung eines gemeinsamen Bodens mit verschiedenen Produkttypen die mikrobielle Vielfalt der Umwelt moduliert, was die Bandbreite der mikrobiellen Vielfalt unterstreicht, die für die Exploration mit dieser Pipeline zur Verfügung steht. Die Auswahl der Produkte ist nicht besonders wichtig. Frühere Arbeiten haben Bananen, Äpfel, Orangen, Erdbeeren, grüne Teeblätter und Kartoffeln verwendet, um den Boden anzureichern, was zu einer ähnlichen Wurmerhöhungseffizienz führte. Auch Mischprodukte wurden effektiv eingesetzt. Das Hauptmerkmal ist, dass verschiedene Produkte einen bestimmten Boden auf unterschiedliche Weise diversifizieren.
Trotz der großen Variation in der mikrobiellen Vielfalt der Umwelt variieren die Mikrobiome des Wurmdarms erheblich weniger, was die Bedeutung der Wurmdarmnische und der Wirtsfilterung für den Aufbau eines Kernmikrobioms des Darms rekapituliert, das sich von dem seiner Bodenumgebung unterscheidet13. Dieses Muster wird am besten mit einer gewichteten UniFrac-PCoA-Analyse beobachtet, die zeigt, dass die Unterschiede zwischen Umweltboden- und Wurmdarmmikrobiomen hauptsächlich auf Unterschiede in der relativen Häufigkeit von Schlüsseltaxa zurückzuführen sind.
Obwohl sich das hier beschriebene Protokoll auf die Ernte von Würmern für die 16S-Sequenzierung konzentriert, können Mikrokosmen verwendet werden, um zusätzliche Fragen von Interesse zu untersuchen. Zum Beispiel können Würmer, die aus Mikrokosmen geerntet werden, anschließend auf die Wirkung eines vielfältigen Darmmikrobioms auf die Wirtsresistenz gegen verschiedene widrige Bedingungen, einschließlich Krankheitserreger oder Toxine, untersucht werden. Alternativ können neuartige Bakterienarten und -stämme aus am Boden geernteten Würmern isoliert und kultiviert werden, wodurch die taxonomische und funktionelle Vielfalt der Bakterien, mit denen Experimente durchgeführt werden können, erweitert wird.
Während Forschungsmethoden im Labor Konsistenz und Reproduzierbarkeit suchen, nutzt die Arbeit mit Mikrokosmen die natürliche Variation, um Wirt-Mikroben-Interaktionen in einem natürlichen Kontext zu erforschen. Dennoch bringt diese Variation auch einige Herausforderungen mit sich. Einige Böden, die einen hohen Anteil an endogenen wirbellosen Tieren enthalten, erfordern möglicherweise zusätzliche Zentrifugations-, Filtrations- und Untersuchungsschritte, um unerwünschte Organismen effektiv aus der Mikrokosmosvorbereitung zu entfernen. Darüber hinaus kann eine geringe mikrobielle Häufigkeit im Boden zu einer unerwünschten Dauerbildung in Wurmpopulationen führen, was eine Erhöhung des mikrobiellen Extrakts oder die Anreicherung des Bodens mit einer größeren Menge an Produkten erfordert. Mit jedem Mikrokosmos-Experiment erforschen die Forscher weiterhin die gesamte taxonomische und funktionelle Vielfalt, die die Natur bietet, und ermöglichen die Entdeckung neuer mikrobieller Taxa und funktioneller Fähigkeiten, die von Infektionsresistenz bis zum Schutz vor Umwelt-Xenobiotika reichen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären, die für den Inhalt dieses Artikels relevant sind.
Danksagungen
Die in diesem Manuskript beschriebene Arbeit wurde durch die NIH-Zuschüsse R01OD024780 und R01AG061302 unterstützt. K.T. wurde außerdem durch ein Summer Undergraduate Research Fellowship der University of California, Berkeley, unterstützt, das von der Rose Hills Foundation finanziert wurde. Die Cartoon-Designs in Abbildung 1 stammen aus BioRender.com.
Materialien
| Name | Company | Catalog Number | Comments |
| AMPure XP Reagent, 60 mL | Beckman Coulter | A63881 | Supplementary File Step 1.3 |
| Bleach (Sodium Hypochlorite) | Sigma-Aldrich | 7681-52-9 | Step 6.5 |
| DNeasy PowerSoil Pro Kit | Qiagen | 47016 | Step 7 DNA extractions |
| dNTP set 10 mM | Invitrogen | 18427013 | Supplementary Step 1.2 |
| Easypet 3 Serological Pipette Controller | Eppendorf | 4430000018 | Used to remove supernatant when specified |
| Greiner Bio-One 25 mL Sterile Serological Pipets | Fisher Scientific | 07-000-368 | Used to remove supernatant when specified |
| KH2PO4 | Fisher Scientific | P285-500 | Used to make M9 |
| Levamisole Hydrochloride | Fisher Scientific | AC187870100 | Step 6.4 |
| M9 Minimal Media Solution | Prepared in-house | N/A | Recipe in wormbook.org |
| MgSO4 | Fisher Scientific | M63-500 | Used to make M9 |
| MiniSeq High Output Reagent Kit (150 cycles) | Illumina | FC-420-1002 | Supplementary Step 1.7 |
| MiniSeq System | Illumina | SY-420-1001 | Commercial sequencer used; Supplementary Step 1.7 |
| Na2HPO4 | Fisher Scientific | S374-500 | Used to make M9 |
| NaCl | Fisher Scientific | S271-3 | Used to make M9 |
| Nematode Growth Media (NGM) | Prepared in-house | N/A | Recipe in wormbook.org |
| Nextera XT DNA Library Preparation Kit (96 samples) | Illumina | FC-131-1096 | Library prep kit used; Supplementary Step 1.4 |
| PhiX Control v3 | Illumina | FC-110-3001 | Supplementary Step 1.7 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530L | Supplementary Step 1.2 |
| PowerLyzer 24 Homogenizer (110/220 V) | Qiagen | 13155 | Step 7.3 |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32851 | Supplementary Steps 1.1 & 1.6 |
| Qubit Fluorometer | Invitrogen | Q33238 | Supplementary Steps 1.1 & 1.6 |
| Triton X-100 | Fisher Scientific | BP-151 | Used to prepare M9+T |
| Zirconia/Silica Beads 1.0 mm diameter | Fisher Scientific | NC9847287 | Step 7.1 |
Referenzen
- Shapira, M. Host-microbiota interactions in Caenorhabditis elegans and their significance. Current Opinion in Microbiology. 38, 142-147 (2017).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 285(2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 7-8 (2006).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Ortiz, A., Vega, N. M., Ratzke, C., Gore, J. Interspecies bacterial competition regulates community assembly in the C. elegans intestine. ISME Journal. 15 (7), 2131-2145 (2021).
- Berg, M., et al. TGFβ/BMP immune signaling affects abundance and function of C. elegans gut commensals. Nature Communications. 10, 604(2019).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Montalvo-Katz, S., Huang, H., Appel, M. D., Berg, M., Shapira, M. Association with soil bacteria enhances p38-dependent infection resistance in Caenorhabditis elegans. Infection and Immunity. 81 (2), 514-520 (2013).
- Frézal, L., Félix, M. A. C. elegans outside the Petri dish. eLife. 4, 05849(2015).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: Gateway to a new host-microbiome model. BMC Biology. 14 (1), 38(2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Berg, M., Zhou, X. Y., Shapira, M. Host-specific functional significance of Caenorhabditis gut commensals. Frontiers in Microbiology. 7, 1622(2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. ISME Journal. 10 (8), 1998-2009 (2016).
- Slowinski, S., et al. Interactions with a complex microbiota mediate a trade-off between the host development rate and heat stress resistance. Microorganisms. 8 (11), 1-9 (2020).
- Pérez-Carrascal, O. M., et al. Host preference of beneficial commensals in a microbially-diverse environment. Frontiers in Cellular and Infection Microbiology. 12, 795343(2022).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- Quast, C., et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools. Nucleic Acids Research. 41, Database issue 590-596 (2013).
- McMurdie, P. J., Holmes, S. phyloseq: An R package for reproducible interactive analysis and graphics of microbiome census data. PLoS One. 8 (4), 61217(2013).
- Lozupone, C., Knight, R. UniFrac: A new phylogenetic method for comparing microbial communities. Applied and Environmental Microbiology. 71 (12), 8228-8235 (2005).
- Lozupone, C., Lladser, M. E., Knights, D., Stombaugh, J., Knight, R. UniFrac: An effective distance metric for microbial community comparison. ISME Journal. 5 (2), 169-172 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten