Method Article
Caenorhabditis elegans'ta Mikrobiyom Araştırmaları için Mikrobiyal Çeşitliliğe Sahip, Doğal Benzeri Ortamlar Olarak Kompost Mikrokozmoslar
Bu Makalede
Özet
Kompost mikrokozmosları, Caenorhabditis elegans'ta mikrobiyom araştırmalarını kolaylaştırmak için doğada bulunan mikrobiyal çeşitliliği laboratuvara getirir. Burada, çevresel mikrobiyal çeşitlilik ile solucan bağırsak mikrobiyom bileşimi arasındaki ilişkileri keşfetmek için çevresel mikrobiyal çeşitliliği modüle etme yeteneğini gösteren deneylerle mikrokozmos deneyleri kurmak için protokoller verilmiştir.
Özet
Nematod Caenorhabditis elegans, konakçılar ve bağırsak mikrobiyomları arasındaki etkileşimlerin altında yatan moleküler mekanizmaları incelemek için yararlı bir model olarak ortaya çıkmaktadır. İyi karakterize edilmiş bakteriler veya tanımlanmış bakteri toplulukları ile yapılan deneyler moleküler mekanizmaların analizini kolaylaştırabilirken, nematodları doğal mikrobiyal bağlamlarında incelemek, bu tür mekanizmaların çeşitliliğini keşfetmek için gereklidir. Aynı zamanda, solucanların vahşi doğadan izole edilmesi her zaman mümkün değildir ve mümkün olduğunda bile, vahşi doğadan örnekleme, C. elegans araştırması için mevcut olan genetik araç setinin kullanımını kısıtlar. Aşağıdaki protokol, mikrobiyal olarak çeşitli ve doğal benzeri ortamlarda laboratuvar içi büyüme için kompost mikrokozmosları kullanan mikrobiyom çalışmaları için bir yöntemi açıklamaktadır.
Yerel kaynaklı toprak, solucanların yetiştirildiği ve daha sonraki analizler için hasat edildikleri, yıkandıkları ve yüzey sterilize edildikleri mikrobiyal toplulukları çeşitlendirmek için ürünlerle zenginleştirilebilir. Temsili deneyler, mikrobiyal topluluğu farklı ürünlerle zenginleştirerek ortak bir toprakta modüle etme yeteneğini göstermektedir ve ayrıca bu farklı ortamlarda yetiştirilen solucanların, kendi çevrelerinden farklı benzer bağırsak mikrobiyomlarını bir araya getirdiğini ve türe özgü bir çekirdek bağırsak mikrobiyomu kavramını desteklediğini göstermektedir. Genel olarak, kompost mikrokozmosları, sentetik mikrobiyal topluluklara veya vahşi nematodların izolasyonuna alternatif olarak mikrobiyom araştırmaları için doğal benzeri laboratuvar içi ortamlar sağlar.
Giriş
Nematod Caenorhabditis elegans, konakçılar ve bağırsak mikrobiyomları arasındaki etkileşimleri incelemek için yararlı bir model olarak ortaya çıkmaktadır 1,2. Bir model olarak, çeşitli avantajlar sunar. İlk olarak, mikropsuz veya gnotobiyotik hayvanların elde edilmesi ve bakımı kolaydır; Ağartıcı, gravid solucanları ve ilişkili mikropları öldürmek için kullanılabilir, ağartmaya dirençli yumurtalarını, ilgilenilen bakteriler tarafından kolonize edilebilen yaş senkronize popülasyonlar olarak büyümek için zarar görmeden bırakır 3,4. Ek olarak, bakteri varlığında yetiştirildiğinde, bir bakteri olan C. elegans, karşılaşılan bakterileri, sindirilen veya atılan duyarlı türlerle yutarken, dirençli ve kalıcı türler solucan bağırsağını kararlı bir şekilde kolonize eder. Dahası, C. elegans çoğunlukla hermafroditiktir ve genetik olarak aynı soy popülasyonlarını üretir, bu da kafa karıştırıcı genetik çeşitliliği azaltır. Mutant ve transgenik solucan suşlarının mevcudiyeti ile birleştiğinde, C. elegans ile çalışmak, araştırmacılara konakçı-mikrop etkileşimlerinin moleküler temellerini araştırmak için gnotobiyotik ve genetik olarak izlenebilir bir model sunar 5,6,7,8.
İyi karakterize edilmiş bakterilerle yapılan deneyler moleküler mekanizmaların analizini kolaylaştırabilirken, solucanların doğada etkileşime girdiği bakterileri tanımlamak ve incelemek, bu tür mekanizmaların çeşitliliğini keşfetmek, işlevleri için doğal bağlamı çözmek ve evrimlerini şekillendiren seçici güçleri anlamak için gereklidir. Laboratuvarın dışında, C. elegans küresel olarak nemli ılıman iklimlerde bulunur; burada popülasyonların, kaynaklar bol olduğunda hızlı nüfus artışı ile karakterize edilen "patlama ve büst" yaşam döngüsünden geçtiği düşünülür, ardından kaynaklar tükendiğinde öncü, strese dayanıklı dauer'lere gelişimsel bir kayma9. Bir toprak nematodu olarak kabul edilmesine rağmen, vahşi çoğalan C. elegans popülasyonları en yaygın olarak, bakteri popülasyonlarının bol ve çeşitli olduğu çürüyen çiçekler veya meyveler gibi ayrışan organik materyallerle beslenir.
Vahşi doğadan izole edilen nematodlardaki bağırsak mikrobiyomunun çalışmaları, bileşimi doğal benzeri mikrokozmos ortamlarında yetiştirilen solucanlarla yapılan çalışmalarla daha da desteklenen çeşitli ancak karakteristik bakteri toplulukları10,11 tanımlamıştır12,13. Birlikte, bu tür çalışmalar bir çekirdek solucan bağırsak mikrobiyomunun tanımlanmasını sağladı2. C. elegans popülasyonlarının vahşi doğada örneklenmesi, doğal solucan-mikrop etkileşimlerinin en doğrudan incelemesini temsil ederken, bol yağışlı bölgeler ve mevsimlerle sınırlı olduğu için her yerde ve her zaman mümkün değildir.10,11. Alternatif olarak, solucanları doğal ortamlarından izole etmek yerine, mikrokozmoslar kullanılarak yapılan deneyler, doğal yaşam alanınılaboratuvara getirir 6,8,12,13,14,15. Mikrokozmos ortamları, çeşitli meyve veya sebzelerle kompostlanmış topraktan hazırlanır ve bu da başlangıç toprak topluluğunun daha da çeşitlendirilmesini sağlar. Mikrobiyal çeşitliliği ve üç boyutlu vahşi toprak ortamını, kontrollü bir laboratuvar tesisinin ve genetik olarak tanımlanmış solucan suşlarının deneysel avantajlarıyla birleştiren izlenebilir deneysel yöntemler sunarlar. Aşağıdaki protokol, kompost mikrokozmosları ile çalışmanın adımlarını detaylandırarak, çeşitli ortamlardan karakteristik bir solucan bağırsak mikrobiyomunun montajını anlamada kullanımlarını göstermektedir.
Protokol
1. Kompostun hazırlanması
- Kompost veya bahçe toprağını uygun herhangi bir kaynaktan elde edin ve laboratuvarın içinde, havanın içeri girmesine izin vermek için kapağı kesilmiş delikleri olan standart bir mutfak plastik kabında saklayın. Meyve sineklerini ve diğer omurgasızları dışarıda tutmak için delikleri pamuk yünü ile kapatın (Şekil 1A).
NOT: Beş yüz gram toprak (1,5 galonluk bir kaba sığdırılır, boyutlar: 30 cm x 20 cm x 10 cm) 12 mikrokozmos için yeterli malzeme sağlayacaktır. - Kompostu veya toprağı, doğranmış ürünlerle veya farklı ürünlerin bir karışımıyla, ürünün toprağa 1: 2 kütle oranında zenginleştirin.
- 20-25 ° C'de 7-14 gün boyunca inkübe edin, günde bir kez karıştırın ve nemi çamurlu hale getirmeden korumak için gerektiğinde M9 ortamı ekleyin.
NOT: Ürünlerle zenginleştirilmemiş topraklar genellikle C. elegans büyümesini desteklemez, ancak hangi spesifik ürünün kullanılacağı, solucan büyümesini destekleyebilecek birçok tür ve karışımla araştırmacıya bağlıdır. Farklı ürünlerle zenginleştirme, bakteri topluluğunun farklı şekillerde çeşitlendirilmesini teşvik edecek ve bağırsak mikrobiyom montajının farklı başlangıç noktalarından incelenmesini sağlayacaktır (tartışma bölümüne bakınız).
2. Kompost mikrokozmoslarının hazırlanması
- Her mikrokozmos için, kalay folyo ve otoklav ile kaplı 30 mL'lik bir cam behere 10 g zenginleştirilmiş kompost ekleyin (Şekil 1B).
- Otoklavlanmış kompostu yenilemek için mikrobiyal ekstrakt hazırlamak için, adım 2.1'de kullanılan aynı kompostun 30 g'ını üç 50 mL tüpün her birine ekleyerek başlayın ve M9 ile doldurun. 1 dakika boyunca vorteks (Şekil 1C).
NOT: Bu, her biri yüzlerce nematodun gelişimini destekleyen dokuz mikro kozmos için yeterli bakteri sağlamalıdır. - Tüpleri oda sıcaklığında (RT) 5 dakika boyunca 560 × g'da santrifüj yapın.
- Peleti rahatsız etmemeye dikkat ederek, süpernatantları serolojik bir pipetle çıkarın ve yeni bir 50 mL tüpte birleştirin.
- RT'de 15 dakika boyunca maksimum hızda (2.000 × g) santrifüj yaparak bakteriyel ekstraktı konsantre edin. peletleri, her mikrokozmos için 200 μL ve mikrokozmoslar içinde solucan gelişiminin görünür bir vekili olarak hizmet edecek bir plakaya eklemek için 200 μL daha fazla olacak şekilde yeterli M9'da yeniden askıya alın.
NOT: Örneğin, dokuz mikrokozmos için, mikrobiyal peleti 2 mL M9'da yeniden askıya alın. - Konsantre mikrobiyal ekstraktın 200 μL'sini otoklavlanmış kompostun her bir kabına ve ayrıca görünür vekil plaka olarak işlev görecek bir NGM plakasına ekleyin.
- Solucanlar eklenmeden önce mikrokozmosları ve proxy plakasını 20-25 ° C'de 24 saat boyunca inkübe edin.
3. Kompost mikrokozmoslarında solucanların yetiştirilmesi
- Deneye başlamak için her mikrokozmosa ve proxy plakasına (adım 2.7) 500-1000 yumurta veya L1 larva3 ekleyin (Şekil 1D).
NOT: Burada açıklanan deneylerde N2 vahşi tip solucanlar kullanılmaktadır. Bununla birlikte, diğer C. elegans suşları (ve potansiyel olarak diğer nematodlar) kullanılabilir. - Solucanları 20 ° C'de yetişkinliğe yükseltin (tipik olarak 3 gün).
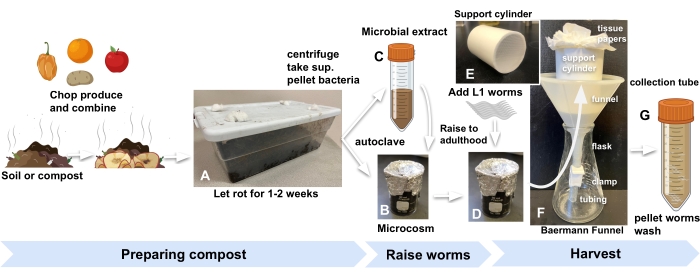
Şekil 1: Kompost mikrokozmoslarının hazırlanması, solucanların yetiştirilmesi ve hasat edilmesi . (A) Yerel toprağı veya kompostu ürünlerle zenginleştirin ve 2 hafta boyunca inkübe edin. (B) otoklavlanmış zenginleştirilmiş toprağı (C) mikrobiyal ekstrakt ile birleştirin ve (D) deneye başlamak için mikrokozmoslara senkronize L1s solucanları eklemeden önce en az 24 saat inkübe edin. (E, F) Hasat etmeye hazır olduğunuzda, mikrokozmostan bir Baermann huni destek silindirine kompost ekleyin ve M9 ile örtün. (G) 15 dakika sonra, filtradı 50 mL'lik bir tüpe bırakın. Kısaltma: sup. = supernatant. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Solucanları hasat etmek için bir Baermann hunisi hazırlama
- Plastik bir huninin sonuna 5-8 cm sert kauçuk boru takarak bir Baermann hunisi monte edin.
- Borunun üzerine bir kelepçe kaydırın ve kapatın.
- Huniye 7 cm uzunluğunda, 5 cm çapında, silindirik PVC boruyu, dibine yapıştırılmış 1 mm naylon örgü ile yerleştirin (Şekil 1E). Silindiri iki yaprak kağıt mendille hizalayın.
- Baermann hunisini bir şişeye yerleştirin (Şekil 1F).
5. Mikrokozmoslardan solucanların toplanması ve ilgili toprak örneklerinin toplanması
- Solucanların yetiştirildiği mikro kozmosa 20 mL M9 ekleyin, karışımı çalkalayın ve ardından karışımı beherden Baermann huni kurulumundaki kağıt mendil kaplı silindire dökün. Kompostu huniye tamamen batırmak için daha fazla M9 ekleyin.
NOT: C. elegans (N2) popülasyonları, kompost mikrokozmoslarında yetişkinliğe, Escherichia coli ile tohumlanan standart agar plakalarında olduğu gibi benzer bir oranda ulaşır. Belirli bir gelişim aşamasında solucanların toplanmasında daha fazla doğruluk için, adım 3.3'teki proxy plakasına bakın. - 30 dakika sonra, hasat edilen solucanları içeren filtratın 50 mL'lik bir tüpe salınması için kelepçeyi çıkarın (Şekil 1G).
- Silindire daha fazla M9 ekleyin ve daha fazla solucan toplamak için ikinci bir tur boyunca tekrarlayın ve ek solucanlar gerekiyorsa bir kez daha tekrarlayın.
NOT: Hasat turlarını tekrarlarken, toprak parçacıklarının geçmesine izin verebilecek doku kağıdının bütünlüğünden ödün vermemeye dikkat edin. En fazla dört hasat turu, doku kağıdı bütünlüğünden ödün vermeden mikrokozmosa orijinal olarak eklenen solucanların en az% 50'sini izole etmelidir. - Solucanları 2 dakika (RT ) boyunca 560 × g'de santrifüj yaparak konsantre edin. Süpernatantın 35 mL'sini serolojik pipetle çıkarın.
- Kalan 15 mL'yi 15 mL'lik bir tüpe aktarın ve solucanları daha da konsantre etmek için 1 dakika boyunca 560 × g'da tekrar santrifüj yapın. Süpernatantın 14 mL'sini serolojik bir pipetle çıkarın.
- Paralel olarak, kalan mikrokozmos toprağının 1 gramını 1,5 mL'lik bir tüpe toplayın. Çevresel bakteri topluluğunu içeren toprak örneklerini derhal işleyin veya solucan örnekleri için aşağıda açıklandığı gibi, nükleik asitlerin daha sonra ekstraksiyonu için -20 ° C'de saklayın.
6. Hasat edilen solucanların yıkanması ve yüzey sterilizasyonu
- Konsantre, hasat edilmiş solucanların 1 mL'sini bir cam pipet kullanarak adım 5.5'ten 1.5 mL'lik bir tüpe aktarın. Solucanların tüpün dibine yerleşmesine izin vermek için 2 dakika boyunca kuluçkaya yatırın. Süpernatanı çıkarın ve alt 100 μL'yi rahatsız edilmeden bırakın.
- 6x'i 1,5 mL M9+T (M9'da %0,025 Triton-X) ile yıkayarak solucanların her seferinde dibe çökmesine izin verin.
- Yıkanmış solucanları 100 μL'lik bir hacimde cam pipet kullanarak yeni bir 1,5 mL tüpe aktarın.
NOT: Protokolün bu noktasında, ilk yıkamadan bu yana yaklaşık 30 dakika geçmiş olmalıdır (adım 6.2). Geçici bakterilerin atılımına ve gıda bakterilerinin tam sindirimine izin vermek için levamisol ilavesinden önce solucanların en az 1 saat yiyeceksiz kalmasına izin verilmesi önerilir. - Solucanları felç etmek için 100 μL 25 mM levamisol hidroklorür ekleyin. RT'de 5 dakika boyunca inkübe edin.
- 200 μL% 4 ağartıcı çözeltisi ekleyin. 2 dakika boyunca kuluçkaya yatırın.
- En alttaki 150 μL'yi rahatsız etmeden bırakarak süpernatanı çıkarın ve yukarıdaki gibi M9 + T ile 3 kat yıkayın.
NOT: Numunelerin kontaminasyonunu en aza indirmek için, filtrelenmiş M9+T (0,2 μm filtre aracılığıyla) kullanılması ve bu noktadan itibaren eldiven giyilmesi önerilir. - Yıkamaları takiben, kalan 150 μL'nin 50 μL'sini bir LB plakası üzerindeki son yıkama ve plakadan alın, harici bakterilerin etkili bir şekilde uzaklaştırılmasını doğrulamak için 48 saat boyunca 25 ° C'de inkübe edin.
NOT: Son yıkamada 30 koloniye kadar (numunede kalan toplam 60 harici bakteri hücresini temsil eder) gözlemlemeye izin verilir ve tipik olarak her yetişkin solucanı kolonize eden binlerce bakteri göz önüne alındığında, analiz edilen mikrobiyom bileşimine sadece marjinal bir katkısı olması beklenir.15. Daha fazla gözlemlendiğinde, numune bütünlüğü tehlikeye girebilir. - Yüzeyle sterilize edilmiş solucanları hemen kullanın (örneğin, [CFU sayımları]'nı kültürlemek için canlı bakterileri çıkarmak için) veya nükleik asitlerin daha sonra ekstraksiyonu için -20 ° C'de saklayın.
7. DNA ekstraksiyonu
NOT: Aşağıdaki adımlar, mikrobiyal DNA'nın topraktan ekstraksiyonu için tasarlanmış ticari bir kit kullanılarak hasat edilen solucanların DNA ekstraksiyonunu açıklamaktadır (bkz.
- Yüzeyi sterilize edilmiş solucanlar (gerekirse RT'de defrost) içeren numuneyi kit tarafından sağlanan tüplere aktarın, sağlanan cam boncukları kabaca 30-50 1 mm çapında zirkonya boncuklarla değiştirin (bkz.
NOT: Gözlemlenen DNA verimleri, zirkonya boncuklarla, kit tarafından sağlanan cam boncuklardan daha yüksektir. Bu gözlemin arkasındaki neden belirlenmemiş olsa da, zirkonya boncukları nematod kütikülünü daha verimli bir şekilde açarak daha fazla bakteri salgılayabilir. - Kompost numuneleri için, toplanan toprağın yaklaşık 250 mg'ını cam boncukları değiştirmeden kitin tüplerine ekleyin.
- Kit tarafından sağlanan tampon çözeltisinin tüm numunelere eklenmesinden sonra, RT'de bir güç homojenizatörü ile homojenize edin (bkz. Malzeme Tablosu) her biri 30 sn için 2.000 rpm'lik iki tur boyunca homojenize edin ve aralarında 30 s duraklayın.
- Kalan DNA saflaştırma adımlarını kit protokolüne göre tamamlayın. Dizileme için yeterince yüksek DNA konsantrasyonları sağlamak için solucan örneklerini en fazla 50 μL elüsyon tamponunda süzün.
Sonuçlar
Toprak mikrokozmosları topluluğunu çeşitlendirme yeteneğini keşfetmek için, aynı başlangıç toprağı, Kaliforniya'nın Berkeley şehrinde bulunan endüstriyel sınıf bir kompostu farklı ürünlerle zenginleştirerek hazırlanan kompost mikrokozmoslarındaki mikrobiyal toplulukları karşılaştırdık: elmalar, dolmalık biberler, portakallar veya patatesler (her biri üçlü olarak ayarlanmış). Ayrıca, her bir kompost ortamının mikrobiyal topluluklarını, ilgili mikrokozmosta yetiştirilen vahşi tip C. elegans'ın bağırsak mikrobiyomu ile karşılaştırdık. Analiz, mikrokozmos başına yaklaşık 500 yüzey sterilize edilmiş yetişkinden ve ilgili mikrokozmosların 250 mg kompost örneklerinden elde edilen DNA örnekleri ile gerçekleştirildi.
Çevresel toprağın ve solucan bağırsağı mikrobiyomlarının karakterizasyonu, bakteriyel 16S rRNA geninin V4 bölgesinin yeni nesil dizilimine dayanıyordu. Sıralama kütüphanesi hazırlığı standart kitler kullanılarak gerçekleştirildi ve ticari bir sıralayıcıda yapılan sıralama ile üreticilerin talimatlarına göre gerçekleştirildi (bkz. Çoklulaştırılmış diziler DADA2 kullanılarak işlenmiş, SILVA v132 referans veritabanına dayalı olarak taksonomi atanmış ve filoseks16,17,18 ile analiz edilmiştir (bkz. Ek Dosya 1, Ek Şekil S1, Ek Şekil S2, Ek Şekil S3, Ek Tablo S1 ve Ek Tablo S2 sıralama ve analizin ayrıntılı bir açıklaması için; tam hesaplama işlem hattı GitHub'da mevcuttur [https://github.com/kennytrang/CompostMicrocosms]). Ham veriler NCBI Sequence Read Archive'da (Bioproject ID PRJNA856419) mevcuttur.
Ortalama olarak, numune başına 73.220 dizi elde edildi. Bu diziler, Rhizobiaceae, Burkholderiaceae ve Bacillaceae gibi çekirdek C. elegans bağırsak mikrobiyomu 13'ün bir parçası olarak kabul edilen aileler de dahil olmak üzere 27 filum ve216 aileyi kapsayan 15.027 amplikon dizi varyantını (ASV) temsil eder. Daha önce baskın üyeler olarak bulunan Enterobacteriaceae ve Pseudomonadaceae, bu sefer bir azınlıktı, ancak yine de kendi toprak ortamlarına kıyasla zenginleştirildi (2-10 kat). Hem ağırlıksız hem de ağırlıklı UniFrac19,20 mesafelerine dayanan karşılaştırmalar, yakın kümeleme ile gösterildiği gibi, aynı ürünle zenginleştirilmiş mikrokozmos üçlüleri arasında iyi bir tekrarlanabilirlik göstermiştir. Buna karşılık, farklı ürünlerle zenginleştirilmiş çevresel toprak mikrobiyomları birbirlerinden uzakta kümelenmiştir ve bu da farklı ürünlerin eklenmesiyle ilk mikrobiyal topluluğu çeşitlendirme yeteneğini göstermektedir (Şekil 2).
Solucan bağırsağı mikrobiyomları ve çevresel toplulukların karşılaştırılmasında, ağırlıksız veya ağırlıklı UniFrac mesafelerine sahip temel koordinat analizi (PCoA), solucan bağırsağı mikrobiyomlarının her bir mikrokozmos tipi için kendi ortamlarından uzakta farklı kümelendiğini göstermiştir (Şekil 2). Ağırlıksız UniFrac mesafelerine dayanan PCoA, toprak ve solucan mikrobiyomları arasında ayrım yapmamış olsa da (Şekil 2A), ağırlıklı mesafelere dayalı kümeleme, solucan bağırsağı ve kompost mikrobiyomlarının net bir şekilde ayrıldığını ortaya koymuştur (Şekil 2B). Bu sonuçlar, konakçı filtrelemesinin, taksonların varlığı açısından çevresel kaynağından tamamen farklı olmayan, ancak mevcut taksonların bir alt kümesi için zenginleştirerek bolluklarını modüle eden bir bağırsak mikrobiyomunu şekillendirmek için çevresel kullanılabilirlik üzerinde çalıştığı bir süreci desteklemektedir.

Şekil 2: Solucan bağırsak mikrobiyomları, kendi ürün çeşitlendirilmiş mikrobiyal ortamlarından uzakta kümelenmektedir. Mikrobiyom bileşimi 16S dizilimi ile belirlendi ve belirlenen ürünle zenginleştirilmiş mikrokozmoslardan veya içlerinde yetiştirilen solucanlardan gelen topluluklar, (A) ağırlıksız veya (B) ağırlıklı UniFrac mesafelerine dayanan PCoA kullanılarak kümelendi. Gösterilen eksenler, örnekler arasındaki topluluk kompozisyonundaki en büyük varyasyonu açıklayanlardır (her mikrokozmos tipi için N = 3). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Yeni nesil sıralama ve veri analizi. Burada kitaplık hazırlama, laboratuvar içi sıralama ve veri analizi adımları sunulmaktadır. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S1: Bir örnekten ters okumalar için bir kalite kontrol grafiği örneği. X ekseni (döngü), okunan dizi boyunca nükleotid konumunu gösterir. Sol Y ekseni kalite puanını gösterir. Gri tonlamalı ısı haritası, her nükleotid konumundaki kalite puanının sıklığını temsil eder; yeşil çizgi, her nükleotid pozisyonundaki medyan kalite puanını gösterir; üst turuncu çizgi, kalite puanı dağılımının çeyreklerini gösterir; alt kırmızı çizgi, nükleotid pozisyonunu genişleten dizi okumalarının yüzdesini gösterir (sağ Y ekseni, burada% 100). Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S2: Farklı örnekler için hata oranları. Farklı örneklerdeki (siyah noktalar) hata sıklığı, gösterilen her olası baz çifti ikamesi için artan kalite puanı ile birlikte azalmalı ve beklenen eğilimi yansıtmalıdır. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S3: Ağırlıklı UniFrac mesafelerine dayanan bir PCoA örneği. Efsanede gösterilen grup adları, farklı mikro kozmoslarda kullanılan kompostu zenginleştirmek için kullanılan ürünü temsil eder. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Tablo S1: Sıralı dizi filtreleme. a Filtrelemeden önce dizi okuma sayısı. b-d Her sütun, bir filtreleme adımından sonra kalan dizi okumalarının sayısını temsil eder: düşük kaliteli okumaları filtreleme (adım 2.5), dada() tarafından gerçekleştirilen algoritmayı gürültü giderme (adım 2.8), ileri ve geri okumaları birleştirme (adım 2.9) ve kimeraları kaldırma (adım 2.11). Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Tablo S2: Meta veri tablosu. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada sunulan protokol, doğal benzeri ortamlarda yetiştirilen nematodların bağırsak mikrobiyomunu incelemek için bir yöntem açıklamakta ve solucanların doğadan izole edilmesine veya sentetik topluluklarda yetiştirilmesine alternatif bir yaklaşım sunmaktadır.
Temsili mikrokozmos deneyinde yakalanan binlerce potansiyel bakteri türü, solucanların evrimleştiği mikrobiyal çeşitliliği yansıtır ve mikrokozmos boru hattının, model bir konakçı organizma ile çalışmanın avantajlarını ve doğal, çeşitli mikrobiyal topluluklarla çalışmanın avantajlarını birleştirme yeteneğini gösterir.
Temsili sonuçlar, ortak bir toprağı farklı ürün türleriyle zenginleştirmenin çevresel mikrobiyal çeşitliliği modüle ettiğini ve bu boru hattını kullanarak keşif için mevcut mikrobiyal çeşitlilik aralığını vurguladığını göstermektedir. Üretim seçimi özellikle önemli değildir. Önceki çalışmalar, toprağı zenginleştirmek için muz, elma, portakal, çilek, yeşil çay yaprakları ve patates kullandı ve bu da benzer solucanların verimliliği artırmasına neden oldu. Karışık ürünler de etkili bir şekilde kullanılmıştır. Temel özellik, farklı ürünlerin belirli bir toprağı farklı şekillerde çeşitlendirmesidir.
Çevresel mikrobiyal çeşitlilikteki geniş varyasyona rağmen, solucan bağırsağı mikrobiyomları önemli ölçüde daha az farklılık gösterir, bu da solucan bağırsak nişinin önemini ve toprak ortamınınkinden farklı bir çekirdek bağırsak mikrobiyomunun montajı için konakçı filtrelemesini özetler13. Bu model en iyi ağırlıklı UniFrac PCoA analizi ile gözlemlenir ve çevresel toprak ile solucan bağırsak mikrobiyomları arasındaki farklılıkların çoğunlukla anahtar taksonların göreceli bolluğundaki farklılıklardan kaynaklandığını gösterir.
Burada açıklanan protokol, 16S dizilimi için solucanların toplanmasına odaklansa da, mikrokozmoslar ilgi çekici ek soruları araştırmak için kullanılabilir. Örneğin, mikrokozmoslardan toplanan solucanlar daha sonra çeşitli bağırsak mikrobiyomunun patojenler veya toksinler de dahil olmak üzere çeşitli olumsuz koşullara karşı konakçı direnci üzerindeki etkisi açısından incelenebilir. Alternatif olarak, yeni bakteri türleri ve suşları, yerden hasat edilmiş solucanlardan izole edilebilir ve kültürlenebilir, bu da deneyler yapmak için mevcut bakterilerin taksonomik ve fonksiyonel çeşitliliğini genişletir.
Laboratuvar ortamlarındaki araştırma yöntemleri tutarlılık ve tekrarlanabilirlik ararken, mikrokozmoslarla çalışmak, konakçı-mikrop etkileşimlerini doğal benzeri bir bağlamda keşfetmek için doğal varyasyondan yararlanır. Bununla birlikte, bu varyasyon da bazı zorluklar ortaya çıkarmaktadır. Yüksek düzeyde endojen omurgasızlar içeren bazı topraklar, istenmeyen organizmaları mikrokozmos preparatından etkili bir şekilde ortadan kaldırmak için ek santrifüjleme, filtreleme ve inceleme adımları gerektirebilir. Ek olarak, topraktaki düşük mikrobiyal bolluk, solucan popülasyonlarında istenmeyen dauer oluşumuna neden olabilir, bu da mikrobiyal ekstraktta bir artış gerektirebilir veya toprağı daha fazla miktarda ürünle zenginleştirebilir. Yapılan her mikrokozmos deneyi ile araştırmacılar, doğanın sağladığı tüm taksonomik ve fonksiyonel çeşitliliği keşfetmeye devam ederek, enfeksiyon direncinden çevresel ksenobiyotiklere karşı korunmaya kadar değişen yeni mikrobiyal taksonların ve fonksiyonel yeteneklerin keşfedilmesini sağlar.
Açıklamalar
Yazarların, bu makalenin içeriğiyle ilgili olduğunu beyan etmek için çıkar çatışması yoktur.
Teşekkürler
Bu makalede açıklanan çalışma, NIH hibeleri R01OD024780 ve R01AG061302 tarafından desteklenmiştir. K.T. ayrıca, Rose Hills Vakfı tarafından finanse edilen Kaliforniya Üniversitesi, Berkeley'den bir Yaz Lisans Araştırma Bursu tarafından desteklendi. Şekil 1'deki karikatür tasarımları BioRender.com'dan elde edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AMPure XP Reagent, 60 mL | Beckman Coulter | A63881 | Supplementary File Step 1.3 |
| Bleach (Sodium Hypochlorite) | Sigma-Aldrich | 7681-52-9 | Step 6.5 |
| DNeasy PowerSoil Pro Kit | Qiagen | 47016 | Step 7 DNA extractions |
| dNTP set 10 mM | Invitrogen | 18427013 | Supplementary Step 1.2 |
| Easypet 3 Serological Pipette Controller | Eppendorf | 4430000018 | Used to remove supernatant when specified |
| Greiner Bio-One 25 mL Sterile Serological Pipets | Fisher Scientific | 07-000-368 | Used to remove supernatant when specified |
| KH2PO4 | Fisher Scientific | P285-500 | Used to make M9 |
| Levamisole Hydrochloride | Fisher Scientific | AC187870100 | Step 6.4 |
| M9 Minimal Media Solution | Prepared in-house | N/A | Recipe in wormbook.org |
| MgSO4 | Fisher Scientific | M63-500 | Used to make M9 |
| MiniSeq High Output Reagent Kit (150 cycles) | Illumina | FC-420-1002 | Supplementary Step 1.7 |
| MiniSeq System | Illumina | SY-420-1001 | Commercial sequencer used; Supplementary Step 1.7 |
| Na2HPO4 | Fisher Scientific | S374-500 | Used to make M9 |
| NaCl | Fisher Scientific | S271-3 | Used to make M9 |
| Nematode Growth Media (NGM) | Prepared in-house | N/A | Recipe in wormbook.org |
| Nextera XT DNA Library Preparation Kit (96 samples) | Illumina | FC-131-1096 | Library prep kit used; Supplementary Step 1.4 |
| PhiX Control v3 | Illumina | FC-110-3001 | Supplementary Step 1.7 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530L | Supplementary Step 1.2 |
| PowerLyzer 24 Homogenizer (110/220 V) | Qiagen | 13155 | Step 7.3 |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32851 | Supplementary Steps 1.1 & 1.6 |
| Qubit Fluorometer | Invitrogen | Q33238 | Supplementary Steps 1.1 & 1.6 |
| Triton X-100 | Fisher Scientific | BP-151 | Used to prepare M9+T |
| Zirconia/Silica Beads 1.0 mm diameter | Fisher Scientific | NC9847287 | Step 7.1 |
Referanslar
- Shapira, M. Host-microbiota interactions in Caenorhabditis elegans and their significance. Current Opinion in Microbiology. 38, 142-147 (2017).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 285(2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 7-8 (2006).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Ortiz, A., Vega, N. M., Ratzke, C., Gore, J. Interspecies bacterial competition regulates community assembly in the C. elegans intestine. ISME Journal. 15 (7), 2131-2145 (2021).
- Berg, M., et al. TGFβ/BMP immune signaling affects abundance and function of C. elegans gut commensals. Nature Communications. 10, 604(2019).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Montalvo-Katz, S., Huang, H., Appel, M. D., Berg, M., Shapira, M. Association with soil bacteria enhances p38-dependent infection resistance in Caenorhabditis elegans. Infection and Immunity. 81 (2), 514-520 (2013).
- Frézal, L., Félix, M. A. C. elegans outside the Petri dish. eLife. 4, 05849(2015).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: Gateway to a new host-microbiome model. BMC Biology. 14 (1), 38(2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Berg, M., Zhou, X. Y., Shapira, M. Host-specific functional significance of Caenorhabditis gut commensals. Frontiers in Microbiology. 7, 1622(2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. ISME Journal. 10 (8), 1998-2009 (2016).
- Slowinski, S., et al. Interactions with a complex microbiota mediate a trade-off between the host development rate and heat stress resistance. Microorganisms. 8 (11), 1-9 (2020).
- Pérez-Carrascal, O. M., et al. Host preference of beneficial commensals in a microbially-diverse environment. Frontiers in Cellular and Infection Microbiology. 12, 795343(2022).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- Quast, C., et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools. Nucleic Acids Research. 41, Database issue 590-596 (2013).
- McMurdie, P. J., Holmes, S. phyloseq: An R package for reproducible interactive analysis and graphics of microbiome census data. PLoS One. 8 (4), 61217(2013).
- Lozupone, C., Knight, R. UniFrac: A new phylogenetic method for comparing microbial communities. Applied and Environmental Microbiology. 71 (12), 8228-8235 (2005).
- Lozupone, C., Lladser, M. E., Knights, D., Stombaugh, J., Knight, R. UniFrac: An effective distance metric for microbial community comparison. ISME Journal. 5 (2), 169-172 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır