A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת זני רקמה מקומיים בגידים באמצעות מתאם תמונה דיגיטלית בקוד פתוח
In This Article
Summary
מאמר זה מתאר אלגוריתם מתאם תמונה דיגיטלית בקוד פתוח למדידת זני רקמות דו-ממדיים מקומיים בתוך צמחי גידים. דיוק הטכניקה אומת באמצעות טכניקות רבות, והיא זמינה לשימוש ציבורי.
Abstract
קיים עניין מדעי רב בהבנת הזנים שתאי גידים חווים באתרם וכיצד זנים אלה משפיעים על עיצוב מחדש של רקמות. בהתבסס על עניין זה, פותחו מספר טכניקות אנליטיות למדידת זני רקמה מקומיים בתוך צמחי גידים במהלך העמסה. עם זאת, במספר מקרים, הדיוק והרגישות של טכניקות אלה לא דווחו, ואף אחד מהאלגוריתמים אינו זמין לציבור. עובדה זו הקשתה על מדידה נרחבת יותר של זני רקמה מקומיים בצמחי גידים. לכן, מטרת מאמר זה הייתה ליצור כלי ניתוח מתוקף למדידת זני רקמה מקומיים בצמחי גידים, זמין וקל לשימוש. באופן ספציפי, אלגוריתם ALDIC (רגימנט-לגראנז'יאני) זמין לציבור הותאם למדידת זנים דו-ממדיים על ידי מעקב אחר התזוזות של גרעיני התא בתוך גידי אכילס של עכבר תחת מתח חד-צירי. בנוסף, הדיוק של הזנים המחושבים אומת על ידי ניתוח תמונות שעברו טרנספורמציה דיגיטלית, כמו גם על ידי השוואת הזנים עם ערכים שנקבעו מטכניקה עצמאית (כלומר, קווים מולבנים). לבסוף, שולבה באלגוריתם טכניקה לשחזור תמונת הייחוס באמצעות שדה התזוזה המחושב, שניתן להשתמש בו כדי להעריך את דיוק האלגוריתם בהיעדר ערכי מתח ידועים או טכניקת מדידה משנית. האלגוריתם מסוגל למדוד זנים עד 0.1 בדיוק של 0.00015. הטכניקה להשוואת תמונת ייחוס משוחזרת לתמונת הייחוס בפועל זיהתה בהצלחה דגימות עם נתונים שגויים והצביעה על כך שבדגימות עם נתונים טובים, כ-85% משדה התזוזה היה מדויק. לבסוף, הזנים שנמדדו בגידי אכילס של עכברים תאמו את הספרות הקודמת. לכן, אלגוריתם זה הוא כלי שימושי ביותר וניתן להתאמה למדידה מדויקת של זני רקמות מקומיים בגידים.
Introduction
גידים הם רקמות רגישות למכנו שמסתגלות ומתנוונות בתגובה לעומס מכני 1,2,3,4. בשל התפקיד שממלאים גירויים מכניים בביולוגיה של תאי הגידים, קיים עניין רב בהבנת הזנים שתאי הגידים חווים בסביבת הרקמה הטבעית במהלך ההעמסה. פותחו מספר טכניקות ניסיוניות ואנליטיות למדידת זני רקמות מקומיים בגידים. אלה כוללים ניתוחי מתאם תמונה דיגיטלית דו-ממדית / תלת-ממדית (DIC) של זני פני השטח באמצעות תבניות כתמים או קווים פוטו-מולבנים (PBLs)5,6,7,8, מדידת השינויים במרחק הצנטרואידי לצנטרואידי של גרעינים בודדים בתוך הרקמה 9,10, ושיטת DIC תלת-ממדית בשדה מלא ששקלה לאחרונה תנועה מחוץ למישור ועיוותים תלת-ממדיים 11 . עם זאת, הדיוק והרגישות של טכניקות אלה דווחו רק במקרים ספורים, ואף אחת מהטכניקות הללו לא פורסמה לציבור, מה שמקשה על אימוץ ושימוש נרחב בטכניקות אלה.
מטרת עבודה זו הייתה ליצור כלי ניתוח מתוקף למדידת זני רקמה מקומיים בצמחי גידים, זמין וקל לשימוש. השיטה שנבחרה מבוססת על אלגוריתם ALDIC (ראשי תיבות של Augmented-Lagrangian Digital Image Correlation – Aldic) שנכתב ב-MATLAB ופותח על ידי Yang ו-Bhattacharya12. אלגוריתם זה הותאם לניתוח דגימות גידים ואומת על ידי יישומו על תמונות שעברו טרנספורמציה דיגיטלית ועל ידי השוואת הזנים שנמדדו בדגימות גידים בפועל לתוצאות שהתקבלו מקווים מולבנים. יתר על כן, פונקציונליות נוספת הוטמעה באלגוריתם כדי לאשר את הדיוק של שדה התזוזה המחושב גם בהיעדר ערכי מאמץ ידועים או טכניקת מדידה משנית. לכן, אלגוריתם זה הוא כלי שימושי ביותר וניתן להתאמה למדידה מדויקת של זני רקמה דו-ממדית מקומית בגידים.
Protocol
מחקר זה אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת פנסילבניה.
1. הכנת רקמות
- לצורך פרוטוקול זה, קצרו את גידי אכילס מעכברים זכרים C57BL/6 בני 2-4 חודשים.
הערה: ניתן להשתמש גם בגידים או רצועות שונים מעכברים או בעלי חיים קטנים אחרים.- בצע חתך בעור שטחי לגיד אכילס כדי לחשוף את גיד הפלנטריס ואת רקמת החיבור שמסביב. לאחר מכן, הסר אותם באמצעות להב כירורגי.
- להפריד את שרירי הסולאוס והגסטרוקנמיוס החשופים מהגפה האחורית, ולגרד אותם בזהירות מגיד אכילס עם להב הניתוח
- להפריד את calcaneus משאר כף הרגל עם חיבור גלגל חיתוך על כלי סיבובי.
- צבעו את הרקמה ב-1.5 מ"ל של תמיסה של 5 מיקרוגרם/מ"ל של 5-(4,6-dichlorotriazinyl) aminofluorescein (DTAF) ו-0.1 M סודיום ביקרבונט למשך 20 דקות על מיקסר מסתובב בטמפרטורת החדר. תמיסה זו מכתימה חלבונים (למשל, מטריצה חוץ-תאית) ברקמה.
הערה: במהלך פרק זמן זה של 20 דקות, יש להשלים את שלב 1.3. - הכינו תמיסה בקנ"מ 1:1,000 של DRAQ5 במי מלח חוצצי פוספט (PBS) כדי להכתים את הגרעינים. השתמש מערבול מערבולת כדי הומוגניזציה של התמיסה.
- לאחר תקופת הדגירה של 20 דקות בשלב 1.2, מעבירים את הרקמה מתמיסת DTAF לתמיסת DRAQ5, ודגרים בחלל חשוך למשך 10 דקות בטמפרטורת החדר.
2. העמסת גידים ורכישת תמונה
הערה: פרוטוקול זה דורש התקן מתיחה שניתן להרכיבו על גבי מיקרוסקופ קונפוקלי. עבור מחקר זה, מכשיר microtensile שתואר על ידי Peterson ו Szczesny13 שימש.
- הניחו את הגיד בידיות האחיזה של מכשיר העמסת המתיחה. לפני הרכבת ידיות האחיזה במכשיר הטעינה, השתמש בקליפרים דיגיטליים כדי למדוד את המרחק בין חיבור הקלקניוס לבין האחיזה הנגדית. מרחק זה הוא אורך מד הגיד.
- לחלופין, הרכיבו את ידיות האחיזה במכשיר ההעמסה לפני החדרת הגיד, ודחפו למגע כדי להגדיר את מיקום המנוע ללא תזוזה. תזוזת המנועים לאחר החדרת הגיד עשויה לספק אורך מד אחיזה מדויק יותר.
- הרכיבו את ידיות האחיזה במכשיר הטעינה, המכיל PBS לשמירה על לחות הרקמות. יישרו את הגיד בצורה הטובה ביותר האפשרית עם ציר ה-X או ציר ה-Y של תמונות המיקרוסקופ, כך שיציאות זן ה-X וזן ה-Y של האלגוריתם יתאימו לצירי הגידים.
הערה: במחקר זה, הגידים היו מיושרים עם ציר ה-x. אם לא ניתן ליישר באופן מושלם את הגיד עם צירי התמונה, אזי ניתן להפוך את פלטי זן ה-x וה-y של האלגוריתם כך שיתאימו לצירים האורכיים/ניצבים של הגיד באמצעות משוואות טרנספורמציית מאמץסטנדרטיות 14. - טען מראש את הגיד עם 1 גרם של מתח, ואם תרצה, להחיל עומס מחזורי כדי precondition את הדגימה. בפרוטוקול זה, לא נעשה שימוש בהתניה מוקדמת מכיוון שמטרת המחקר הייתה לאמת את זני הרקמה המקומיים שנמדדו ולא למדוד את תכונות חומר הרקמה. אם יש עניין למדוד את תכונות החומר בקנה מידה מאקרו, אשר תלויים בהיסטוריית הטעינה, אז preconditioning מומלץ. לאחר התניה מוקדמת והתאוששות, יש להחיל מחדש טעינה מוקדמת של 1 גרם.
- אם תרצה, בצע פוטואקונומיקה של קבוצה של ארבעה קווים במרווחים של 80 מיקרומטר זה מזה באזור המרכזי של הרקמה (ראה Peterson and Szczesny13 לפרטים נוספים).
הערה: הקווים המולבנים שימשו לאימות המדידות של אלגוריתם ALDIC ואינם נחוצים לביצוע ה- ALDIC עצמו. ניתן להתאים את מספר הקווים וריווחם, ולבחור את מיקום הקווים כדי למנוע ממצאים במדגם שיפחיתו את בהירות הקו. - חזור על הליך ההלבנה בצד שמאל וימין של הרקמה ליד האחיזות.
- באמצעות המיקרוסקופ הקונפוקלי, קבל תמונות נפחיות (x,y: 1.25 μm/pixel, z: 2.5 μm/pixel) של הפלואורסצנטיות DTAF ו-DRAQ5 בטעינה מוקדמת של 1 גרם.
- בצעו כבש מאמץ במתח של 0.5%/s עד 2%. שימו לב שניתן להתאים את קצב המאמץ ואת גודל המאמץ המצטבר.
- הניחו לרקמה להילחץ למשך 10 דקות.
הערה: יש לבחור את משך ההרפיה במתח כך שהדגימה תהיה תחת עומס כמו-סטטי בקירוב במהלך רכישת התמונה. כדי לקבוע אם משך הרפיית המאמץ מקובל, קבעו את שיפוע עקומת הכוח-זמן במהלך הדקה האחרונה של הרפיית המאמץ (איור משלים 1), והכפילו את השיפוע הזה במשך ההדמיה הכולל. במחקר זה, הכוח המופעל בהפרש הזן הגדול ביותר מעולם לא השתנה ביותר מ-5%. - צלם תמונה נפחית נוספת של הרקמה לאחר עיוות.
- חזור על שלבים 2.7-2.9 עד לקבלת הזן הסופי הרצוי. במאמר זה נבחר ערך זן סופי של 12%.
3. עיבוד תמונה
- השתמש ב- ImageJ או בפיג'י כדי ליצור הקרנות z מרביות של כל תמונה נפחית של ערוץ DRAQ5 (גרעיני). זה ישמש כתמונות מנוקדות דו-ממדיות עבור ALDIC.
- שמור את הקרנות z בעוצמה מרבית כקבצים .tiff, ותן להן שם בהתאם למוסכמה הבאה למתן שמות.
- השתמש במספר כתו הראשון של שם התמונה.
- יש את המספר מתאים לסדר שבו התמונות ייחשבו במהלך ניתוח המתח. לדוגמה, התמונה הראשונה צריכה להתחיל באחת, והתמונה השנייה צריכה להתחיל בשתיים. ניתן לבחור מספרים שונים, אך עליהם להגדיל ברצף. מוסכמה למתן שמות לדוגמה היא כדלקמן: "0_Experiment1_MaxZProjection".
- שמור את כל הקרנות z בעוצמה מרבית ששמן השתנה בתיקיה.
4. ניתוח שורות פוטולבין, התקנת קוד ויישום
הערה: שלבים אלה נחוצים רק אם רוצים לאשר את הדיוק של אלגוריתם ALDIC באמצעות קווים מולבנים. הקוד מחשב את זן הרקמה המקומית כשינוי הממוצע המנורמל במרחק בין כל קו מולבן בתוך קבוצת הקווים הפוטו-מולבנים. במחקר זה, הערכים המקומיים הממוצעים הוערכו בממוצע על פני כל קבוצות הקווים המולבנים (כלומר, במרכז ובקצה השמאלי/ימני) כדי לקבוע ערך זן רקמה מקומי ממוצע יחיד עבור כל דגימה. ערך זה שימש אז להערכת הדיוק של אלגוריתם ALDIC.
- הורד את התיקיה "קוד PBL" מ- GitHub (https://github.com/Szczesnytendon/TendonStrainCalc), והעבר את כל התוכן לספריית העבודה ב- MATLAB.
- פתח את סקריפט MATLAB "Micro_Mech_Template.m".
- לחצו על ' הפעל' ובחרו באחד מקובצי התמונה הכוללים את התמונות הנפחיות. התמונות הנפחיות יכולות להיות כל אחד מסוגי הקבצים הבאים: .lsm , .tiff , .nd2 .
- התוכנה תטען באופן אוטומטי את כל התמונות בתיקייה ותציג תמונה מוקרנת של תמונת נפח הייחוס. כשתתבקש, לחץ באמצעות לחצן העכבר השמאלי ליצירת קווים מרובי נקודות העוקבים אחר הקצה השמאלי והימני של הדגימה. לחץ באמצעות לחצן העכבר הימני כדי לסיים שורה. לאחר עיבוד הקלט, אם הקצוות נכונים, הקש על אישור כדי לקבל את התוצאה.
- צייר קו אלכסוני אקראי על פני הדגימה כקו התייחסות כשתתבקש.
- הזן את מספר הקווים הפוטו-לבנים שנוצרו, ועקוב אחר הקווים המולבנים באמצעות קווים מרובי נקודות.
- אם התוצאה מקובלת, קבל אותה. אם התוצאה שגויה, התאם אותה ועבד מחדש.
- חזור על שלב 4.2 עבור כל התמונות והעבר את כל התמונות של קווים במעקב לתיקייה אחת.
- פתח את הסקריפט "Micro_Mech_Strain.m".
- הקש Run כדי להפעיל את הקוד ובחר אחת מהתמונות שנשמרו שבהן מתבצע מעקב אחר הקווים הפוטולבנים.
- ודא שהתמונות הנלוות שנבחרו נכונות לאחר בחירת התמונה על-ידי הקשה על אישור.
5. יצירת תמונות שעברו טרנספורמציה דיגיטלית
הערה: שלבים אלה נחוצים רק אם רוצים לאשר את הדיוק של אלגוריתם ALDIC באמצעות תמונות שעברו טרנספורמציה דיגיטלית. תמונות אלה מדמות שדות מתח דו-ממדיים הומוגניים בסדר גודל ידוע על ידי שינוי מלאכותי של תמונת הייחוס.
- הורד את הקוד "Digital_strain.m" מ- GitHub (https://github.com/Szczesnytendon/TendonStrainCalc).
- פתח והפעל את הקוד.
- כשתתבקשו, הוסיפו את הערכים הרצויים למאמץ המרבי שהופעל, לתוספת המאמץ שהוחלה וליחס פואסון. לחץ על אישור.
הערה: עבור ניסוי זה, הזן המרבי שהופעל היה 0.1 (10%), תוספת הזן המופעל הייתה 0.02 (2%), ונעשה שימוש ביחס פואסון של 1, אשר עולה בקנה אחד עם נתוני הניסוי של בדיקת מתיחה של גידים15,16. הקוד משתמש בפונקציה המוטבעת MATLAB imwarp ובערכי הקלט (לדוגמה, דרגות מאמץ, יחס פואסון) כדי ליצור את התמונות שעברו טרנספורמציה דיגיטלית. - כשתתבקש, בחר בתמונת ההפניה הלא מעוותת.
- לכל הפרש קבוע של מאמץ, מוצגת שכבת-על של תמונת הייחוס והתמונה ששינתה את צורתה. התמונה שעברה טרנספורמציה תישמר בספרייה תחת הכותרת "DigitallyTransformedX%Strain", כאשר X הוא תוספת המאמץ.
6. חישוב מאמץ ותיקוף, התקנת קוד ויישום
- הורד את התיקיה "חישוב מאמץ וקוד אימות" מ- GitHub (https://github.com/Szczesnytendon/TendonStrainCalc), והעבר את כל התוכן לספריית העבודה של MATLAB
- התקן מהדר mex C/C++ לפי Yang and Bhattacharya12. השלבים מסוכמים להלן.
- בדקו את MATLAB אם הותקן מהדר mex C/C++ על ידי הקלדת "mex -setup" בחלון הפקודה של MATLAB והקשה על Enter.
- אם מופיעה שגיאה המציינת שהמהדר אינו נתמך או קיים, המשך לשלב 6.3 ולשלב 6.4.
- אם אין שגיאה, המשך לשלב 6.5
- כדי להוריד מהדר mex C/C++, עבור אל "https:/tdm-gcc.tdragon.net/" ובחר את מהדר TDM-gcc.
- התקן את המהדר שהורדת במיקום ידוע.
- חזור לחלון הפקודה של MATLAB והקלד: "setenv("MW_MINGW64_LOC","[הקלד את נתיב ההתקנה שלך כאן]")". לדוגמה, זה יכול להיות "setenv("MW_MINGW64_LOC","C:\TDM-GCC-64")". אם פקודה זו פועלת בהצלחה, המהדר mex מותקן כראוי.
- הזן את סקריפט הפונקציה "main_aldic.m" ושנה את שורה 22 כך שתתאים לפקודה שבוצעה בשלב 6.5.
- פתח את הסקריפט "Strain_calc_and_validate.m".
- לחץ על Run כדי להתחיל בניתוח התמונה.
- כשתתבקש, שנה את הערכים עבור פרמטרי ALDIC כרצונך.
הערה: גודל החלון צריך להיות פי 0.25 עד פי 1 מגודל קבוצת המשנה. לקבלת מידע נוסף אודות אפשרויות הפרמטרים, עיין במדריך למשתמש המקוון: (https://www.researchgate.net/publication/344796296_Augmented_Lagrangian_Digital
_Image_Correlation_AL-DIC_Code_Manual).- במחקר זה נעשה שימוש בערכים הבאים:
גודל תת-קבוצה (פיקסלים): 20
גודל חלון (פיקסלים): 10
שיטה לפתרון ALDIC: הפרש סופי (1)
לא נעשה שימוש במחשוב מקבילי (1)
שיטה לחישוב ניחוש ראשוני: חיפוש Multigrid מבוסס על פירמידת תמונה (0)
- במחקר זה נעשה שימוש בערכים הבאים:
- כשתתבקש, בחר בתיבת הסימון "כן" כדי שהאלגוריתם ישמור באופן אוטומטי את הערך הממוצע, סטיית התקן והמפות הדו-ממדיות עבור אוסף המשתנים הרצוי (לדוגמה, זן x, זן y, זן גזירה, אזורים פגומים וכו'). בחר אילו משתנים יש לשמור ולחץ על אישור.
- כשתתבקש, שנה את הפרמטרים כרצונך.
- בניסוי זה נעשה שימוש בערכים הבאים:
נקודות מסביב לחישוב מאמץ (numP): 12
מקדם מתאם לזיהוי אזור רע (corr_threshold): 0.5
גודל אזור משנה (פיקסלים) לניתוח אזור שגוי (תת-גודל): 32
- בניסוי זה נעשה שימוש בערכים הבאים:
- כשתתבקש, בחר בתיקייה המכילה את הקרנות z בעוצמה מרבית ששמן השתנה. שים לב שהתוכנה מבצעת באופן אוטומטי ALDIC מצטבר כדי לקבוע את שדות המאמץ של התמונות המעוותות. כלומר, כל תמונה מעוותת משמשת כתמונת "ייחוס" חדשה לתמונה המעוותת הבאה. זה משפר את דיוק התוצאות (איור משלים 2) בהשוואה לביצוע ALDIC מצטבר, שבו כל תמונה מעוותת מושווית בחזרה לתמונת הייחוס המקורית (0% מתח). לביצוע ניתוח מצטבר, טען את התמונות אך בחר רק בתמונת ההפניה המקורית ובתמונה המעוותת המעניינת.
הערה: הזן הרגיל מחושב כ- λ - 1, כאשר λ הוא מתיחת הרקמה. מתיחת הרקמה מחושבת לפי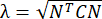 , כאשר N = [1 0]T או [0 1]T עבור כיוון x וכיוון y, בהתאמה, ו- C = F T F, כאשר F הוא שיפוע העיוות המחושב באמצעות נקודות "numP" המקיפות כל פלט נקודת נתונים על ידי אלגוריתם ALDIC. זן הגזירה מחושב כ
, כאשר N = [1 0]T או [0 1]T עבור כיוון x וכיוון y, בהתאמה, ו- C = F T F, כאשר F הוא שיפוע העיוות המחושב באמצעות נקודות "numP" המקיפות כל פלט נקודת נתונים על ידי אלגוריתם ALDIC. זן הגזירה מחושב כ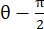 - , כאשר
- , כאשר 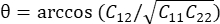 .
. - כשתתבקש, לחץ לחיצה שמאלית ליצירת מצולע בעל ארבע נקודות כדי להגדיר את אזור העניין למדידת הזנים. התחל עם הנקודה בפינה השמאלית העליונה, והקצה את הנקודות הבאות בכיוון השעון.
הערה: המשתנה "אחסון" שנשמר בסביבת העבודה של MATLAB מכיל את כל הערכים עבור זן x ממוצע, סטיית תקן של זן x, זן y ממוצע, סטיית תקן של זן Y, זן גזירה ממוצע, סטיית תקן של זן גזירה ואחוז אזורים פגומים. האזורים הרעים מוגדרים על פי ניתוח מקדם המתאם באזור העניין שנבחר בשלב 6.13. התיקיה "NuclearTrackingResults" (אשר ניתן לשנות את שמה על ידי התאמת שורות 555 ו 556) מאחסן את כל החלקות שצוינו בשלב 6.10. תיקיה זו מכילה גם קובץ גיליון אלקטרוני בשם "תוצאות", המאחסן את כל האמצעים וסטיות התקן שצוינו בשלב 6.10.
תוצאות
לפני ניתוח שדות המאמץ בדגימות רקמה אמיתיות, פרוטוקול ALDIC אומת לראשונה באמצעות תמונות מתוחות/מותמרות דיגיטלית של גרעינים בתוך גידי אכילס של עכבר. באופן ספציפי, התמונות שונו כדי לייצר באופן דיגיטלי זנים אחידים בכיוון x של 2%, 4%, 6%, 8% ו -10% מתח עם יחס פואסון מדומה של 115,16
Discussion
מטרת מאמר זה הייתה לספק שיטה מתוקפת בקוד פתוח למדידת שדות המאמץ הדו-ממדי בגידים תחת עומס מתיחה. הבסיס של התוכנה התבסס על אלגוריתם ALDICזמין לציבור 12. אלגוריתם זה הוטמע בקוד MATLAB גדול יותר עם פונקציונליות נוספת של ניתוח מתח מצטבר (לעומת מצטבר). אלגוריתם מותאם זה יושם לאחר מכן לבדיק?...
Disclosures
לכל המחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו מומנה על ידי המכונים הלאומיים לבריאות (R21 AR079095) והקרן הלאומית למדע (2142627).
Materials
| Name | Company | Catalog Number | Comments |
| 5-DTAF (5-(4,6-Dichlorotriazinyl) Aminofluorescein), single isomer | ThermoFisher | D16 | |
| Calipers | Mitutoyo | 500-196-30 | |
| Confocal Microscope | Nikon | A1R HD | |
| Corning LSE Vortex Mixer | Coning | 6775 | |
| DRAQ5 Fluorescent Probe Solution (5 mM) | ThermoFisher | 62554 | |
| MATLAB | MathWorks | R2022b | |
| Tensile Loading Device | N/A | N/A | Tensile loading device described in Peterson et al, 2020. (ref 13) |
| Tube Revolver Rotator | ThermoFisher | 88881001 |
References
- Devkota, A. C. Distributing a fixed amount of cyclic loading to tendon explants over longer periods induces greater cellular and mechanical responses. Journal of Orthopaedic Research. 11 (4), 1609-1612 (2007).
- Sun, H. B., et al. Cycle-dependent matrix remodeling gene expression response in fatigue-loaded rat patellar tendons. Journal of Orthopaedic Research. 28 (10), 1380-1386 (2010).
- Shepherd, J. H., Screen, H. R. C. Fatigue loading of tendon. International Journal of Experimental Pathology. 94 (4), 260-270 (2013).
- Paschall, L., Pedaprolu, K., Carrozzi, S., Dhawan, A., Szczesny, S. Mechanical stimulation as both the cause and the cure of tendon and ligament injuries. Regenerative Rehabilitation: From Basic Science to the Clinic. , 359-386 (2022).
- Andarawis-Puri, N., Ricchetti, E. T., Soslowsky, L. J. Rotator cuff tendon strain correlates with tear propagation. Journal of Biomechanics. 42 (2), 158-163 (2009).
- Cheng, V. W. T., Screen, H. R. C. The micro-structural strain response of tendon. Journal of Materials Science. 42 (21), 8957-8965 (2007).
- Luyckx, T., et al. Digital image correlation as a tool for three-dimensional strain analysis in human tendon tissue. Journal of Experimental Orthopaedics. 1 (1), 7 (2014).
- Duncan, N. A., Bruehlmann, S. B., Hunter, C. J., Shao, X., Kelly, E. J. In situ cell-matrix mechanics in tendon fascicles and seeded collagen gels: Implications for the multiscale design of biomaterials. Computer Methods in Biomechanics and Biomedical Engineering. 17 (1), 39-47 (2014).
- Arnoczky, S. P., Lavagnino, M., Whallon, J. H., Hoonjan, A. In situ cell nucleus deformation in tendons under tensile load; A morphological analysis using confocal laser microscopy. Journal of Orthopaedic Research. 20 (1), 29-35 (2002).
- Screen, H. R. C., Bader, D. L., Lee, D. A., Shelton, J. C. Local strain measurement within tendon. Strain. 40 (4), 157-163 (2004).
- Fung, A. K., Paredes, J. J., Andarawis-Puri, N. Novel image analysis methods for quantification of in situ 3-D tendon cell and matrix strain. Journal of Biomechanics. 67, 184-189 (2018).
- Yang, J., Bhattacharya, K. Augmented Lagrangian digital image correlation. Experimental Mechanics. 59 (2), 187-205 (2019).
- Peterson, B. E., Szczesny, S. E. Dependence of tendon multiscale mechanics on sample gauge length is consistent with discontinuous collagen fibrils. Acta Biomaterialia. 117, 302-309 (2020).
- Humphrey, J. D., O'Rourke, S. L. . An Introduction to Biomechanics. , (2015).
- Reese, S. P., Weiss, J. A. Tendon fascicles exhibit a linear correlation between Poisson's ratio and force during uniaxial stress relaxation. Journal of Biomechanical Engineering. 135 (3), 34501 (2013).
- Ahmadzadeh, H., Freedman, B. R., Connizzo, B. K., Soslowsky, L. J., Shenoy, V. B. Micromechanical poroelastic finite element and shear-lag models of tendon predict large strain dependent Poisson's ratios and fluid expulsion under tensile loading. Acta Biomaterialia. 22, 83-91 (2015).
- Szczesny, S. E., Elliott, D. M. Interfibrillar shear stress is the loading mechanism of collagen fibrils in tendon. Acta Biomaterialia. 10 (6), 2582-2590 (2014).
- Han, W. M., et al. Macro- to microscale strain transfer in fibrous tissues is heterogeneous and tissue-specific. Biophysical Journal. 105 (3), 807-817 (2013).
- Pedaprolu, K., Szczesny, S. E. A novel, open-source, low-cost bioreactor for load-controlled cyclic loading of tendon explants. Journal of Biomechanical Engineering. 144 (8), 084505 (2022).
- Gatt, R., et al. Negative Poisson's ratios in tendons: An unexpected mechanical response. Acta Biomaterialia. 24, 201-208 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved