Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение локальных деформаций тканей в сухожилиях с помощью корреляции цифровых изображений с открытым исходным кодом
В этой статье
Резюме
В этой статье описывается алгоритм корреляции цифровых изображений с открытым исходным кодом для измерения локальных 2D-деформаций тканей в эксплантатах сухожилий. Точность метода была подтверждена с использованием нескольких методов, и она доступна для публичного использования.
Аннотация
Существует значительный научный интерес к пониманию штаммов, которые испытывают сухожильные клетки in situ , и того, как эти штаммы влияют на ремоделирование тканей. Основываясь на этом интересе, было разработано несколько аналитических методов для измерения локальных деформаций тканей в сухожильных эксплантатах во время нагрузки. Однако в нескольких случаях о точности и чувствительности этих методов не сообщалось, и ни один из алгоритмов не является общедоступным. Это затруднило более широкое измерение локальных деформаций тканей в эксплантатах сухожилий. Таким образом, цель этой статьи состояла в том, чтобы создать валидированный инструмент анализа для измерения локальных тканевых деформаций в сухожильных эксплантатах, который был бы легко доступен и прост в использовании. В частности, общедоступный алгоритм дополненной лагранжевой корреляции цифровых изображений (ALDIC) был адаптирован для измерения 2D-деформаций путем отслеживания смещений ядер клеток в ахилловых сухожилиях мыши при одноосном напряжении. Кроме того, точность рассчитанных деформаций была подтверждена путем анализа изображений с цифровым преобразованием, а также путем сравнения деформаций со значениями, определенными независимым методом (т.е. фотообесцвеченными линиями). Наконец, в алгоритм был включен метод реконструкции эталонного изображения с использованием рассчитанного поля смещения, который может быть использован для оценки точности алгоритма в отсутствие известных значений деформации или вторичного метода измерения. Алгоритм способен измерять деформации до 0,1 с точностью до 0,00015. Метод сравнения реконструированного эталонного изображения с фактическим эталонным изображением успешно идентифицировал образцы, которые имели ошибочные данные, и показал, что в образцах с хорошими данными примерно 85% поля смещения было точным. Наконец, штаммы, измеренные в ахилловых сухожилиях мыши, соответствовали предыдущей литературе. Таким образом, этот алгоритм является очень полезным и адаптируемым инструментом для точного измерения локальных деформаций тканей в сухожилиях.
Введение
Сухожилия представляют собой механочувствительные ткани, которые адаптируются и дегенерируют в ответ на механическую нагрузку 1,2,3,4. Из-за роли, которую механические стимулы играют в биологии сухожильных клеток, существует большой интерес к пониманию деформаций, которые сухожильные клетки испытывают в нативной тканевой среде во время нагрузки. Было разработано несколько экспериментальных и аналитических методов для измерения локальных деформаций тканей в сухожилиях. К ним относятся 2D/3D цифровой корреляционный анализ изображений (DIC) поверхностных деформаций с использованием либо спекл-узоров, либо фотообесцвеченных линий (PBL)5,6,7,8, измерение изменений расстояния между центроидами и центроидами отдельных ядер в ткани9,10 и недавний полнопольный метод 3D DIC, который учитывает движение вне плоскости и 3D-деформации 11 . Однако о точности и чувствительности этих методов сообщалось лишь в нескольких случаях, и ни один из этих методов не был обнародован, что затрудняет широкое внедрение и использование этих методов.
Цель этой работы состояла в том, чтобы создать валидированный инструмент анализа для измерения локальных деформаций тканей в эксплантатах сухожилий, который был бы легко доступен и прост в использовании. Выбранный метод основан на общедоступном алгоритме дополненной лагранжевой корреляции цифровых изображений (ALDIC), написанном в MATLAB, который был разработан Янгом и Бхаттачарьей12. Этот алгоритм был адаптирован для анализа образцов сухожилий и проверен путем применения его к изображениям с цифровым преобразованием и сравнения штаммов, измеренных в реальных образцах сухожилий, с результатами, полученными из фотообесцвеченных линий. Кроме того, в алгоритме был реализован дополнительный функционал для подтверждения точности рассчитанного поля смещения даже при отсутствии известных значений деформации или вторичной методики измерения. Таким образом, этот алгоритм является очень полезным и адаптируемым инструментом для точного измерения локальных 2D-деформаций тканей в сухожилиях.
протокол
Это исследование было одобрено Комитетом по уходу за животными и их использованию Университета штата Пенсильвания.
1. Подготовка тканей
- Для этого протокола собирают ахилловы сухожилия у 2-4-месячных самцов мышей C57BL/6.
ПРИМЕЧАНИЕ: Также можно использовать различные сухожилия или связки мышей или других мелких животных.- Сделайте надрез на коже поверхностно по отношению к ахиллову сухожилию, чтобы обнажить подошвенное сухожилие и окружающую соединительную ткань. Затем удалите их с помощью хирургического лезвия.
- Отделите открытую камбаловидную мышцу и икроножную мышцу от задней конечности и осторожно соскребите их с ахиллова сухожилия хирургическим лезвием
- Отделите пяточную кость от остальной части стопы с помощью насадки-отрезного круга на вращающемся инструменте.
- Окрашивают ткань в 1,5 мл 5 мкг/мл раствора 5-(4,6-дихлортриазинил)аминофлуоресцеина (ДТАФ) и 0,1 М буфера бикарбоната натрия в течение 20 мин на вращающемся смесителе при комнатной температуре. Этот раствор окрашивает белки (например, внеклеточный матрикс) в ткани.
ПРИМЕЧАНИЕ: В течение этого 20-минутного периода необходимо выполнить шаг 1.3. - Приготовьте раствор DRAQ5 в солевом буфере 1:1,000 в фосфатно-буферном физиологическом растворе (PBS) для окрашивания ядер. Используйте вихревой смеситель для гомогенизации раствора.
- После 20-минутного инкубационного периода на шаге 1.2 перенесите ткань из раствора DTAF в раствор DRAQ5 и инкубируйте в темном помещении в течение 10 минут при комнатной температуре.
2. Нагрузка на сухожилия и получение изображения
ПРИМЕЧАНИЕ: Для этого протокола требуется растягивающее устройство, которое может быть установлено поверх конфокального микроскопа. Для этого исследования использовалось микрорастяжимое устройство, описанное Петерсоном и Щесны13 .
- Поместите сухожилие в захваты растягивающего нагрузочного устройства. Перед установкой захватов в загрузочное устройство с помощью цифровых штангенциркулей измерьте расстояние между насадкой пяточной кости и противоположной рукояткой. Это расстояние является длиной сухожилия.
- В качестве альтернативы установите захваты в загрузочное устройство перед вставкой сухожилия и вступите в контакт, чтобы определить положение двигателя с нулевым рабочим объемом. Смещение двигателей после введения сухожилия может обеспечить потенциально более точную длину калибра от захвата до захвата.
- Установите захваты в загрузочное устройство, которое содержит PBS для поддержания увлажнения тканей. Выровняйте сухожилие как можно лучше по оси X или Y изображений микроскопа так, чтобы выходы алгоритма x-деформации и y-деформации соответствовали осям сухожилий.
ПРИМЕЧАНИЕ: В этом исследовании сухожилия были выровнены по оси x. Если невозможно идеально выровнять сухожилие с осями изображения, то выходы алгоритма x-деформации и y-деформации могут быть преобразованы для выравнивания с продольными/перпендикулярными осями сухожилия с использованием стандартных уравнений преобразования деформации14. - Предварительно нагружите сухожилие 1 г натяжения и, при желании, примените циклическую нагрузку для предварительного кондиционирования образца. В этом протоколе предварительное кондиционирование не использовалось, поскольку цель исследования состояла в том, чтобы проверить измеренные местные штаммы тканей, а не измерить свойства тканевого материала. Если есть интерес к измерению макромасштабных свойств материала, которые зависят от истории загрузки, рекомендуется предварительное кондиционирование. После предварительного кондиционирования и восстановления повторно нанесите 1 г предварительной нагрузки.
- При желании фотоотбеливают набор из четырех линий, расположенных на расстоянии 80 мкм друг от друга в центральной области ткани (подробнее см. Peterson and Szczesny13 ).
ПРИМЕЧАНИЕ: Фотообесцвеченные линии использовались для проверки измерений алгоритма ALDIC и не являются необходимыми для выполнения самого ALDIC. Количество и расстояние между линиями можно регулировать, а расположение линий следует выбирать таким образом, чтобы избежать каких-либо артефактов в образце, которые могли бы снизить четкость линии. - Повторите процедуру фотообесцвечивания на левом и правом краях ткани возле захватов.
- С помощью конфокального микроскопа можно получить объемные изображения (x,y: 1,25 мкм/пиксель, z: 2,5 мкм/пиксель) флуоресценции DTAF и DRAQ5 при 1 г предварительной нагрузки.
- Выполните увеличение деформации при деформации от 0,5% до 2%. Обратите внимание, что скорость деформации и величина дополнительной деформации можно регулировать.
- Дайте тканям расслабиться в течение 10 минут.
ПРИМЕЧАНИЕ: Продолжительность релаксации напряжения должна быть выбрана таким образом, чтобы образец находился под приблизительно квазистатической нагрузкой во время получения изображения. Чтобы определить, является ли продолжительность релаксации напряжения приемлемой, определите наклон кривой силы-времени в течение последней минуты релаксации напряжения (дополнительный рисунок 1) и умножьте этот наклон на общую продолжительность изображения. В этом исследовании сила, приложенная при наибольшем приращении деформации, никогда не изменялась более чем на 5%. - Сделайте еще одно объемное изображение ткани после деформации.
- Повторяйте шаги 2.7-2.9 до тех пор, пока не будет достигнута желаемая конечная деформация. В этой работе было выбрано окончательное значение штамма 12%.
3. Обработка изображений
- Используйте ImageJ или Fiji для создания максимальных z-проекций каждого объемного изображения канала DRAQ5 (ядерного). Это будет служить 2D-пятнистыми изображениями для ALDIC.
- Сохраните z-проекции максимальной интенсивности в виде файлов .tiff и назовите их в соответствии со следующим соглашением об именовании.
- Используйте цифру в качестве первого символа имени изображения.
- Пусть число соответствует порядку, в котором изображения будут рассматриваться во время анализа деформации. Например, первое изображение должно начинаться с единицы, а второе изображение должно начинаться с двух. Можно выбирать разные числа, но они должны последовательно увеличиваться. Пример соглашения об именах выглядит следующим образом: «0_Experiment1_MaxZProjection».
- Сохраните все переименованные z-проекции максимальной интенсивности в папку.
4. Установка и применение кода фотообесцвеченного линейного анализа
ПРИМЕЧАНИЕ: Эти шаги необходимы только в том случае, если необходимо подтвердить точность алгоритма ALDIC с использованием фотообесцвеченных линий. Код вычисляет локальную деформацию ткани как среднее нормализованное изменение расстояния между каждой фотообесцвеченной линией в наборе фотообесцвеченных линий. В этом исследовании средние локальные значения были затем усреднены по всем наборам фотообесцвеченных линий (т.е. в центре и на левом / правом концах), чтобы определить одно среднее значение локальной деформации ткани для каждого образца. Затем это значение использовалось для оценки точности алгоритма ALDIC.
- Загрузите папку «PBL Code» с GitHub (https://github.com/Szczesnytendon/TendonStrainCalc) и переместите все содержимое в рабочий каталог в MATLAB.
- Откройте сценарий MATLAB «Micro_Mech_Template.m».
- Нажмите кнопку «Выполнить» и выберите один из файлов изображений, содержащих объемные изображения. Объемные образы могут быть любого из следующих типов: .lsm, .tiff, .nd2.
- Программа автоматически загрузит все изображения в папку и отобразит проецируемое изображение эталонного объемного изображения. При появлении запроса щелкните левой кнопкой мыши , чтобы создать многоточечные линии, которые обводят левый и правый концы образца. Щелкните правой кнопкой мыши , чтобы завершить строку. После обработки входных данных, если края верны, нажмите Ok , чтобы принять результат.
- Нарисуйте случайную диагональную линию поперек образца в качестве контрольной линии при появлении запроса.
- Введите количество созданных фотообесцвеченных линий и обведите фотообесцвеченные линии многоточечными линиями.
- Если результат приемлем, примите его. Если результат ошибочный, скорректируйте его и обработайте повторно.
- Повторите шаг 4.2 для всех изображений и переместите все изображения с трассированными линиями в одну папку.
- Откройте скрипт «Micro_Mech_Strain.m».
- Нажмите «Выполнить», чтобы выполнить код, и выберите одно из сохраненных изображений, на котором прослеживаются фотообесцвеченные линии.
- После выбора убедитесь в правильности выбранных сопроводительных изображений, нажав кнопку ОК.
5. Создание изображений с цифровым преобразованием
ПРИМЕЧАНИЕ: Эти шаги необходимы только в том случае, если необходимо подтвердить точность алгоритма ALDIC с использованием изображений с цифровым преобразованием. Эти изображения имитируют однородные 2D-поля деформаций известной величины путем искусственного преобразования эталонного изображения.
- Загрузите код «Digital_strain.m» с GitHub (https://github.com/Szczesnytendon/TendonStrainCalc).
- Откройте и запустите код.
- При появлении запроса вставьте желаемые значения для максимальной приложенной деформации, приращения приложенной деформации и коэффициента Пуассона. Нажмите ОК.
ПРИМЕЧАНИЕ: Для этого эксперимента максимальная приложенная деформация составила 0,1 (10%), приращение приложенной деформации составило 0,02 (2%), и был использован коэффициент Пуассона, равный 1, что согласуется с экспериментальными данными испытания сухожилий на растяжение15,16. Код использует встроенную функцию MATLAB imwarp и входные значения (например, приращения деформации, коэффициент Пуассона) для создания изображений с цифровым преобразованием. - При появлении запроса выберите недеформированный эталонный образ.
- Для каждого приращения деформации отображается наложение эталонного изображения и преобразованного изображения. Преобразованное изображение будет сохранено в каталоге под названием «DigitallyTransformedX%Strain», где X — шаг деформации.
6. Расчет деформации и установка и применение кода проверки
- Загрузите папку «Strain Calculation and Validation Code» с GitHub (https://github.com/Szczesnytendon/TendonStrainCalc) и переместите все содержимое в рабочий каталог MATLAB
- Установите компилятор mex C/C++ в соответствии с Янгом и Бхаттачарьей12. Эти шаги кратко изложены ниже.
- Проверьте MATLAB, чтобы узнать, установлен ли компилятор mex C/C++, введя «mex -setup» в командном окне MATLAB и нажав Enter.
- Если появляется ошибка, указывающая, что компилятор не поддерживается или не присутствует, перейдите к шагам 6.3 и 6.4.
- Если ошибка отсутствует, перейдите к шагу 6.5
- Чтобы загрузить компилятор mex C/C++, перейдите по адресу https:/tdm-gcc.tdragon.net/ и выберите компилятор TDM-gcc.
- Установите загруженный компилятор в известное расположение.
- Вернитесь в командное окно MATLAB и введите: "setenv("MW_MINGW64_LOC","[Введите здесь путь установки]")". Например, это может быть "setenv("MW_MINGW64_LOC","C:\TDM-GCC-64")". Если эта команда выполняется успешно, компилятор mex установлен правильно.
- Введите сценарий функции «main_aldic.m» и измените строку 22 в соответствии с командой, выполненной на шаге 6.5.
- Откройте скрипт «Strain_calc_and_validate.m».
- Нажмите кнопку «Выполнить», чтобы начать анализ изображения.
- При появлении запроса измените значения параметров ALDIC по своему усмотрению.
ПРИМЕЧАНИЕ: Размер окна должен быть от 0,25 до 1 раза больше размера подмножества. Дополнительные сведения о выборе параметров см. в онлайн-руководстве пользователя: (https://www.researchgate.net/publication/344796296_Augmented_Lagrangian_Digital
_Image_Correlation_AL-DIC_Code_Manual).- В данном исследовании использовались следующие значения:
Размер подмножества (пикселей): 20
Размер окна (пикселей): 10
Метод решения ALDIC: конечная разность (1)
Параллельные вычисления не использовались (1)
Метод вычисления начального предположения: многосеточный поиск на основе пирамиды изображений (0)
- В данном исследовании использовались следующие значения:
- При появлении запроса установите флажок «Да», чтобы алгоритм автоматически сохранял среднее значение, стандартное отклонение и 2D-карты для нужного набора переменных (например, x-деформация, y-деформация, деформация сдвига, плохие области и т. д.). Выберите, какие переменные следует сохранить, и нажмите Ok.
- При появлении запроса измените параметры по своему усмотрению.
- В этом эксперименте использовались следующие значения:
Окружающие точки для расчета деформации (числоП): 12
Коэффициент корреляции для идентификации плохого региона (corr_threshold): 0.5
Размер подобласти (в пикселях) для анализа неверных областей (Subsize): 32
- В этом эксперименте использовались следующие значения:
- При появлении запроса выберите папку, содержащую переименованные z-проекции максимальной интенсивности. Обратите внимание, что программное обеспечение автоматически выполняет инкрементальный ALDIC для определения напряженных полей деформированных изображений. То есть каждое деформированное изображение служит новым «эталонным» изображением для следующего деформированного изображения. Это повышает точность результатов (дополнительный рисунок 2) по сравнению с выполнением кумулятивного ALDIC, где каждое деформированное изображение сравнивается с исходным эталонным изображением (деформация 0%). Чтобы выполнить кумулятивный анализ, загрузите изображения, но выберите только исходное эталонное изображение и деформированное изображение, которое вас интересует.
ПРИМЕЧАНИЕ: Нормальная деформация рассчитывается как λ - 1, где λ - растяжение ткани. Растяжение ткани рассчитывается по формуле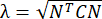 , где N = [1 0]T или [0 1]T для направления x и направления y, соответственно, и C = F T F, где F — градиент деформации, рассчитанный с использованием точек «numP», окружающих каждую точку данных, выводимую алгоритмом ALDIC. Деформация сдвига вычисляется как
, где N = [1 0]T или [0 1]T для направления x и направления y, соответственно, и C = F T F, где F — градиент деформации, рассчитанный с использованием точек «numP», окружающих каждую точку данных, выводимую алгоритмом ALDIC. Деформация сдвига вычисляется как 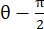 , где
, где 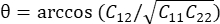 .
. - При появлении запроса щелкните левой кнопкой мыши, чтобы создать четырехточечный многоугольник, чтобы определить область, представляющую интерес для измерения деформаций. Начните с точки в левом верхнем углу и назначьте последующие точки по часовой стрелке.
ПРИМЕЧАНИЕ: Переменная «Хранилище», сохраненная в рабочем пространстве MATLAB, содержит все значения для средней деформации x, стандартного отклонения деформации x, средней деформации y, стандартного отклонения деформации y, средней деформации сдвига, стандартного отклонения деформации сдвига и процента поврежденных областей. Плохие области определяются в соответствии с анализом коэффициентов корреляции в интересующей области, выбранной на шаге 6.13. В папке "NuclearTrackingResults" (которую можно переименовать, скорректировав строки 555 и 556) хранятся все графики, указанные на шаге 6.10. Эта папка также содержит файл электронной таблицы с именем «Результаты», в котором хранятся все средние значения и стандартные отклонения, указанные в шаге 6.10.
Результаты
Перед анализом полей деформации в реальных образцах тканей протокол ALDIC был сначала проверен с использованием цифровых напряженных / преобразованных изображений ядер в ахилловых сухожилиях мыши. В частности, изображения были преобразованы для получения в цифровом виде однородных деф...
Обсуждение
Цель этой статьи состояла в том, чтобы предоставить проверенный метод с открытым исходным кодом для измерения 2D-полей деформации в сухожилиях при растягивающей нагрузке. Основа программного обеспечения была основана на общедоступном алгоритме ALDIC12. Этот алгоритм был встр...
Раскрытие информации
У всех авторов нет конфликтов интересов, подлежащих раскрытию.
Благодарности
Эта работа финансировалась Национальными институтами здравоохранения (R21 AR079095) и Национальным научным фондом (2142627).
Материалы
| Name | Company | Catalog Number | Comments |
| 5-DTAF (5-(4,6-Dichlorotriazinyl) Aminofluorescein), single isomer | ThermoFisher | D16 | |
| Calipers | Mitutoyo | 500-196-30 | |
| Confocal Microscope | Nikon | A1R HD | |
| Corning LSE Vortex Mixer | Coning | 6775 | |
| DRAQ5 Fluorescent Probe Solution (5 mM) | ThermoFisher | 62554 | |
| MATLAB | MathWorks | R2022b | |
| Tensile Loading Device | N/A | N/A | Tensile loading device described in Peterson et al, 2020. (ref 13) |
| Tube Revolver Rotator | ThermoFisher | 88881001 |
Ссылки
- Devkota, A. C. Distributing a fixed amount of cyclic loading to tendon explants over longer periods induces greater cellular and mechanical responses. Journal of Orthopaedic Research. 11 (4), 1609-1612 (2007).
- Sun, H. B., et al. Cycle-dependent matrix remodeling gene expression response in fatigue-loaded rat patellar tendons. Journal of Orthopaedic Research. 28 (10), 1380-1386 (2010).
- Shepherd, J. H., Screen, H. R. C. Fatigue loading of tendon. International Journal of Experimental Pathology. 94 (4), 260-270 (2013).
- Paschall, L., Pedaprolu, K., Carrozzi, S., Dhawan, A., Szczesny, S. Mechanical stimulation as both the cause and the cure of tendon and ligament injuries. Regenerative Rehabilitation: From Basic Science to the Clinic. , 359-386 (2022).
- Andarawis-Puri, N., Ricchetti, E. T., Soslowsky, L. J. Rotator cuff tendon strain correlates with tear propagation. Journal of Biomechanics. 42 (2), 158-163 (2009).
- Cheng, V. W. T., Screen, H. R. C. The micro-structural strain response of tendon. Journal of Materials Science. 42 (21), 8957-8965 (2007).
- Luyckx, T., et al. Digital image correlation as a tool for three-dimensional strain analysis in human tendon tissue. Journal of Experimental Orthopaedics. 1 (1), 7 (2014).
- Duncan, N. A., Bruehlmann, S. B., Hunter, C. J., Shao, X., Kelly, E. J. In situ cell-matrix mechanics in tendon fascicles and seeded collagen gels: Implications for the multiscale design of biomaterials. Computer Methods in Biomechanics and Biomedical Engineering. 17 (1), 39-47 (2014).
- Arnoczky, S. P., Lavagnino, M., Whallon, J. H., Hoonjan, A. In situ cell nucleus deformation in tendons under tensile load; A morphological analysis using confocal laser microscopy. Journal of Orthopaedic Research. 20 (1), 29-35 (2002).
- Screen, H. R. C., Bader, D. L., Lee, D. A., Shelton, J. C. Local strain measurement within tendon. Strain. 40 (4), 157-163 (2004).
- Fung, A. K., Paredes, J. J., Andarawis-Puri, N. Novel image analysis methods for quantification of in situ 3-D tendon cell and matrix strain. Journal of Biomechanics. 67, 184-189 (2018).
- Yang, J., Bhattacharya, K. Augmented Lagrangian digital image correlation. Experimental Mechanics. 59 (2), 187-205 (2019).
- Peterson, B. E., Szczesny, S. E. Dependence of tendon multiscale mechanics on sample gauge length is consistent with discontinuous collagen fibrils. Acta Biomaterialia. 117, 302-309 (2020).
- Humphrey, J. D., O'Rourke, S. L. . An Introduction to Biomechanics. , (2015).
- Reese, S. P., Weiss, J. A. Tendon fascicles exhibit a linear correlation between Poisson's ratio and force during uniaxial stress relaxation. Journal of Biomechanical Engineering. 135 (3), 34501 (2013).
- Ahmadzadeh, H., Freedman, B. R., Connizzo, B. K., Soslowsky, L. J., Shenoy, V. B. Micromechanical poroelastic finite element and shear-lag models of tendon predict large strain dependent Poisson's ratios and fluid expulsion under tensile loading. Acta Biomaterialia. 22, 83-91 (2015).
- Szczesny, S. E., Elliott, D. M. Interfibrillar shear stress is the loading mechanism of collagen fibrils in tendon. Acta Biomaterialia. 10 (6), 2582-2590 (2014).
- Han, W. M., et al. Macro- to microscale strain transfer in fibrous tissues is heterogeneous and tissue-specific. Biophysical Journal. 105 (3), 807-817 (2013).
- Pedaprolu, K., Szczesny, S. E. A novel, open-source, low-cost bioreactor for load-controlled cyclic loading of tendon explants. Journal of Biomechanical Engineering. 144 (8), 084505 (2022).
- Gatt, R., et al. Negative Poisson's ratios in tendons: An unexpected mechanical response. Acta Biomaterialia. 24, 201-208 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены