Method Article
בידוד נוירונים היפותלמיים ממוקדים למחקרים על ויסות הורמונלי, מטבולי וחשמלי
In This Article
Summary
כאן אנו מציגים פרוטוקול לגידול תת-סוגים ספציפיים של תאי היפותלמוס בתרבית. ניתן לבחור את התאים על סמך סמני ממברנה אופורטוניים/ייחודיים ולהשתמש בהם ביישומים רבים, כולל בדיקות אימונופלואורסצנטיות, אלקטרופיזיולוגיות וביוכימיות.
Abstract
ההיפותלמוס מווסת תהליכים מטבוליים בסיסיים על ידי שליטה בתפקודים מגוונים כמו צריכת מזון, טמפרטורת הגוף ושחרור הורמונים. מכיוון שתפקודי ההיפותלמוס נשלטים על ידי תת-קבוצות ספציפיות של אוכלוסיות נוירונים, היכולת לבודד אותם מספקת כלי מרכזי לחקר מנגנונים מטבוליים. בהקשר זה, המורכבות העצבית של ההיפותלמוס מציבה אתגרים יוצאי דופן.
מסיבות אלה, טכניקות חדשות, כגון מיון תאים מופעל מגנטית (MACS), נחקרו. מאמר זה מתאר יישום חדש של מיון תאים המופעלים מגנטית (MACS) באמצעות טכנולוגיית מיקרו-חרוזים כדי לבודד אוכלוסייה עצבית ממוקדת ממוחות של עכברים לפני הלידה. הטכניקה פשוטה ומבטיחה תרבית נוירונים היפותלמית ראשונית טהורה ביותר ובת קיימא עם יכולת שחזור גבוהה. ההיפותלמוס מנותק בעדינות, נוירונים מבודדים באופן סלקטיבי ומופרדים מתאי גלייה, ולבסוף, באמצעות נוגדן ספציפי לסמן פני התא, נבחרת אוכלוסיית העניין.
לאחר הבידוד, תאי עצב ממוקדים יכולים לשמש כדי לחקור את המאפיינים המורפולוגיים, החשמליים והאנדוקריניים שלהם ואת תגובותיהם בתנאים נורמליים או פתולוגיים. יתר על כן, בהתחשב בתפקידים המגוונים של ההיפותלמוס בוויסות הזנה, חילוף חומרים, מתח, שינה ומוטיבציה, מבט מקרוב על נוירונים ממוקדים וספציפיים לאזור עשוי לספק תובנה לגבי המשימות שלהם בסביבה מורכבת זו.
Introduction
ההיפותלמוס הוא אזור רב-ראשי במוח המתווך תפקודים אנדוקריניים, אוטונומיים, ויסצרליים והתנהגותיים, כולל האכלה, חילוף חומרים, שינה, טמפרטורת גוף, התנהגות חברתית וחשק מיני 1,2,3,4,5. הטרוגניות תפקודית מושגת על ידי שילוב סינרגטי של מנגנונים ביוכימיים וחשמליים: נוירונים היפותלמיים יורים פוטנציאלי פעולה ומפרישים ומשחררים הורמונים ונוירופפטידים כדי לווסת אזורים ואיברי מוח בגוף. לבסוף, נוירונים היפותלמיים מתרגמים מסרים הומיאוסטטיים מהגוף, ומגיבים במשוב לטווח ארוך וקצר ובתקנות הזנהקדימה 6.
הסביבה העצבית המורכבת של ההיפותלמוס כוללת נוירונים אנדוקריניים מגנוצלולאיים, שחרור אוקסיטוצין ווזופרסין; נוירונים פרוו-צלולריים, המעורבים בעיקר בוויסות הורמונלי מערכתי, ומשחררים, למשל, הורמון שחרור תירוטרופין (TRH), והורמון שחרור קורטיקוטרופין (CRH) לבלוטת יותרת המוח; נוירוני הקרנה פפטידרגיים גדולים, שחרור אורקסין והורמון ריכוז מלנין (MCH); ונוירונים פפטידרגיים פרוו-תאיים של גרעין ארקואט (ARC) המשחררים POMC (proopiomelanocortin) ו-AgRP (חלבון הקשור לאגוטי), הנקראים ARCPOMC ו-ARCAgRP, בהתאמה. יחד עם תאים מפרישים, נוירונים מעוררים ומעכבים אחרים, כולל נוירונים דופמינרגיים, גלוטמינרגיים ונוירונים GABAergic 7, מעורבים ביצירת מעגלים תוך-היפותלמיים וחוץ-היפותלמיים, ובכך יוצרים רשתות מתואמות בקנה מידה גדול של הטרוגניות תאית ניכרת8.
גיוון ההיפותלמוס היה אתגר שחוקרים מנסים להתגבר עליו במהלך 50 השנים האחרונות. כדי לחקור את ההטרוגניות הזו בהיפותלמי המתפתח, הבוגר והמזדקן, החוקרים, מצד אחד, משתמשים בריצוף RNA של תא בודד כדי לחקור ארגון עצבי, כמו גם חתימות מולקולריות ושעתוק (transcriptomic signatures). מאמץ זה סיפק מבט מעמיק על התפקידים המגוונים של נוירונים היפותלמיים והתייחס לקשרים בין זהות תאית לבין תפקידה האפשרי במערכת הפיזיולוגית 8,9,10. מצד שני, תפקודים עצביים נחקרו על ידי מניפולציות אופטוגנטיות וגישות התנהגותיות פוטומטריית סיבים, המאפשרות מבט מקרוב על מבנה המעגל. בשני העשורים האחרונים, טכנולוגיית Cre-recombinase אפשרה לחוקרים לעורר או לעכב באופן אונטוגני קבוצה ממוקדת של נוירונים תוך התבוננות בשינויים בהתנהגויות ובתגובות הגוף 6,11,12.
עם זאת, גישות אלה בוחנות את תפקודי ההיפותלמוס מנקודת מבט כללית מבלי לצלול עמוק יותר לתוך המנגנונים התאיים הספציפיים או הבסיס הביולוגי לתפקידם בסביבה ההיפותלמית המורכבת. כדי להתמודד עם זה, מעט מאוד מחקרים התמקדו בחקירת תכונות מולקולריות, ביוכימיות וחשמליות תוך שימוש בתרביות היפותלמוס ראשוניות הטרוגניות. מחקרים אלה ביקשו לנתח תהליכים עצביים ספציפיים בסביבה מורכבת ויצרו מודלים אינטגרטיביים של מנגנונים פיזיולוגיים13,14,15. עם זאת, תרבויות לא ספציפיות מציבות אתגרים משמעותיים. לדוגמה, הקישוריות הפיזיולוגית והפיזור האנטומי של תאי העצב משתבשים על-ידי ציפוי נוירונים מאזורים שונים בהיפותלמוס שבדרך כלל לא היו מתקשרים, מה שיוצר השפעות מבלבלות. בנוסף, לכל אזור תפקידים שונים ואוכלוסיות נוירונים מגוונות, מה שמקשה על חקר תהליכים ביולוגיים פשוטים.
כדי להתמודד עם אתגרים אלה, בעשור האחרון יושמו גישות חדשות לבידוד תאי עצב מעניינים, כגון אימונופנינג, מיון תאים מופעל פלואורסצנטי (FACS) ומיון תאים מגנטי מופעל (MACS). אימונופנינג היא אסטרטגיה המשמשת לטיהור תאים ממוקדים באמצעות צלחות מצופות נוגדנים לסדרה של בחירות לא עצביות (שליליות) ועצביות (חיוביות). בעוד טכניקה זו יכולה, באופן עקרוני, ליצור תרביות תאים מטוהרים תפוקה גבוהה, בפועל, משמש בעיקר עבור אסטרוציטים ואוליגודנדרוציטים שכן תאים אלה יכולים לעמוד בפני שעות של מניפולציה16,17. טכנולוגיית FACS היא כלי רב עוצמה למיון תאים על בסיס סמנים פלואורסצנטיים ומאפיינים תאיים באמצעות ציטומטריית זרימה18,19,20. עם זאת, מעט מאוד מחקרים השתמשו בשיטה זו כדי לבודד תאים לתרבית תאים. הטכניקה יקרה ודורשת כוח אדם מיומן מאוד לשימוש ותחזוקה; בנוסף, מאתגר לשמור על תאים ברי קיימא וסטריליים בסוף הליך המיון21. בסך הכל, MACS נראה טכניקה פשוטה ולא יקרה להשגת תרביות טהורות מאוד קיימא של נוירונים ראשוניים היפותלמוס. השיטה משתמשת בחרוזים מגנטיים המקושרים לתאים באמצעות נוגדן. זה מאפשר לבודד את התאים באמצעות השדה המגנטי של העמודה.
כאן אנו מתארים שיטה המבוססת על טכנולוגיית MACS, אשר משמשת בדרך כלל עם נוירונים קליפת המוח. פרוטוקול זה מאפשר לבודד, באופן עקרוני, נוירונים היפותלמיים קיימא וטהורים מאוד. במחקר זה אנו מכינים תרביות ראשוניות של תאי עצב המבטאים את קולטן הלפטין (LepR), כגון תאי עצב ARCPOMC ו-ARCAgRP , שנמצאים רק בגרעין ארקואט. תאי עצב אלה מגיבים ללפטין, הורמון אנורקסיגני המופרש על ידי רקמת השומן, בדרכים ביוכימיות וחשמליות. לכן, הבידוד של קבוצת נוירונים זו בתרבית מאפשר לחקור את התכונות ההורמונליות, המטבוליות והחשמליות שלהם במבחנה.
Protocol
הערה: מבט כללי על הליך הניסוי מומחש באופן גרפי באיור 1A. כל הניסויים בעכברים שבוצעו במחקר זה אושרו על ידי הוועדה לטיפול ושימוש בבעלי חיים של המוסד שלנו (IACUC). השתמשנו בעכברי C57BL6/J בני 3 חודשים, ששוכנו בוויבריום מאושר על ידי האגודה להערכה והסמכה של Laboratory Animal Care International (AAALAC), תחת השגחתו של וטרינר. העכברים חיו בכלובים גדולים, עם מחזור אור-חושך של 12 שעות, והוזנו אד ליביטום.
1. התעברות ואימות הריון
- מקם עכברים מכל רקע וגנוטיפ של עניין לרבייה. רשום את התאריך והמשקל של הנקבה לפני ההתעברות.
- לאחר 6 שעות, בדוק את הנקבה עבור לוח עם בדיקה. אם הלוח קיים, להפריד את הנקבה מן הזכר. אם הפלאק אינו נוכח, השאירו את הנקבה בכלוב עד למחרת, ואז הפרידו את העכברים.
- בימים 7, 10 ו -14 לאחר ההתעברות, לשקול את הנקבה כדי לאשר הריון.
2. מדיה, צלחת 24 בארות והכנת חומרים
- ביום בידוד התא, יש להניח את כיסויי הזכוכית המצופים פולי-D-ליזין מוכנים לשימוש (ראו טבלת חומרים) בצלחת בת 24 בארות כדלקמן:
- מתחת למכסה מנוע ביולוגי, יש לעקר אריזה אחת המכילה 15 כיסויים עם 70% אתנול ולתת לה להתייבש. פתחו את האריזה והניחו את הכיסויים בצלחת בקוטר 60 מ"מ. נערו את הצלחת אופקית כדי להפריד בין הכיסויים. לאחר מכן, הפוך את הצלחת כדי להרים כיסויים בודדים כדי להיות ממוקם בבארות של צלחת 24 בארות.
- שטפו את הכיסויים פעם אחת עם 1.0 מ"ל של תמיסת מלח מאוזנת סטרילית של האנק (HBSS) למשך 5 דקות.
- בינתיים, הכינו 20.0 מ"ל של חומרי ציפוי באופן הבא: ל-18.31 מ"ל BME (Basal Medium Eagle, + Earle's Salts), בתוספת 1.0 מ"ל של סרום בקר עוברי מומת בחום (FBS), הוסיפו 200 מיקרוליטר נתרן פירובט (מציר 100x), 200 מיקרוליטר גלוטמין (ממלאי של 200 ננומטר) ו-100 מיקרוליטר פניצילין/סטרפטומיצין (ממלאי של 200x).
- החלף את HBSS בבארות עם 1.0 מ"ל של מדיה ציפוי ומניחים את הצלחת באינקובטור ב 37 ° C.
- בעזרת מבער בונזן, מלטשים באש שלוש פיפטות פסטר בקטרים הולכים ופוחתים. מחזיקים את הצינור ביד אחת, מכניסים את הקצה ללהבה ומסירים אותו במהירות. חזרו על התהליך עד שהקצה מחליק והקוטר מצטמצם לקוטר הרצוי (מוערך על ידי העין).
3. הכנת מגיב לדיסוציאציה של רקמות עצביות, בהתאם להוראות ערכת הדיסוציאציה העצבית
- לאחר חימום מאגר העיכול 1 בטמפרטורת החדר, הכינו את Enzyme Mix 1 על ידי ערבוב 50 μL של אנזים 1 עם 1.91 מ"ל של Buffer 1 ואת Enzyme Mix 2 על ידי ערבוב 15 μL של אנזים 2 עם 30 μL של Digestion Buffer 2. התערובות מספיקות כדי לשמש לרקמת המוח של כל העוברים.
- הכינו אלבומין בסרום בקר 0.5% (BSA) ב-HBSS, לדוגמה, 0.25 גרם ב-50.0 מ"ל HBSS.
4. חילוץ עוברים
- הוציאו שני מלקחיים דקים ישרים, מלקחיים נקודתיים מעוקלים וזוג אחד של מספריים כירורגיים עדינים ועיקרו אותם באתנול 70% לפני השימוש. לאחר מכן, מלאו את צלחות הפטרי ב- HBSS.
- יש להרדים סכר הרה E14-E16 אחד בתא CO2 ולבצע פריקת צוואר הרחם.
הערה: יש לבצע את השלבים הבאים מתחת למכסה המנוע בתנאים סטריליים: - לעקר את הבטן עם 70% אתנול. לפתוח את חלל הבטן מן סימפיזת הערווה לתהליך xiphoid של כלוב הצלעות עם מספריים כירורגיים ומלקחיים.
- מוציאים את קרן הרחם ומניחים אותה בצלחת בקוטר 100 מ"מ מלאה בHBSS קר כקרח ושוטפים היטב.
- לחלץ ולהפריד את כל העוברים מהרחם עם מלקחיים עדינים. ערפו במהירות את ראשיהם של העוברים בעזרת מספריים כירורגיים עדינים ו/או מלקחיים. מניחים את הראשים בצלחת פטרי 60 מ"מ מלאה HBSS.
5. מיצוי היפותלמוס, איסוף, ודיסוציאציה של רקמות
- הניחו מלקחיים עדינים בחלל העין כדי להחזיק את המוח. בעזרת המלקחיים העדינים האחרים, הסירו את העור ואת הגולגולת על ידי קילוף עד שהמוח נראה לעין. להבדיל את המוח מרקמות אחרות על סמך המראה הלבן שלו. העור והגולגולת ורודים ועשירים בכלי דם.
- הוציאו את המוח מהגולגולת באמצעות מלקחיים נקודתיים מעוקלים וגרפו את המוח מנורות הריח, והפכו אותו הפוך.
- כעת קליפת המוח היא גחון, וההיפותלמוס נראה באופן דורסלי על פני השטח העליונים (איור 1B). בעזרת המלקחיים המעוקלים, הסירו את שכבת קרומי המוח וכלי הדם עד שהמוח נראה לבן וצלול.
- בעזרת המלקחיים המעוקלים, מפרידים את אזור ההיפותלמוס משאר המוח.
- חותכים את ההיפותלמוס ל 3-4 חתיכות קטנות עם pipet, להעביר את החתיכות לתוך צינור 15 מ"ל.
- חזור על השלבים עבור העוברים האחרים בזמן שהצינור על קרח.
- מלאו את הצינורית ב-6.0 מ"ל HBSS ותנו לרקמה לשקוע, הסירו את הסופר-נטנט והוסיפו את Enzyme Mix 1. מערבבים בעדינות ומסעירים את הצינור כדי למנוע את הרקמה.
- לדגור על הצינור באמבט מים של 37 מעלות צלזיוס למשך 15 דקות ולעורר את הרקמה כל 5 דקות כדי להשהות מחדש את הרקמה.
- לאחר 15 דקות, הוסיפו 30 מיקרוליטר של תערובת אנזימים 2. לנתק את רקמת המוח באמצעות פיפטה פסטר עם הקוטר הגדול ביותר (<1 מ"מ). פיפט למעלה ולמטה פי 10 מבלי ליצור בועות.
- לדגור במשך 10 דקות ב 37 ° C באמבט המים. בעדינות לעורר את הצינור כדי להשעות מחדש את הרקמה כל 5 דקות.
- לאחר 10 דקות, הוסיפו את 15 μL הנותרים של תערובת אנזימים 2. נתקו את הרקמה פי 10 עם שתי פיפטות מלוטשות אש אחרות בקוטר הולך ופוחת, למעלה ולמטה מבלי ליצור בועות.
- לצינור עם הרקמה המנותקת, הוסף מיד 10.0 מ"ל של HBSS-0.5% BSA וצנטריפוגה ב 300 × גרם למשך 10 דקות בטמפרטורת החדר.
- שאפו את הסופרנאטנט והשהו מחדש את גלולת התא ב-1.0 מ"ל של HBS-0.5% BSA.
6. ספירת תאים
- דללו את תרחיף התא ביחס 1:5 באמצעות HBSS-0.5% BSA.
- מניחים 10 μL של תרחיף התא המדולל בתא ספירה של נויבאואר.
- תחת מיקרוסקופ שדה בהיר, ספרו רק את התאים שנמצאים בארבעת הריבועים הפינתיים של התא. חישוב הממוצע ולהכפיל ב 5 × 104.
הערה: ודא שיש >106 תאים להמשיך לבידוד תאים; מספר התא האופטימלי הוא 107.
7. בחירה שלילית
הערה: ברירה שלילית מאפשרת למשתמשים להשיג תרבית נוירונים ראשונית טהורה על-ידי הפרדת תאים עצביים ולא-עצביים. השתמש בתמיסות מקוררות מראש.
- צנטריפוגה את מתלה התא ב 300 × גרם במשך 3 דקות (צנטריפוגה ניתן להאריך עד 10 דקות). שאפו בעדינות את הסופרנאטנט והשהו מחדש את הגלולה לריכוז של 107 תאים ב-80 מיקרוליטר של HBSS-0.5% BSA.
- הוסיפו 20 μL של קוקטייל נוגדנים ביוטין של תאים לא עצביים ודגרו במשך 5 דקות ב-4°C.
- שטפו את התאים כדי להסיר נוגדנים חופשיים עם 2.0 מ"ל של HBSS-0.5% BSA וצנטריפוגה ב 300 × גרם במשך 3 דקות.
- שאפו בעדינות את הסופרנאטנט והשהו מחדש את הגלולה ב-80 מיקרוליטר של HBSS-0.5% BSA. הוסיפו 20 מיקרוליטר של מיקרו-כדוריות אנטי-ביוטין, ערבבו היטב ודגרו במשך 10 דקות ב-4°C.
- הוסף 0.5 מ"ל של HBSS-0.5% BSA עבור עד 107 תאים והמתן עד שהעמוד המגנטי מוכן.
8. הפרדה מגנטית, בחירה שלילית
הערה: הפרדה מגנטית היא שלב מכריע המאפשר הפרדה של תאים שאינם עצביים מתאי העצב. הדגימה שמכילה תאים עצביים ולא-עצביים מועברת דרך השדה המגנטי, והתאים הלא-עצביים, שקשורים לקומפלקס ביוטין-נוגדנים-חרוזים מגנטיים, לכודים בטור (איור 1C). התאים העצביים החופשיים מדוללים דרך העמודה ונאספים בצינור של 15 מ"ל.
- הכינו את המעמד (הכלול בערכה) עם המפריד ועמודת הטרשת הנפוצה כפי שמוצג באיור 1C.
- פתח את העמודה והגדר את המעמד רק כאשר התאים מוכנים להפרדה.
- יש לשטוף את העמוד עם 0.5 מ"ל של HBSS-0.5% BSA. המתן עד שהתמיסה תפסיק לטפטף.
- כדי לאסוף תאים עצביים, מניחים צינור של 15 מ"ל מתחת לעמודה ומעבירים 0.5 מ"ל של תרחיף התא דרך העמודה. לאסוף את eluate בצינור עד שהוא מפסיק לטפטף. כדי ללכוד תאים עצביים שיורית, לשטוף את עמודה 3 x 0.5 מ"ל של HBSS-0.5% BSA.
- כדי לאסוף תאים שאינם נוירונים, הסר את העמוד מהמגנט והנח אותו בתוך צינור חדש של 15 מ"ל. הוסף 1.0 מ"ל של HBSS--0.5% BSA לעמודה והשתמש בבוכנה כדי לאסוף את התאים הלא-עצביים המסומנים מגנטית.
- צנטריפוגה את התאים העצביים והלא עצביים ב 300 × גרם במשך 3 דקות. שאפו בעדינות את הסופרנאטנט והשהו מחדש את התאים ב-1.0 מ"ל של HBSS-0.5% BSA. ספור את התאים כפי שתואר קודם לכן בסעיף 6.
- במידת הצורך, צלחת את התאים שאינם עצביים בצלחת 24 באר; אחרת השליכו אותם.
9. בחירה חיובית
הערה: ברגע שמתקבלת השעיה טהורה של תאי עצב, מתבצעת ברירה חיובית כדי לבודד את תאי היעד. ניתן לבודד תאים באמצעות נוגדן מצומד ביוטין ספציפי עבור אנטיגן פני השטח. הנוגדן מוכר על ידי חרוזים מגנטיים אנטי ביוטין. על ידי הזרמת תרחיף התא דרך העמודה, רק התאים המעניינים לכודים בשדה המגנטי.
- צנטריפוגה את תרחיף התא העצבי הטהור ב 300 × גרם במשך 3 דקות. שאפו בעדינות את הסופרנאטנט והשהו מחדש את הגלולה ב-80 מיקרוליטר של HBSS-0.5% BSA. יש להוסיף את הנוגדן הספציפי בהתאם להוראות היצרן ולדגור בטמפרטורה של 4°C למשך 10 דקות.
הערה: אם מחפשים תאים המבטאים את ה-LepR, אנו מציעים נוגדן Mouse Leptin R Biotinylated (ראה טבלת חומרים) בריכוז של 0.50 מיקרוגרם/106 תאים. - יש לשטוף את עודפי הנוגדן עם 2.0 מ"ל של HBSS-0.5% BSA וצנטריפוגה ב-300 × גרם למשך 3 דקות.
- הסר את הסופרנטנט, השהה מחדש את הגלולה ב 80 μL של HBSS-0.5% BSA, והוסף 20 μL של מיקרו-חרוזים אנטי-ביוטין. יש לדגור ב-4°C למשך 10 דקות.
- עבור כל 107 תאים, הוסף 0.5 מ"ל של HBSS-0.5% BSA והמתן עד שהעמוד המגנטי מוכן.
10. הפרדה מגנטית, בחירה חיובית
- הכן את המעמד עם המפריד ועמודת MS. יש לשטוף את עמודת הטרשת הנפוצה עם 0.5 מ"ל של HBSS-0.5% BSA. חכו עד שהטפטוף ייפסק.
- מניחים צינור של 15 מ"ל מתחת לעמודה, מעבירים 0.5 מ"ל של תרחיף התא דרך העמודה, ואוספים את האלואט המרכיב את התאים העצביים הלא ספציפיים. כדי לנקות את העמודה של תאים עצביים לא ספציפיים שיורית, לשטוף עם 3 x 0.5 מ"ל של HBSS-0.5% BSA.
- הסר את העמוד מהמגנט, הכנס אותו לצינור חדש של 15 מ"ל והוסף 1.0 מ"ל של HBSS-0.5% BSA. השתמש בבוכנה כדי לשטוף את תאי היעד.
- צנטריפוגה שני צינורות ב 300 × גרם במשך 3 דקות. הסר בעדינות את supernatant ו resuspend אותו ב 0.5 מ"ל של ציפוי בינוני.
- ספור את התאים כפי שתואר קודם לכן בסעיף 6.
- צלחת הן תאים ממוקדים כבקרה חיובית ותאים לא ספציפיים כבקרה שלילית בצפיפות של 120,000-200,000 תאים / מ"מ3 בלוח 24 בארות שהוכן קודם לכן כמתואר בסעיף 2 ודגרה ב 37 ° C ב 5% CO 2, 9% O2, ו 95% לחות במשך 12 שעות.
11. תחזוקת תרבית תאים
- הכינו 20 מ"ל של מדיום תרבית עם 19.2 מ"ל של מדיום תרבית עצבית, 400 מיקרוליטר של תוסף B27 (ממלאי של פי 50), 200 מיקרוליטר של גלוטמין (ממלאי של 200 מיקרומטר) ו-100 מיקרוליטר של פניצילין/סטרפטומיצין (ממלאי של פי 200).
- החלף את אמצעי הציפוי מ -24 צלחת באר המכילה תאים עצביים או לא עצביים.
- יש לשטוף עם 2 x 1.0 מ"ל של HBSS.
- הוסף 1.0 מ"ל של מדיה תרבותית.
- רענן את המדיה כל 2/3 ימים על ידי החלפת 0.5 מ"ל של מדיה ישנה עם 0.5 מ"ל של מדיה טרייה.
הערה: ניתן לשמור תאים בתרבית ולהשתמש בהם עד 21 יום במבחנה (DIV21).
12. צביעת נוירון immunofluorescence
- 12 שעות לפני הצביעה, מכינים תמיסה המורכבת מ-50/50 מתנול ואצטון ומקררים אותה בטמפרטורה של -20°C למשך הלילה.
- לשטוף את הנוירונים בצלחת 24-well עם 2 x 1.0 מ"ל של 1x פוספט buffered מלוחים (PBS) במשך 5 דקות.
- החלף את תמיסת PBS ב- 1.0 מ"ל של תמיסת 50/50 ודגור בקרח למשך 20 דקות.
- יש לשטוף עם PBS אחד במשך 3 x 5 דקות.
- חסום את תאי העצב עם 3% BSA ב-1x PBS למשך שעה אחת בטמפרטורת החדר.
- הכן את תמיסת הנוגדנים הראשונית ב- 3% BSA ב- 1x PBS, תוך שימוש בריכוז הנוגדנים המוזכר בהוראות היצרן. הנוגדנים והריכוזים בהם נעשה שימוש מפורטים בטבלת החומרים.
- החליפו את תמיסת החסימה בתמיסת הנוגדנים הראשונית ודגרו בטמפרטורה של 4°C למשך הלילה.
- שטפו את התאים במשך 3 x 10 דקות עם 1x PBS.
- הכינו את תמיסת הנוגדנים המשנית עם 3% BSA ב-1x PBS, תוך שימוש בריכוזי הנוגדנים בהתאם להוראות היצרן. הנוגדנים המשניים המשמשים מפורטים בטבלת החומרים.
- לדגור את התאים עם תמיסת נוגדנים משנית בטמפרטורת החדר במשך 1 שעות.
- שטפו את התאים במשך 3 x 10 דקות עם 1x PBS.
- השאר את הנוירונים ב 1x PBS במהלך הליך הרכבה. הניחו טיפה קטנה של אמצעי הרכבה (עם או בלי 4',6-diamidino-2-phenylindole לזיהוי גרעיני) על שקופית המיקרוסקופ. חלצו מכסה זכוכית אחד המכיל נוירונים עם מלקחיים וטפחו על צד הכיסוי על ממחטת נייר כדי לייבש את עודפי PBS. הפוך את תלוש הכיסוי על מדיום ההרכבה, וודא שהנוירונים פונים לשקופיות המיקרוסקופ; לחץ בעדינות והסר את מדיית ההרכבה העודפת עם נייר טישו.
- שקופיות המיקרוסקופ מוכנות לניתוח באמצעות שדה בהיר או מיקרוסקופ קונפוקלי.
תוצאות
מאמר זה מתאר פרוטוקול לבידוד תאי עצב ממוקדים בהיפותלמוס (איור 1). היקף השיטה הוא ללמוד מאפיינים עצביים ספציפיים בהקשר מבוקר ומבודד. כך חולצו עוברי עכברים מהסכרים ההריוניים ב-E14-E16. קרומי המוח הוסרו, וההיפותלמוס בודד משאר המוח. הרקמה נותקה בעדינות עם שתי תערובות של אנזימים שהוכנו זה עתה באמצעות ערכת הדיסוציאציה הנזכרת. ראשית, תאים לא-עצביים הופרדו מתאי עצב – גליה, מיקרוגליה, ותאי עצב נאספו באותו תרחיף חד-תאי. לשם כך, תאים לא-עצביים סומנו באמצעות קוקטייל של נוגדנים המזהים אפיטופים שאינם נוירונים. לאחר הדגירה, קומפלקס תאי הנוגדנים צומד עם מיקרו-כדוריות מגנטיות ולאחר מכן עבר דרך עמוד מגנטי כדי ללכוד את התאים הלא-עצביים.
שלב זה הניב שני תרחיפים של תאים, האחד מכיל תאים לא עצביים והשני מכיל תאים עצביים. ניתן היה לצפות את שני המתלים באופן מיידי. לחלופין, ניתן לבצע מניפולציה נוספת על השעיית התאים העצביים כדי להפריד תת-אוכלוסייה עצבית (השעיה ממוקדת) מהשאר באמצעות אותה אסטרטגיה. בהתבסס על הניסוי המעניין, התאים העצביים יכולים להיות מצופים מ 125,000 עד 200,000 תאים / מ"מ3. התרביות הפחות צפופות יכולות לשמש לניתוח תאי עצב ברזולוציה של תא יחיד: מהתפתחות אקסונלית, היווצרות סינפטית והעברה לאלקטרופיזיולוגיה. התרביות הצפופות יותר יכולות לשמש לניתוחים ביוכימיים, כולל מיצוי DNA ו-RNA, כתם מערבי, כתם דרומי, כתם צפוני, PCR בזמן אמת וריצוף RNA.
במחקר זה, LepR נועד לבודד תאי עצב המעורבים במערכת המלנוקורטין, כגון תאי העצב ARCPOMC ו-ARCAgRP. התאים צופו בצפיפויות שנעו בין 120,000 תאים/מ"מ 3, עבור נוירוני LepR+, ועד 200,000 תאים/מ"מ 3 עבור אוכלוסיות נוירונים גנריות. לאחר 48 שעות, תאי עצב מסוג LepR+ החלו ליצור תאי עצב (איור 2). ב- DIV4, הרחבות אקסונליות הראו התקדמות, בעוד תהליכים דנדריטיים החלו להופיע. ב-DIV6, תאי העצב היו מפותחים מספיק ולכן היו מוכנים לניתוח. ניסויי אימונופלואורסנציה על תאי עצב מסוג LepR+ הראו ביטוי של 99% של LepR (ירוק, איור 3A). לא נצפו תאי גלייה או תאים אחרים שאינם עצביים, מה שמאשר את טוהר התרבות העצבית הראשונית. האופי העצבי של התאים אושר על-ידי צביעת חלבון 2 (MAP2) הקשור למיקרוטובול, עם זיהוי של אקסונים ובליטות דנדריטיות (איור 3B). ב-DIV10, 30% מתאי LepR+ ביטאו POMC (אדום). זה צפוי מכיוון שרוב תאי LepR+ מבטאים POMC או AgRP. איור 3C,D ממחיש לוקליזציה משותפת בין אותות POMC ו-LepR. שימו לב שהקו-לוקליזציה הייתה בולטת בגרעין ובסביבתו, כצפוי.
תרביות כלליות המכילות אוכלוסיות עצביות הטרוגניות היפותלמיות שימשו לשליטה. אימונופלואורסנציה הדגימה קישוריות ופונקציונליות סינפטית, כפי שהוערכו על-ידי צביעה משותפת של Synapsin-1 (ירוק) ו-PSD 95 (אדום) (איור 4A,B). מספר תאי העצב מסוג LepR+ שהיו נוכחים בתרבית הכללית היה ~5%, אחוז התואם את הרעיון שרוב תאי העצב המבטאים LepR נבחרו במהלך תהליך ההפרדה המגנטית (תאי LepR+ מייצגים מתוארים באיור 4C,D). כל הנתונים שנוצרו או נותחו במהלך מחקר זה זמינים בכתובת https://doi.org/10.5061/dryad.cnp5hqc9c.
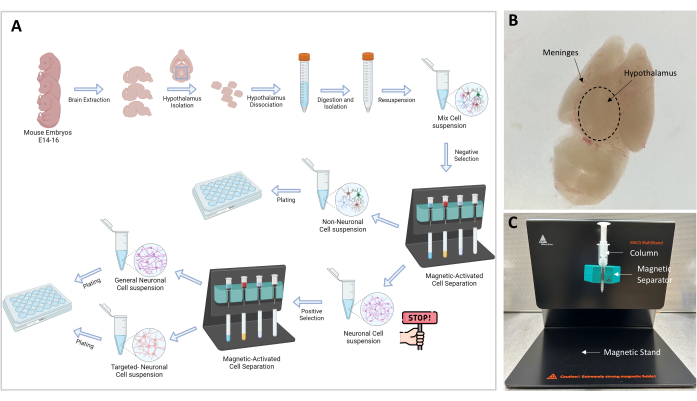
איור 1: תרשים זרימה ניסיוני והגדרתו . (A) ייצוג גרפי של הליך הניסוי. Go-no-go: ≥106 תאים נחוצים כדי להמשיך לבידוד תאים; מספר התא האופטימלי הוא 107. (B) תמונה מייצגת של מוח עובר E16. ההיפותלמוס וקרומי המוח מסומנים. (C) הגדרת MACS המשמשת להפרדה ולבידוד של תאי יעד. מעמד מגנטי, מפריד מגנטי ועמוד מסומנים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
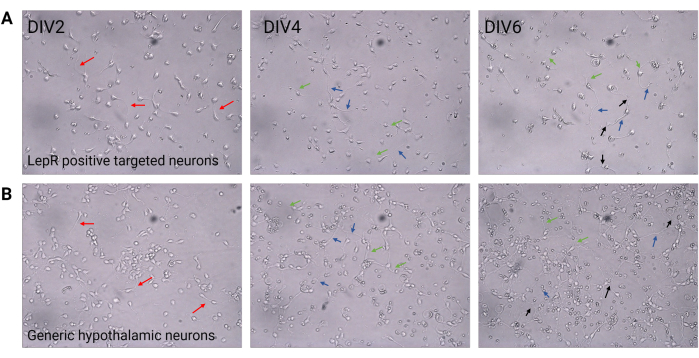
איור 2: תרבית עצבית בין DIV2 ל-DIV6. (A) תאי LepR+ שהתקבלו מהברירה החיובית מראים צפיפות תאים וקישוריות מופחתות, אך התפתחות נורמלית של נוירוטים (חיצים אדומים), אקסונים (חיצים כחולים) ודנדריטים (חיצים ירוקים). התאים צופו בצפיפות של 120,000 תאים למ"מ3. סרגל קנה מידה = 100 מיקרומטר. (B) נוירונים היפותלמיים גנריים, מצופים בצפיפות של 200,000 תאים/מ"מ3, מציגים תכונות התפתחות וגדילה נורמליות וקישוריות (חיצים שחורים). סרגל קנה מידה = 100 מיקרומטר. קיצורים: DIV = ימים במבחנה; LepR = קולטן לפטין. כל הנתונים שנוצרו או נותחו כדי לבנות נתון זה זמינים בעת https://doi.org/10.5061/dryad.cnp5hqc9c. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
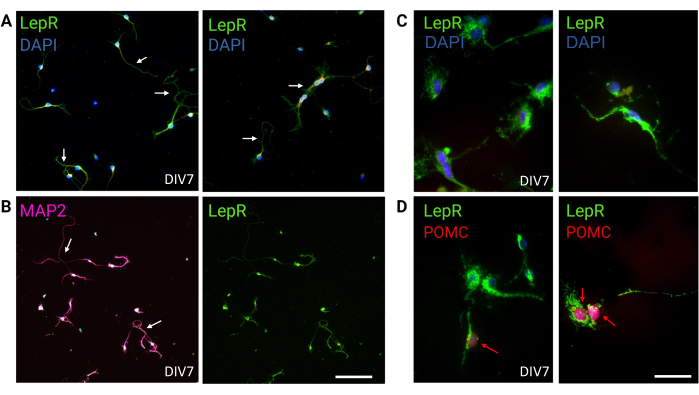
איור 3: תאי עצב In vivo ממוחזרים על-ידי תאי עצב מסוג LepR+ בתרבית. (A) תמונות מייצגות של תרבית תאי עצב המבטאים את ה-LepR (ירוק; DAPI הוא כחול). תשעים ותשעה אחוזים מהתאים ביטאו את ה-LepR. תאי עצב צופו בצפיפות של 120,000 תאים/מ"מ3. ב-DIV7, תאי העצב הציגו אקסונים מוארכים, התבגרות דנדריטית וקישוריות עצבית (חיצים). סרגל קנה מידה = 40 מיקרומטר. (B) אימונופלואורסנציה עם אנטי-MAP2 שימשה כדי לאשר את הטבע העצבי של התאים. מודגמות מורפולוגיות ספציפיות לתאי עצב כגון אקסונים, דנדריטים ובליטות (חיצים). סרגל קנה מידה = 40 מיקרומטר. (C) הגדלה של תאי LepR+. LepR בירוק ו-DAPI בכחול. סרגל קנה מידה = 10 מיקרומטר. (D) צביעה משותפת עם LepR (ירוק) ו-POMC (אדום). בערך 30% מתאי העצב מסוג LepR+ היו קו-אימונוריאקטיביים ל-POMC, שזוהה ברמת הגרעין (חיצים אדומים). סרגל קנה מידה = 10 מיקרומטר. קיצורים: DAPI = 4',6-diamidino-2-phenylindole; MAP2 = חלבון הקשור למיקרוטובול 2; POMC = proopiomelanocortin; LepR = קולטן לפטין. כל הנתונים שנוצרו או נותחו כדי לבנות נתון זה זמינים בעת https://doi.org/10.5061/dryad.cnp5hqc9c. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
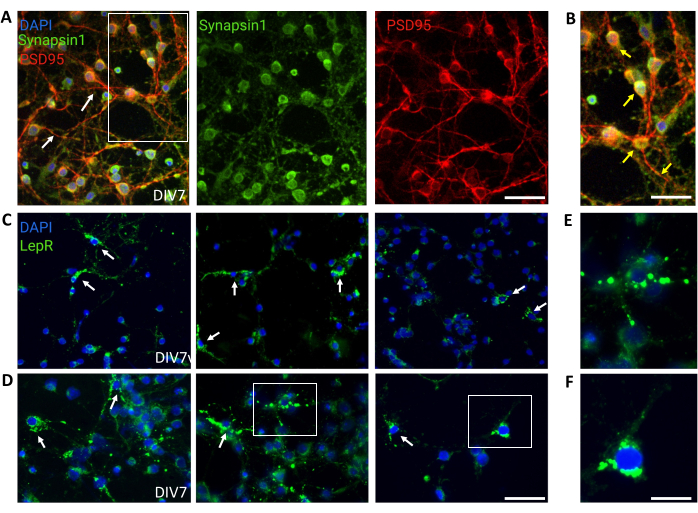
איור 4: תאי In vivo ממוחזרים על-ידי תאי עצב היפותלמיים גנריים בתרבית. (A) תמונות מייצגות של תרבית עצבית היפותלמית גנרית מוכתמת בסינפסין 1 (ירוק), PSD95 (אדום) ו-DAPI (כחול). תאי העצב הפגינו קישוריות מפותחת ופונקציונליות סינפטית (חיצים). סרגל קנה מידה = 40 מיקרומטר. (B) הגדלה של התיבה ב-(A), המציגה לוקליזציה משותפת של Synapsin 1 (ירוק) ו-PSD95 (אדום, חצים). סרגל קנה מידה = 20 מיקרומטר. (ג,ד) תמונות מייצגות המציגות תאי LepR+ בתרבית כללית. תאי LepR+ (ירוק) היוו ~5% מכלל התאים. תאי LepR+ מייצגים מסומנים באמצעות חצים. סרגל קנה מידה = 40 מיקרומטר. (ה,ו) הגדלות של הקופסאות ב- (C,D) המראות קולטני לפטין פונקטה ירוקים הממוקמים בסומה. סרגל קנה מידה = 20 מיקרומטר. כל הנתונים שנוצרו או נותחו כדי לבנות נתון זה זמינים בעת https://doi.org/10.5061/dryad.cnp5hqc9c. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
חקירת התכונות הביוכימיות והחשמליות של נוירונים היפותלמיים היא המפתח להבנת הבסיס המולקולרי של חילוף חומרים, ויסות תרמי, ניהול מצב רוח, התנהגות האכלה ועוד. עם זאת, ההטרוגניות העצבית של ההיפותלמוס הופכת מאמץ זה למאתגר, ויש צורך בשיטות לבודד ולחקור תת-אוכלוסיות היפותלמיות ספציפיות.
טכניקות In vivo משתמשות ב-CRE-רקומבינאז, אופטוגנטיקה, פוטומטריית סיבים והדמיית סידן. גישות אלה מאפשרות בעיקר לחקור את התכונות החשמליות של נוירונים היפותלמיים, ומעט מאוד שיטות זמינות כיום לחקור את התכונות הלא חשמליות שלהם. טכנולוגיית MACS שפותחה במחקר זה יכולה לספק טכניקה מקובלת לבידוד תת-אוכלוסיות נוירונים היפותלמיות ספציפיות במבחנה, ובכך לאפשר טיפולים וניתוחים ממוקדים. תרביות עצביות פשוטות יותר לניהול בהשוואה לתרביות משותפות של אוכלוסיות נוירונים שונות. בנוסף, תרבויות טהורות נמנעות מהשפעות מבלבלות הנובעות מנוכחות של גליה ומיקרוגליה. לפיכך, נוירונים מאותו אזור וסוג ההיפותלמוס יכולים להיחקר בתגובה לקלטים מטבוליים והורמונליים ספציפיים.
בפרוטוקול הזה בחרנו תאי עצב היפותלמיים שמבטאים את ה-LepR. תאי LepR+ מבודדים גודלו בתרבית כדי לחקור את המאפיינים התאיים, המורפולוגיים והמולקולריים שלהם, שקשה לחקור in vivo. טוהר התרבויות היה 99%, מה שתמך בדיוק השיטה. בנוסף, תאי LepR+ היו בריאים וברי קיימא ב-DIV7 עד DIV21.
טכניקה זו, עם זאת, יש כמה מגבלות. E18 או תרביות נוירונים טהורות ישנות יותר מאתגרות לתחזוקה. לכן, חלון החילוץ מוגבל ל- E14-E16. משמעות הדבר היא כי שינויים תאיים המתרחשים לאחר E16 מתפספסים. לדוגמה, הביטוי של קולטן הלפטין בנוירוני ARC עולה במהלך התקופה המוקדמת שלאחר הלידה22. הליך הבידוד חייב להתבצע מהר ככל האפשר כדי להפחית מתח תאי ומוות ולשפר את התשואה. ההליך יכול להימשך עד 5 שעות; לפיכך, חיוני לשמור על תנאים סטריליים ולהפחית את המניפולציה למינימום הדרוש. הברירה החיובית עלולה להוביל לתשואה נמוכה בשל הכמויות הנמוכות של הרקמה הזמינה, מה שמגביל את מספר הניסויים שניתן לבצע בתכשיר יחיד. נצפתה מוות עצבי מוגבר, כנראה בשל צפיפות תאים נמוכה וקישוריות עצבית מופחתת ותמיכה תוך עצבית.
יתר על כן, הנוגדן המכוון לאנטיגן המעניין חייב להיקשר לפני השטח של התא כדי להבטיח הפרדה נכונה; בדרך כלל, נוגדנים המשמשים ציטומטריית זרימה מתאימים לטכניקת MACS. אם הנוגדן לא שימש בעבר בשיטות הפרדת תאים, יש צורך בניסויי אימות וטיטרציה כדי לקבוע את השימוש והריכוז האידיאליים. מיצוי של תאים ממוקדים דורש סמן פני התא. כאן השתמשנו בנוגדן ביוטינילציה, אך באופן עקרוני ניתן להשתמש גם בנוגדנים מצומדים עם מולקולות אחרות, כגון FITC (fluorescein isothiocyanate) ו-PE (אנטי-פיקואריתרין מטוהרים). טכנולוגיית MACS יכולה להיות מיושמת גם על נוירונים המבטאים פלואורופור, כגון GFP או חלבון Tag אחר, מה שעשוי להגדיל את הספציפיות והתפוקה. אם לא נעשה שימוש בפלואורופור, החלופה תהיה לאשר את ביטוי המולקולה המעניינת על ידי אימונופלואורסנציה לפני ביצוע ניסויים בתאים חיים. מחקרים עתידיים יבחנו את תקפותן של חלופות אלה.
היבט חשוב אחד שמחקר זה לא התייחס אליו נוגע ל"נאמנות" של אוכלוסיות תת-עצביות. וידאנו שתאי העצב LepR+ בתרבית ביטאו POMC, שהוא חתימה של נוירוניPOMC מקוריים של ARC. עם זאת, יהיה צורך בבדיקות נוספות כדי להסיק כי תרביות נוירונים LepR+ לשחזר את עמיתיהם invivo הילידים. בסך הכל, פרוטוקול הבידוד העצבי MACS המוצג כאן עשוי לספק שיטה תקפה ויעילה לחקר מנגנוני היפותלמוס במבחנה שאחרת היה קשה לחקור in vivo.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
דמויות גרפיות נוצרו עם BioRender.com. עבודה זו נתמכה על ידי מענק NIA (R01AG060919) ומענק NSF (2030348) ל- FS.
Materials
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
References
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707(2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803(2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450(2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050(2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944(2021).
- Foo, L. C. Purification of rat and mouse astrocytes by immunopanning. 2013 (5), Cold Spring Harbor Protocols. 421-432 (2013).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), Cold Spring Harbor Protocols. 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594(2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12(2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved