Method Article
ホルモン、代謝、および電気的制御の研究のための標的視床下部ニューロンの分離
要約
ここでは、培養で特定の視床下部細胞サブタイプを増殖させるためのプロトコルを示します。細胞は、適切な/独自の膜マーカーに基づいて選択でき、免疫蛍光、電気生理学的、生化学的アッセイなど、多くのアプリケーションで使用できます。
要約
視床下部は、食物摂取量、体温、ホルモン放出などのさまざまな機能を制御することにより、基本的な代謝プロセスを調節します。視床下部の機能はニューロン集団の特定のサブセットによって制御されているため、それらを分離する能力は、代謝メカニズムを研究するための主要なツールを提供します。この点で、視床下部のニューロンの複雑さは例外的な課題をもたらします。
これらの理由から、磁気活性化セルソーティング(MACS)などの新しい技術が検討されています。この論文では、マイクロビーズ技術を使用して磁気活性化細胞ソーティング(MACS)の新しいアプリケーションについて説明し、出生前のマウスの脳から標的ニューロン集団を分離します。この技術はシンプルで、再現性の高い高純度で実行可能な初代視床下部ニューロン培養を保証します。視床下部を穏やかに解離させ、ニューロンを選択的に単離してグリア細胞から分離し、最後に、細胞表面マーカーに特異的な抗体を用いて、目的の集団を選択する。
単離されると、標的ニューロンを使用して、形態学的、電気的、内分泌的特徴、および正常状態または病理学的状態におけるそれらの応答を調査できます。さらに、摂食、代謝、ストレス、睡眠、モチベーションの調節における視床下部の多彩な役割を考えると、標的ニューロンと領域特異的ニューロンを詳しく調べることで、この複雑な環境における視床下部のタスクについての洞察が得られる可能性があります。
概要
視床下部は、摂食、代謝、睡眠、体温、社会的行動、性欲などの内分泌、自律神経、内臓、および行動機能を仲介する脳の多面的な領域です1,2,3,4,5。機能的不均一性は、生化学的および電気的メカニズムの相乗的な組み合わせによって達成される:視床下部ニューロンは活動電位を発火し、ホルモンおよび神経ペプチドを分泌および放出して身体の脳領域および器官を調節する。最後に、視床下部ニューロンは、身体からの恒常性メッセージを翻訳し、長期的および短期的なフィードバックとフィードフォワード規制で応答します6。
視床下部の複雑なニューロン環境は、オキシトシンおよびバソプレッシンを放出する大細胞内分泌ニューロンを含む。主に全身ホルモン調節に関与し、例えば甲状腺刺激ホルモン放出ホルモン(TRH)およびコルチコトロピン放出ホルモン(CRH)を下垂体に放出するパルボ細胞ニューロン。オレキシンおよびメラニン濃縮ホルモン(MCH)を放出する大きなペプチド作動性投射ニューロン;弓状核(ARC)のパルボ細胞ペプチド作動性ニューロンは、それぞれARCPOMCおよびARC AgRPと名付けられたPOMC(プロオピオメラノコルチン)およびAgRP(アグーチ関連タンパク質)を放出する。分泌細胞とともに、ドーパミン作動性ニューロン、グルタミン作動性ニューロン7、GABA作動性ニューロンを含む他の興奮性および抑制性ニューロンが視床下部内および視床下部外回路の形成に関与し、それによってかなりの細胞不均一性の大規模な協調ネットワークを作成します8。
視床下部の多様性は、研究者が過去50年間克服しようとしてきた課題でした。視床下部の発達、成熟、および老化におけるこの不均一性を研究するために、研究者は、一方では、単一細胞RNAシーケンシングを使用して、ニューロン組織、ならびに分子およびトランスクリプトームシグネチャを調査してきました。この取り組みは、視床下部ニューロンの多彩な役割についての洞察に満ちた調査を提供し、細胞の同一性と生理学的システムにおけるその可能な役割との関係に対処しました8,9,10。一方、神経機能は、光遺伝学的操作やファイバーフォトメトリー行動アプローチによって研究されており、回路構造を詳しく調べています。過去20年間で、Cre-リコンビナーゼ技術により、研究者は、行動や身体反応の変化を観察しながら、標的ニューロン群を個体発生的に刺激または阻害することができました6,11,12。
しかし、これらのアプローチは、特定の細胞メカニズムや複雑な視床下部環境におけるそれらの役割の生物学的基盤を深く掘り下げることなく、一般的な観点から視床下部機能を調べます。これに対処するために、不均一な初代視床下部培養を利用した分子的、生化学的、および電気的特性の調査に焦点を当てた研究はほとんどありません。これらの研究は、複雑な環境における特定のニューロンプロセスを解剖し、生理学的メカニズムの統合モデルを生成しようとしました13,14,15。それにもかかわらず、非特定の文化は重大な課題をもたらします。たとえば、ニューロンの生理学的接続性と解剖学的分布は、通常は相互作用しないさまざまな視床下部領域のニューロンをメッキすることによって破壊され、交絡効果を生み出します。さらに、各領域には異なる役割と多彩なニューロン集団があり、単純な生物学的プロセスを研究することは困難です。
これらの課題に対処するために、過去10年間で、イムノパニング、蛍光活性化細胞ソーティング(FACS)、磁気活性化細胞ソーティング(MACS)など、関心のあるニューロンを分離するための新しいアプローチが実装されてきました。イムノパニングは、抗体コーティングされたディッシュを使用して標的細胞を精製し、一連の非ニューロン(陰性)およびニューロン(陽性)の選択に採用される戦略です。この技術は、原則として、高収率の精製細胞培養を生成することができるが、実際には、これらの細胞は数時間の操作に耐えることができるため、主に星状細胞および希突起膠細胞に使用される16,17。FACSテクノロジーは、フローサイトメトリー18、19、20を使用して蛍光マーカーと細胞特性に基づいて細胞を選別するための強力なツールです。しかし、細胞培養のために細胞を単離するためにこの方法を使用した研究はほとんどありませんでした。この技術は高価であり、使用および保守するには高度なスキルを持つ人員が必要です。さらに、選別手順21の終了時に生存細胞および無菌細胞を維持することは困難である。全体として、MACSは、視床下部初代ニューロンの高純度で生存可能な培養物を得るための単純で安価な技術であるように思われます。この方法は、抗体を介して細胞に連結された磁気ビーズを利用する。これにより、カラムの磁場を使用して細胞を単離することができます。
ここでは、皮質ニューロンで一般的に使用されるMACS技術に基づく方法について説明します。このプロトコルは、原則として、生存可能で高純度の視床下部ニューロンを単離することを可能にする。本研究では、ARCPOMCやARC AgRP ニューロンなど、弓状核にのみ存在するレプチン受容体(LepR)を発現するニューロンの初代培養を作製します。これらのニューロンは、脂肪組織から分泌される食欲抑制ホルモンであるレプチンに生化学的および電気的方法で反応します。したがって、培養中のこの群のニューロンの単離は、 in vitroでのそれらのホルモン、代謝、および電気的特性の研究を可能にする。
プロトコル
注:実験手順の全体図を 図1Aに図示しています。この研究で実施されたマウスを用いたすべての実験は、私たちの施設の動物管理および使用委員会(IACUC)によって承認されました。3ヶ月齢のC57BL6/Jマウスを使用し、国際実験動物管理協会(AAALAC)承認のビバリウムに獣医師の世話をして飼育しました。マウスは、12時間の明暗サイクルで大きなケージに住み、 自由摂食されました。
1.受胎と妊娠の確認
- 繁殖のために関心のある任意の背景および遺伝子型のマウスを配置する。受胎前の女性の日付と体重を記録します。
- 6時間後、プローブで女性のプラークを検査します。プラークが存在する場合は、女性を男性から分離します。プラークが存在しない場合は、翌日までメスをケージに入れたままにしてから、マウスを分離します。
- 受胎後7、10、および14日目に、妊娠を確認するために女性の体重を量ります。
2. 培地、24ウェルプレート、材料調製
- 細胞単離の日に、すぐに使用できるポリ-D-リジンコーティングされたガラスカバースリップ( 材料表を参照)を次のように24ウェルプレートに入れます。
- 生物学的フードの下で、15枚のカバーガラスを含む単一のパッケージを70%エタノールで滅菌し、乾燥させます。パッケージを開き、カバーガラスを60mmプレートに入れます。プレートを水平に振ってカバーガラスを分離します。次に、プレートを反転させて、24ウェルプレートのウェルに配置する単一のカバーガラスをピックアップします。
- カバーガラスを1.0 mLの滅菌ハンクスバランス塩溶液(HBSS)で5分間1回洗浄します。
- それまでの間、20.0 mLのプレーティングメディアを次のように調製します:18.31 mLのBME(基礎培地イーグル、+アールの塩)、1.0 mLの熱不活化ウシ胎児血清(FBS)を添加し、200 μLのピルビン酸ナトリウム(100倍ストックから)、200 μLのグルタミン(200 nMストックから)、および100 μLのペニシリン/ストレプトマイシン(200xストックから)。
- ウェル内のHBSSを1.0 mLのメッキ培地に交換し、プレートを37°Cのインキュベーターに入れます。
- ブンゼンバーナーを使用して、直径の小さい3つのパスツールピペットをファイアポリッシュします。片手でピペットを持ち、先端を炎に挿入し、すばやく取り除きます。先端が滑らかになり、直径が目的の直径に縮小されるまで、このプロセスを繰り返します(目で評価)。
3.神経解離キットの指示に従って、神経組織解離のための試薬調製
- 消化バッファー1を室温で温めた後、50 μLの酵素1と1.91 mLのバッファー1を混合して酵素ミックス1を調製し、酵素215 μLと消化バッファー230 μLを混合して酵素ミックス2を調製します。ミックスは、すべての胚の脳組織に使用するのに十分です。
- HBSS中の0.5%ウシ血清アルブミン(BSA)、例えば、50.0mLのHBSS中の0.25gを調製する。
4.胚抽出
- 2つのまっすぐな細かい鉗子、1つの湾曲したポイント鉗子、および1組の細かい手術用はさみをオートクレーブし、使用前に70%エタノールで滅菌します。次に、ペトリ皿にHBSSを入れます。
- CO2 チャンバー内の1つのE14-E16妊娠中のダムを安楽死させ、頸部脱臼を行います。
注意: 次の手順は、無菌条件下でボンネット内で実行する必要があります。 - 腹部を70%エタノールで滅菌します。恥骨結合から胸郭の剣状突起まで腹腔を外科用ハサミと鉗子で切り開きます。
- 子宮角を取り出し、氷冷HBSSで満たされた100mmプレートに入れ、よく洗います。
- 細かい鉗子で子宮からすべての胚を抽出して分離します。細かい外科用ハサミや鉗子で胚をすばやく斬首します。HBSSで満たされた60mmのペトリ皿にヘッドを置きます。
5.視床下部の抽出、収集、および組織解離
- 脳を保持するために眼腔に1つの細かい鉗子を置きます。他の細かい鉗子を使用して、脳が見えるまで剥がして皮膚と頭蓋骨を取り除きます。その白い外観に基づいて他の組織と脳を区別します。皮膚と頭蓋骨はピンク色で血管系が豊富です。
- 湾曲した先端鉗子を使用して頭蓋骨から脳を取り除き、嗅球から脳をすくい取り、逆さまにします。
- 現在、皮質は腹側にあり、視床下部は上面に背側に見えます(図1B)。湾曲した鉗子で、脳が白く透明になるまで髄膜と血管の層を取り除きます。
- 湾曲した鉗子で、視床下部領域を脳の他の部分から分離します。
- 視床下部を3〜4個の小片に切り、ピペットで15 mLチューブに移します。
- チューブが氷上にある間に他の胚についても手順を繰り返します。
- チューブに6.0 mLのHBSSを満たし、組織を沈降させ、上清を取り除き、酵素ミックス1を追加します。組織を防ぐためにチューブを静かに混合して攪拌します。
- チューブを37°Cの水浴中で15分間インキュベートし、5分ごとに組織を攪拌して組織を再懸濁します。
- 15分後、30 μLの酵素ミックス2を加えます。最大の直径(<1 mm)のピペットパスツールを使用して脳組織を解離します。泡を形成せずに10倍上下にピペットします。
- 水浴中で37°Cで10分間インキュベートします。チューブを静かに攪拌して、5分ごとに組織を再懸濁します。
- 10分後、残りの15 μLの酵素ミックス2を追加します。気泡を形成することなく、直径が減少する他の2つのファイアポリッシュピペットと組織を上下に10倍解離します。
- 解離した組織のチューブに、直ちに10.0 mLのHBSS-0.5% BSAを加え、300 × g で室温で10分間遠心分離します。
- 上清を吸引し、細胞ペレットを1.0 mLのHBS-0.5% BSAに再懸濁します。
6.細胞カウント
- HBSS-0.5% BSAを用いて細胞懸濁液を1:5に希釈します。
- 希釈した細胞懸濁液10 μLをノイバウアー計数チャンバーに入れます。
- 明視野顕微鏡下で、4つのチャンバーの角の正方形にある細胞のみを数えます。平均を計算し、5 × 104を掛けます。
注:細胞単離に進むには、>10個の6 個のセルがあることを確認してください。最適なセル数は107です。
7.ネガティブセレクション
注:ネガティブセレクションにより、ユーザーはニューロン細胞と非ニューロン細胞を分離することにより、純粋な初代ニューロン培養を得ることができます。予冷溶液を使用してください。
- 細胞懸濁液を300 × g で3分間遠心分離します(遠心分離は最大10分まで延長できます)。上清を穏やかに吸引し、ペレットを80 μLのHBSS-0.5% BSAに107 細胞の濃度に再懸濁します。
- 20 μLの非神経細胞ビオチン抗体カクテルを加え、4°Cで5分間インキュベートします。
- 細胞を洗浄して遊離抗体を除去し、2.0 mLのHBSS-0.5% BSAで300 × g で3分間遠心分離します。
- 上清を穏やかに吸引し、ペレットを80 μLのHBSS-0.5% BSAに再懸濁します。20 μLの抗ビオチンマイクロビーズを添加し、十分に混合し、4°Cで10分間インキュベートします。
- 0.5 mLのHBSS-0.5% BSAを最大10個の7 セルに加え、磁気カラムの準備が整うまで待ちます。
8.磁気分離、ネガティブセレクション
注:磁気分離は、ニューロン細胞から非ニューロン細胞を分離することを可能にする重要なステップです。神経細胞と非神経細胞を含むサンプルを磁場に通し、ビオチン-抗体-磁気ビーズ複合体に結合した非神経細胞をカラムに捕捉します(図1C)。遊離ニューロン細胞はカラムを通して溶出され、15 mLチューブに集められます。
- 図1Cに示すように、セパレーターとMSカラムを備えたスタンド(キットに含まれています)を準備します。
- カラムを開き、セルを分離する準備ができたときにのみスタンドをセットアップします。
- 0.5 mLのHBSS-0.5% BSAでカラムをリンスします。溶液の滴下が止まるまで待ちます。
- 神経細胞を回収するには、15 mLチューブをカラムの下に置き、0.5 mLの細胞懸濁液をカラムに通します。滴下が止まるまで溶出液をチューブに集めます。残留神経細胞を捕捉するには、HBSS-0.5% BSAのカラム3 x 0.5 mLを洗浄します。
- 非神経細胞を採取するには、カラムを磁石から取り外し、新しい15 mlチューブに入れます。1.0 mLのHBSS--0.5% BSAをカラムに加え、プランジャーを使用して磁気標識された非神経細胞を回収します。
- 神経細胞および非神経細胞を300 × g で3分間遠心分離します。上清を穏やかに吸引し、細胞を1.0 mLのHBSS-0.5% BSAに再懸濁します。セクション 6 で前述したようにセルをカウントします。
- 必要に応じて、非神経細胞を24ウェルプレートにプレートします。それ以外の場合は破棄します。
9.ポジティブセレクション
注:純粋な神経細胞懸濁液が得られると、標的細胞を単離するためにポジティブ選択が行われます。細胞は、表面抗原に対する特異的なビオチン結合抗体を用いて単離することができる。抗体は抗ビオチン磁気ビーズによって認識されます。細胞懸濁液をカラムに流すことによって、目的の細胞のみが磁場に捕捉される。
- 純粋な神経細胞懸濁液を300 × g で3分間遠心分離します。上清を穏やかに吸引し、ペレットを80 μLのHBSS-0.5% BSAに再懸濁します。製造元の指示に従って特異的抗体を添加し、4°Cで10分間インキュベートします。
注:LepRを発現する細胞を探す場合は、0.50 μg/106細胞の濃度のマウスレプチンRビオチン化抗体(材料の表を参照)をお勧めします。 - 余分な抗体を2.0 mLのHBSS-0.5% BSAで洗い流し、300 × g で3分間遠心分離します。
- 上清を除去し、ペレットを80 μLのHBSS-0.5% BSAに再懸濁し、20 μLの抗ビオチンマイクロビーズを加えます。4°Cで10分間インキュベートします。
- 107 細胞ごとに、0.5 mLのHBSS-0.5% BSAを添加し、磁気カラムの準備が整うまで待ちます。
10.磁気分離、正の選択
- セパレーターとMSカラムを備えたスタンドを準備します。MS カラムを 0.5 mL の HBSS-0.5% BSA で洗い流します。滴りが止まるまで待ちます。
- 15 mLチューブをカラムの下に置き、0.5 mLの細胞懸濁液をカラムに通し、非特異的神経細胞を含む溶出液を回収します。残存非特異的神経細胞のカラムを洗浄するには、3 x 0.5 mLのHBSS-0.5% BSAで洗浄します。
- カラムを磁石から取り出し、新しい15 mLチューブに入れ、1.0 mLのHBSS-0.5% BSAを加えます。プランジャーを使用して、ターゲット細胞を洗い流します。
- 両方のチューブを300 × g で3分間遠心分離します。上清を静かに除去し、0.5 mLのプレーティング培地に再懸濁します。
- セクション 6 で前述したようにセルをカウントします。
- ポジティブコントロールとしての標的細胞とネガティブコントロールとしての非特異的細胞の両方を、セクション2に記載したように予め調製した24ウェルプレートに120,000〜200,000細胞/mm3の密度でプレートし、5%CO2、9%O2、および95%湿度中で37°Cで12時間インキュベートする。
11. 細胞培養の維持
- 19.2 mLの神経細胞培養培地、400 μLのB27サプリメント(50倍ストックから)、200 μLのグルタミン(200 μMストックから)、および100 μLのペニシリン/ストレプトマイシン(200倍ストックから)を含む20 mLの培養培地を準備します。
- ニューロン細胞または非ニューロン細胞を含む24ウェルプレートのプレーティング培地を交換します。
- 2 x 1.0 mLのHBSSで洗浄します。
- 1.0 mLの培地を加えます。
- 0.5 mLの古い培地を0.5 mLの新しい培地と交換して、2/3日ごとに培地を更新します。
注:細胞は培養中に維持することができ、 in vitro で最大21日間使用できます(DIV21)。
12. ニューロン免疫蛍光染色
- 染色の12時間前に、50/50メタノールとアセトンからなる溶液を調製し、-20°Cで一晩冷却します。
- 24 ウェルプレート内のニューロンを 2 x 1.0 mL の 1x リン酸緩衝生理食塩水 (PBS) で 5 分間洗浄します。
- PBS溶液を1.0 mLの50/50溶液に置き換え、氷中で20分間インキュベートします。
- 1x PBSで3 x 5分間洗浄します。
- ニューロンを1x PBS中の3%BSAで室温で1時間ブロックします。
- 製造元の指示に従って記載されている抗体濃度を使用して、1x PBS中の3%BSA中の一次抗体溶液を調製します。使用した抗体および濃度は、 材料表に記載されています。
- ブロッキング溶液を一次抗体溶液に交換し、4°Cで一晩インキュベートします。
- 細胞を1x PBSで3 x 10分間洗浄します。
- 製造元の指示に従って抗体の濃度を使用して、1x PBS中の3%BSAを含む二次抗体溶液を調製します。使用した二次抗体は 材料表に記載されています。
- 細胞を二次抗体溶液とともに室温で1時間インキュベートします。
- 細胞を1x PBSで3 x 10分間洗浄します。
- 取り付け手順中にニューロンを1x PBSに残します。少量の封入剤(核同定用の4',6-ジアミジノ-2-フェニルインドールの有無にかかわらず)を顕微鏡スライドに置きます。ニューロンを含むガラス製のカバーガラスを鉗子で1枚取り出し、紙ティッシュのカバーガラスの側面を軽くたたいて余分なPBSを乾かします。封入剤のカバーガラスを裏返し、ニューロンが顕微鏡スライドに面していることを確認します。ティッシュペーパーで余分な封入メディアをそっと押して取り外します。
- 顕微鏡スライドは、明視野顕微鏡または共焦点顕微鏡で分析する準備ができています。
結果
この論文では、視床下部の標的ニューロンを分離するためのプロトコルについて説明します (図1)。この方法の範囲は、制御され孤立した状況で特定のニューロン特性を研究することです。したがって、マウス胚はE14-E16で妊娠ダムから抽出されました。髄膜が除去され、視床下部が脳の他の部分から分離されました。組織は、参照された解離キットを使用して新たに調製された酵素の2つの混合物で穏やかに解離されました。まず、神経細胞から非神経細胞を分離し、グリア、ミクログリア、およびニューロンを同じ単一細胞懸濁液に回収した。この目的のために、非神経細胞を、非神経細胞表面エピトープを認識する抗体のカクテルを用いて標識した。インキュベーション後、抗体-細胞複合体を磁気マイクロビーズと結合させ、続いて磁気カラムを通過させて非神経細胞をトラップしました。
このステップにより、2つの細胞懸濁液が得られ、1つは非ニューロンを含み、もう1つはニューロン細胞を含みます。両方のサスペンションはすぐにメッキすることができました。あるいは、ニューロン細胞懸濁液をさらに操作して、同じ戦略を用いてニューロン亜集団(標的懸濁液)を残りの部分から分離することができる。関心のある実験に基づいて、ニューロン細胞は125,000〜200,000細胞/ mm3まで播種することができます。密度の低い培養物は、軸索の発達、シナプス形成、伝達から電気生理学まで、単一細胞の分解能でニューロンを分析するために使用できます。より高密度の培養物は、DNAおよびRNA抽出、ウェスタンブロット、サザンブロット、ノーザンブロット、リアルタイムPCR、およびRNAシーケンシングなどの生化学的分析に使用できます。
この研究では、LepRは、ARCPOMCおよびARC AgRPニューロンなどのメラノコルチン系に関与するニューロンを単離するために標的とされました。細胞は、LepR+ニューロンの120,000細胞/mm3から一般的なニューロン集団の200,000細胞/mm3の範囲の密度で播種されました。48時間後、LepR+ニューロンは神経突起を形成し始めました(図2)。DIV4では、軸索伸長が進行を示し、樹状突起が現れ始めた。DIV6では、ニューロンは十分に発達していたため、分析する準備ができていました。LepR+ニューロンの免疫蛍光実験では、LepRの99%の発現が示されました(緑、図3A)。グリア細胞または他の非神経細胞は観察されず、初代神経細胞培養の純度が確認されました。細胞の神経細胞の性質は、微小管関連タンパク質2(MAP2)染色によって確認され、軸索および樹状突起が同定された(図3B)。DIV10では、LepR+細胞の30%がPOMC(赤色)を発現した。これは、LepR+細胞の大部分がPOMCまたはAgRPのいずれかを発現していることから予想される。図3C,Dは、POMCシグナルとLepRシグナル間の共局在を示す。共局在は、予想通り、核とその周辺で顕著であったことに注意してください。
不均一な視床下部ニューロン集団を含む一般的な培養物を対照に使用した。免疫蛍光は、シナプシン-1(緑)とPSD 95(赤)の共染色によって評価されたように、シナプスの接続性と機能性を示しました(図4A、B)。一般培養中に存在するLepR+ニューロンの数は~5%であり、LepR発現ニューロンの大部分が磁気分離プロセス中に選択されたという考えと一致する割合でした(代表的なLepR+細胞を 図4C、Dに示します)。この調査中に生成または分析されたすべてのデータは、https://doi.org/10.5061/dryad.cnp5hqc9c で入手できます。
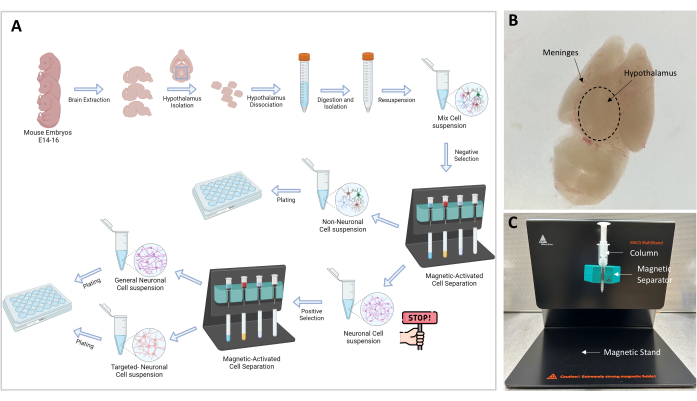
図1:実験フローチャートとセットアップ 。 (A)実験手順のグラフ表示。ゴーノーゴー:細胞単離に進むには≥106 細胞が必要です。最適なセル数は107です。(B)E16胚脳の代表的な画像。視床下部と髄膜が必要です。 (C)標的細胞の分離および単離に使用されるMACSセットアップ。マグネットスタンド、マグネットセパレーター、カラムが示されています。 この図の拡大版を表示するには、ここをクリックしてください。
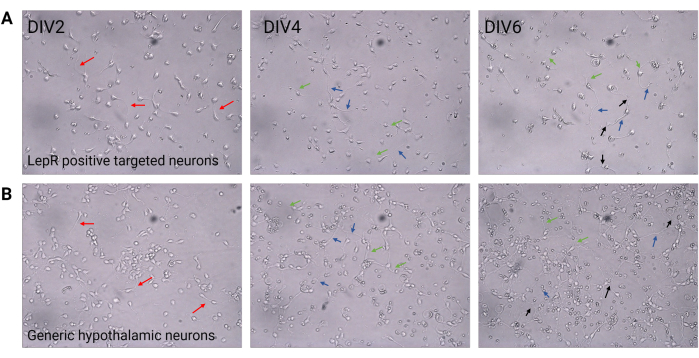
図2:DIV2とDIV6の間の神経細胞培養 。 (A)ポジティブセレクションから得られたLepR+細胞は、細胞密度と結合性の低下を示しますが、神経突起(赤い矢印)、軸索(青い矢印)、樹状突起(緑の矢印)の正常な発達を示します。細胞を120,000細胞/mm3の密度で播種した。スケールバー = 100 μm。(B)200,000細胞/ mm3の密度で播種された一般的な視床下部ニューロンは、正常な発生および成長の特徴と接続性を示します(黒い矢印)。スケールバー = 100 μm。略語:DIV = インビトロでの日数;LepR = レプチン受容体。この図を作成するために生成または分析されたすべてのデータは、https://doi.org/10.5061/dryad.cnp5hqc9c で入手できます。 この図の拡大版を表示するには、ここをクリックしてください。
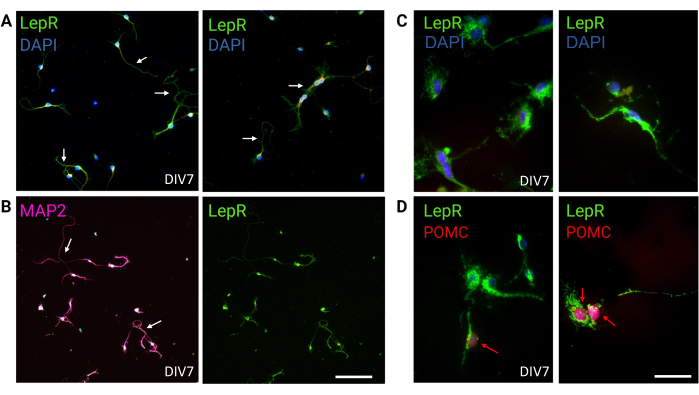
図3:培養LepR+ニューロンによって再現された in vivo ニューロン。 (A)LepRを発現するニューロンの培養物の代表的な画像(緑;DAPIは青色です)。細胞の99%がLepRを発現した。ニューロンは120,000細胞/mm3 の密度で播種した。DIV7では、ニューロンは細長い軸索、樹状突起の成熟、およびニューロンの接続性を示しました(矢印)。スケールバー = 40 μm。(B)抗MAP2による免疫蛍光法を用いて、細胞の神経細胞性を確認した。軸索、樹状突起、突起などの神経特異的な形態が示されています(矢印)。スケールバー = 40 μm。(C)LepR+細胞の拡大。緑でLepR、青でDAPI。スケールバー = 10 μm。(D)LepR(緑)およびPOMC(赤)との共染色。LepR+ニューロンの約30%はPOMCに対して共免疫反応性であり、POMCは核のレベルで検出されました(赤い矢印)。スケールバー = 10 μm。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;MAP2 = 微小管関連タンパク質2;POMC = プロオピオメラノコルチン;LepR = レプチン受容体。この図を作成するために生成または分析されたすべてのデータは、https://doi.org/10.5061/dryad.cnp5hqc9c で入手できます。この図の拡大版を表示するには、ここをクリックしてください。
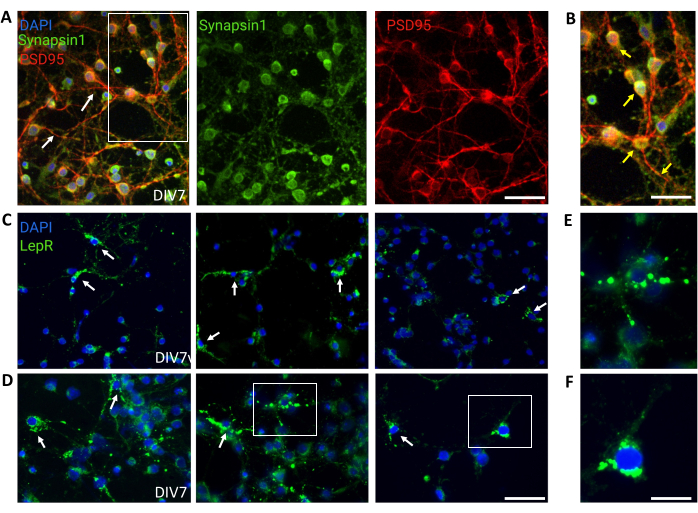
図4:in vivo細胞は、培養された一般的な視床下部ニューロンによって再現されます。 (A)シナプシン1(緑)、PSD95(赤)、およびDAPI(青)で染色された一般的な視床下部ニューロン培養の代表的な画像。ニューロンは、十分に発達した接続性とシナプス機能を示しました(矢印)。スケールバー = 40 μm。(B)(A)における箱の拡大率、シナプシン1(緑)およびPSD95(赤、矢印)の共局在を示す。スケールバー = 20 μm。(C,D)一般的な培養におけるLepR+細胞を示す代表的な画像。LepR+細胞(緑色)は全体の~5%を占めた。代表的なLepR+細胞を矢印で示す。スケールバー = 40 μm。(E,F)(C、D)のボックスの倍率は、体細胞に局在する緑色の点状レプチン受容体を示す。スケールバー = 20 μm。この図を作成するために生成または分析されたすべてのデータは、https://doi.org/10.5061/dryad.cnp5hqc9c で入手できます。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
視床下部ニューロンの生化学的および電気的特性を調査することは、代謝、体温調節、気分管理、摂食行動などの分子基盤を理解するための鍵です。しかし、視床下部のニューロンの不均一性はこの努力を困難にし、特定の視床下部亜集団を分離して研究する方法が必要です。
in vivo 技術では、CREリコンビナーゼ、オプトジェネティック、ファイバーフォトメトリー、およびカルシウムイメージングが採用されています。これらのアプローチは、主に視床下部ニューロンの電気的特性の研究を可能にし、それらの非電気的属性を調査するために現在利用可能な方法はほとんどありません。この研究で開発されたMACS技術は、特定の視床下部ニューロン亜集団を in vitroで 分離するのに適した技術を提供し、それによって標的治療と分析を提供する可能性があります。ニューロン培養は、異なるニューロン集団の共培養と比較して管理が簡単です。さらに、純粋な培養は、グリアおよびミクログリアの存在に起因する交絡効果を回避する。したがって、同じ視床下部領域およびタイプのニューロンは、特定の代謝およびホルモン入力に応答して研究することができる。
このプロトコルでは、LepRを発現する視床下部ニューロンを選択しました。単離したLepR+細胞を培養し、 in vivoで の研究が困難な細胞、形態、分子特性を調べました。培養物の純度は99%であり、この方法の正確さを裏付けています。さらに、LepR+細胞はDIV7でDIV21まで健康で生存可能でした。
ただし、この手法にはいくつかの制限があります。E18以上の純粋なニューロン培養は維持が困難です。したがって、抽出のウィンドウは E14-E16 に限定されます。これは、E16の後に起こる細胞の変化が見逃されていることを意味します。例えば、ARCニューロンにおけるレプチン受容体の発現は、出生後早期に増加する22。単離のための手順は、細胞のストレスと死を減らし、収量を改善するためにできるだけ早く実行されなければなりません。手順には最大5時間かかる場合があります。したがって、無菌状態を維持し、操作を必要最小限に抑えることが不可欠です。ポジティブ選択は、利用可能な組織の量が少ないために収率が低くなり、単一の調製物で実行できる実験の数が制限される可能性があります。おそらく細胞密度が低く、ニューロンの接続性とニューロン内サポートが低下したために、ニューロン死の上昇が観察されました。
さらに、目的の抗原を標的とする抗体は、正しい分離を保証するために細胞表面に結合する必要があります。通常、フローサイトメトリーに使用される抗体は、MACS技術に適している。抗体がこれまで細胞分離法で使用されたことがない場合は、理想的な使用法と濃度を決定するためにバリデーションと滴定実験が必要です。標的細胞の抽出には、細胞表面マーカーが必要です。ここではビオチン化抗体を使用しましたが、原理的には、FITC(フルオレセインイソチオシアネート)やPE(精製抗フィコエリスリン)などの他の分子と結合した抗体も使用できます。MACS技術は、GFPや他のTagタンパク質などの蛍光色素を発現するニューロンにも適用でき、特異性と収量が向上する可能性があります。蛍光色素を使用しない場合、代替手段は、生細胞実験を行う前に免疫蛍光法によって目的分子の発現を確認することです。今後の研究では、これらの代替案の妥当性がテストされます。
この研究が取り上げなかった重要な側面の1つは、ニューロン下集団の「忠実度」に関するものです。培養したLepR+ニューロンは、天然ARC POMCニューロンの特徴であるPOMCを発現していることを確認しました。ただし、LepR+ニューロン培養が本来のin vivo対応物を再現していると結論付けるには、さらにテストが必要です。全体として、ここで提示されたMACSニューロン分離プロトコルは、in vivoで調査することが困難なin vitro視床下部メカニズムを研究するための有効で効果的な方法を提供する可能性があります。
開示事項
著者は、利益相反がないことを宣言します。
謝辞
グラフィカルな図は BioRender.com で作成されました。この作業は、FSへのNIA助成金(R01AG060919)とNSF助成金(2030348)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
参考文献
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707(2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803(2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450(2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050(2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944(2021).
- Foo, L. C. Purification of rat and mouse astrocytes by immunopanning. 2013 (5), Cold Spring Harbor Protocols. 421-432 (2013).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), Cold Spring Harbor Protocols. 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594(2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12(2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved