Method Article
Isolamento di neuroni ipotalamici mirati per studi di regolazione ormonale, metabolica ed elettrica
In questo articolo
Riepilogo
Qui presentiamo un protocollo per far crescere specifici sottotipi di cellule ipotalamiche in coltura. Le cellule possono essere selezionate in base a marcatori di membrana opportuni/unici e utilizzate in molte applicazioni, tra cui immunofluorescenza, saggi elettrofisiologici e biochimici.
Abstract
L'ipotalamo regola i processi metabolici fondamentali controllando funzioni varie come l'assunzione di cibo, la temperatura corporea e il rilascio di ormoni. Poiché le funzioni dell'ipotalamo sono controllate da specifici sottoinsiemi di popolazioni neuronali, la capacità di isolarli fornisce uno strumento importante per lo studio dei meccanismi metabolici. A questo proposito, la complessità neuronale dell'ipotalamo pone sfide eccezionali.
Per questi motivi, sono state esplorate nuove tecniche, come il Magnetic-Activated Cell Sorting (MACS). Questo documento descrive una nuova applicazione dello smistamento cellulare attivato magneticamente (MACS) utilizzando la tecnologia delle microsfere per isolare una popolazione neuronale mirata dal cervello dei topi prenatali. La tecnica è semplice e garantisce una coltura di neuroni ipotalamici primari altamente pura e vitale con un'elevata riproducibilità. L'ipotalamo viene delicatamente dissociato, i neuroni vengono selettivamente isolati e separati dalle cellule gliali e, infine, utilizzando un anticorpo specifico per un marcatore di superficie cellulare, viene selezionata la popolazione di interesse.
Una volta isolati, i neuroni mirati possono essere utilizzati per studiare le loro caratteristiche morfologiche, elettriche ed endocrine e le loro risposte in condizioni normali o patologiche. Inoltre, dati i ruoli variegati dell'ipotalamo nella regolazione dell'alimentazione, del metabolismo, dello stress, del sonno e della motivazione, uno sguardo più attento ai neuroni mirati e specifici della regione può fornire informazioni sui loro compiti in questo ambiente complesso.
Introduzione
L'ipotalamo è un'area del cervello su più fronti che media le funzioni endocrine, autonome, viscerali e comportamentali, tra cui l'alimentazione, il metabolismo, il sonno, la temperatura corporea, il comportamento sociale e il desiderio sessuale 1,2,3,4,5. L'eterogeneità funzionale è ottenuta da una combinazione sinergica di meccanismi biochimici ed elettrici: i neuroni ipotalamici attivano potenziali d'azione e secernono e rilasciano ormoni e neuropeptidi per modulare le regioni cerebrali e gli organi del corpo. Infine, i neuroni ipotalamici traducono i messaggi omeostatici del corpo, rispondendo con feedback a lungo e breve termine e regolazioni feedforward6.
Il complesso ambiente neuronale dell'ipotalamo comprende neuroni endocrini magnocellulari, che rilasciano ossitocina e vasopressina; neuroni parvocellulari, principalmente coinvolti nella regolazione ormonale sistemica, rilasciando ad esempio l'ormone di rilascio della tireotropina (TRH) e l'ormone di rilascio della corticotropina (CRH) nella ghiandola pituitaria; grandi neuroni di proiezione peptidergica, che rilasciano orexina e ormone che concentra la melanina (MCH); e neuroni peptidergici parvocellulari del nucleo arcuato (ARC) che rilasciano POMC (proopiomelanocortina) e AgRP (proteina correlata all'agouti), denominati rispettivamente ARCPOMC e ARCAgRP. Insieme alle cellule secretorie, altri neuroni eccitatori e inibitori, tra cui i neuroni dopaminergici, glutaminergici e GABAergici 7, sono coinvolti nella formazione di circuiti intraipotalamici ed extraipotalamici, creando così reti coordinate su larga scala di notevole eterogeneità cellulare8.
La diversità ipotalamica è stata una sfida che i ricercatori hanno cercato di superare negli ultimi 50 anni. Per studiare questa eterogeneità nello sviluppo dell'ipotalame maturo, maturo e invecchiato, i ricercatori, da un lato, hanno impiegato il sequenziamento dell'RNA a singola cellula per esplorare l'organizzazione neuronale, nonché le firme molecolari e trascrittomiche. Questo sforzo ha fornito uno sguardo approfondito sui ruoli variegati dei neuroni ipotalamici e ha affrontato le connessioni tra l'identità cellulare e il suo possibile ruolo nel sistema fisiologico 8,9,10. D'altra parte, le funzioni neuronali sono state studiate mediante manipolazioni optogenetiche e approcci comportamentali di fotometria delle fibre, che consentono di osservare da vicino la struttura dei circuiti. Negli ultimi due decenni, la tecnologia Cre-ricombinasi ha permesso ai ricercatori di stimolare o inibire ontogeneticamente un gruppo mirato di neuroni osservando i cambiamenti nei comportamenti e nelle risposte del corpo 6,11,12.
Tuttavia, questi approcci esaminano le funzioni ipotalamiche da una prospettiva generale senza approfondire i meccanismi cellulari specifici o le basi biologiche del loro ruolo all'interno del complesso ambiente ipotalamico. Per affrontare questo problema, pochissimi studi si sono concentrati sullo studio delle proprietà molecolari, biochimiche ed elettriche utilizzando colture ipotalamiche primarie eterogenee. Questi studi hanno cercato di sezionare specifici processi neuronali in un ambiente complesso e hanno generato modelli integrativi di meccanismi fisiologici13,14,15. Ciononostante, le culture non specifiche pongono sfide significative. Ad esempio, la connettività fisiologica e la distribuzione anatomica dei neuroni vengono interrotte dalla placcatura di neuroni provenienti da diverse regioni ipotalamiche che normalmente non interagirebbero, creando effetti confondenti. Inoltre, ogni regione ha ruoli diversi e popolazioni neuronali variegate, rendendo difficile lo studio di semplici processi biologici.
Per affrontare queste sfide, nell'ultimo decennio, sono stati implementati nuovi approcci per isolare i neuroni di interesse, come l'immunopanning, il Fluorescent-Activated-Cell-Sorting (FACS) e il Magnetic-Activated-Cell-Sorting (MACS). L'immunopanning è una strategia impiegata per purificare le cellule bersaglio utilizzando piastre rivestite di anticorpi per una serie di selezioni non neuronali (negative) e neuronali (positive). Mentre questa tecnica potrebbe, in linea di principio, generare colture cellulari purificate ad alto rendimento, in pratica viene utilizzata principalmente per astrociti e oligodendrociti poiché queste cellule possono resistere a ore di manipolazione16,17. La tecnologia FACS è un potente strumento per ordinare le cellule in base ai marcatori fluorescenti e alle caratteristiche cellulari utilizzando la citometria a flusso18,19,20. Tuttavia, pochissimi studi hanno utilizzato questo metodo per isolare le cellule per la coltura cellulare. La tecnica è costosa e richiede personale altamente qualificato per l'utilizzo e la manutenzione; Inoltre, è difficile mantenere cellule vitali e sterili alla fine della procedura di cernita21. Nel complesso, la MACS sembra essere una tecnica semplice e non costosa per ottenere colture altamente pure e vitali di neuroni primari ipotalamici. Il metodo utilizza perle magnetiche collegate alle cellule tramite un anticorpo. Ciò consente di isolare le cellule utilizzando il campo magnetico della colonna.
Qui descriviamo un metodo basato sulla tecnologia MACS, che viene tipicamente utilizzato con i neuroni corticali. Questo protocollo permette di isolare, in linea di principio, neuroni ipotalamici vitali e altamente puri. In questo studio, prepariamo colture primarie di neuroni che esprimono il recettore della leptina (LepR), come i neuroni ARCPOMC e ARCAgRP , che sono presenti solo nel nucleo arcuato . Questi neuroni rispondono alla leptina, un ormone anoressizzante secreto dal tessuto adiposo, in modo biochimico ed elettrico. Pertanto, l'isolamento di questo gruppo di neuroni in coltura consente di studiare le loro proprietà ormonali, metaboliche ed elettriche in vitro.
Protocollo
NOTA: Una vista generale della procedura sperimentale è illustrata graficamente nella Figura 1A. Tutti gli esperimenti con i topi eseguiti in questo studio sono stati approvati dal Comitato per la cura e l'uso degli animali (IACUC) della nostra istituzione. Sono stati utilizzati topi C57BL6/J di 3 mesi, che sono stati ospitati in un vivaio approvato dall'Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC), sotto la cura di un veterinario. I topi vivevano in grandi gabbie, con un ciclo luce-buio di 12 ore, e venivano nutriti ad libitum.
1. Verifica del concepimento e della gravidanza
- Posizionare topi di qualsiasi provenienza e genotipo di interesse per la riproduzione. Registrare la data e il peso della femmina prima del concepimento.
- Dopo 6 ore, ispezionare la femmina per verificare la presenza di placca con una sonda. Se la placca è presente, separare la femmina dal maschio. Se la placca non è presente, tieni la femmina nella gabbia fino al giorno successivo, quindi separa i topi.
- Ai giorni 7, 10 e 14 dopo il concepimento, pesare la femmina per confermare la gravidanza.
2. Preparazione dei terreni, della piastra a 24 pozzetti e del materiale
- Il giorno dell'isolamento cellulare, posizionare i vetrini coprioggetti pronti all'uso rivestiti di poli-D-lisina (vedi Tabella dei materiali) in una piastra a 24 pozzetti come segue:
- Sotto una cappa biologica, sterilizzare una singola confezione contenente 15 vetrini coprioggetti con etanolo al 70% e lasciare asciugare. Aprire la confezione e posizionare i vetrini coprioggetti in una piastra da 60 mm. Agitare la piastra orizzontalmente per separare i vetrini coprioggetti. Quindi, capovolgere la piastra per prelevare i vetrini coprioggetti singoli da posizionare nei pozzetti di una piastra a 24 pozzetti.
- Lavare i vetrini coprioggetti una volta con 1,0 ml di soluzione salina bilanciata sterile Hank's (HBSS) per 5 minuti.
- Nel frattempo, preparare 20,0 mL di terreno di placcatura come segue: a 18,31 mL di BME (Basal Medium Eagle, + Sali di Earle), integrati con 1,0 mL di siero fetale bovino inattivato al calore (FBS), aggiungere 200 μL di piruvato di sodio (da uno stock 100x), 200 μL di glutammina (da uno stock da 200 nM) e 100 μL di penicillina/streptomicina (da uno stock 200x).
- Sostituire l'HBSS nei pozzetti con 1,0 mL di terreno di placcatura e posizionare la piastra nell'incubatore a 37 °C.
- Utilizzando un bruciatore Bunsen, lucidare a fuoco tre pipette Pasteur di diametro decrescente. Tenendo la pipetta con una mano, inserire la punta nella fiamma e rimuoverla rapidamente. Ripetere il processo fino a quando la punta non si leviga e il diametro si riduce al diametro desiderato (valutato a occhio).
3. Preparazione del reagente per la dissociazione del tessuto neurale, seguendo le indicazioni del kit di dissociazione neurale
- Dopo aver riscaldato il tampone di digestione 1 a temperatura ambiente, preparare la miscela enzimatica 1 mescolando 50 μL di enzima 1 con 1,91 mL di tampone 1 e la miscela enzimatica 2 mescolando 15 μL di enzima 2 con 30 μl di tampone di digestione 2. Le miscele sono sufficienti per essere utilizzate per il tessuto cerebrale di tutti gli embrioni.
- Preparare lo 0,5% di albumina sierica bovina (BSA) in HBSS, ad esempio 0,25 g in 50,0 mL di HBSS.
4. Estrazione dell'embrione
- Autoclavare due pinze fini diritte, una pinza a punta curva e un paio di forbici chirurgiche fini e sterilizzarle con etanolo al 70% prima dell'uso. Quindi, riempi le piastre di Petri con HBSS.
- Sopprimere una madre incinta E14-E16 nella camera CO2 ed eseguire la lussazione cervicale.
NOTA: I seguenti passaggi devono essere eseguiti sotto la cappa in condizioni sterili: - Sterilizzare l'addome con etanolo al 70%. Tagliare la cavità addominale dalla sinfisi pubica al processo xifoideo della gabbia toracica con forbici chirurgiche e pinze.
- Estrarre il corno uterino e metterlo in una piastra da 100 mm riempita con HBSS ghiacciato e lavare accuratamente.
- Estrarre e separare tutti gli embrioni dall'utero con una pinza fine. Decapitare rapidamente gli embrioni con forbici chirurgiche sottili e/o pinze. Posizionare le testine nella capsula di Petri da 60 mm riempita con HBSS.
5. Estrazione, raccolta e dissociazione tissutale dell'ipotalamo
- Posiziona una pinza sottile nella cavità oculare per trattenere il cervello. Usando l'altra pinza fine, rimuovere la pelle e il cranio sbucciando fino a quando il cervello non è visibile. Distingui il cervello dagli altri tessuti in base al suo aspetto bianco. La pelle e il cranio sono rosa e ricchi di vascolarizzazione.
- Rimuovere il cervello dal cranio utilizzando la pinza a punta curva e estrarre il cervello dai bulbi olfattivi, capovolgendolo.
- Ora la corteccia è ventrale e l'ipotalamo è visibile dorsalmente sulla superficie superiore (Figura 1B). Con la pinza curva, rimuovere lo strato di meningi e vasi sanguigni fino a quando il cervello non appare bianco e chiaro.
- Con la pinza curva, separa l'area ipotalamica dal resto del cervello.
- Tagliare l'ipotalamo in 3-4 piccoli pezzi e con una pipetta, trasferire i pezzi in una provetta da 15 ml.
- Ripetere i passaggi per gli altri embrioni mentre la provetta è sul ghiaccio.
- Riempire la provetta con 6,0 mL di HBSS e lasciare che il tessuto si depositi, rimuovere il surnatante e aggiungere Enzyme Mix 1. Mescolare e agitare delicatamente il tubo per evitare che il tessuto si formi.
- Incubare la provetta a bagnomaria a 37 °C per 15 minuti e agitare il tessuto ogni 5 minuti per risospendere il tessuto.
- Dopo 15 minuti, aggiungere 30 μL di miscela enzimatica 2. Dissociare il tessuto cerebrale utilizzando la pipetta Pasteur con il diametro maggiore (<1 mm). Pipettare su e giù 10 volte senza formare bolle.
- Incubare per 10 minuti a 37 °C a bagnomaria. Agitare delicatamente il tubo per risospendere il tessuto ogni 5 minuti.
- Dopo 10 minuti, aggiungere i restanti 15 μL di miscela enzimatica 2. Dissociare il tessuto 10 volte con le altre due pipette lucidate a fuoco di diametro decrescente, su e giù senza formare bolle.
- Alla provetta con il tessuto dissociato, aggiungere immediatamente 10,0 mL di HBSS-0,5% BSA e centrifugare a 300 × g per 10 min a temperatura ambiente.
- Aspirare il surnatante e risospendere il pellet cellulare in 1,0 mL di HBS-0,5% BSA.
6. Conteggio delle cellule
- Diluire la sospensione cellulare 1:5 utilizzando HBSS-0,5% BSA.
- Porre 10 μL della sospensione cellulare diluita in una camera di conteggio Neubauer.
- Al microscopio in campo chiaro, conta solo le cellule che si trovano nei quadrati angolari delle quattro camere. Calcola la media e moltiplica per 5 × 104.
NOTA: Assicurarsi che ci siano >106 celle per procedere all'isolamento delle celle; Il numero di celle ottimale è 107.
7. Selezione negativa
NOTA: La selezione negativa consente agli utenti di ottenere una coltura di neuroni primari puri separando cellule neuronali e non neuronali. Utilizzare soluzioni preraffreddate.
- Centrifugare la sospensione cellulare a 300 × g per 3 minuti (la centrifugazione può essere prolungata fino a 10 minuti). Aspirare delicatamente il surnatante e risospendere il pellet a una concentrazione di 10-7 cellule in 80 μL di HBSS-0,5% BSA.
- Aggiungere 20 μL di cocktail biotina-anticorpo di cellule non neuronali e incubare per 5 minuti a 4 °C.
- Lavare le cellule per rimuovere l'anticorpo libero con 2,0 mL di HBSS-0,5% BSA e centrifugare a 300 × g per 3 min.
- Aspirare delicatamente il surnatante e risospendere il pellet in 80 μL di HBSS-0,5% BSA. Aggiungere 20 μL di microsfere anti-biotina, mescolare accuratamente e incubare per 10 minuti a 4 °C.
- Aggiungere 0,5 mL di HBSS-0,5% BSA per un massimo di 107 celle e attendere che la colonna magnetica sia pronta.
8. Separazione magnetica, selezione negativa
NOTA: La separazione magnetica è un passaggio cruciale che consente la separazione delle cellule non neuronali dalle cellule neuronali. Il campione contenente cellule neuronali e non neuronali viene fatto passare attraverso il campo magnetico e le cellule non neuronali, che sono legate a un complesso biotina-anticorpo-microsfere magnetiche, vengono intrappolate nella colonna (Figura 1C). Le cellule neuronali libere vengono eluite attraverso la colonna e vengono raccolte in una provetta da 15 ml.
- Preparare il supporto (incluso nel kit) con il separatore e la colonna MS come mostrato nella Figura 1C.
- Aprire la colonna e allestire il supporto solo quando le celle sono pronte per essere separate.
- Risciacquare la colonna con 0,5 mL di HBSS-0,5% BSA. Attendere che la soluzione smetta di gocciolare.
- Per raccogliere le cellule neuronali, posizionare una provetta da 15 mL sotto la colonna e far passare 0,5 mL della sospensione cellulare attraverso la colonna. Raccogliere l'eluato nella provetta fino a quando non smette di gocciolare. Per catturare le cellule neuronali residue, lavare la colonna con 3 x 0,5 mL di HBSS-0,5% BSA.
- Per raccogliere le cellule non neuronali, rimuovere la colonna dal magnete e posizionarla all'interno di una nuova provetta da 15 ml. Aggiungere 1,0 mL di HBSS-0,5% BSA alla colonna e utilizzare lo stantuffo per raccogliere le cellule non neuronali marcate magneticamente.
- Centrifugare le cellule neuronali e non neuronali a 300 × g per 3 min. Aspirare delicatamente il surnatante e risospendere le cellule in 1,0 mL di HBSS-0,5% BSA. Contare le celle come descritto in precedenza nella sezione 6.
- Se necessario, placcare le cellule non neuronali in una piastra a 24 pozzetti; altrimenti scartarli.
9. Selezione positiva
NOTA: Una volta ottenuta una sospensione di cellule neuronali pure, viene effettuata una selezione positiva per isolare le cellule bersaglio. Le cellule possono essere isolate utilizzando uno specifico anticorpo coniugato con biotina per un antigene di superficie. L'anticorpo è riconosciuto dalle microsfere magnetiche anti-biotina. Facendo scorrere la sospensione cellulare attraverso la colonna, solo le cellule di interesse vengono intrappolate nel campo magnetico.
- Centrifugare la sospensione di cellule neuronali pure a 300 × g per 3 min. Aspirare delicatamente il surnatante e risospendere il pellet in 80 μL di HBSS-0,5% BSA. Aggiungere l'anticorpo specifico seguendo le istruzioni del produttore e incubare a 4 °C per 10 min.
NOTA: Se si cercano cellule che esprimono LepR, si consiglia un anticorpo biotinilato Leptina R di topo (vedere la tabella dei materiali) ad una concentrazione di 0,50 μg/106 cellule. - Lavare via l'anticorpo in eccesso con 2,0 mL di HBSS-0,5% BSA e centrifugare a 300 × g per 3 min.
- Rimuovere il surnatante, risospendere il pellet in 80 μL di HBSS-0,5% BSA e aggiungere 20 μL di microsfere anti-biotina. Incubare a 4 °C per 10 min.
- Per ogni 107 celle, aggiungere 0,5 mL di HBSS-0,5% BSA e attendere che la colonna magnetica sia pronta.
10. Separazione magnetica, selezione positiva
- Preparare il supporto con il separatore e la colonna MS. Risciacquare la colonna MS con 0,5 mL di HBSS-0,5% BSA. Attendere che il gocciolamento si fermi.
- Posizionare una provetta da 15 mL sotto la colonna, far passare 0,5 mL della sospensione cellulare attraverso la colonna e raccogliere l'eluato che comprende le cellule neuronali non specifiche. Per pulire la colonna dalle cellule neuronali residue non specifiche, lavare con 3 x 0,5 mL di HBSS-0,5% BSA.
- Rimuovere la colonna dal magnete, posizionarla in una nuova provetta da 15 mL e aggiungere 1,0 mL di HBSS-0,5% BSA. Usa lo stantuffo per scovare le cellule bersaglio.
- Centrifugare entrambe le provette a 300 × g per 3 min. Rimuovere delicatamente il surnatante e risospenderlo in 0,5 mL di mezzo di placcatura.
- Contare le celle come descritto in precedenza nella sezione 6.
- Piastre sia le cellule mirate come controllo positivo che le cellule non specifiche come controllo negativo a una densità di 120.000-200.000 cellule/mm3 nella piastra a 24 pozzetti precedentemente preparata come descritto nella sezione 2 e incubare a 37 °C al 5% di CO 2, al 9% di O2 e al 95% di umidità per 12 ore.
11. Mantenimento della coltura cellulare
- Preparare 20 mL di terreno di coltura con 19,2 mL di terreno di coltura neuronale, 400 μL di integratore di vitamina B27 (da uno stock 50x), 200 μL di glutammina (da uno stock da 200 μM) e 100 μL di penicillina/streptomicina (da uno stock 200x).
- Sostituire il mezzo di placcatura dalla piastra a 24 pozzetti contenente cellule neuronali o non neuronali.
- Lavare con 2 x 1,0 ml di HBSS.
- Aggiungere 1,0 mL di terreno di coltura.
- Aggiornare il supporto ogni 2/3 giorni sostituendo 0,5 mL di terreno vecchio con 0,5 ml di terreno nuovo.
NOTA: Le cellule possono essere mantenute in coltura e utilizzate per un massimo di 21 giorni in vitro (DIV21).
12. Colorazione a immunofluorescenza neuronale
- Dodici ore prima della colorazione, preparare una soluzione composta da metanolo e acetone 50/50 e raffreddarla a -20 °C per una notte.
- Lavare i neuroni nella piastra a 24 pozzetti con 2 x 1,0 ml di 1x soluzione salina tamponata con fosfato (PBS) per 5 minuti.
- Sostituire la soluzione PBS con 1,0 mL della soluzione 50/50 e incubare nel ghiaccio per 20 minuti.
- Lavare con 1x PBS per 3 x 5 min.
- Bloccare i neuroni con BSA al 3% in 1x PBS per 1 ora a temperatura ambiente.
- Preparare la soluzione di anticorpi primari in BSA al 3% in 1x PBS, utilizzando la concentrazione di anticorpi indicata nelle istruzioni del produttore. Gli anticorpi e le concentrazioni utilizzate sono elencati nella tabella dei materiali.
- Sostituire la soluzione bloccante con la soluzione anticorpale primaria e incubare a 4 °C per una notte.
- Lavare le celle per 3 x 10 minuti con 1x PBS.
- Preparare la soluzione anticorpale secondaria con BSA al 3% in 1x PBS, utilizzando le concentrazioni degli anticorpi seguendo le istruzioni del produttore. Gli anticorpi secondari utilizzati sono elencati nella Tabella dei Materiali.
- Incubare le cellule con la soluzione anticorpale secondaria a temperatura ambiente per 1 ora.
- Lavare le celle per 3 x 10 minuti con 1x PBS.
- Lasciare i neuroni in PBS 1x durante la procedura di montaggio. Posizionare una piccola goccia di mezzo di montaggio (con o senza 4',6-diamidino-2-fenilindolo per l'identificazione nucleare) sul vetrino del microscopio. Estrarre un vetrino coprioggetti contenente neuroni con una pinza e picchiettare il lato del vetrino coprioggetto su un fazzoletto di carta per asciugare il PBS in eccesso. Capovolgere il vetrino coprioggetto sul mezzo di montaggio, assicurandosi che i neuroni siano rivolti verso i vetrini del microscopio; Premere delicatamente e rimuovere il supporto di montaggio in eccesso con carta velina.
- I vetrini del microscopio sono pronti per essere analizzati con un microscopio in campo chiaro o confocale.
Risultati
Questo articolo descrive un protocollo per l'isolamento dei neuroni mirati dell'ipotalamo (Figura 1). Lo scopo del metodo è quello di studiare specifiche caratteristiche neuronali in un contesto controllato e isolato. Così, embrioni di topo sono stati estratti dalle madri gravide a E14-E16. Le meningi sono state rimosse e l'ipotalamo è stato isolato dal resto del cervello. Il tessuto è stato delicatamente dissociato con due miscele di enzimi preparati al momento utilizzando il kit di dissociazione di riferimento. In primo luogo, le cellule non neuronali sono state separate dalle cellule neuronali: glia, microglia e neuroni sono stati raccolti nella stessa sospensione unicellulare. A tal fine, le cellule non neuronali sono state marcate utilizzando un cocktail di anticorpi che riconoscono epitopi di superficie non neuronali. Dopo l'incubazione, il complesso anticorpo-cellula è stato coniugato con microsfere magnetiche e successivamente è passato attraverso una colonna magnetica per intrappolare le cellule non neuronali.
Questo passaggio ha prodotto due sospensioni cellulari, una contenente cellule non neuronali e l'altra contenente cellule neuronali. Entrambe le sospensioni potrebbero essere placcate immediatamente. In alternativa, la sospensione delle cellule neuronali potrebbe essere ulteriormente manipolata per separare una sottopopolazione neuronale (sospensione mirata) dal resto utilizzando la stessa strategia. Sulla base dell'esperimento di interesse, le cellule neuronali possono essere placcate da 125.000 a 200.000 cellule/mm3. Le colture meno dense possono essere utilizzate per analizzare i neuroni a risoluzione di singola cellula: dallo sviluppo assonale, alla formazione sinaptica e alla trasmissione all'elettrofisiologia. Le colture più dense possono essere utilizzate per analisi biochimiche, tra cui l'estrazione di DNA e RNA, western blot, Southern blot, Northern blot, real-time PCR e sequenziamento dell'RNA.
In questo studio, LepR è stato mirato a isolare i neuroni coinvolti nel sistema melanocortinico, come i neuroni ARCPOMC e ARCAgRP. Le cellule sono state piastrate a densità che vanno da 120.000 cellule/mm 3, per i neuroni LepR+, a 200.000 cellule/mm3 per le popolazioni neuronali generiche. Dopo 48 ore, i neuroni LepR+ hanno iniziato a formare neuriti (Figura 2). A DIV4, le estensioni assonali hanno mostrato progressi, mentre i processi dendritici hanno iniziato a comparire. A DIV6, i neuroni erano sufficientemente sviluppati ed erano quindi pronti per essere analizzati. Gli esperimenti di immunofluorescenza sui neuroni LepR+ hanno mostrato un'espressione del 99% di LepR (verde, Figura 3A). Non sono state osservate cellule gliali o altre cellule non neuronali, confermando la purezza della coltura neuronale primaria. La natura neuronale delle cellule è stata confermata dalla colorazione della proteina 2 associata ai microtubuli (MAP2), con l'identificazione di assoni e protrusioni dendritiche (Figura 3B). A DIV10, il 30% delle cellule LepR+ esprimeva POMC (rosso). Ciò è previsto poiché la maggior parte delle cellule LepR+ esprime POMC o AgRP. La Figura 3C,D illustra la co-localizzazione tra i segnali POMC e LepR. Si noti che la co-localizzazione era prominente in corrispondenza e intorno al nucleo, come previsto.
Per il controllo sono state utilizzate colture generali contenenti popolazioni neuronali ipotalamiche eterogenee. L'immunofluorescenza ha dimostrato la connettività e la funzionalità sinaptica, come valutato dalla co-colorazione Synapsin-1 (verde) e PSD 95 (rosso) (Figura 4A,B). Il numero di neuroni LepR+ presenti nella coltura generale era ~5%, una percentuale coerente con l'idea che la maggior parte dei neuroni che esprimono LepR erano stati selezionati durante il processo di separazione magnetica (le cellule LepR+ rappresentative sono illustrate nella Figura 4C,D). Tutti i dati generati o analizzati durante questo studio sono disponibili all'indirizzo https://doi.org/10.5061/dryad.cnp5hqc9c.
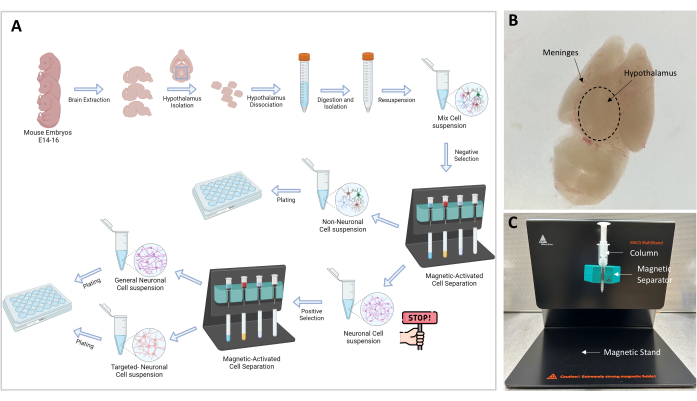
Figura 1: Diagramma di flusso sperimentale e configurazione . (A) Rappresentazione grafica della procedura sperimentale. Go-no-go: ≥10 6 cellule sono necessarieper procedere all'isolamento cellulare; Il numero di celle ottimale è 107. (B) Immagine rappresentativa di un cervello embrionale E16. Sono indicati l'ipotalamo e le meningi. (C) Configurazione MACS utilizzata per la separazione e l'isolamento delle cellule bersaglio. Sono indicati il supporto magnetico, il separatore magnetico e la colonna. Fare clic qui per visualizzare una versione più grande di questa figura.
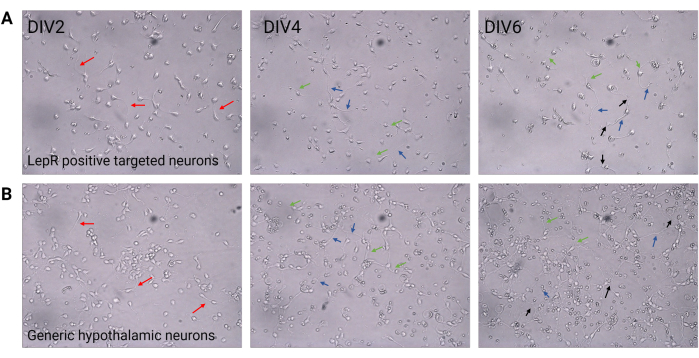
Figura 2: Coltura neuronale tra DIV2 e DIV6. (A) Le cellule LepR+ ottenute dalla selezione positiva mostrano una ridotta densità cellulare e connettività, ma un normale sviluppo di neuriti (frecce rosse), assoni (frecce blu) e dendriti (frecce verdi). Le celle sono state placcate con una densità di 120.000 cellule/mm3. Barra della scala = 100 μm. (B) I neuroni ipotalamici generici, placcati ad una densità di 200.000 cellule/mm3, mostrano normali caratteristiche di sviluppo e crescita e connettività (frecce nere). Barra della scala = 100 μm. Abbreviazioni: DIV = giorni in vitro; LepR = recettore della leptina. Tutti i dati generati o analizzati per costruire questa figura sono disponibili all'indirizzo https://doi.org/10.5061/dryad.cnp5hqc9c. Fare clic qui per visualizzare una versione più grande di questa figura.
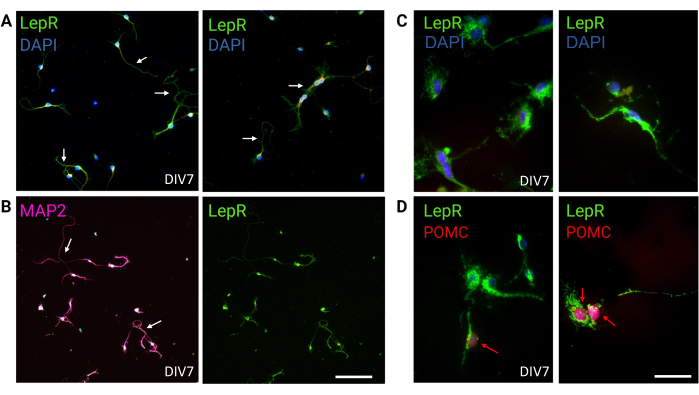
Figura 3: I neuroni in vivo sono ricapitolati da neuroni LepR+ in coltura. (A) Immagini rappresentative di una coltura di neuroni che esprimono il LepR (verde; DAPI è blu). Il novantanove per cento delle cellule esprimeva il LepR. I neuroni sono stati placcati a 120.000 cellule/mm3 densità. A DIV7, i neuroni presentavano assoni allungati, maturazione dendritica e connettività neuronale (frecce). Barra della scala = 40 μm. (B) L'immunofluorescenza con anti-MAP2 è stata utilizzata per confermare la natura neuronale delle cellule. Vengono dimostrate morfologie neuronali-specifiche come assoni, dendriti e protrusioni (frecce). Barra della scala = 40 μm. (C) Ingrandimento delle cellule LepR+. LepR in verde e DAPI in blu. Barra della scala = 10 μm. (D) Co-colorazione con LepR (verde) e POMC (rosso). Circa il 30% dei neuroni LepR+ erano co-immunoreattivi al POMC, che è stato rilevato a livello del nucleo (frecce rosse). Barra della scala = 10 μm. Abbreviazioni: DAPI = 4',6-diamidino-2-fenilindolo; MAP2 = proteina 2 associata ai microtubuli; POMC = proopiomelanocortina; LepR = recettore della leptina. Tutti i dati generati o analizzati per costruire questa figura sono disponibili all'indirizzo https://doi.org/10.5061/dryad.cnp5hqc9c. Fare clic qui per visualizzare una versione più grande di questa figura.
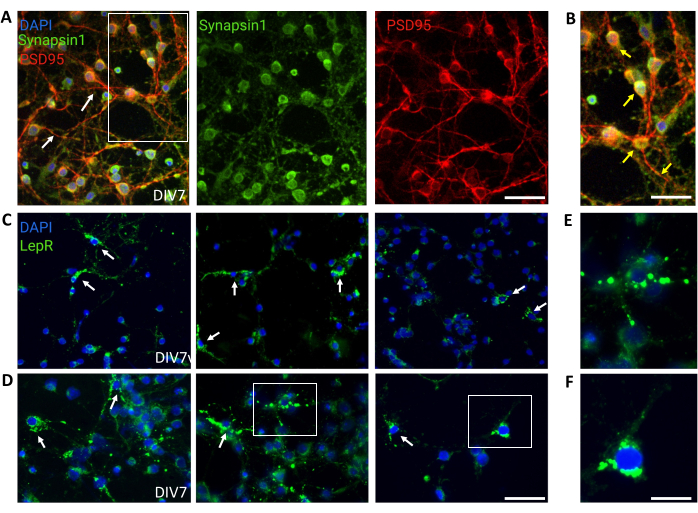
Figura 4: Le cellule in vivo sono ricapitolate da neuroni ipotalamici generici in coltura. (A) Immagini rappresentative di coltura neuronale ipotalamica generica colorata con Synapsin 1 (verde), PSD95 (rosso) e DAPI (blu). I neuroni hanno mostrato una connettività e una funzionalità sinaptica ben sviluppate (frecce). Barra della scala = 40 μm. (B) Ingrandimento del riquadro in (A), che mostra la co-localizzazione di Synapsin 1 (verde) e PSD95 (rosso, frecce). Barra della scala = 20 μm. (C,D) Immagini rappresentative che mostrano le cellule LepR+ in una coltura generale. Le cellule LepR+ (verdi) rappresentavano ~5% del totale. Le cellule LepR+ rappresentative sono indicate da frecce. Barra della scala = 40 μm. (E,F) Ingrandimenti delle caselle in (C,D) che mostrano i recettori della leptina dei punti verdi localizzati al soma. Barra della scala = 20 μm. Tutti i dati generati o analizzati per costruire questa figura sono disponibili all'indirizzo https://doi.org/10.5061/dryad.cnp5hqc9c. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Studiare le proprietà biochimiche ed elettriche dei neuroni ipotalamici è la chiave per comprendere le basi molecolari del metabolismo, della termoregolazione, della gestione dell'umore, del comportamento alimentare e altro ancora. Tuttavia, l'eterogeneità neuronale dell'ipotalamo rende questo sforzo impegnativo e sono necessari metodi per isolare e studiare specifiche sottopopolazioni ipotalamiche.
Le tecniche in vivo impiegano la CRE-ricombinasi, l'optogenetica, la fotometria delle fibre e l'imaging del calcio. Questi approcci consentono principalmente lo studio delle proprietà elettriche dei neuroni ipotalamici e pochissimi metodi sono attualmente disponibili per studiare i loro attributi non elettrici. La tecnologia MACS sviluppata in questo studio potrebbe fornire una tecnica in grado di isolare specifiche sottopopolazioni neuronali ipotalamiche in vitro, consentendo così trattamenti e analisi mirati. Le colture neuronali sono più semplici da gestire rispetto alle co-colture di diverse popolazioni neuronali. Inoltre, le colture pure evitano gli effetti confondenti derivanti dalla presenza di glia e microglia. Pertanto, i neuroni della stessa regione ipotalamica e dello stesso tipo potrebbero essere studiati in risposta a specifici input metabolici e ormonali.
In questo protocollo, abbiamo selezionato i neuroni ipotalamici che esprimono il LepR. Le cellule LepR+ isolate sono state coltivate per studiare le loro caratteristiche cellulari, morfologiche e molecolari che sono difficili da studiare in vivo. La purezza delle colture era del 99%, a sostegno dell'accuratezza del metodo. Inoltre, le cellule LepR+ erano sane e vitali a DIV7 fino a DIV21.
Questa tecnica, tuttavia, presenta alcune limitazioni. Le colture di neuroni puri E18 o più vecchie sono difficili da mantenere. Pertanto, la finestra di estrazione è limitata a E14-E16. Ciò implica che i cambiamenti cellulari che si verificano dopo l'E16 non vengono rilevati. Ad esempio, l'espressione del recettore della leptina nei neuroni ARC aumenta durante il primo periodo postnatale22. La procedura per l'isolamento deve essere eseguita il più rapidamente possibile per ridurre lo stress e la morte cellulare e migliorare la resa. La procedura può durare fino a 5 ore; Pertanto, è essenziale mantenere le condizioni di sterilità e ridurre la manipolazione al minimo necessario. La selezione positiva può portare a una bassa resa a causa delle basse quantità di tessuto disponibile, limitando il numero di esperimenti che possono essere eseguiti con un singolo preparato. È stata osservata un'elevata morte neuronale, probabilmente a causa della bassa densità cellulare e della ridotta connettività neuronale e del supporto intraneuronale.
Inoltre, l'anticorpo che ha come bersaglio l'antigene di interesse deve legarsi alla superficie cellulare per garantire una corretta separazione; di solito, gli anticorpi utilizzati per la citometria a flusso sono adatti per la tecnica MACS. Se l'anticorpo non è mai stato utilizzato in precedenza nei metodi di separazione cellulare, sono necessari esperimenti di convalida e titolazione per determinare l'uso e la concentrazione ideali. L'estrazione di cellule bersaglio richiede un marcatore di superficie cellulare. In questo caso abbiamo utilizzato un anticorpo biotinilato, ma in linea di principio potrebbero essere utilizzati anche anticorpi coniugati con altre molecole, come FITC (isotiocianato di fluoresceina) e PE (anti-ficoeritrina purificata). La tecnologia MACS potrebbe anche essere applicata ai neuroni che esprimono un fluoroforo, come GFP o un'altra proteina Tag, aumentando potenzialmente la specificità e la resa. Se non viene utilizzato un fluoroforo, l'alternativa sarebbe quella di confermare l'espressione della molecola di interesse mediante immunofluorescenza prima di eseguire esperimenti su cellule vive. Studi futuri metteranno alla prova la validità di queste alternative.
Un aspetto importante che questo studio non ha affrontato riguarda la "fedeltà" delle popolazioni sub-neuronali. Abbiamo accertato che i neuroni LepR+ in coltura esprimevano POMC, che è una firma dei neuroninativi ARC POMC . Tuttavia, saranno necessari ulteriori test per concludere che le colture neuronali LepR+ ricapitolano le loro controparti native in vivo . Nel complesso, il protocollo di isolamento neuronale MACS qui presentato può fornire un metodo valido ed efficace per studiare in vitro meccanismi ipotalamici che altrimenti sarebbero difficili da studiare in vivo.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Le figure grafiche sono state create con BioRender.com. Questo lavoro è stato sostenuto da una sovvenzione NIA (R01AG060919) e da una sovvenzione NSF (2030348) a FS.
Materiali
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
Riferimenti
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707(2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803(2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450(2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050(2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944(2021).
- Foo, L. C. Purification of rat and mouse astrocytes by immunopanning. 2013 (5), Cold Spring Harbor Protocols. 421-432 (2013).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), Cold Spring Harbor Protocols. 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594(2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12(2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon