Method Article
Isolamento de neurônios hipotalâmicos direcionados para estudos de regulação hormonal, metabólica e elétrica
Neste Artigo
Resumo
Aqui apresentamos um protocolo para o crescimento de subtipos específicos de células hipotalâmicas em cultura. As células podem ser selecionadas com base em marcadores de membrana oportunos/únicos e usadas em muitas aplicações, incluindo imunofluorescência, ensaios eletrofisiológicos e bioquímicos.
Resumo
O hipotálamo regula processos metabólicos fundamentais, controlando funções tão variadas como ingestão de alimentos, temperatura corporal e liberação de hormônios. Como as funções do hipotálamo são controladas por subgrupos específicos de populações neuronais, a capacidade de isolá-los fornece uma ferramenta importante para o estudo de mecanismos metabólicos. Nesse sentido, a complexidade neuronal do hipotálamo impõe desafios excepcionais.
Por essas razões, novas técnicas, como a Classificação Celular Ativada Magnética (MACS), têm sido exploradas. Este artigo descreve uma nova aplicação da classificação de células ativadas por magnetismo (MACS) usando a tecnologia de microesferas para isolar uma população-alvo neuronal de cérebros de camundongos pré-natais. A técnica é simples e garante uma cultura de neurônios hipotalâmicos primários altamente pura, viável e com alta reprodutibilidade. O hipotálamo é suavemente dissociado, os neurônios são seletivamente isolados e separados das células gliais e, finalmente, usando um anticorpo específico para um marcador de superfície celular, a população de interesse é selecionada.
Uma vez isolados, os neurônios-alvo podem ser usados para investigar suas características morfológicas, elétricas e endócrinas e suas respostas em condições normais ou patológicas. Além disso, dados os papéis variados do hipotálamo na regulação da alimentação, metabolismo, estresse, sono e motivação, um olhar mais atento aos neurônios específicos e específicos da região pode fornecer informações sobre suas tarefas neste ambiente complexo.
Introdução
O hipotálamo é uma área multifacetada do cérebro que medeia funções endócrinas, autonômicas, viscerais e comportamentais, incluindo alimentação, metabolismo, sono, temperatura corporal, comportamento social e desejo sexual 1,2,3,4,5. A heterogeneidade funcional é alcançada por uma combinação sinérgica de mecanismos bioquímicos e elétricos: neurônios hipotalâmicos disparam potenciais de ação e secretam e liberam hormônios e neuropeptídeos para modular regiões cerebrais e órgãos do corpo. Finalmente, os neurônios hipotalâmicos traduzem mensagens homeostáticas do corpo, respondendo com feedback de longo e curto prazo e regulações feedforward6.
O complexo ambiente neuronal do hipotálamo inclui neurônios endócrinos magnocelulares, liberando ocitocina e vasopressina; neurônios parvocelulares, primariamente envolvidos na regulação hormonal sistêmica, liberando, por exemplo, hormônio liberador de tireotrofina (TRH) e hormônio liberador de corticotropina (CRH) para a glândula pituitária; grandes neurônios de projeção peptidérgica, liberando orexina e hormônio concentrador de melanina (MCH); e neurônios peptidérgicos parvocelulares do Núcleo Arcuado (ARC) liberando POMC (proopiomelanocortina) e AgRP (proteína relacionada à cutia), denominados ARCPOMC e ARC AgRP, respectivamente. Juntamente com as células secretoras, outros neurônios excitatórios e inibitórios, incluindo neurônios dopaminérgicos, glutaminérgicos e gabaérgicos 7, estão envolvidos na formação de circuitos intra-hipotalâmicos e extra-hipotalâmicos, criando redes coordenadas em larga escala de considerável heterogeneidade celular8.
A diversidade hipotalâmica tem sido um desafio que os pesquisadores vêm tentando superar nos últimos 50 anos. Para estudar essa heterogeneidade no hipotálamo em desenvolvimento, maduro e envelhecido, os pesquisadores, por um lado, têm empregado o sequenciamento de RNA de célula única para explorar a organização neuronal, bem como assinaturas moleculares e transcriptômicas. Esse esforço proporcionou um olhar perspicaz sobre os papéis variados dos neurônios hipotalâmicos e abordou as conexões entre a identidade celular e seu possível papel no sistema fisiológico 8,9,10. Por outro lado, as funções neuronais têm sido investigadas por manipulações optogenéticas e abordagens comportamentais de fotometria com fibra, permitindo um olhar atento à estrutura dos circuitos. Nas últimas duas décadas, a tecnologia da Cre-recombinase permitiu aos pesquisadores estimular ou inibir ontogeneticamente um grupo-alvo de neurônios enquanto observavam mudanças nos comportamentos e nas respostas corporais 6,11,12.
No entanto, essas abordagens examinam as funções hipotalâmicas de uma perspectiva geral sem mergulhar mais profundamente nos mecanismos celulares específicos ou na base biológica de seu papel dentro do ambiente hipotalâmico complexo. Para resolver isso, poucos estudos têm se concentrado na investigação de propriedades moleculares, bioquímicas e elétricas utilizando culturas hipotalâmicas primárias heterogêneas. Esses estudos buscaram dissecar processos neuronais específicos em um ambiente complexo e geraram modelos integrativos de mecanismos fisiológicos13,14,15. No entanto, culturas não específicas representam desafios significativos. Por exemplo, a conectividade fisiológica e a distribuição anatômica dos neurônios são interrompidas pelo revestimento de neurônios de diferentes regiões hipotalâmicas que normalmente não interagiriam, criando efeitos de confusão. Além disso, cada região tem papéis diferentes e populações neuronais variegadas, dificultando o estudo de processos biológicos simples.
Para enfrentar esses desafios, na última década, novas abordagens foram implementadas para isolar neurônios de interesse, como immunopanning, Fluorescent-Activated-Cell-Sorting (FACS) e Magnetic-Activated-Cell-Sorting (MACS). O immunopanning é uma estratégia empregada para purificar células-alvo usando placas revestidas com anticorpos para uma série de seleções não-neuronais (negativas) e neuronais (positivas). Embora essa técnica possa, em princípio, gerar culturas de células purificadas de alto rendimento, na prática, é mais utilizada para astrócitos e oligodendrócitos, uma vez que essas células podem resistir a horas de manipulação16,17. A tecnologia FACS é uma poderosa ferramenta para classificar células com base em marcadores fluorescentes e características celulares por citometria de fluxo18,19,20. No entanto, poucos estudos utilizaram esse método para isolar células para cultura celular. A técnica é cara e requer pessoal altamente qualificado para uso e manutenção; Além disso, é um desafio manter células viáveis e estéreis ao final do procedimento de triagem21. Em geral, a MACS parece ser uma técnica simples e não dispendiosa para obter culturas altamente puras e viáveis de neurônios primários hipotalâmicos. O método utiliza esferas magnéticas ligadas às células por meio de um anticorpo. Isso permite que as células sejam isoladas usando o campo magnético da coluna.
Aqui descrevemos um método baseado na tecnologia MACS, que é tipicamente usado com neurônios corticais. Este protocolo permite isolar, em princípio, neurônios hipotalâmicos viáveis e altamente puros. Neste estudo, preparamos culturas primárias de neurônios que expressam o Receptor de Leptina (LepR), como ARCPOMC e ARC AgRP , que estão presentes apenas no Núcleo Arcuado. Esses neurônios respondem à leptina, hormônio anorexígeno secretado pelo tecido adiposo, de forma bioquímica e elétrica. Portanto, o isolamento desse grupo de neurônios em cultura permite o estudo de suas propriedades hormonais, metabólicas e elétricas in vitro.
Protocolo
NOTA: Uma visão geral do procedimento experimental é ilustrada graficamente na Figura 1A. Todos os experimentos com camundongos realizados neste estudo foram aprovados pelo Comitê de Cuidados e Uso de Animais (IACUC) de nossa instituição. Foram utilizados camundongos C57BL6/J com 3 meses de idade, alojados em um biotério aprovado pela Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC), sob os cuidados de um veterinário. Os camundongos viveram em gaiolas grandes, com ciclo claro-escuro de 12 h, e foram alimentados ad libitum.
1. Concepção e verificação da gravidez
- Coloque camundongos de qualquer background e genótipo de interesse para reprodução. Registre a data e o peso da fêmea antes da concepção.
- Após 6 h, inspecione a fêmea em busca de uma placa com uma sonda. Se a placa estiver presente, separe a fêmea do macho. Se a placa não estiver presente, mantenha a fêmea na gaiola até o dia seguinte e, em seguida, separe os camundongos.
- Nos dias 7, 10 e 14 pós-concepção, pesar a fêmea para confirmar a gravidez.
2. Mídia, placa de 24 poços e preparação do material
- No dia do isolamento celular, coloque, pronto para uso, tampas de vidro revestidas de poli-D-lisina (ver Tabela de Materiais) em uma placa de 24 poços da seguinte forma:
- Sob uma capa biológica, esterilize uma única embalagem contendo 15 lamínulas com etanol 70% e deixe secar. Abra a embalagem e coloque as lamínulas em uma placa de 60 mm. Agite a placa horizontalmente para separar as lamínulas. Em seguida, inverta a placa para pegar as tampas simples a serem colocadas nos poços de uma placa de 24 poços.
- Lave as lamínulas uma vez com 1,0 mL de solução salina balanceada de Hank estéril (HBSS) por 5 min.
- Enquanto isso, preparar 20,0 mL de meio de plaqueamento da seguinte forma: para 18,31 mL de BME (Basal Medium Eagle, + Sais de Earle), suplementado com 1,0 mL de soro fetal bovino (FBS) inativado pelo calor, adicionar 200 μL de piruvato de sódio (de um estoque de 100x), 200 μL de glutamina (de um estoque de 200 nM) e 100 μL de penicilina/estreptomicina (de um estoque de 200x).
- Substitua o HBSS nos poços por 1,0 mL de meio de revestimento e coloque a placa na incubadora a 37 °C.
- Usando um queimador de Bunsen, polir três pipetas Pasteur em diâmetros decrescentes. Segurando a pipeta com uma mão, insira a ponta na chama e remova-a rapidamente. Repita o processo até que a ponta alise e o diâmetro seja reduzido para o diâmetro desejado (avaliado a olho).
3. Preparo de reagentes para Dissociação do Tecido Neural, seguindo as orientações do kit de Dissociação Neural
- Após aquecer o Tampão de Digestão 1 à temperatura ambiente, prepare a Mistura de Enzimas 1 misturando 50 μL de Enzima 1 com 1,91 mL de Tampão 1 e a Mistura de Enzimas 2 misturando 15 μL de Enzima 2 com 30 μL de Tampão de Digestão 2. As misturas são suficientes para serem usadas no tecido cerebral de todos os embriões.
- Preparar Albumina de Soro Bovino (BSA) a 0,5% em HBSS, por exemplo, 0,25 g em 50,0 mL de HBSS.
4. Extração de embriões
- Autoclave duas pinças finas retas, uma pinça de ponta curva e uma tesoura cirúrgica fina e esterilize-as com etanol 70% antes do uso. Em seguida, recheie as placas de Petri com HBSS.
- Eutanasiar uma fêmea gestante E14-E16 na câmara CO2 e realizar o deslocamento cervical.
NOTA: As seguintes etapas devem ser executadas sob o capô em condições estéreis: - Esterilizar o abdome com etanol 70%. Cortar a cavidade abdominal da sínfise púbica para o processo xifoide da caixa torácica com tesoura cirúrgica e pinça.
- Extrair o corno uterino e colocá-lo em uma placa de 100 mm cheia de HBSS gelado e lavar completamente.
- Extrair e separar todos os embriões do útero com pinças finas. Decapitar rapidamente os embriões com tesoura cirúrgica fina e/ou pinça. Coloque as cabeças na placa de Petri de 60 mm preenchida com HBSS.
5. Extração, coleta e dissociação tecidual do hipotálamo
- Coloque uma pinça fina na cavidade ocular para segurar o cérebro. Usando as outras pinças finas, remova a pele e o crânio descascando até que o cérebro esteja visível. Distinguir o cérebro de outros tecidos com base em sua aparência branca. A pele e o crânio são róseos e ricos em vasculatura.
- Remova o cérebro do crânio usando a pinça de ponto curva e retire o cérebro dos bulbos olfativos, virando-o de cabeça para baixo.
- Já o córtex é ventral e o hipotálamo é visível dorsalmente na superfície superior (Figura 1B). Com a pinça curva, remova a camada de meninges e vasos sanguíneos até que o cérebro pareça branco e claro.
- Com a pinça curva, separe a área hipotalâmica do resto do cérebro.
- Corte o hipotálamo em 3-4 pedaços pequenos e, com um pipete, transfira os pedaços para um tubo de 15 mL.
- Repita os passos para os outros embriões enquanto o tubo estiver no gelo.
- Encher o tubo com 6,0 mL de HBSS e deixar o tecido assentar, remover o sobrenadante e adicionar Enzyme Mix 1. Misture e agite suavemente o tubo para evitar o tecido.
- Incubar o tubo em banho-maria a 37 °C por 15 min e agitar o tecido a cada 5 min para ressuspender o tecido.
- Após 15 min, adicionar 30 μL de mistura enzimática 2. Dissociar o tecido cerebral utilizando a pipeta Pasteur de maior diâmetro (<1 mm). Pipete para cima e para baixo 10x sem formar bolhas.
- Incubar durante 10 min a 37 °C em banho-maria. Agite suavemente o tubo para ressuspender o tecido a cada 5 min.
- Após 10 min, adicione os restantes 15 μL de mistura enzimática 2. Dissociar o tecido 10x com as outras duas pipetas polidas a fogo de diâmetro decrescente, para cima e para baixo sem formar bolhas.
- Ao tubo com o tecido dissociado, adicionar imediatamente 10,0 mL de HBSS-BSA a 0,5% e centrifugar a 300 × g por 10 min à temperatura ambiente.
- Aspirar o sobrenadante e ressuspender o pellet de células em 1,0 mL de HBS-BSA 0,5%.
6. Contagem de células
- Diluir a suspensão celular 1:5 com HBSS-BSA a 0,5%.
- Colocar 10 μL da suspensão de células diluídas numa câmara de contagem de Neubauer.
- Sob um microscópio de campo claro, conte apenas as células que estão nos quadrados de canto das quatro câmaras. Calcule a média e multiplique por 5 × 104.
NOTA: Certifique-se de que existem >106 células para proceder ao isolamento celular; o número ideal de células é 107.
7. Seleção negativa
NOTA: A seleção negativa permite que os usuários obtenham uma cultura de neurônio primário puro separando células neuronais e não neuronais. Use soluções pré-resfriadas.
- Centrifugar a suspensão da célula a 300 × g por 3 min (a centrifugação pode ser estendida até 10 min). Aspirar suavemente o sobrenadante e ressuspender o pellet até uma concentração de 10a 7 células em 80 μL de HBSS-0,5% BSA.
- Adicionar 20 μL de Coquetel de Biotina-Anticorpo de Células Não Neuronais e incubar por 5 min a 4 °C.
- Lavar as células para remover o anticorpo livre com 2,0 mL de HBSS-BSA 0,5% e centrifugar a 300 × g por 3 min.
- Aspirar suavemente o sobrenadante e ressuspender o pellet em 80 μL de HBSS-BSA 0,5%. Adicionar 20 μL de microesferas anti-biotina, misturar bem e incubar durante 10 min a 4 °C.
- Adicionar 0,5 mL de HBSS-BSA a 0,5% para até 10 a 7 células e aguardar até quea coluna magnética esteja pronta.
8. Separação magnética, seleção negativa
NOTA: A separação magnética é uma etapa crucial que permite a separação das células não neuronais das células neuronais. A amostra contendo células neuronais e não neuronais é passada através do campo magnético e as células não neuronais, que estão ligadas a um complexo biotina-anticorpo-esferas magnéticas, ficam aprisionadas na coluna (Figura 1C). As células neuronais livres são eluídas através da coluna e coletadas em um tubo de 15 mL.
- Prepare o suporte (incluído no kit) com o separador e a coluna MS, conforme mostrado na Figura 1C.
- Abra a coluna e configure o suporte somente quando as células estiverem prontas para serem separadas.
- Enxaguar a coluna com 0,5 mL de HBSS-BSA 0,5%. Aguarde até que a solução pare de pingar.
- Para coletar células neuronais, coloque um tubo de 15 mL sob a coluna e passe 0,5 mL da suspensão celular através da coluna. Colete o eluato no tubo até parar de pingar. Para capturar células neuronais residuais, lavar a coluna 3 x 0,5 mL de HBSS-BSA 0,5%.
- Para coletar células não neuronais, remova a coluna do ímã e coloque-a dentro de um novo tubo de 15 ml. Adicionar 1,0 mL de HBSS--BSA a 0,5% à coluna e usar o êmbolo para coletar as células não neuronais marcadas magneticamente.
- Centrifugar as células neuronais e não neuronais a 300 × g por 3 min. Aspirar suavemente o sobrenadante e ressuspender as células em 1,0 mL de HBSS-BSA 0,5%. Conte as células conforme descrito anteriormente na secção 6.
- Se necessário, plaquear as células não neuronais em uma placa de 24 poços; caso contrário, descarte-os.
9. Seleção positiva
NOTA: Uma vez obtida uma suspensão de células neuronais puras, a seleção positiva é realizada para isolar as células-alvo. As células podem ser isoladas usando um anticorpo específico conjugado à biotina para um antígeno de superfície. O anticorpo é reconhecido por esferas magnéticas anti-biotina. Ao fluir a suspensão celular através da coluna, apenas as células de interesse ficam presas no campo magnético.
- Centrifugar a suspensão de células neuronais puras a 300 × g por 3 min. Aspirar suavemente o sobrenadante e ressuspender o pellet em 80 μL de HBSS-BSA 0,5%. Adicionar o anticorpo específico seguindo as instruções do fabricante e incubar a 4 °C durante 10 minutos.
NOTA: Se as células que expressam a LepR forem procuradas, sugerimos um Anticorpo Biotinilado de Leptina R de Camundongo (ver Tabela de Materiais) na concentração de 0,50 μg/106 células. - Lavar o excesso de anticorpos com 2,0 mL de HBSS-BSA 0,5% e centrifugar a 300 × g por 3 min.
- Remover o sobrenadante, ressuspender o pellet em 80 μL de HBSS-BSA 0,5% e adicionar 20 μL de microesferas anti-biotina. Incubar a 4 °C durante 10 min.
- Para cada 10a 7 células, adicionar 0,5 mL de HBSS-BSA a 0,5% e aguardar até que a coluna magnética esteja pronta.
10. Separação magnética, seleção positiva
- Prepare o suporte com o separador e a coluna MS. Enxaguar a coluna MS com 0,5 mL de HBSS-BSA 0,5%. Espere até que o gotejamento pare.
- Colocar um tubo de 15 mL sob a coluna, passar 0,5 mL da suspensão celular pela coluna e coletar o eluato que compreende as células neuronais inespecíficas. Para limpar a coluna de células neuronais residuais inespecíficas, lavar com 3 x 0,5 mL de HBSS-BSA 0,5%.
- Retire a coluna do ímã, coloque-a em um novo tubo de 15 mL e adicione 1,0 mL de HBSS-BSA 0,5%. Use o êmbolo para liberar as células-alvo.
- Centrifugar ambos os tubos a 300 × g por 3 min. Retire suavemente o sobrenadante e volte a suspendê-lo em 0,5 mL de meio de plaqueamento.
- Conte as células conforme descrito anteriormente na secção 6.
- Plaquear tanto as células-alvo como controle positivo quanto as células não específicas como controle negativo a 120.000-200.000 células/mm3 de densidade na placa de 24 poços previamente preparada conforme descrito na seção 2 e incubar a 37 °C em 5% de CO 2, 9% de O2 e 95% de umidade por 12 h.
11. Manutenção da cultura celular
- Preparar 20 mL de meio de cultura com 19,2 mL de Meio de Cultura Neuronal, 400 μL de suplemento B27 (de um estoque de 50x), 200 μL de glutamina (de um estoque de 200 μM) e 100 μL de penicilina/estreptomicina (de um estoque de 200x).
- Substitua o meio de revestimento da placa de 24 poços contendo células neuronais ou não neuronais.
- Lavar com 2 x 1,0 mL de HBSS.
- Adicionar 1,0 mL de meio de cultura.
- Atualizar a mídia a cada 2/3 dias, substituindo 0,5 mL de mídia antiga por 0,5 mL de mídia fresca.
OBS: As células podem ser mantidas em cultura e utilizadas por até 21 dias in vitro (DIV21).
12. Coloração de imunofluorescência neuronal
- Doze horas antes da coloração, preparar uma solução composta por 50/50 metanol e acetona e arrefecer a -20 °C durante a noite.
- Lavar os neurônios na placa de 24 poços com 2 x 1,0 mL de solução salina tamponada com fosfato (PBS) por 5 min.
- Substitua a solução de PBS por 1,0 mL da solução 50/50 e incube em gelo por 20 min.
- Lave com 1x PBS por 3 x 5 min.
- Bloquear os neurônios com BSA 3% em 1x PBS por 1 h à temperatura ambiente.
- Preparar a solução de anticorpos primários em BSA a 3% em 1x PBS, usando a concentração de anticorpos mencionada nas instruções do fabricante. Os anticorpos e as concentrações utilizadas estão listados na Tabela de Materiais.
- Substitua a solução de bloqueio pela solução de anticorpos primários e incube a 4 °C durante a noite.
- Lave as células por 3 x 10 min com 1x PBS.
- Preparar a solução de anticorpos secundários com BSA a 3% em 1x PBS, utilizando as concentrações dos anticorpos seguindo as instruções do fabricante. Os anticorpos secundários utilizados estão listados na Tabela de Materiais.
- Incubar as células com a solução de anticorpos secundários à temperatura ambiente durante 1 h.
- Lave as células por 3 x 10 min com 1x PBS.
- Deixe os neurônios em 1x PBS durante o procedimento de montagem. Coloque uma pequena gota de meio de montagem (com ou sem 4',6-diamidino-2-fenilindol para identificação nuclear) na lâmina do microscópio. Extraia uma lamínula de vidro contendo neurônios com pinça e bata na lateral da lamínula em um tecido de papel para secar o excesso de PBS. Vire a tampa no meio de montagem, certificando-se de que os neurônios estejam voltados para as lâminas do microscópio; Pressione e remova suavemente o excesso de mídia de montagem com papel higiênico.
- As lâminas do microscópio estão prontas para serem analisadas com um microscópio de campo claro ou um microscópio confocal.
Resultados
Este trabalho descreve um protocolo para o isolamento de neurônios-alvo do hipotálamo (Figura 1). O objetivo do método é estudar características neuronais específicas em um contexto controlado e isolado. Assim, embriões de camundongos foram extraídos das fêmeas prenhes em E14-E16. As meninges foram removidas e o hipotálamo foi isolado do restante do cérebro. O tecido foi suavemente dissociado com duas misturas de enzimas recém-preparadas usando o kit de dissociação referenciado. Primeiro, as células não-neuronais foram separadas das células neuronais - glia, microglia, e os neurônios foram coletados na mesma suspensão de célula única. Para este fim, as células não-neuronais foram marcadas usando um coquetel de anticorpos reconhecendo epítopos de superfície não-neuronal. Após a incubação, o complexo anticorpo-célula foi conjugado com microesferas magnéticas e, posteriormente, passado através de uma coluna magnética para aprisionar as células não neuronais.
Essa etapa resultou em duas suspensões celulares, uma contendo células não neuronais e outra contendo células neuronais. Ambas as suspensões poderiam ser chapeadas imediatamente. Alternativamente, a suspensão de células neuronais poderia ser manipulada para separar uma subpopulação neuronal (suspensão direcionada) do resto usando a mesma estratégia. Com base no experimento de interesse, as células neuronais podem ser plaqueadas de 125.000 a 200.000 células/mm3. As culturas menos densas podem ser usadas para analisar neurônios em resolução unicelular: desde o desenvolvimento axonal, formação sináptica e transmissão até a eletrofisiologia. As culturas mais densas podem ser usadas para análises bioquímicas, incluindo extração de DNA e RNA, western blot, Southern blot, Northern blot, PCR em tempo real e sequenciamento de RNA.
Neste estudo, o LepR foi direcionado para isolar neurônios envolvidos no sistema melanocortina, como os neurônios ARCPOMC e ARC AgRP. As células foram plaqueadas em densidades que variaram de 120.000 células/mm3, para neurônios LepR+, a 200.000 células/mm3, para populações neuronais genéricas. Após 48 h, os neurônios LepR+ começaram a formar neuritos (Figura 2). Na DIV4, as extensões axonais mostraram progresso, enquanto os processos dendríticos começaram a aparecer. Na DIV6, os neurônios estavam suficientemente desenvolvidos e, portanto, prontos para serem analisados. Experimentos de imunofluorescência em neurônios LepR+ mostraram 99% de expressão de LepR (verde, Figura 3A). Não foram observadas células gliais ou outras células não neuronais, confirmando a pureza da cultura neuronal primária. A natureza neuronal das células foi confirmada pela coloração pela proteína 2 associada aos microtúbulos (MAP2), com a identificação de axônios e protrusões dendríticas (Figura 3B). Na DIV10, 30% das células LepR+ expressaram POMC (vermelho). Isso é esperado, pois a maioria das células LepR+ expressa POMC ou AgRP. A Figura 3C,D ilustra a co-localização entre os sinais POMC e LepR. Note-se que a co-localização foi proeminente dentro e ao redor do núcleo, como esperado.
Culturas gerais contendo populações neuronais hipotalâmicas heterogêneas foram usadas para controle. A imunofluorescência demonstrou conectividade sináptica e funcionalidade, conforme avaliado pelas cocolorações Sinapsina-1 (verde) e PSD 95 (vermelho) (Figura 4A,B). O número de neurônios LepR+ presentes na cultura geral foi de ~5%, uma porcentagem consistente com a noção de que a maioria dos neurônios que expressam LepR foram selecionados durante o processo de separação magnética (células LepR+ representativas estão ilustradas na Figura 4C,D). Todos os dados gerados ou analisados durante este estudo estão disponíveis no https://doi.org/10.5061/dryad.cnp5hqc9c.
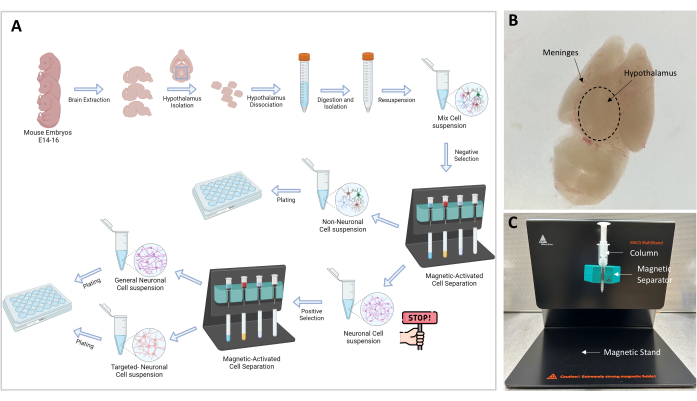
Figura 1: Fluxograma experimental e configuração. (A) Representação gráfica do procedimento experimental. Go-no-go: ≥106 células são necessárias para proceder ao isolamento celular; o número ideal de células é 107. (B) Imagem representativa do cérebro de um embrião E16. O hipotálamo e as meninges são indicados. (C) Configuração MACS usada para a separação e isolamento de células-alvo. Suporte magnético, separador magnético e coluna são indicados. Clique aqui para ver uma versão maior desta figura.
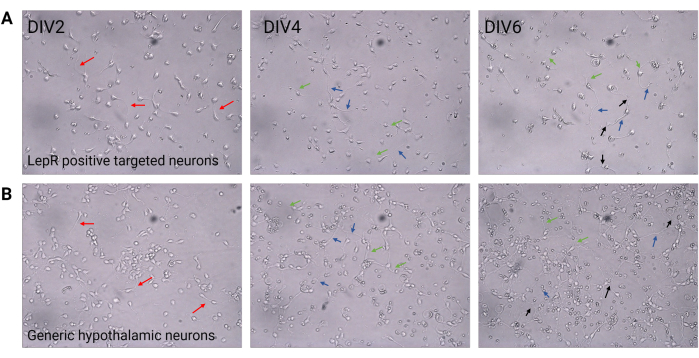
Figura 2: Cultura neuronal entre DIV2 e DIV6. (A) As células LepR+ obtidas da seleção positiva apresentam densidade celular e conectividade reduzidas, mas desenvolvimento normal de neuritos (setas vermelhas), axônios (setas azuis) e dendritos (setas verdes). As células foram plaqueadas a uma densidade de 120.000 células/mm3. Barra de escala = 100 μm. (B) Neurônios hipotalâmicos genéricos, plaqueados a uma densidade de 200.000 células/mm3, apresentam características normais de desenvolvimento, crescimento e conectividade (setas pretas). Barra de escala = 100 μm. Abreviações: DIV = dias in vitro; LepR = receptor de leptina. Todos os dados gerados ou analisados para a construção deste valor estão disponíveis no https://doi.org/10.5061/dryad.cnp5hqc9c. Clique aqui para ver uma versão maior desta figura.
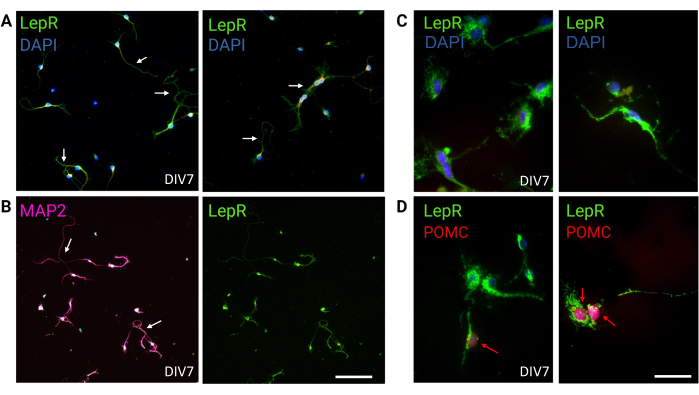
Figura 3: Neurônios in vivo são recapitulados por cultura de neurônios LepR+. (A) Imagens representativas de uma cultura de neurônios expressando a LepR (verde; DAPI é azul). Noventa e nove por cento das células expressaram a LepR. Os neurônios foram plaqueados a 120.000 células/mm3 de densidade. Na DIV7, os neurônios apresentavam axônios alongados, maturação dendrítica e conectividade neuronal (setas). Barra de escala = 40 μm. (B) A imunofluorescência com anti-MAP2 foi utilizada para confirmar a natureza neuronal das células. Morfologias neuronai-específicas como axônios, dendritos e protrusões são demonstradas (setas). Barra de escala = 40 μm. (C) Ampliação das células LepR+. LepR em verde e DAPI em azul. Barra de escala = 10 μm. (D) Cocoloração com LepR (verde) e POMC (vermelho). Cerca de 30% dos neurônios LepR+ eram co-imunorreativos à CMPO, que foi detectada ao nível do núcleo (setas vermelhas). Barra de escala = 10 μm. Abreviações: DAPI = 4',6-diamidino-2-fenilindol; MAP2 = proteína 2 associada aos microtúbulos; POMC = proopiomelanocortina; LepR = receptor de leptina. Todos os dados gerados ou analisados para a construção deste valor estão disponíveis no https://doi.org/10.5061/dryad.cnp5hqc9c. Clique aqui para ver uma versão maior desta figura.
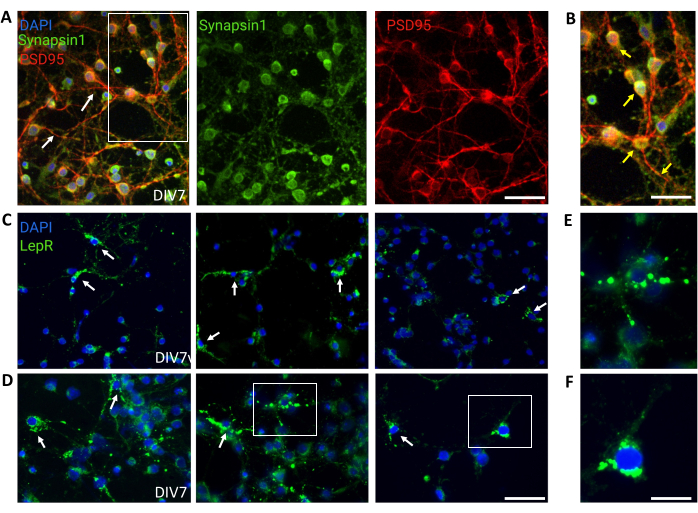
Figura 4: As células in vivo são recapituladas por cultura de neurônios hipotalâmicos genéricos. (A) Imagens representativas de cultura neuronal hipotalâmica genérica corada com Sinapsina 1 (verde), PSD95 (vermelho) e DAPI (azul). Os neurônios exibiram conectividade e funcionalidade sináptica bem desenvolvidas (setas). Barra de escala = 40 μm. (B) Ampliação da caixa em (A), mostrando a co-localização de Sinapsina 1 (verde) e PSD95 (vermelho, setas). Barra de escala = 20 μm. (C,D) Imagens representativas mostrando células LepR+ em uma cultura geral. As células LepR+ (verdes) representaram ~5% do total. Células LepR+ representativas são indicadas por setas. Barra de escala = 40 μm. (E,F) Magnificações das caixas em (C,D) mostrando receptores de leptina puncta verde localizados no soma. Barra de escala = 20 μm. Todos os dados gerados ou analisados para a construção deste valor estão disponíveis no https://doi.org/10.5061/dryad.cnp5hqc9c. Clique aqui para ver uma versão maior desta figura.
Discussão
Investigar as propriedades bioquímicas e elétricas dos neurônios hipotalâmicos é a chave para entender a base molecular do metabolismo, termorregulação, gerenciamento do humor, comportamento alimentar e muito mais. No entanto, a heterogeneidade neuronal do hipotálamo torna esse esforço desafiador, e métodos para isolar e estudar subpopulações hipotalâmicas específicas são necessários.
Técnicas in vivo empregam CRE-recombinase, optogenética, fotometria de fibra e imagem de cálcio. Essas abordagens permitem principalmente o estudo das propriedades elétricas dos neurônios hipotalâmicos, e poucos métodos estão atualmente disponíveis para investigar seus atributos não-elétricos. A tecnologia MACS desenvolvida neste estudo pode fornecer uma técnica capaz de isolar subpopulações neuronais hipotalâmicas específicas in vitro, proporcionando assim tratamentos e análises direcionadas. Culturas neuronais são mais simples de manejar em comparação com co-culturas de diferentes populações neuronais. Além disso, culturas puras evitam efeitos de confusão decorrentes da presença de glia e microglia. Assim, neurônios de uma mesma região e tipo hipotalâmico poderiam ser estudados em resposta a inputs metabólicos e hormonais específicos.
Neste protocolo, selecionamos neurônios hipotalâmicos que expressam a LepR. Células LepR+ isoladas foram cultivadas para investigar suas características celulares, morfológicas e moleculares, que são difíceis de estudar in vivo. A pureza das culturas foi de 99%, suportando a acurácia do método. Além disso, as células LepR+ foram saudáveis e viáveis na DIV7 até a DIV21.
Essa técnica, no entanto, apresenta algumas limitações. Culturas de neurônios puros E18 ou mais antigas são difíceis de manter. Portanto, a janela de extração é limitada a E14-E16. Isso implica que as alterações celulares que ocorrem após E16 são perdidas. Por exemplo, a expressão do receptor de leptina em neurônios ARC aumenta durante o período pós-natal precoce22. O procedimento de isolamento deve ser realizado o mais rápido possível para reduzir o estresse celular e a morte e melhorar o rendimento. O procedimento pode levar até 5 h; Assim, é essencial manter as condições estéreis e reduzir a manipulação ao mínimo necessário. A seleção positiva pode levar a um baixo rendimento devido à baixa quantidade de tecido disponível, limitando o número de experimentos que podem ser realizados com uma única preparação. Elevada morte neuronal foi observada, provavelmente devido à baixa densidade celular e reduzida conectividade neuronal e suporte intraneuronal.
Além disso, o anticorpo que tem como alvo o antígeno de interesse deve se ligar à superfície celular para garantir uma separação correta; geralmente, os anticorpos usados para citometria de fluxo são adequados para a técnica MACS. Se o anticorpo não tiver sido usado antes em métodos de separação celular, experimentos de validação e titulação são necessários para determinar o uso e a concentração ideais. A extração de células-alvo requer um marcador de superfície celular. Aqui usamos um anticorpo biotinilado, mas em princípio, anticorpos conjugados com outras moléculas, como FITC (isotiocianato de fluoresceína) e PE (anti-ficoeritrina purificada), também poderiam ser usados. A tecnologia MACS também pode ser aplicada a neurônios que expressam um fluoróforo, como GFP ou outra proteína Tag, potencialmente aumentando a especificidade e o rendimento. Se um fluoróforo não for empregado, a alternativa seria confirmar a expressão da molécula de interesse por imunofluorescência antes de realizar experimentos com células vivas. Estudos futuros testarão a validade dessas alternativas.
Um aspecto importante que este estudo não abordou diz respeito à "fidelidade" das populações subneuronais. Verificamos que os neurônios LepR+ cultivados expressaram POMC, que é uma assinatura de neurônios ARCPOMC nativos. No entanto, mais testes serão necessários para concluir que as culturas neuronais LepR+ recapitulam suas contrapartes nativas in vivo . Em geral, o protocolo de isolamento neuronal MACS aqui apresentado pode fornecer um método válido e eficaz para estudar mecanismos hipotalâmicos in vitro que, de outra forma, seriam difíceis de investigar in vivo.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Figuras gráficas foram criadas com BioRender.com. Este trabalho foi apoiado por uma bolsa NIA (R01AG060919) e uma concessão NSF (2030348) para FS.
Materiais
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
Referências
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707(2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803(2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450(2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050(2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944(2021).
- Foo, L. C. Purification of rat and mouse astrocytes by immunopanning. 2013 (5), Cold Spring Harbor Protocols. 421-432 (2013).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), Cold Spring Harbor Protocols. 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594(2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12(2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados