Method Article
Выделение таргетных нейронов гипоталамуса для исследований гормональной, метаболической и электрической регуляции
В этой статье
Резюме
Здесь мы представляем протокол выращивания специфических подтипов клеток гипоталамуса в культуре. Клетки могут быть отобраны на основе подходящих/уникальных мембранных маркеров и использоваться во многих приложениях, включая иммунофлуоресцентный, электрофизиологический и биохимический анализы.
Аннотация
Гипоталамус регулирует основные метаболические процессы, контролируя такие разнообразные функции, как прием пищи, температура тела и высвобождение гормонов. Поскольку функции гипоталамуса контролируются определенными подмножествами нейронных популяций, способность изолировать их является основным инструментом для изучения метаболических механизмов. В связи с этим нейронная сложность гипоталамуса представляет исключительные проблемы.
По этим причинам были изучены новые методы, такие как магнитно-активированная сортировка клеток (MACS). В этой статье описывается новое применение магнитно-активированной сортировки клеток (MACS) с использованием технологии микрогранул для выделения целевой популяции нейронов из пренатального мозга мышей. Методика проста и гарантирует получение высокочистой и жизнеспособной культуры первичных нейронов гипоталамуса с высокой воспроизводимостью. Гипоталамус мягко диссоциируют, нейроны селективно выделяют и отделяют от глиальных клеток, и, наконец, используя специфическое антитело для маркера клеточной поверхности, отбирают интересующую популяцию.
После выделения нейроны-мишени могут быть использованы для изучения их морфологических, электрических и эндокринных характеристик и их реакций в нормальных или патологических условиях. Кроме того, учитывая разнообразную роль гипоталамуса в регулировании питания, обмена веществ, стресса, сна и мотивации, более пристальный взгляд на целевые и регионально-специфические нейроны может дать представление об их задачах в этой сложной среде.
Введение
Гипоталамус — это многоответственная область мозга, которая опосредует эндокринные, вегетативные, висцеральные и поведенческие функции, включая питание, обмен веществ, сон, температуру тела, социальное поведение и половое влечение 1,2,3,4,5. Функциональная гетерогенность достигается синергетическим сочетанием биохимических и электрических механизмов: нейроны гипоталамуса возбуждают потенциалы действия, секретируют и высвобождают гормоны и нейропептиды для модуляции областей мозга и органов тела. Наконец, нейроны гипоталамуса транслируют гомеостатические сообщения от организма, реагируя на них долгосрочной и краткосрочной обратной связьюи прямыми регуляциями.
Сложная нейронная среда гипоталамуса включает магноцеллюлярные эндокринные нейроны, высвобождающие окситоцин и вазопрессин; парвоцеллюлярные нейроны, в первую очередь участвующие в системной гормональной регуляции, высвобождающие, например, тиреотропин-рилизинг-гормон (ТРГ) и кортикотропин-рилизинг-гормон (КРГ) в гипофиз; крупные пептидергические проекционные нейроны, высвобождающие орексин и меланинконцентрирующий гормон (MCH); и парвоцеллюлярные пептидергические нейроны дугообразного ядра (ARC), высвобождающие POMC (проопиомеланокортин) и AgRP (белок, связанный с агути), названные ARCPOMC и ARCAgRP соответственно. Вместе с секреторными клетками другие возбуждающие и тормозные нейроны, в том числе дофаминергические, глутаминергические и ГАМКергические нейроны 7, участвуют в формировании интрагипоталамических и экстрагипоталамических цепей, тем самым создавая крупномасштабные координированные сети значительной клеточной гетерогенности8.
Разнообразие гипоталамуса было проблемой, которую исследователи пытались преодолеть в течение последних 50 лет. Чтобы изучить эту гетерогенность в развивающемся, зрелом и стареющем гипоталамусе, исследователи, с одной стороны, использовали секвенирование одноклеточной РНК для изучения организации нейронов, а также молекулярных и транскриптомных сигнатур. Эта работа предоставила проницательный взгляд на различные роли нейронов гипоталамуса и рассмотрела связи между клеточной идентичностью и ее возможной ролью в физиологической системе 8,9,10. С другой стороны, функции нейронов были исследованы с помощью оптогенетических манипуляций и поведенческих подходов фотометрии волокон, что позволило внимательно изучить структуру схемы. За последние два десятилетия технология кре-рекомбиназы позволила исследователям онтогенетически стимулировать или ингибировать целевую группу нейронов, наблюдая за изменениями в поведении и реакциях организма 6,11,12.
Тем не менее, эти подходы рассматривают функции гипоталамуса с общей точки зрения, не углубляясь в конкретные клеточные механизмы или биологические основы их роли в сложной гипоталамической среде. Чтобы решить эту проблему, очень немногие исследования были сосредоточены на изучении молекулярных, биохимических и электрических свойств с использованием гетерогенных первичных культур гипоталамуса. Эти исследования были направлены на препарирование специфических нейронных процессов в сложной среде и создали интегративные модели физиологических механизмов13,14,15. Тем не менее, неспецифические культуры создают значительные проблемы. Например, физиологические связи и анатомическое распределение нейронов нарушаются из-за того, что нейроны из разных областей гипоталамуса не взаимодействуют, создавая искажающие эффекты. Кроме того, каждая область имеет разные роли и разнообразные популяции нейронов, что затрудняет изучение простых биологических процессов.
Для решения этих проблем в последнее десятилетие были внедрены новые подходы к выделению интересующих нейронов, такие как иммунопанорамирование, флуоресцентно-активированная клеточная сортировка (FACS) и магнитно-активированная клеточная сортировка (MACS). Иммунопаннирование — это стратегия, используемая для очищения клеток-мишеней с помощью тарелок, покрытых антителами, для серии ненейрональных (отрицательных) и нейрональных (положительных) селекций. Хотя этот метод может, в принципе, генерировать высокопродуктивные очищенные клеточные культуры, на практике он в основном используется для астроцитов и олигодендроцитов, поскольку эти клетки могут выдерживать многочасовые манипуляции16,17. Технология FACS является мощным инструментом для сортировки клеток на основе флуоресцентных маркеров и клеточных характеристик с помощью проточной цитометрии18,19,20. Тем не менее, очень немногие исследования использовали этот метод для выделения клеток для клеточной культуры. Методика является дорогостоящей и требует высококвалифицированного персонала для использования и обслуживания; Кроме того, сложно сохранить жизнеспособные и стерильные клетки в конце процедуры сортировки21. В целом, MACS представляется простым и недорогим методом получения высокочистых и жизнеспособных культур первичных нейронов гипоталамуса. В методе используются магнитные шарики, связанные с клетками через антитела. Это позволяет изолировать ячейки с помощью магнитного поля колонки.
Здесь мы опишем метод, основанный на технологии MACS, которая обычно используется с корковыми нейронами. Этот протокол позволяет изолировать, в принципе, жизнеспособные и высокочистые нейроны гипоталамуса. В этом исследовании мы готовим первичные культуры нейронов, экспрессирующих рецептор лептина (LepR), таких как нейроны ARCPOMC и ARCAgRP , которые присутствуют только в дугообразном ядре. Эти нейроны реагируют на лептин, анорексигенный гормон, секретируемый жировой тканью, биохимическим и электрическим путями. Поэтому выделение этой группы нейронов в культуре позволяет изучать их гормональные, метаболические и электрические свойства in vitro.
протокол
ПРИМЕЧАНИЕ: Общий вид экспериментальной процедуры графически проиллюстрирован на рисунке 1А. Все эксперименты на мышах, проведенные в этом исследовании, были одобрены Комитетом по уходу за животными и их использованию (IACUC) нашего учреждения. Мы использовали 3-месячных мышей C57BL6/J, которые были помещены в виварий, одобренный Международной ассоциацией по оценке и аккредитации лабораторных животных (AAALAC), под наблюдением ветеринара. Мыши жили в больших клетках с 12-часовым циклом света и темноты и кормились вволю.
1. Подтверждение зачатия и беременности
- Размещайте мышей любого происхождения и генотипа, представляющих интерес для разведения. Запишите дату и вес самки до зачатия.
- Через 6 ч осмотрите самку на наличие налета с помощью щупа. Если бляшка присутствует, отделите самку от самца. Если налета нет, подержите самку в клетке до следующего дня, затем отделите мышей.
- На 7, 10 и 14 день после зачатия взвесьте самку, чтобы подтвердить беременность.
2. Среда, 24-луночная пластина и подготовка материала
- В день выделения клеток поместите готовые к использованию стеклянные покровные стекла с поли-D-лизиновым покрытием (см. таблицу материалов) в 24-луночный планшет следующим образом:
- Под биологическим колпаком простерилизуйте одну упаковку, содержащую 15 покровных стекол с 70% этанолом, и дайте высохнуть. Откройте упаковку и поместите покровные листы в пластину диаметром 60 мм. Встряхните пластину горизонтально, чтобы отделить покровные стекла. Затем переверните пластину, чтобы подобрать отдельные покровные стекла, которые будут помещены в лунки 24-луночной пластины.
- Промойте покровные стекла один раз 1,0 мл стерильного сбалансированного солевого раствора Хэнка (HBSS) в течение 5 минут.
- Тем временем приготовьте 20,0 мл гальванической среды следующим образом: до 18,31 мл BME (Basal Medium Eagle, + Earle's Salts), дополненные 1,0 мл термоинактивированной фетальной бычьей сыворотки (FBS), добавьте 200 мкл пирувата натрия (из 100-кратного бульона), 200 мкл глутамина (из 200-кратного запаса) и 100 мкл пенициллина/стрептомицина (из 200-кратного запаса).
- Замените HBSS в лунках 1,0 мл гальванического материала и поместите планшет в инкубатор при температуре 37 °C.
- С помощью горелки Бунзена отполируйте огнем три пипетки Пастера с убывающим диаметром. Придерживая пипетку одной рукой, вставьте наконечник в пламя и быстро выньте его. Повторяйте процесс до тех пор, пока кончик не станет гладким, а диаметр не уменьшится до нужного диаметра (оценивается на глаз).
3. Приготовление реагента для диссоциации нервной ткани в соответствии с указаниями набора для диссоциации нервной ткани.
- После нагревания пищеварительного буфера 1 при комнатной температуре приготовьте ферментную смесь 1, смешав 50 мкл фермента 1 с 1,91 мл буфера 1, и ферментную смесь 2, смешав 15 мкл фермента 2 с 30 мкл пищеварительного буфера 2. Смесей достаточно для использования в мозговой ткани всех эмбрионов.
- Приготовьте 0,5% бычий сывороточный альбумин (БСА) в HBSS, например, 0,25 г в 50,0 мл HBSS.
4. Извлечение эмбрионов
- Автоклавируйте два прямых тонких щипца, один щипец с изогнутым концом и одну пару тонких хирургических ножниц и стерилизуйте их 70% этанолом перед использованием. Затем наполните чашки Петри HBSS.
- Усыпить одну беременную самку Е14-Е16 в камереСО2 и выполнить вывих шейки матки.
ПРИМЕЧАНИЕ: Следующие действия должны быть выполнены под колпаком в стерильных условиях: - Простерилизуйте брюшную полость 70% этиловым спиртом. Хирургическими ножницами и щипцами разрезают брюшную полость от лобкового симфиза до мечевидного отростка грудной клетки.
- Извлеките рог матки и поместите его в 100-миллиметровую пластину, наполненную ледяным HBSS, и тщательно вымойте.
- Извлеките и отделите все эмбрионы от матки тонкими щипцами. Быстро обезглавьте эмбрионы тонкими хирургическими ножницами и/или щипцами. Поместите головки в чашку Петри диаметром 60 мм, наполненную HBSS.
5. Экстракция, забор и диссоциация тканей гипоталамуса
- Поместите один тонкий щипец в глазную полость, чтобы удерживать мозг. С помощью других тонких щипцов удалите кожу и череп путем шелушения до тех пор, пока мозг не станет виден. Отличить мозг от других тканей можно по его белому внешнему виду. Кожа и череп розовые и богаты сосудистой сетью.
- Извлеките мозг из черепа с помощью щипцов с изогнутым концом и вычерпайте мозг из обонятельных луковиц, перевернув его вверх ногами.
- Теперь кора вентральная, а гипоталамус виден дорсально на верхней поверхности (рис. 1Б). Изогнутыми щипцами удаляйте слой мозговых оболочек и кровеносных сосудов до тех пор, пока мозг не станет белым и чистым.
- С помощью изогнутых щипцов отделите область гипоталамуса от остальной части мозга.
- Разрежьте гипоталамус на 3-4 небольших кусочка и с помощью пипетки переложите кусочки в пробирку объемом 15 мл.
- Повторите эти действия для других эмбрионов, пока трубка находится на льду.
- Наполните пробирку 6,0 мл HBSS и дайте ткани осесть, удалите надосадочную жидкость и добавьте смесь ферментов 1. Осторожно перемешайте и перемешайте трубку, чтобы предотвратить образование тканей.
- Инкубируйте пробирку на водяной бане с температурой 37 °C в течение 15 минут и перемешивайте ткань каждые 5 минут, чтобы снова суспендировать ткань.
- Через 15 минут добавьте 30 мкл ферментной смеси 2. Диссоциировать ткани головного мозга можно с помощью пипетки Пастера с наибольшим диаметром (<1 мм). Пипетируйте вверх и вниз 10 раз, не образуя пузырьков.
- Выдерживать 10 мин при температуре 37 °C на водяной бане. Осторожно встряхивайте трубку, чтобы ресуспендировать ткань каждые 5 минут.
- Через 10 минут добавьте оставшиеся 15 мкл ферментной смеси 2. Диссоциировать ткань 10 раз двумя другими отполированными огнем пипетками уменьшающегося диаметра, вверх и вниз, не образуя пузырьков.
- В пробирку с диссоциированной тканью немедленно добавляют 10,0 мл HBSS-0,5% БСА и центрифугируют при 300 × г в течение 10 мин при комнатной температуре.
- Отсасывайте надосадочную жидкость и ресуспендируйте клеточную гранулу в 1,0 мл HBS-0,5% BSA.
6. Подсчет клеток
- Разбавляют клеточную суспензию 1:5 с использованием HBSS-0,5% BSA.
- Поместите 10 мкл разбавленной клеточной суспензии в счетную камеру Нойбауэра.
- Под светлопольным микроскопом подсчитайте только те клетки, которые находятся в угловых квадратах четырехкамерной камеры. Вычислите среднее и умножьте на 5 × 104.
ПРИМЕЧАНИЕ: Убедитесь, что имеется >106 клеток, чтобы приступить к изоляции клеток; Оптимальное количество ячеек – 107.
7. Отрицательный отбор
ПРИМЕЧАНИЕ: Отрицательный отбор позволяет пользователям получить чистую культуру первичных нейронов путем разделения нейронных и ненейрональных клеток. Используйте предварительно охлажденные растворы.
- Центрифугируют клеточную суспензию при 300 × г в течение 3 мин (центрифугирование можно продлить до 10 мин). Осторожно отсасывайте надосадочную жидкость и ресуспендируйте гранулу до концентрации 107 клеток в 80 мкл HBSS-0,5% BSA.
- Добавьте 20 мкл коктейля из ненейрональных клеток с биотином и антителами и инкубируйте в течение 5 минут при 4 °C.
- Промывают клетки для удаления свободных антител 2,0 мл HBSS-0,5% BSA и центрифугируют при 300 × г в течение 3 мин.
- Осторожно аспирируйте надосадочную жидкость и повторно суспендируйте гранулу в 80 мкл HBSS-0,5% BSA. Добавьте 20 мкл микрогранул антибиотика, тщательно перемешайте и инкубируйте в течение 10 минут при 4 °C.
- Добавьте 0,5 мл HBSS-0,5% BSA для 10-7 ячеек и подождите, пока магнитная колонка будет готова.
8. Магнитная сепарация, отрицательный отбор
ПРИМЕЧАНИЕ: Магнитная сепарация является важным этапом, который позволяет отделить ненейрональные клетки от нейронных. Образец, содержащий нейрональные и ненейрональные клетки, пропускают через магнитное поле, и ненейрональные клетки, которые связаны с комплексом биотин-антитело-магнитный шарик, захватываются в колонке (рис. 1C). Свободные нейронные клетки элюируются через колонку и собираются в пробирку объемом 15 мл.
- Подготовьте подставку (входит в комплект) с разделителем и колонкой MS, как показано на рисунке 1C.
- Открываем колонку и устанавливаем подставку только тогда, когда ячейки готовы к разделению.
- Промойте колонку 0,5 мл HBSS-0,5% BSA. Подождите, пока раствор перестанет капать.
- Для сбора нейрональных клеток поместите пробирку объемом 15 мл под колонку и пропустите через колонку 0,5 мл клеточной суспензии. Собирайте элюат в тюбик до тех пор, пока он не перестанет капать. Для захвата остаточных нейрональных клеток промывают колонку 3 х 0,5 мл HBSS-0,5% BSA.
- Чтобы собрать ненейрональные клетки, снимите колонку с магнита и поместите ее в новую пробирку объемом 15 мл. Добавьте 1,0 мл HBSS--0,5% BSA в колонку и используйте поршень для сбора магнитно-меченых ненейрональных клеток.
- Центрифугируют нейрональные и ненейрональные клетки при 300 × г в течение 3 мин. Осторожно отсасывайте надосадочную жидкость и ресуспендируйте клетки в 1,0 мл HBSS-0,5% BSA. Подсчитайте количество клеток, как описано ранее в разделе 6.
- При необходимости поместите ненейрональные клетки в 24-луночную пластину; в противном случае отбросьте их.
9. Положительный отбор
ПРИМЕЧАНИЕ: После получения чистой суспензии нейрональных клеток проводится положительный отбор для выделения клеток-мишеней. Клетки могут быть выделены с помощью специфического конъюгированного биотином антитела для поверхностного антигена. Антитело распознается по магнитным шарикам антибиотина. При прохождении клеточной суспензии через колонку в магнитное поле попадают только интересующие нас клетки.
- Центрифугируют чистую суспензию нейрональных клеток при 300 × г в течение 3 мин. Осторожно аспирируйте надосадочную жидкость и повторно суспендируйте гранулу в 80 мкл HBSS-0,5% BSA. Добавьте специфические антитела в соответствии с инструкциями производителя и инкубируйте при 4 °C в течение 10 минут.
ПРИМЕЧАНИЕ: Если ищутся клетки, экспрессирующие LepR, мы предлагаем биотинилированное антитело к мышиному лептину R (см. таблицу материалов) в концентрации 0,50 мкг/106 клеток. - Смойте излишки антител 2,0 мл HBSS-0,5% BSA и центрифугируйте при 300 × г в течение 3 мин.
- Удалите надосадочную жидкость, повторно суспендируйте гранулу в 80 мкл HBSS-0,5% BSA и добавьте 20 мкл микрогранул антибиотика. Инкубируют при 4 °C в течение 10 мин.
- На каждые 107 ячеек добавляют 0,5 мл HBSS-0,5% BSA и ждут, пока магнитный столбик будет готов.
10. Магнитная сепарация, положительный отбор
- Подготовьте подставку с сепаратором и колонкой МС. Промойте колонку MS 0,5 мл HBSS-0,5% BSA. Подождите, пока капание прекратится.
- Поместите пробирку объемом 15 мл под колонку, пропустите через колонку 0,5 мл клеточной суспензии и соберите элюат, содержащий неспецифические нейрональные клетки. Чтобы очистить колонку от остаточных неспецифических нейрональных клеток, промыть 3 х 0,5 мл HBSS-0,5% BSA.
- Снимите колонку с магнита, поместите ее в новую пробирку объемом 15 мл и добавьте 1,0 мл HBSS-0,5% BSA. Используйте поршень, чтобы промыть целевые клетки.
- Центрифугируют обе пробирки при 300 × г в течение 3 мин. Осторожно удалите надосадочную жидкость и повторно суспендируйте ее в 0,5 мл гальванической среды.
- Подсчитайте ячейки, как описано ранее в разделе 6.
- В 24-луночном планшете, предварительно подготовленном, как описано в разделе 2, и инкубируют при температуре 37 °C при 5% CO 2 2, 9% O2 и влажности 95% в течение 12 ч.
11. Поддержание клеточных культур
- Приготовьте 20 мл питательной среды с 19,2 мл питательной среды для нейронов, 400 мкл добавки B27 (из 50-кратного запаса), 200 мкл глутамина (из 200-мкМ материала) и 100 мкл пенициллина/стрептомицина (из 200-кратного запаса).
- Замените гальваническую среду из 24-луночной пластины, содержащей нейрональные или ненейрональные клетки.
- Промойте 2 x 1,0 мл HBSS.
- Добавьте 1,0 мл питательной среды.
- Обновляйте носитель каждые 2-3 дня, заменяя 0,5 мл старого носителя на 0,5 мл свежего носителя.
ПРИМЕЧАНИЕ: Клетки можно поддерживать в культуре и использовать до 21 дня in vitro (DIV21).
12. Иммунофлуоресцентное окрашивание нейронов
- За двенадцать часов до окрашивания приготовьте раствор, состоящий из метанола и ацетона в соотношении 50/50 и охладите его при -20 °C в течение ночи.
- Промойте нейроны в 24-луночном планшете 2 x 1,0 мл 1x фосфатно-солевого буфера (PBS) в течение 5 минут.
- Замените раствор PBS 1,0 мл раствора 50/50 и инкубируйте во льду в течение 20 минут.
- Стирайте с 1x PBS в течение 3 x 5 минут.
- Блокируйте нейроны 3% BSA в 1x PBS в течение 1 ч при комнатной температуре.
- Приготовьте первичный раствор антител в 3% BSA в 1x PBS, используя концентрацию антител, указанную в инструкциях производителя. Используемые антитела и их концентрации указаны в таблице материалов.
- Замените блокирующий раствор первичным раствором антител и инкубируйте при 4 °C в течение ночи.
- Промывайте клетки в течение 3 x 10 минут с помощью 1x PBS.
- Приготовьте раствор вторичных антител с 3% BSA в 1x PBS, используя концентрации антител в соответствии с инструкциями производителя. Используемые вторичные антитела перечислены в таблице материалов.
- Инкубируют клетки с раствором вторичных антител при комнатной температуре в течение 1 ч.
- Промывайте клетки в течение 3 x 10 минут с помощью 1x PBS.
- Оставьте нейроны в 1x PBS во время процедуры монтажа. Поместите небольшую каплю монтажной среды (с 4',6-диамидино-2-фенилиндолом или без него для ядерной идентификации) на предметное стекло микроскопа. Извлеките щипцами один стеклянный покровный листок, содержащий нейроны, и постучите стороной покровного стекла по бумажной салфетке, чтобы высушить излишки PBS. Переверните защитное стекло на монтажном носителе, убедившись, что нейроны обращены к предметным стеклам микроскопа; Аккуратно прижмите и удалите излишки монтажного носителя папиросной бумагой.
- Предметные стекла микроскопа готовы к анализу с помощью светлопольного или конфокального микроскопа.
Результаты
В данной работе описан протокол выделения нейронов-мишеней гипоталамуса (рис. 1). Область применения метода заключается в изучении специфических характеристик нейронов в контролируемом и изолированном контексте. Таким образом, эмбрионы мышей были извлечены из беременных маток в Е14-Е16. Мозговые оболочки были удалены, а гипоталамус изолирован от остального мозга. Ткань мягко диссоциировали с помощью двух смесей ферментов, свежеприготовленных с использованием указанного набора для диссоциации. Во-первых, ненейрональные клетки были отделены от нейрональных клеток — глии, микроглии, и нейроны были собраны в одну и ту же одноклеточную суспензию. С этой целью ненейрональные клетки были помечены с помощью коктейля антител, распознающих ненейрональные поверхностные эпитопы. После инкубации комплекс антитело-клетка конъюгировали с магнитными микрогранулами, а затем пропускали через магнитную колонку для захвата ненейрональных клеток.
На этом этапе были получены две клеточные суспензии, одна из которых содержала ненейрональные, а другая — нейронные. Обе подвески можно было сразу же покрыть. В качестве альтернативы, суспензию нейрональных клеток можно дополнительно манипулировать, чтобы отделить субпопуляцию нейронов (таргетная суспензия) от остальных, используя ту же стратегию. Исходя из интересующего эксперимента, нейронные клетки могут быть покрыты от 125 000 до 200 000 клеток/мм3. Менее плотные культуры могут быть использованы для анализа нейронов с одноклеточным разрешением: от развития аксонов, синаптического образования и передачи до электрофизиологии. Более плотные культуры можно использовать для биохимических анализов, включая экстракцию ДНК и РНК, вестерн-блоттинг, саузерн-блоттинг, северный блоттинг, ПЦР в реальном времени и секвенирование РНК.
В этом исследовании LepR был нацелен на изоляцию нейронов, участвующих в меланокортиновой системе, таких как нейроны ARCPOMC иARC AgRP. Клетки были покрыты с плотностью от 120 000 клеток/мм3 для нейронов LepR+ до 200 000 клеток/мм3 для генерических популяций нейронов. Через 48 ч нейроны LepR+ начали образовывать нейриты (рис. 2). В DIV4 аксональные расширения показали прогресс, в то время как начали появляться дендритные процессы. В DIV6 нейроны были достаточно развиты и, следовательно, были готовы к анализу. Иммунофлуоресцентные эксперименты на нейронах LepR+ показали 99% экспрессию LepR (зеленый, рис. 3A). Глиальных клеток или других ненейрональных клеток обнаружено не было, что подтверждает чистоту первичной культуры нейронов. Нейрональная природа клеток была подтверждена окрашиванием микротрубочками-ассоциированным белком 2 (MAP2) с идентификацией аксонов и дендритных выпячиваний (рис. 3Б). В DIV10 30% клеток LepR+ экспрессировали POMC (красный). Это ожидаемо, поскольку большинство клеток LepR+ экспрессируют либо POMC, либо AgRP. На рисунке 3C, D показана совместная локализация сигналов POMC и LepR. Заметьте, что колокализация была заметна в ядре и вокруг него, как и ожидалось.
Для контроля использовали общие культуры, содержащие гетерогенные популяции нейронов гипоталамуса. Иммунофлуоресценция продемонстрировала синаптическую связь и функциональность, что было оценено по совместному окрашиванию Синапсином-1 (зеленый) и PSD 95 (красный) (рис. 4A, B). Количество нейронов LepR+, присутствующих в общей культуре, составило ~5%, что согласуется с представлением о том, что большинство нейронов, экспрессирующих LepR, были отобраны в процессе магнитного разделения (репрезентативные клетки LepR+ проиллюстрированы на рисунке 4C, D). Все данные, полученные или проанализированные в ходе этого исследования, доступны на сайте https://doi.org/10.5061/dryad.cnp5hqc9c.
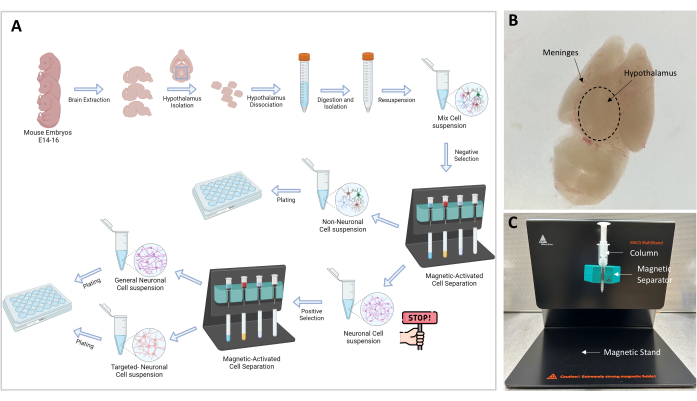
Рисунок 1: Блок-схема и схема эксперимента . (А) Графическое представление экспериментальной процедуры. Go-no-go: ≥106 клеток необходимы для того, чтобы приступить к изоляции клеток; Оптимальное количество ячеек – 107. (B) Репрезентативное изображение мозга эмбриона E16. Показаны гипоталамус и мозговые оболочки. (C) Настройка MACS, используемая для разделения и изоляции целевых клеток. Указаны магнитная стойка, магнитный сепаратор и колонна. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
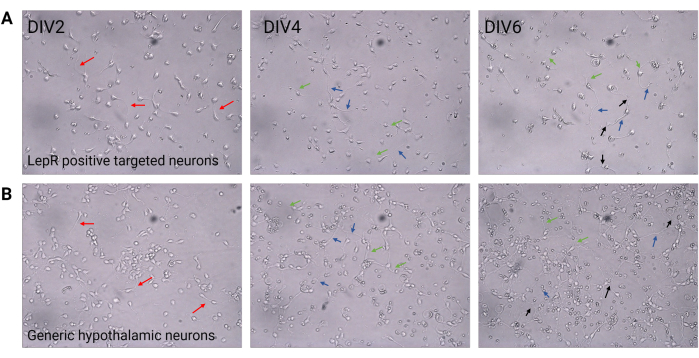
Рисунок 2: Культура нейронов между DIV2 и DIV6. (A) Клетки LepR+, полученные в результате положительного отбора, демонстрируют пониженную плотность клеток и связность, но нормальное развитие нейритов (красные стрелки), аксонов (синие стрелки) и дендритов (зеленые стрелки). Ячейки покрывали плотностью 120 000 клеток/мм3. Масштабная линейка = 100 мкм. (B) Общие нейроны гипоталамуса, покрытые плотностью 200 000 клеток/мм3, демонстрируют нормальные особенности развития и роста, а также связи (черные стрелки). Масштабная линейка = 100 мкм. Сокращения: DIV = дни in vitro; LepR = рецептор лептина. Все данные, сгенерированные или проанализированные для построения этого рисунка, доступны по адресу https://doi.org/10.5061/dryad.cnp5hqc9c. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
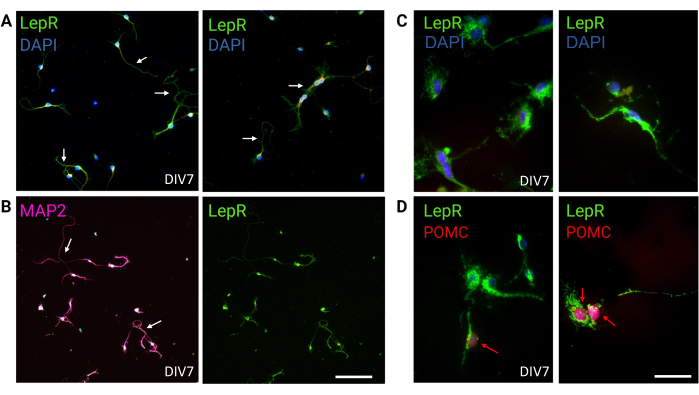
Рисунок 3: Нейроны in vivo рекапитулируются культивированными нейронами LepR+. (A) Репрезентативные изображения культуры нейронов, экспрессирующих LepR (зеленый; DAPI — синий). Девяносто девять процентов клеток экспрессировали LepR. Нейроны были покрыты плотностью 120 000 клеток/мм3 . В DIV7 нейроны демонстрировали удлиненные аксоны, дендритное созревание и нейронные связи (стрелки). Масштабная линейка = 40 мкм. (B) Иммунофлуоресценция с анти-MAP2 была использована для подтверждения нейрональной природы клеток. Демонстрируются нейронно-специфические морфологии, такие как аксоны, дендриты и выступы (стрелки). Масштабная линейка = 40 мкм. (C) Увеличение клеток LepR+. LepR в зеленом цвете и DAPI в синем. Масштабная линейка = 10 мкм. (D) Совместное окрашивание с LepR (зеленый) и POMC (красный). Примерно 30% нейронов LepR+ были коиммунореактивными к POMC, который был обнаружен на уровне ядра (красные стрелки). Масштабная линейка = 10 мкм. Сокращения: DAPI = 4',6-диамидино-2-фенилиндол; MAP2 = белок, ассоциированный с микротрубочками 2; POMC = проопиомеланокортин; LepR = рецептор лептина. Все данные, сгенерированные или проанализированные для построения этого рисунка, доступны по адресу https://doi.org/10.5061/dryad.cnp5hqc9c. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
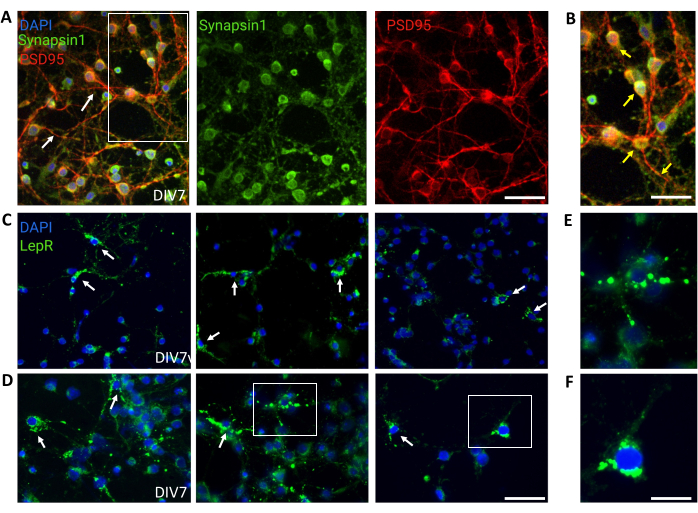
Рисунок 4: Клетки in vivo рекапитулируются культивируемыми генерическими нейронами гипоталамуса. (A) Репрезентативные изображения общей культуры нейронов гипоталамуса, окрашенные синапсином 1 (зеленый), PSD95 (красный) и DAPI (синий). Нейроны продемонстрировали хорошо развитую связность и синаптическую функциональность (стрелки). Масштабная линейка = 40 мкм. (B) Увеличение прямоугольника на рисунке (A), показывающее совместную локализацию Synapsin 1 (зеленый) и PSD95 (красный, стрелки). Масштабная линейка = 20 мкм. (С,Д) Репрезентативные изображения, показывающие клетки LepR+ в общей культуре. Ячейки LepR+ (зеленые) составили ~5% от общего числа. Репрезентативные ячейки LepR+ обозначены стрелками. Масштабная линейка = 40 мкм. (Д,Ж) Увеличение прямоугольников на рисунке (C,D) с изображением зеленых точечных лептиновых рецепторов, локализованных в соме. Масштабная линейка = 20 мкм. Все данные, сгенерированные или проанализированные для построения этого рисунка, доступны по адресу https://doi.org/10.5061/dryad.cnp5hqc9c. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Исследование биохимических и электрических свойств нейронов гипоталамуса является ключом к пониманию молекулярных основ метаболизма, терморегуляции, управления настроением, пищевого поведения и многого другого. Однако нейрональная гетерогенность гипоталамуса затрудняет эту работу, и необходимы методы выделения и изучения специфических субпопуляций гипоталамуса.
Методы in vivo используют CRE-рекомбиназу, оптогенетическую фотометрию, фотометрию волокон и кальциевую визуализацию. Эти подходы позволяют, главным образом, изучать электрические свойства нейронов гипоталамуса, и в настоящее время существует очень мало методов для исследования их неэлектрических свойств. Технология MACS, разработанная в этом исследовании, может обеспечить метод, поддающийся изоляции специфических субпопуляций нейронов гипоталамуса in vitro, тем самым обеспечивая целенаправленное лечение и анализ. Нейронные культуры проще в управлении по сравнению с кокультурами из разных популяций нейронов. Кроме того, чистые культуры позволяют избежать искажающих эффектов, связанных с присутствием глии и микроглии. Таким образом, нейроны из одной и той же области и типа гипоталамуса могут быть изучены в ответ на специфические метаболические и гормональные входы.
В этом протоколе мы отобрали нейроны гипоталамуса, экспрессирующие LepR. Изолированные клетки LepR+ культивировали для изучения их клеточных, морфологических и молекулярных характеристик, которые трудно изучить in vivo. Чистота культур составила 99%, что подтверждает точность метода. Кроме того, клетки LepR+ были здоровыми и жизнеспособными на уровне DIV7 до DIV21.
Эта методика, однако, имеет некоторые ограничения. Культуры чистых нейронов E18 или более старых сложно поддерживать. Поэтому окно экстракции ограничено Е14-Е16. Это означает, что клеточные изменения, происходящие после Е16, пропускаются. Например, экспрессия лептинового рецептора в нейронах ARC увеличивается в раннем постнатальном периоде22. Процедура изоляции должна быть выполнена как можно быстрее, чтобы уменьшить клеточный стресс и гибель и повысить урожайность. Процедура может занять до 5 часов; Следовательно, важно поддерживать стерильные условия и свести манипуляции к минимально необходимому. Положительный отбор может привести к низкому выходу из-за малого количества доступной ткани, что ограничивает количество экспериментов, которые можно провести с одним препаратом. Наблюдалась повышенная гибель нейронов, вероятно, из-за низкой плотности клеток и снижения нейронных связей и внутринейрональной поддержки.
Кроме того, антитело, нацеленное на интересующий антиген, должно связываться с поверхностью клетки, чтобы гарантировать правильное разделение; Обычно антитела, используемые для проточной цитометрии, подходят для метода MACS. Если антитело ранее не использовалось в методах разделения клеток, необходимы эксперименты по валидации и титрованию для определения идеального использования и концентрации. Для извлечения клеток-мишеней требуется маркер клеточной поверхности. Здесь мы использовали биотинилированное антитело, но в принципе можно использовать и антитела, конъюгированные с другими молекулами, такими как FITC (флуоресцеин изотиоцианат) и PE (очищенный антификоэритрин). Технология MACS также может быть применена к нейронам, экспрессирующим флуорофор, такой как GFP или другой белок Tag, потенциально повышая специфичность и выход. Если флуорофор не используется, альтернативой может быть подтверждение экспрессии интересующей молекулы с помощью иммунофлуоресценции перед проведением экспериментов с живыми клетками. Будущие исследования проверят обоснованность этих альтернатив.
Один из важных аспектов, который не был рассмотрен в этом исследовании, касается «верности» субнейрональных популяций. Установлено, что культивируемые нейроны LepR+ экспрессируют POMC, что является сигнатурой нативных нейроновARC POMC . Тем не менее, потребуются дополнительные тесты, чтобы сделать вывод о том, что культуры нейронов LepR+ повторяют свои нативные аналоги in vivo . В целом, протокол выделения нейронов MACS, представленный здесь, может обеспечить валидный и эффективный метод изучения механизмов гипоталамуса in vitro , которые в противном случае было бы трудно исследовать in vivo.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Графические фигуры были созданы с помощью BioRender.com. Эта работа была поддержана грантом NIA (R01AG060919) и грантом NSF (2030348).
Материалы
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
Ссылки
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707 (2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803 (2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450 (2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050 (2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944 (2021).
- Foo, L. C. . Purification of rat and mouse astrocytes by immunopanning. 2013 (5), 421-432 (2013).
- Emery, B., Dugas, J. C. . Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594 (2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12 (2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены