Method Article
Profilazione metabolica ad alto rendimento per perfezionamenti del modello di microalghe
In questo articolo
Riepilogo
Questo protocollo dimostra l'uso di una piattaforma tecnologica di microarray fenotipo (PM) per definire i requisiti metabolici di Chlamydomonas reinhardtii, una microalga verde, e perfezionare un modello di rete metabolica esistente.
Abstract
I modelli metabolici sono ricostruiti sulla base dell'annotazione del genoma disponibile di un organismo e forniscono strumenti predittivi per studiare i processi metabolici a livello di sistema. I modelli metabolici su scala genomica possono includere lacune e reazioni che non sono verificate sperimentalmente. I modelli ricostruiti di specie microalgali recentemente isolate comporteranno debolezze a causa di queste lacune, poiché di solito ci sono scarse prove biochimiche disponibili per il metabolismo di tali isolati. La tecnologia del fenotipo microarray (PM) è un metodo efficace e ad alto rendimento che determina funzionalmente le attività metaboliche cellulari in risposta a una vasta gamma di metaboliti in entrata. La combinazione dei saggi fenotipici ad alto rendimento con la modellazione metabolica può consentire di ricostruire o ottimizzare rapidamente i modelli di rete metabolica esistenti fornendo prove biochimiche per supportare ed espandere le prove genomiche. Questo lavoro mostrerà l'uso di saggi PM per lo studio delle microalghe utilizzando come esempio la specie modello di microalgale verde Chlamydomonas reinhardtii. L'evidenza sperimentale per oltre 254 reazioni ottenute da PM è stata utilizzata in questo studio per espandere e perfezionare un modello di rete metabolica di C. reinhardtii su scala genomica, iRC1080, di circa il 25%. Il protocollo creato qui può essere utilizzato come base per profilare funzionalmente il metabolismo di altre microalghe, compresi i mutanti noti delle microalghe e nuovi isolati.
Introduzione
L'ottimizzazione del metabolismo algale per una produzione migliorata e stabile di metaboliti mirati richiede lo sviluppo di complesse strategie di ingegneria metabolica attraverso analisi a livello di sistema delle reti metaboliche. I modelli di rete metabolica possono guidare i progetti razionali per il rapido sviluppo di strategie di ottimizzazione1,2,3,4. Sebbene siano state sequenziate circa 160 specie microalgali5, ci sono, a nostra conoscenza, solo 44 modelli metabolici algali disponibili4,6,7. A causa della difficoltà di ottenere dati fenotipici metabolici ad alto rendimento per la convalida sperimentale delle informazioni genomiche, la ricostruzione di modelli di rete di alta qualità è in ritardo rispetto al rapido sviluppo del sequenziamento del genoma algale.
C. reinhardtii è un interessante sistema modello per studi basati su algali. Questa specie può crescere fotoautotroficamente o eterotroficamente ed è stata ampiamente utilizzata come organismo modello nella ricerca di base e applicata. La sua sequenza genomica è stata pubblicata nel 20078,con modelli metabolici su scala genomica successivamente ricostruiti per le specie9,10,11. Il modello in scala genomica per C. reinhardtii (iRC1080) è stato ricostruito da Chang et al. 10 basato su prove genomiche e di letteratura (che comportano ~ 250 fonti). Ha 1.706 metaboliti con 2.190reazioni 10; tuttavia, la completezza del modello non ha potuto essere verificata al di là delle prove sperimentali pubblicate disponibili all'epoca.
La tecnologia dei microarray fenotipi (PM) è una piattaforma ad alto rendimento in grado di fornire informazioni di profilazione metabolica per microrganismi eterotrofi e cellule di coltura tissutale. In particolare, può essere utilizzato per affrontare il divario di conoscenza fenotipo-genotipo nelle microalghe, come riportato per la prima volta per Chlamydomonas reinhardtii12 e successivamente per una specie di Chloroidium13 e Chlorella14. Studiando le risposte cellulari a migliaia di metaboliti, molecole di segnalazione, osmoliti e molecole emozionali, i saggi PM possono fornire un profilo metabolico funzionale e offrire approfondimenti sulla funzione, il metabolismo e la sensibilità ambientale15,16,17. In particolare, i saggi PM rilevano l'utilizzo dei metaboliti delle cellule in micropiasche a 96 pozzette con diversi nutrienti, metaboliti o osmoliti contenuti in ciascun pozzetta. Inoltre, è anche possibile saggiare molecole bioattive, come antibiotici e ormoni. Come determinato dall'intensità della produzione di colore mediante la riduzione del NADH di un colorante redox a base di tetrazolio, l'utilizzo metabolico dei substrati viene valutato in termini di respirazione cellulare15,16,17. Gli esperimenti in micropiasche a 96 pozzette possono essere monitorati e determinati automaticamente nel tempo con la piattaforma PHENOTYPE Microarray Instrument (PMI). Venti micropiastre a 96 pozzetto sono progettate per rappresentare i metaboliti comuni per studiare i fenotipi cellulari per utilizzare fonti di carbonio, azoto, zolfo e fosforo, insieme a diversi effetti osmotici / ionici e pH. La tecnologia PM è stata utilizzata con successo per l'aggiornamento e l'aggiornamento di una serie di modelli metabolici su scala genomica esistenti per microrganismi15,16,17,18.
Il protocollo e i dati mostrati qui si basano su lavori precedentemente pubblicati da Chaiboonchoe et al. 12 Il lavoro presentato descrive in dettaglio l'uso del metodo di analisi del PM per caratterizzare i fenotipi metabolici delle microalghe e per espandere un modello metabolico algale esistente di C. reinhardtii, nonché per guidare la ricostruzione di nuovi modelli metabolici.
Protocollo
1. Esperimenti di microarray fenotipo
- Ottenere il ceppo CC-503 di C. reinhardtii dal Chlamydomonas Resource Center dell'Università del Minnesota, USA (https://www.chlamycollection.org).
- Far crescere le cellule in mezzi freschi di Tris-Acetato-Fosfato (TAP)19 con concentrazioni finali di 400 μg/mL di timentin, 50 μg/mL di ampicillina e 100 μg/mL di kanamicina (per inibire la crescita batterica) sotto i 400 micromol fotoni/m2s, a 25 °C, per due giorni fino alla fase intermedia.
- Girare la coltura a 2.000 x g per 10 minuti a 22 °C ed eliminare il surnatante senza disturbare il pellet.
- Preparare un mezzo TAP fresco contenente lo 0,1% di colorante viola tetrazolico "D".
NOTA: Modificare i supporti TAP in questo passaggio per escludere alcuni nutrienti a seconda della categoria di metaboliti testati in ciascuna piastra (ad esempio, escludere il cloruro di ammonio per le piastre di origine azotata). - Ripresa del pellet in un mezzo TAP fresco preparato (dal punto 1.2) ad una concentrazione finale di 1 x 106 celle/ml.
- Utilizzare piastre di analisi di array di composti chimici (fonti di carbonio, fonti di azoto, piastre di fonti di fosforo e zolfo e fonti di azoto peptidico).
- Inoculare un'aliquota di 100 μL di mezzi contenenti cellule in ciascun pozzetti delle piastre di dosaggio.
NOTA: Assicurarsi di duplicare i test. - Strisciare le cellule su piastre di estratto di lievito / peptone ed eseguire la colorazione del grammo, come in Smith et al. 20 prima e dopo il test per monitorare la contaminazione batterica.
- Inserire le piastre di analisi dell'array di composti chimici nel sistema di lettura delle micropiasche.
- Incubare tutte le piastre a 30 °C per un massimo di 7 giorni e programmare il sistema di lettura delle micropiasche per leggere il cambio di colore del colorante ogni 15 minuti.
NOTA: poiché la maggior parte dei lettori di micropiasche non fornisce una fonte di luce continua durante l'incubazione, le alghe dovrebbero essere in grado di effettuare la respirazione eterotrofica.
2. Analisi dei dati
- Esportare i dati cinetici grezzi dal lettore di micropiasche come file CSV, che verranno successivamente utilizzati come input per il pacchetto Omnilog Phenotype Microarray (OPM) in R. Aggiungere le informazioni biologiche come metadati (ad esempio, designazione del ceppo, mezzi di crescita, temperatura, ecc.).
- Utilizzo del software di conversione dati PM Kinetic; caricare i file di dati D5E e convertirli in file OKA utilizzando le seguenti righe di comando nel software di analisi cinetica PM:
Carica | Importa (individuare la cartella dei file OKA) | Popolare i filtri | Importa | Aggiungi tutte le piastre | Chiudere.
Esporta | scegliere i dati di lettura (Kinetic), scegliere il formato (CSV) (Tabulate Header)e scegliere le lastre (ogni piastra (singoli file)) | Esportare i dati | Salvare. - Per eseguire l'analisi dei dati Phenotype Microarray (PM), utilizzare il pacchetto software OPM21,22 che viene eseguito all'interno dell'ambiente software R. Il pacchetto, l'esercitazione e la documentazione di riferimento sono disponibili all'indirizzo: http://www.goeker.org/opm/. In RStudio, un'interfaccia utente grafica per R, installare il pacchetto opm e le relative dipendenze utilizzando i seguenti comandi:
fonte (http://www.goeker.org/opm/install_opm.R)
biblioteca (opm) - Passare alla directory che contiene i file CSV dei dati cinetici e importare i dati utilizzando la funzioneopm read_:
x <- read_opm(".", convert="grp", include=list ("csv:")) - Aggregare e discretizzare i dati cinetici utilizzando la stima curva-parametro.
Per (i in 1 :length(x)) {
x[[i]]
x[[i]] <- do_disc(x[[i]], cutoff = FALSO)
}
#Collection dei metadati
metadata <- collect_template(".")
metadata$Strain <- c("BLANK","CC- 503")
for (I in 1 :length(x)) {x[[i]] <- include_metadata(x[[i]], md = metadata, replace = TRUE)} - Utilizzare la funzione xy_plot per mappare le misurazioni della respirazione (o della crescita) (asse y) in funzione del tempo (asse x) per le piastre a 96 pozzetti analizzate.
print (xy_plot(x[[ 1]], include ="Strain", theor.max = FALSE)) - Visualizza i dati come una mappa di calore utilizzando la funzione level_plot per consentire una rapida panoramica comparativa dei dati cinetici.
level_plot(x, main = list(), colors = opm_opt("color.borders"), panel.headers = metadata$Strain, cex = NULL, strip.fmt = list(), striptext.fmt = list(), legend.sep =" ", space ="Lab", bias = 0.7 , num.colors = 200 L) - Estrarre importanti informazioni biologiche, i parametri della curva, dalle curve cinetiche grezze e includere la fase di ritardo (λ), il tasso di crescita (μ), la respirazione cellulare massima (A) e l'area sotto la curva (AUC)21. Per identificare i metaboliti positivi, utilizzare i valori A del controllo negativo, che rappresenta la reattività abiotica del colorante con il mezzo, oltre al bianco di ciascuna piastra microwell come valori di sottrazione di fondo. La funzione extract viene utilizzata per ottenere il parametro A.
opm_opt("curve.param")
param <- estratto (x, as.labels = list("Ceppo")))
- Utilizzo del software di conversione dati PM Kinetic; caricare i file di dati D5E e convertirli in file OKA utilizzando le seguenti righe di comando nel software di analisi cinetica PM:
3. Identificazione di reazioni e geni associati a nuovi metaboliti
- Cerca KEGG (Kyoto Encyclopedia of Genes and Genomes) (http://www.genome.jp/kegg/) e MetaCyc (http://metacyc.org/) per identificare i numeri della Commissione Enzimatica (ECs) per le reazioni che utilizzano metaboliti trovati da array di composti chimici23,2423,24.
- Utilizzare i numeri EC identificati come base di ricerca in più risorse di annotazione algale disponibili come Joint Genome Institute (JGI), Phytozome (http://www.phytozome.net) e pubblicazioni peer-reviewed23,25,26,27.
- Se una query non restituisce alcuna evidenza genetica per un dato numero CE, identificare le proteine associate rilevanti in altri organismi, a partire dalle specie più vicine al C. reinhardtii, quindi effettuare una ricerca basata sul profilo utilizzando il server NCBI PSI-BLAST con impostazioni predefinite e utilizzare proteine non ridondanti (nr) in C. reinhardtii (taxid:3055) per identificare i geni candidati associati allareazione 12.
- Cura manualmente gli hit PSI-BLAST con valori E di < 0,05 per la pertinenza al numero EC cercato interrogando tali hit BLAST tramite i server di previsione del dominio proteico EMBL-EBI Pfam (http://pfam.xfam.org/search) o InterPro (http://www.ebi.ac.uk/interpro/). Si noti che le ultime due scansioni sono passaggi critici per garantire l'identificazione della corretta attività enzimatica per la proteina.
4. Perfezionamento e valutazione del modello
- Utilizzare l'ultima versione di COBRA Toolbox v.3.028in MATLAB29,30piattaforma per eseguire i seguenti passaggi per il perfezionamento del modello. COBRA Toolbox può essere installato seguendo i passaggi in: https://opencobra.github.io/cobratoolbox/stable/installation.html . In alternativa, si noti che COBRA Toolbox è implementato anche in altri linguaggi di programmazione open source, come Python (COBRApy31) ed è disponibile all'indirizzo: https://opencobra.github.io/cobrapy/ .
- Dopo aver installato COBRA Toolbox v.3.0, apri MATLAB ed esegui il seguente comando per inizializzare la casella degli strumenti:
initCobraToolbox; - Aggiungere le reazioni identificate con i loro geni associati al modello metabolico, come iRC1080, utilizzando le funzioni COBRA Toolbox addReaction e changeGeneAssociation. Passare alla directory che contiene il modello iRC1080, scaricato da http://bigg.ucsd.edu/models/iRC1080 ed eseguire i seguenti comandi per caricare il modello, rinominarlo e aggiungere una nuova reazione e il gene associato.
Load('iRC 1080 .mat')
modelNew = iRC 1080;
modelNew = addReaction(modelNew, 'D-ALA 2' , ...
{'d-ala[c]' , 'atp[c]' , ...
'D-aladata[c]' , 'adp[c]' , 'pi[c]' , ...
'h[c]' },[- 2 - 1 1 1 1 1 ],false);
modelNEW = changeGeneAssociation(modelNew, ...
«D-ALA 2», «au.g 14655 _t 1»); - In alcuni casi, quando il metabolita non viene prodotto intracellulare ma viene prelevato dal mezzo, aggiungere al modello le reazioni di trasporto per i nuovi metaboliti. Queste reazioni di trasporto rappresentano la diffusione passiva di un metabolita dal mezzo extracellulare al citosol. Inoltre, aggiungere una corrispondente reazione di scambio artificiale utilizzando la funzione addExchangeRxn per immettere o emettere il metabolita nel mezzo extracellulare.
modelNew = addReaction(modelNew, 'CYCPt' , ...
{'cycp[e]','cycp[c]' },[- 1 1 ],true)'
modelNew = addExchangeRxn(modelNew, 'cycp[e]' ,- 1000 ,1000 ); - Testare il comportamento del nuovo modello risultante, ad esempio iBD1106, eseguendo l'analisi del bilancio di flusso (FBA) utilizzando la funzione optimizeCbModel in condizioni di luce e buio per la massimizzazione della biomassa come funzione obiettivo. Per la crescita della luce, impostare i limiti inferiore e superiore delle reazioni luminose della lito' solare PRISM a 646,07 (velocità massima). Per una crescita oscura, impostare i limiti di tutte le reazioni luminose PRISM a zero. Utilizzare la funzione Biomassa definita in precedenza10 per la crescita in condizioni di buio e luce. La soluzione FBA produrrà due vettori corrispondenti ai flussi di reazione (solution.v) e al costo ridotto (solution.w), nonché un vettore corrispondente ai prezzi ombra dei metaboliti (solution.y).
%Simula la crescita in condizioni di luce:
modelNew = changeRxnBounds(modelNew,{ ...
% «PRISM_solar_litho» , ...
'PRISM_solar_exo' , ...
'PRISM_incandescent_ 60 W' , ...
'PRISM_fluorescent_cool_ 215 W' , ...
'PRISM_metal_halide' , ...
'PRISM_high_pressure_sodium' , ...
'PRISM_growth_room' , ...
'PRISM_white_LED' , ...
«PRISM_red_LED_array_ 653 nm» , ...
«PRISM_red_LED_ 674 nm» , ...
'PRISM_fluorescent_warm_ 18 W' , ...
'PRISM_design_growth' , ...
}, 0, 'b' );
modelNew = changeObjective(modelNew, 'BIOMASS_Chlamy_mixo');
FBAsolutionNew = optimizeCbModel(modelNew, 'max'); - Ripetere il passaggio 4.1.4 per iRC1080 per confrontare le soluzioni FBA ottenute per iBD1106 con quelle ottenute per iRC1080.
- È disponibile una gamma di metodi COBRA che possono essere utilizzati per confrontare i modelli (ad esempio, analisi della variabilità del flusso, studi di delezione genica, analisi di robustezza, previsioni di divisione del flusso, FBA, campionamento, ecc.). Tutorial dettagliati sono disponibili su https://opencobra.github.io/cobratoolbox/stable/tutorials/index.html. Qui, viene fornito un esempio in cui il modello iRC1080 viene confrontato con la sua versione raffinata, iBD1106, ottenendo i prezzi ombra (sensibilità della funzione obiettivo della biomassa ai cambiamenti nella variabile di sistema) dei metaboliti contabilizzato in ciascun modello.
Ottenere i prezzi ombra per i metaboliti:
shadowPrices = table(modelNew.mets, ...
modelNew.metNames, FBAsolutionNew.y);
- Dopo aver installato COBRA Toolbox v.3.0, apri MATLAB ed esegui il seguente comando per inizializzare la casella degli strumenti:
Risultati
Screening del fenotipo Microarray dell'alga modello Chlamydomonas reinhardtii
I saggi PM testano la capacità dell'alga di utilizzare varie fonti di carbonio, azoto, zolfo e fosforo in un mezzo minimo. In questa descrizione dei metodi, abbiamo dimostrato come i saggi PM sono stati utilizzati per identificare il metabolismo del carbonio e dell'azoto. La cinetica di utilizzo del carbonio e dell'azoto è stata misurata con un lettore di micropiasche. I dati sono stati analizzati utilizzando il software PMI. La cinetica riassuntiva delle piastre di dosaggio PM selezionate (PM01 e PM03) è mostrata nella Figura 1. I "grafici xy" mostrano le misurazioni della respirazione nel tempo tracciate per i saggi delle piastre a 96 pozzi, dove l'asse y e l'asse x rappresentano rispettivamente i valori delle misurazioni grezze e del tempo. I dati sono stati convertiti in un modello di mappa termica per analizzare comparativamente l'assemblaggio dei dati cinetici.
La pipeline di raffinazione della rete metabolica su scala genomica utilizzando i dati PM (Figura 2) illustra l'integrazione dei saggi PM ad alto rendimento con le prove sperimentali fornite dalle ricerche genomiche in grado di espandere un modello di rete metabolica.
Per determinare la riproducibilità dei dati PM ottenuti dalle piastre PM01 - 04 e PM10, è stata analizzata una regressione lineare per tracciare i dati di due esperimenti di replica indipendenti l'uno contro l'altro (Figura 3). La figura 3 mostra che la maggior parte dei dati erano quasi simili in quanto cadono sulla linea del 45 °, con solo pochi valori anomali presenti, e il loro coefficiente di determinazione R2 era 0,9. La consistenza e la riproducibilità degli esperimenti per l'alga sono verificate da questo appezzamento.
Identificazione di nuovi metaboliti
Il test PM ha identificato 662 metaboliti in sette piastre; PM01-PM04 e PM06-PM08, mentre la gascromatografia Time-Of-Flight (GC-TOF) aveva identificato 77 metaboliti32 (Figura 4). Confrontando questi due insiemi con i 1068 metaboliti contabili nell'iRC1080, solo sei metaboliti si sovrapponevano tra i tre insiemi e 149 si sovrapponevano tra l'iRC1080 e il PM. Questo risultato dimostra che la piattaforma di profilazione metabolica può essere una fonte significativa di nuove informazioni metaboliche.
L'acido acetico era l'unica fonte di carbonio rilevata nella piastra PM01 come carbonio di supporto dopo aver sottratto il segnale di fondo. Questo risultato è coerente con la letteratura33 e mostra la specificità dei saggi DI PM. I test PM hanno rivelato nuove fonti di zolfo, fosforo e azoto che C. reinhardtii può utilizzare per la crescita. I metaboliti dello zolfo erano solfato, tiosolfato, tetrationato e DL-lipoamide. Le fonti di fosforo erano tiofosfato, ditiofosfato, acido D-3-fosfo-glicerico e cisteamina-S-fosfato. I metaboliti fonte di azoto erano L-ammino e D-amminoacidi, compresi gli amminoacidi meno comuni; L-omoserina, L-piroglutammica, metilammina, etilammina, etanolamina e D,L-α-ammino-butirrico, e 108 di-peptidi e cinque tri-peptidi (Tabella 1). Tutti i 128 metaboliti appena identificati sono stati cercati in KEGG e MetaCyc per le loro reazioni associate, i numeri EC e le vie.
I nuovi 128 metaboliti sono stati associati a 49 numeri EC unici. Di questi, 15 EC sono stati collegati alle loro prove genomiche utilizzando cinque fonti tra cui; Phytozome Version 10.0.234 JGI Version 435, AUGUSTUS 5.0 e 5.210 annotazioni da Manichaikul et al. 36 e KEGG13. I metaboliti senza evidenza genomica sono stati inseriti nel sito web Universal Protein Resource (UniProt, http://www.uniprot.org/)37,38 dove le loro sequenze correlate sono state trovate in altri organismi. Le sequenze omologhe in C. reinhardtii sono state identificate eseguendo Position-Specific Iterated BLAST (PSI-BLAST, https://blast.ncbi.nlm.nih.gov/Blast.cgi) dal sito web NCBI considerando solo sequenze che hanno prodotto allineamenti significativi (valore E <0,005).
Perfezionamento del modello
Le reazioni associate ai nuovi 128 metaboliti, insieme ai loro geni codificati, sono state aggiunte al modello iRC1080, espandendo la rete. Il modello risultante iBD1106, rappresenta 2.444 reazioni, 1.959 metaboliti e 1.106 geni (Tabella 2). Le nuove 254 reazioni aggiunte sono state 20 reazioni di ossidazione degli aminoacidi, 108 reazioni di idrolisi di-peptidica, cinque reazioni di idrolisi tripeptidica e 120 reazioni di trasporto, codificate da quattro geni (Cre02.g096350.t1.3, au.g14655_t1, e_gwW.1.243.1, Cre12.g486350.t1.3).
Un totale di 113 nuove reazioni aggiunte spiegano l'idrolisi di di-peptidi e tri-peptidi. L'idrolisi di di-peptidi e tri-peptidi è associata a due geni, uno per i di-peptidi (Cre02.g078650.t1.3) e uno per i tri-peptidi (Cre16.g675350.t1.3).
Per quanto riguarda le fonti di fosforo, è stata aggiunta una reazione per l'idrolisi della cisteamina-S-fosfato in cisteamina e fosfato associata al gene JLM_162926.
Lo strumento WoLF PSORT39 (http://www.genscript.com/psort/wolf_psort.html) e i risultati riportati da Ghamsari et al. 35 sono stati applicati per ottenere la specifica dei compartimenti cellulari in cui avvengono le nuove reazioni. Analizzando le sequenze proteiche associate alle nuove reazioni, WoLF PSORT ha previsto il citosol come compartimento cellulare per le reazioni.
Un modello metabolico generato può contenere lacune quando le informazioni biochimiche sono incomplete. In questi casi, viene utilizzato gapFind, un comando COBRA. Elenca le lacune alla radice e consente l'identificazione di nuove lacune nell'introduzione del nuovo modello. I metaboliti che non possono essere prodotti in un modello metabolico sono indicati come lacuneradicolare 40,41. L'analisi del root gap ha indicato che entrambi i modelli iRC1080 e iBD1106 contengono gli stessi 91 gap. Ciò dimostra che l'aggiunta dei nuovi metaboliti e delle loro reazioni associate non ha introdotto ulteriori lacune nelle radici. Va notato che il metodo di fenotipizzazione utilizzato in questo protocollo non chiude le lacune delle radici, perché i metaboliti del gap radicale originale mancano di meccanismi di trasporto o produzione, che non sono stati affrontati nei saggi di fenotipizzazione. L'analisi del bilancio di flusso è stata effettuata per testare il comportamento metabolico di iBD1106 in condizioni di luce e buio; (senza acetato) e (con acetato), rispettivamente. L'algoritmo massimizza le reazioni precursori della biomassa per una funzione oggettiva (crescita della biomassa). Per valutare il coinvolgimento di ciascun metabolita nella funzione obiettivo impostata, sono stati calcolati i "prezzi ombra" per tutti i metaboliti. Il cambiamento nella funzione oggettiva riguardante le variazioni di flusso del metabolita definisce il prezzo ombra di un metabolita30,42. L'indicazione se un metabolita è in "eccesso" o sta "limitando" la funzione oggettiva può essere determinata dall'analisi dei prezzi ombra, ad esempio la produzione di biomassa. Valori di prezzo ombra negativi o positivi rivelano metaboliti che, al momento dell'aggiunta, diminuiranno o aumenteranno la funzione obiettivo. I valori zero dei prezzi ombra rivelano metaboliti che non influenzeranno la funzione obiettivo. Il confronto dei prezzi ombra tra iBD1106 e iRC1080 nella Figura 5 mostra che, per la maggior parte dei metaboliti, non si osserva un cambiamento significativo; tuttavia, le differenze si riscontrano rispettivamente in 105 e 70 casi in condizioni di crescita chiare e scure. La Tabella 4 include esempi di tali metaboliti.
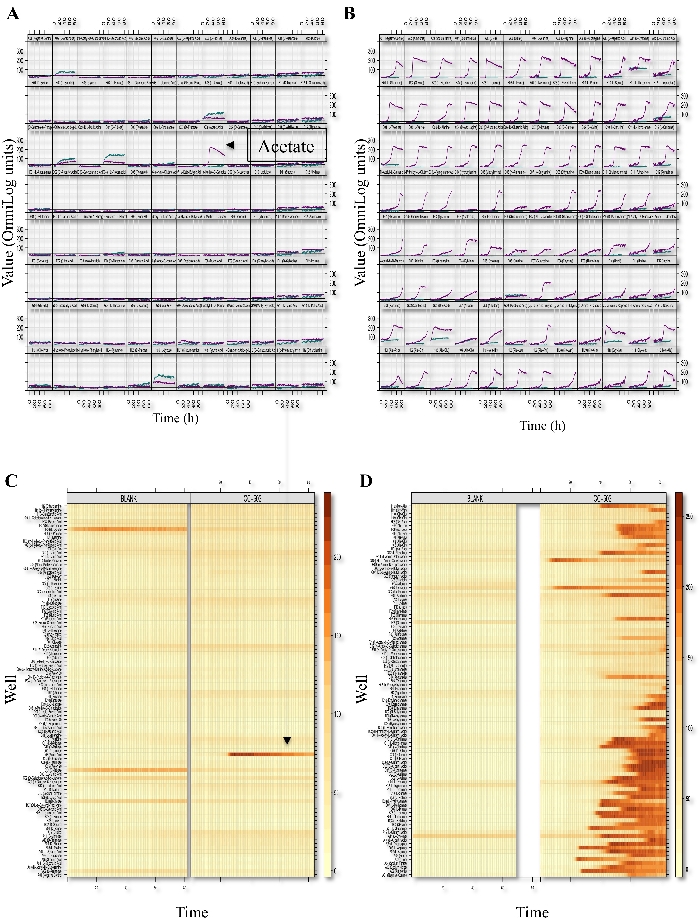
Figura 1: Profilo fenotipico dei microarray di C. reinhardtii. Respirazione XY-plots e grafici di livello del PM01 (Fonti di carbonio; A, C) e PM03 (fonti di azoto; B, D) vengono mostrate le piastre di dosaggio. La figura è una matrice 8x12 in cui ogni cellula rappresenta una piastra di pozzo e, quindi, un dato metabolita o ambiente di crescita. All'interno di ogni rappresentazione di celle o pozzi, le curve rappresentano la conversione del colorante per riduzione (asse y) in funzione del tempo (asse x). Le curve di respirazione PM dal CC-503 e dai pozzeli vuoti sono mostrate in ogni cella e sono indicate dal colore (il colore verde acqua rappresenta i pozzeli vuoti e il colore viola rappresenta CC-503). Il grafico a livello rappresenta ogni curva di respirazione come una sottile linea orizzontale che cambia colore (o rimane invariata) nel tempo. I cambiamenti di colore della mappa di calore vanno dal giallo chiaro (poca o nessuna respirazione ha avuto luogo) all'arancione scuro o al marrone (ha avuto luogo una respirazione significativa). Vengono mostrati i metaboliti utilizzati da C. reinhardtii (CC-503) e le piastre bianche. Questa cifra è tratta da un lavoro precedentemente pubblicato da Chaiboonchoe et al. 12Fare clic qui per visualizzare una versione più grande di questa figura.
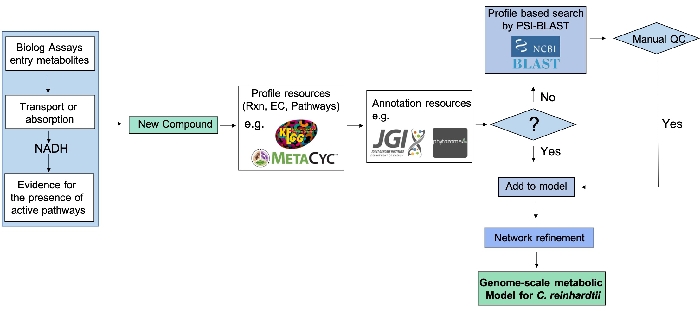
Figura 2: Pipeline di raffinamento della rete metabolica su scala genomica utilizzando i dati PM. Dopo che un nuovo composto risulta positivo in un test PM, il suo numero di Commissione enzimatica (EC), la reazione e la via vengono identificati dai database disponibili, ad esempio KEGG e MetaCyc. Le prove genomiche vengono quindi estratte da risorse genomiche e di annotazione quando disponibili e costituiscono un collegamento tra genotipo e fenotipo. Quando l'evidenza genomica diretta non è disponibile, la sequenza proteica viene identificata dai numeri EC e l'evidenza genetica viene identificata tramite PSI-Blast. La rete metabolica ricostruita viene quindi perfezionata sulla base di composti appena identificati, ma solo dopo una fase di controllo della qualità che comporta l'interrogazione dei domini proteici utilizzando database pertinenti. Questa figura è stata modificata dal lavoro precedentemente pubblicato da Chaiboonchoe et al. 12Fare clic qui per visualizzare una versione più grande di questa figura.
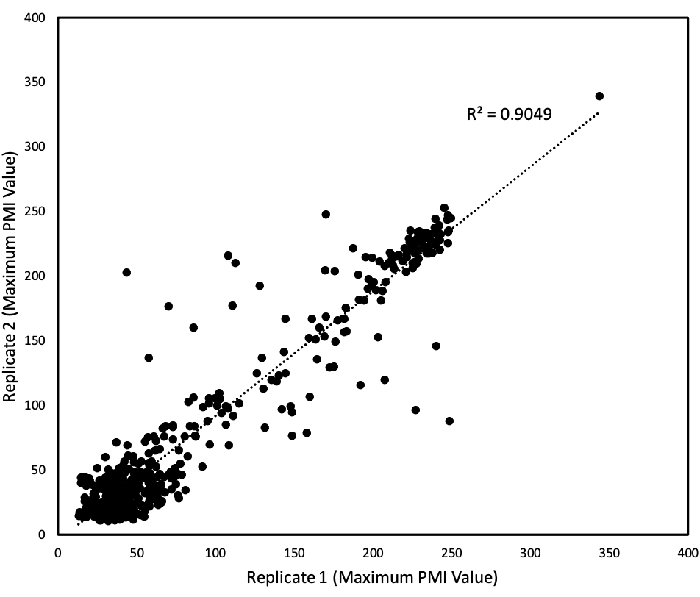
Figura 3: Riproducibilità dei test PM. I valori PMI sono stati raccolti in un periodo di 168 ore e i valori massimi PMI sono stati tracciati per due studi replicati. Ogni asse rappresenta i valori PMI massimi per ogni studio (l'asse x è uno studio di replica e l'asse y un altro). I valori riprodotti sono equidistanti da ciascun asse. Ogni punto rappresenta un singolo valore massimo. La regressione lineare è stata eseguita da un software per fogli di calcolo e viene mostrato il coefficiente di determinazione risultante (R2). Questa figura è stata modificata dal lavoro precedentemente pubblicato da Chaiboonchoe et al. 12Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Diagramma di Venn dei metaboliti. Il diagramma di Venn enumera i metaboliti identificati dalle piastre PM, dal modello metabolico iRC1080 e dagli esperimenti gascromatografia Time of Flight (GC-TOF). Ogni cerchio indica il numero totale di metaboliti esistenti in ciascun rispettivo metodo di studio. Allo stesso tempo, le regioni sovrapposte rappresentano il numero di metaboliti condivisi tra questi metodi. Il modello metabolico iRC1080 contiene un totale di 1.068 metaboliti unici. Il GC-TOF ha identificato un totale di 77 metaboliti32, mentre ci sono un totale di 662 metaboliti identificati utilizzando le piastre PM. Questa cifra è tratta da lavori precedentemente pubblicati da Chaiboonchoe et al. 12Fare clic qui per visualizzare una versione più grande di questa figura.
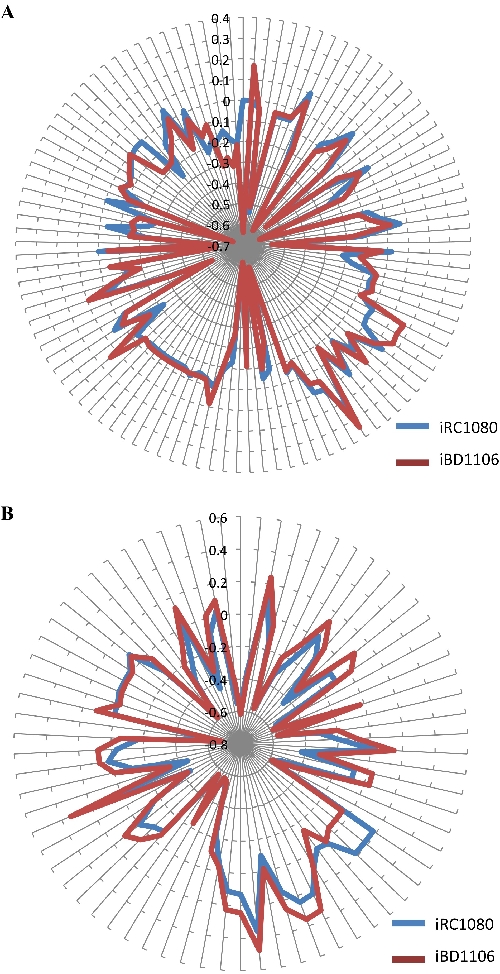
Figura 5: Prezzi ombra dei metaboliti in iRC1080 e iBD1106 in condizioni diverse per la massimizzazione della biomassa. Ogni cerchio sui "grafici radar" corrisponde a un valore di prezzo ombra, mentre ogni linea che si estende dal centro di un grafico indica un metabolita. (A) Prezzi ombra e comportamenti metabolici di iRC1080 e iBD1106 in una leggera condizione di crescita; (B), diversi comportamenti metabolici di iRC1080 e iBD1106 in una condizione di crescita oscura. Questa cifra è tratta da lavori precedentemente pubblicati da Chaiboonchoe et al. 12Fare clic qui per visualizzare una versione più grande di questa figura.
| Biolog Chimico | CE* | Annotazione genica | PSI-BLAST |
| Cisteamina-S-fosfato | 3.1.3.1 | JLM_1629261,2,3,4 | |
| Tetrationato | 1.8.2.2 | valore E insignificante | |
| 1.8.5.2 | valore E insignificante | ||
| D-Alanina | 1.4.1.1 | XP_001700222.1 | |
| 1.5.1.22 | QC manuale non riuscito | ||
| 2.1.2.7 | valore E insignificante | ||
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| 2.3.2.10 | valore E insignificante | ||
| 2.3.2.14 | valore E insignificante | ||
| 2.3.2.16 | valore E insignificante | ||
| 2.3.2.17 | valore E insignificante | ||
| 2.3.2.18 | valore E insignificante | ||
| 2.6.1.21 | QC manuale non riuscito | ||
| 3.4.13.22 | XP_001698572.1, XP_001693532.1, XP_001701890.1, XP_001700930.1 | ||
| 3.4.16.4 | Chlre2_kg.scaffold_ 140000391,2,3 | ||
| 3.4.17.8 | QC manuale non riuscito | ||
| 3.4.17.13 | valore E insignificante | ||
| 3.4.17.14 | valore E insignificante | ||
| 4.5.1.2 | valore E insignificante | ||
| 6.1.1.13 | QC manuale non riuscito | ||
| 6.1.2.1 | QC manuale non riuscito | ||
| 6.3.2.4 | au.g14655_t11,2,3 | ||
| 6.3.2.10 | QC manuale non riuscito | ||
| 6.3.2.16 | valore E insignificante | ||
| 6.3.2.35 | valore E insignificante | ||
| D-Asparagina | 1.4.5.1 | valore E insignificante | |
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| 3.1.1.96 | valore E insignificante | ||
| 2.3.1.36 | valore E insignificante | ||
| 1.4.99.1 | XP_001692123.1 | ||
| 3.5.1.77 | e_gwW.1.243.11,2 | ||
| 3.5.1.81 | valore E insignificante | ||
| 5.1.1.10 | QC manuale non riuscito | ||
| Acido D-aspartico | 6.3.1.12 | valore E insignificante | |
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| Acido D-Glutammico | 1.4.3.7 | valore E insignificante | |
| 1.4.3.3 | valore E insignificante | ||
| D-lisina | 5.4.3.4 | valore E insignificante | |
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| 6.3.2.37 | QC manuale non riuscito | ||
| D-Serina | 2.7.11.8 | valore E insignificante | |
| 2.7.11.17 | Cre12.g486350.t1.31,2,3,4 | ||
| 3.4.21.78 | QC manuale non riuscito | ||
| 3.4.21.104 | QC manuale non riuscito | ||
| 4.3.1.18 | g6244.t14 | QC manuale non riuscito | |
| 6.3.2.35 | valore E insignificante | ||
| 6.3.3.5 | valore E insignificante | ||
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| D-Valina | 1.21.3.1 | QC manuale non riuscito | |
| 6.3.2.26 | QC manuale non riuscito | ||
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| Acido L-Piroglutammico | |||
| Tiofosfato | |||
| Ditiofosfato | |||
| Etilammina | 6.3.1.6 | ||
| Acido D,L-a-Amino-Butirrico | 2.1.1.49 | valore E insignificante | |
| 1.4.3.3 | Cre02.g096350.t1.35 | ||
| Di-peptide | 3.4.13.18 | Cre02.g078650.t1.31 | |
| Tri-peptide | 3.4.11.4 | Cre16.g675350.t1.31 |
Tabella 1: Elenco dei metaboliti positivi identificati per l'utilizzo del substrato (C, P, S, N) non presenti nel modello metabolico iRC1080. *La reazione non è stata inclusa se non è stato identificato alcun gene. 1 Phytozome versione 10.0.2 (http://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_Creinhardtii). numero arabo JGI versione 4 35. 3 Augustus versione 510. 4 KEGG (http://www.genome.jp/kegg/kegg1.html). 5 JGI versione 3.136. Questa tabella è tratta da lavori precedentemente pubblicati da Chaiboonchoe et al. 12 anni
| Modello | Reazioni | Metaboliti | Geni |
| iRC1080 · | 2,191 | 1,706 | 1,086 |
| iBD1106 · | 2,445 | 1,959 | 1,106 |
Tabella 2: Contenuto di iRC1080 e iBD1106. Questa tabella è tratta da lavori precedentemente pubblicati da Chaiboonchoe et al. 12 anni
| Categoria o Classe di reazioni | Numero di reazioni |
| Aminoacidi | 20 |
| Dipeptidi | 108 |
| Tripeptidi | 5 |
| Reazione di trasporto | 120 |
Tabella 3: Sintesi delle nuove reazioni in iBD1106. Questa tabella è tratta da lavori precedentemente pubblicati da Chaiboonchoe et al. 12 anni
| Condizione di crescita | Metabolita | Nome | iRC1080 · | iBD1106 · | |
| 4r5au | 4-(1-D-Ribitylamino)-5-aminouracile | 0 | 0.168 | ||
| 5aprbu | 5-Ammino-6-(5'-fosforibilammino)uracile | -0.009 | 0.158 | ||
| Leggero | pa1819Z18111Z | 1-(9Z)-octadecenoil,2-(11Z)-ottadecenoil-sn-glicerolo3-fosfato | -0.009 | -0.65 | |
| Oscuro | 4abut | 4-aminobutanoato | 0.18 | -0.05 | |
Tabella 4: Esempio di prezzi ombra significativi per iRC1080 e iBD1106. Questa tabella è tratta da lavori precedentemente pubblicati da Chaiboonchoe et al. 12 anni
Discussione
La fenotipizzazione metabolica della microalga verde, C. reinhardtii,è stata descritta qui utilizzando piastre di analisi PM ad alta produttività e un PMI non modificato. I saggi sono stati utilizzati per un totale di 190 fonti di carbonio (PM01 e PM02), 95 fonti di azoto (PM03), 59 fonti di fosforo e 35 fonti di zolfo (PM04), insieme a fonti di azoto peptidico (PM06-08). La respirazione positiva è stata osservata per 148 nutrienti (un test positivo per l'utilizzo della fonte C, quattro saggi positivi per ciascun utilizzo della sorgente S e della sorgente P e 139 saggi positivi per l'utilizzo della sorgente N). I substrati o i nutrienti (carbonio, azoto, fosforo o zolfo) componenti del fluido non devono essere aggiunti al mezzo definito quando applicati alle micropiasche PM pertinenti che testano ciascuna di tali fonti.
Il metodo qui mostrato è efficace per caratterizzare i fenotipi delle microalghe metaboliche che possono essere utilizzati per estendere i modelli di rete metabolica esistenti o dirigere la ricostruzione di nuovi modelli. Inoltre, poiché i requisiti nutrizionali della maggior parte delle microalghe non sono noti, questa piattaforma può essere utilizzata per definirli rapidamente. Nelson et al. 43 avevano applicato con successo questi metodi per identificare nuovi composti che supportano la crescita delle microalghe Chloroidium sp. UTEX 3007 e hanno utilizzato le informazioni ottenute per definire i metaboliti di ingresso delle specie, che, a differenza di Chlamydomonas, includono 40 diverse fonti di carbonio.
Uno dei principali limiti del PM per la profilazione delle microalghe è che il PMI non ha illuminazione nella camera di incubazione e le microalghe devono essere in grado di svolgere il metabolismo eterotrofico. L'assenza di luce potrebbe influenzare l'interpretazione dei modelli che incorporano la luce per calcolare i flussi metabolici. Le coppie di geni con funzioni di coordinamento si sono co-evolute per costituire hub di rete metabolica e la distinzione tra hub di rete fotosintetici e non fotosintetici può essere fatta44. In generale, gli hub di rete fotosintetici (cioè i nodi altamente connessi nel modello) sarebbero lasciati fuori dai modelli eterotrofici. Per scopi pratici, la modellazione dell'eterotrofismo nelle specie mixotrofiche dovrebbe omettere le reazioni note per essere guidate dalla luce e tenere conto delle differenze di bilancio energetico tra le condizioni. Pertanto, la modellazione del metabolismo dipendente dalla luce e indipendente dalla luce è una pratica standard nella modellazione metabolica di Chlamydomonas6,45.
Alcune microalghe verdi, come Le Trebouxiofite, sono note per assimilare una varietà di molecole di carbonio per la crescita, e si pensa che questo sia sorto dalla loro lunga storia evolutiva come membri dei licheni46. Mentre le clorofite come Chlamydomonas possono utilizzare l'acetato per la crescita, la microalga marina marrone Tisochrysis lutea, nota per il suo potenziale di produrre commercialmente acidi grassi polinsaturi a catena molto lunga (VLC-PUFA), non può usare acetato ma può usare il glicerolo per lacrescita 47. Concentrazione di biomassa superiore a 100 g l−1 peso della cella secca è stata raggiunta con clorella con aggiunta ottimizzata di fonti di carbonio organico in modalità batch alimentata48. Inoltre, l'aggiunta di zucchero alla clorellavulgaris può elevare il suo sequestro di CO2, fornendo così un beneficio additivo durante la crescita fotosintetica49. La maggior parte delle microalghe eterotrofiche può anche crescere mixotroficamente, ma la Chlorophyte Chromochloris zofingiensis ha dimostrato di interrompere la fotosintesi con l'aggiunta di zucchero50.
Le diatomee, appartenenti alla divisione Bacillariophyta, sono un gruppo importante di fitoplancton. Sebbene la maggior parte delle diatomee possa crescere solo fotoautotroficamente, alcune di esse possono essere coltivate mixotroficamente o eterotroficamente51. Ad esempio, il glicerolo è stato trovato per sostenere la crescita alla luce in assenza di CO2 in alcune diatomee, tra cui la specie modello Phaeodactylum tricornutum52. Inoltre, alcune diatomee bentoniche come Nitzschia linearis possono crescere sui carboidrati al buio53. È probabile che estenda i saggi di PM alle diatomee e ad altri gruppi algali integrando adeguate fonti di carbonio organico per consentire alle cellule di crescere eterotroficamente, e una strategia di mixotrofia può anche essere potenzialmente utilizzata per le microalghe autotrofiche obbligate che forniscono un apporto di luce minimamente richiesto.
Per valutare la riproducibilità dei dati, si consiglia vivamente di eseguire test duplicati per tutte le piastre. Un saggio può essere considerato positivo solo se, dopo sottrazione dal controllo negativo e dai rispettivi pozzi vuoti, l'assorbanza (valore PMI) è positiva. Questa descrizione, in presenza del composto testato, è un riflesso della reazione abiotica del colorante con il mezzo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Un importante supporto per questo lavoro è stato fornito dal NYUAD Center for Genomics and Systems Biology (CGSB), finanziato da Tamkeen nell'ambito della sovvenzione del New York University Abu Dhabi Research Institute (73 71210 CGSB9) e nyu Abu Dhabi Faculty Research Funds (AD060). W.F. è stato inoltre supportato dal Hundred Talents Program della Zhejiang University. Ringraziamo Ashish Jaiswal per l'aiuto nella registrazione del video. Ringraziamo Hong Cai per aver generato i dati del fenotipo metabolico.
Materiali
| Name | Company | Catalog Number | Comments |
| Ampicillin | VWR | 97062-796 | |
| Biolog assay plates [ PM01-08] | Biolog, Hayward, CA, USA | ||
| Biolog Omnilog Instrument | Biolog, Hayward, CA, USA | ||
| Chlamydomonas reinhardtii strain CC-503 | Chlamydomonas Resource Center at the University of Minnesota, USA. | Regents of the University of Minnesota | |
| Kanamycin | VWR | 0408-EU-10G | |
| Tetrazolium Violet Dye “D” | Biolog, Hayward, CA, USA | ||
| Timentin | GlaxoSmithKline Australia Pty Ltd | 42010012-2 |
Riferimenti
- Oberhardt, M. A., Palsson, B. Ø, Papin, J. A. J. M. Applications of genome-scale metabolic reconstructions. Molecular Systems Biology. 5 (1), 320(2009).
- Schmidt, B. J., Lin-Schmidt, X., Chamberlin, A., Salehi-Ashtiani, K., Papin, J. A. Metabolic systems analysis to advance algal biotechnology. Biotechnology Journal. 5 (7), 660-670 (2010).
- Koskimaki, J. E., Blazier, A. S., Clarens, A. F., Papin, J. A. J. I. B. Computational models of algae metabolism for industrial applications. Industrial Biotechnology. 9 (4), 185-195 (2013).
- Koussa, J., Chaiboonchoe, A., Salehi-Ashtiani, K. J. B. Computational approaches for microalgal biofuel optimization: a review. BioMed Research. 2014, 649453(2014).
- Nelson, D. R., et al. Large-scale genome sequencing reveals the driving forces of viruses in microalgal evolution. Cell Host & Microbe. 29 (2), 250-266 (2021).
- Shene, C., Asenjo, J. A., Chisti, Y. Metabolic modelling and simulation of the light and dark metabolism of Chlamydomonas reinhardtii. The Plant Journal. 96 (5), 1076-1088 (2018).
- Tibocha-Bonilla, J. D., Zuñiga, C., Godoy-Silva, R. D., Zengler, K. Advances in metabolic modeling of oleaginous microalgae. Biotechnology for Biofuels. 11 (1), 241(2018).
- Merchant, S. S., et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions. Science. 318 (5848), 245-250 (2007).
- May, P., Christian, J. -O., Kempa, S., Walther, D. J. B. G. ChlamyCyc: an integrative systems biology database and web-portal for Chlamydomonas reinhardtii. BMC Genomics. 10 (1), 209(2009).
- Chang, R. L., et al. Metabolic network reconstruction of Chlamydomonas offers insight into light-driven algal metabolism. Molecular Systems Biology. 7 (1), (2011).
- de Oliveira Dal'Molin, C. G., Quek, L. -E., Palfreyman, R. W., Nielsen, L. K. AlgaGEM - a genome-scale metabolic reconstruction of algae based on the Chlamydomonas reinhardtii genome. BMC Genomics. 12 (5), (2011).
- Chaiboonchoe, A., et al. Microalgal metabolic network model refinement through high-throughput functional metabolic profiling. Frontiers in Bioengineering and Biotechnology. 2, 68(2014).
- Kanehisa, M., et al. Data, information, knowledge and principle: back to metabolism in KEGG. Nucleic Acids Research. 42 (1), 199-205 (2014).
- Zuñiga, C., et al. Genome-scale metabolic model for the green alga Chlorella vulgaris UTEX 395 accurately predicts phenotypes under autotrophic, heterotrophic, and mixotrophic growth conditions. Plant Physiology. 172 (1), 589-602 (2016).
- Bochner, B. R. New technologies to assess genotype-phenotype relationships. Nature Reviews Genetics. 4 (4), 309-314 (2003).
- Bochner, B. R. Global phenotypic characterization of bacteria. FEMS Microbiology Reviews. 33 (1), 191-205 (2009).
- Bochner, B. R., Gadzinski, P., Panomitros, E. Phenotype microarrays for high-throughput phenotypic testing and assay of gene function. Genome Research. 11 (7), 1246-1255 (2001).
- Bartell, J. A., Yen, P., Varga, J. J., Goldberg, J. B., Papin, J. A. Comparative metabolic systems analysis of pathogenic Burkholderia. Journal of Bacteriology. 196 (2), 210-226 (2014).
- Gorman, D. S., Levine, R. J. P. otN. A. oS. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. PNAS. 54 (6), 1665-1669 (1965).
- Smith, A. C., Hussey, M. A. Gram stain protocols. American Society for Microbiology. , 1-9 (2005).
- Vaas, L. A. I., et al. opm: an R package for analysing OmniLog phenotype microarray data. Bioinformatics. 29 (14), 1823-1824 (2013).
- Vaas, L. A. I., Sikorski, J., Michael, V., Göker, M., Klenk, H. -P. Visualization and Curve-Parameter Estimation Strategies for Efficient Exploration of Phenotype Microarray Kinetics. PLoS ONE. 7 (4), 34846(2012).
- Caspi, R., et al. The MetaCyc database of metabolic pathways and enzymes-a 2019 update. Nucleic Acids Research. 48 (1), 445-453 (2020).
- Kanehisa, M., Furumichi, M., Sato, Y., Ishiguro-Watanabe, M., Tanabe, M. KEGG: integrating viruses and cellular organisms. Nucleic Acids Research. , (2020).
- Lopez, D., Casero, D., Cokus, S. J., Merchant, S. S., Pellegrini, M. Algal Functional Annotation Tool: a web-based analysis suite to functionally interpret large gene lists using integrated annotation and expression data. BMC Bioinformatics. 12 (1), 282(2011).
- Caspi, R., et al. The MetaCyc database of metabolic pathways and enzymes. Nucleic Acids Research. 46, 633-639 (2018).
- Sahoo, S., et al. dEMBF v2. 0: An Updated Database of Enzymes for Microalgal Biofuel Feedstock. Plant and Cell Physiology. 61 (5), 1019-1024 (2020).
- Heirendt, L., et al. Creation and analysis of biochemical constraint-based models using the COBRA Toolbox v. 3.0. Nature Protocols. 14 (3), 639-702 (2019).
- Heirendt, L., et al. Creation and analysis of biochemical constraint-based models using the COBRA Toolbox v. 3.0. Nature Protocols. 1, (2019).
- Orth, J. D., Thiele, I., Palsson, B. Ø What is flux balance analysis. Nature Biotechnology. 28 (3), 245(2010).
- Ebrahim, A., Lerman, J. A., Palsson, B. O., Hyduke, D. R. COBRApy: constraints-based reconstruction and analysis for python. BMC Systems Biology. 7 (1), 74(2013).
- Bölling, C., Fiehn, O. Metabolite profiling of Chlamydomonas reinhardtii under nutrient deprivation. Plant Physiology. 139 (4), 1995-2005 (2005).
- Harris, E. H. The Chlamydomonas sourcebook: introduction to Chlamydomonas and its laboratory use. 1, Academic Press. (2009).
- Goodstein, D. M., et al. Phytozome: a comparative platform for green plant genomics. Nucleic Acids Research. 40, 1178-1186 (2012).
- Ghamsari, L., et al. Genome-wide functional annotation and structural verification of metabolic ORFeome of Chlamydomonas reinhardtii. BMC Genomics. 12 (1), 4(2011).
- Manichaikul, A., et al. Metabolic network analysis integrated with transcript verification for sequenced genomes. Nature Methods. 6 (8), 589-592 (2009).
- Apweiler, R., et al. UniProt: the Universal Protein knowledgebase. Nucleic Acids Research. 32, 115-119 (2004).
- Consortium, T. U. Activities at the universal protein resource (UniProt). Nucleic Acids Research. 42 (11), 7486-7486 (2014).
- Horton, P., et al. PSORT: protein localization predictor. Nucleic Acids Research. 35, suppl_2 585-587 (2007).
- Becker, S. A., et al. Quantitative prediction of cellular metabolism with constraint-based models: the COBRA Toolbox. Nature Protocols. 2 (3), 727-738 (2007).
- Schellenberger, J., et al. Quantitative prediction of cellular metabolism with constraint-based models: the COBRA Toolbox v2.0. Nature Protocols. 6 (9), 1290(2011).
- Varma, A., Boesch, B. W., Palsson, B. O. Stoichiometric interpretation of Escherichia coli glucose catabolism under various oxygenation rates. Applied and Environmental Microbiology. 59 (8), 2465-2473 (1993).
- Nelson, D. R., et al. The genome and phenome of the green alga Chloroidium sp. UTEX 3007 reveal adaptive traits for desert acclimatization. eLife. , 25783(2017).
- Chaiboonchoe, A., et al. Systems level analysis of the Chlamydomonas reinhardtii metabolic network reveals variability in evolutionary co-conservation. Molecular BioSystems. 12 (8), 2394-2407 (2016).
- Chang, R. L., et al. Metabolic network reconstruction of Chlamydomonas offers insight into light-driven algal metabolism. Molecular Systems Biology. 7 (1), 518(2011).
- Rajendran, A., Hu, B. Mycoalgae biofilm: development of a novel platform technology using algae and fungal cultures. Biotechnology for Biofuels. 9 (1), 112(2016).
- Hu, H., et al. Effect of cultivation mode on the production of docosahexaenoic acid by Tisochrysis lutea. AMB Express. 8 (1), 50(2018).
- Bumbak, F., Cook, S., Zachleder, V., Hauser, S., Kovar, K. Best practices in heterotrophic high-cell-density microalgal processes: achievements, potential and possible limitations. Applied Microbiology and Biotechnology. 91 (1), 31(2011).
- Fu, W., et al. Sugar-stimulated CO2 sequestration by the green microalga Chlorella vulgaris. Science of the Total Environment. 654, 275-283 (2019).
- Roth, M. S., et al. Regulation of oxygenic photosynthesis during trophic transitions in the green alga Chromochloris zofingiensis. The Plant Cell. , (2019).
- Villanova, V., et al. Investigating mixotrophic metabolism in the model diatom Phaeodactylum tricornutum. Philosophical Transactions of the Royal Society B: Biological Sciences. 372 (1728), 20160404(2017).
- Cerón-García, M., et al. Mixotrophic growth of Phaeodactylum tricornutum on fructose and glycerol in fed-batch and semi-continuous modes. Bioresource Technology. 147, 569-576 (2013).
- Tuchman, N. C., Schollett, M. A., Rier, S. T., Geddes, P. Advances in Algal Biology: A Commemoration of the Work of Rex Lowe. , Springer. 167-177 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon