Method Article
Combinazione di stampa 3D ed elettrofilatura per la produzione di volantini biomimetici per valvole cardiache
In questo articolo
Riepilogo
Il metodo presentato offre un modo innovativo per l'ingegneria di strutture in fibre biomimetiche in scaffold tridimensionali (3D) (ad esempio, volantini di valvole cardiache). Le geometrie conduttive stampate in 3D sono state utilizzate per determinare forma e dimensioni. L'orientamento e le caratteristiche delle fibre sono stati regolabili individualmente per ogni strato. Più campioni potrebbero essere prodotti in un'unica configurazione.
Abstract
L'elettrofilatura è diventata una tecnica ampiamente utilizzata nell'ingegneria dei tessuti cardiovascolari in quanto offre la possibilità di creare scaffold (micro)fibrosi con proprietà regolabili. Lo scopo di questo studio era quello di creare scaffold multistrato che imitassero le caratteristiche architettoniche della fibra dei lembi delle valvole cardiache umane utilizzando collettori conduttivi stampati in 3D.
I modelli di cuspidi delle valvole aortiche sono stati creati utilizzando un software commerciale di progettazione assistita da computer (CAD). L'acido polilattico conduttivo è stato utilizzato per fabbricare modelli di volantini stampati in 3D. Questi negativi a cuspide sono stati integrati in un mandrino elettrofilante rotante appositamente progettato. Tre strati di poliuretano sono stati filati sul collettore, imitando l'orientamento delle fibre delle valvole cardiache umane. La superficie e la struttura delle fibre sono state valutate con un microscopio elettronico a scansione (SEM). L'applicazione del colorante fluorescente ha inoltre permesso la visualizzazione microscopica della struttura in fibra multistrato. Sono state eseguite prove di trazione per valutare le proprietà biomeccaniche degli scaffold.
La stampa 3D di parti essenziali per il carro di elettrofilatura è stata possibile in breve tempo per un budget ridotto. Le cuspidi della valvola aortica create seguendo questo protocollo erano a tre strati, con un diametro della fibra di 4,1 ± 1,6 μm. La microscopia a fluorescenza ha rivelato singoli strati con fibre allineate in modo diverso, con ogni strato che raggiunge con precisione la configurazione di fibra desiderata. Le impalcature prodotte hanno mostrato un'elevata resistenza alla trazione, specialmente lungo la direzione di allineamento. I file di stampa per i diversi raccoglitori sono disponibili come File supplementare 1, File supplementare 2, File supplementare 3, File supplementare 4 e File supplementare 5.
Con un protocollo di configurazione e flusso di lavoro altamente specializzato, è possibile imitare tessuti con strutture di fibre complesse su più strati. La rotazione diretta su collettori stampati in 3D crea una notevole flessibilità nella produzione di forme 3D a bassi costi di produzione.
Introduzione
Le malattie cardiovascolari sono la principale causa di morte nei paesi occidentali 1. Sebbene vengano condotte ricerche approfondite in questo campo, si stima che il carico di malattie degenerative delle valvole cardiache aumenterà ulteriormente nei prossimi anni2. La sostituzione chirurgica o interventistica della valvola cardiaca è possibile come opzione terapeutica. A questo punto sono disponibili valvole cardiache meccaniche e bioprotesiche, entrambe con inconvenienti individuali. Le valvole meccaniche sono trombogeniche e richiedono anticoagulazione per tutta la vita. Sebbene le valvole biologiche non richiedano anticoagulazione, mostrano una mancanza di rimodellamento, un alto tasso di calcificazione e una concomitante degradazione3.
Le valvole cardiache ingegnerizzate nei tessuti potrebbero essere in grado di affrontare questi inconvenienti introducendo un'impalcatura microfibra nel corpo che consente il rimodellamento in vivo. Sono disponibili vari metodi, ad esempio elettrofilatura (ESP), decellularizzazione, microstampaggio, spray, dip-coat e bioprinting 3D. Questi metodi possono essere scelti per creare proprietà specifiche, essere più economici e veloci, o semplicemente a causa della mancanza di alternative. Metodi e materiali possono anche essere combinati per creare strutture più complesse4. Ad esempio, l'ESP è stata una tecnica standard per la creazione di scaffold nell'ingegneria tissutale, consentendo la combinazione di materiali diversi e la regolazione dei diametri delle fibre, degli orientamenti delle fibre e delle porosità4. Inoltre, una varietà di tecniche di post-elaborazione consentono un rimodellamento ottimizzato dei tessuti, una migliore emocompatibilità e una biodegradazione regolabile degli scaffold elettrofilati 5,6,7.
L'ESP di base utilizza collettori statici o rotanti, che hanno un'influenza diretta sul grado di allineamento delle fibre e sui diametri delle fibre ottenuti8. A causa delle restrizioni di produzione, i classici collettori rotanti ESP sono costituiti da tamburi rotanti, dischi, fili o barre metalliche. L'introduzione della stampa 3D consente la creazione di geometrie di collettori più personalizzate che non sono limitate dalle tecniche di produzione tradizionali. Questa individualizzazione è particolarmente utile per la creazione di costrutti 3D come i volantini delle valvole cardiache.
L'architettura naturale a tre strati (fibrosa, spongiosa, ventricolare) dei lembi valvolari cardiaci umani è la risposta dei tessuti alle forze meccaniche e allo stress di taglio a cui sono esposti durante il ciclo cardiaco 9,10. Le fibre della lamina fibrosa sono orientate circonferenzialmente, mentre le fibre della lamina spongiosa sono allineate casualmente e quelle della lamina ventricolare radialmente. Viene quindi proposto un triplo strato con i corrispondenti orientamenti delle fibre per imitare le proprietà di queste valvole in un'impalcatura ingegnerizzata nei tessuti.
Il protocollo del flusso di lavoro descrive un metodo innovativo per produrre volantini di valvole cardiache 3D a tre strati utilizzando la stampa 3D e l'elettrofilatura. Inoltre, viene presentata una fase di controllo qualità per garantire un orientamento accurato delle fibre in ogni strato.
Protocollo
1. Lavori preparatori
- Stampa 3D
NOTA: i seguenti passaggi richiedono il download dei file "Standard Triangle Language" (STL) forniti come File supplementare 1, File supplementare 2, File supplementare 3, File supplementare 4 e File supplementare 5 con questo manoscritto. Le parti del collettore sono fornite come file STL. La flangia di collegamento viene fornita come file STEP ("STandard for the Exchange of Product model data" per consentire la regolazione del raccoglitore per adattarlo alle singole configurazioni. Inoltre, un disegno tecnico per le barre metalliche centrali è previsto per la produzione convenzionale come file supplementare 6.- Aprire il software di affettatura (vedere la Tabella dei materiali) e configurare la testina di stampa attiva per l'acido polilattico non conduttivo (PLA) e un ugello da 0,4 mm.
NOTA: il software di affettatura, il diametro del filamento e dell'ugello possono variare a seconda della stampante 3D disponibile. - Caricare i file STL Specimen_mount_A (file supplementare 3) e Speciment_mount_B (file supplementare 4) nel software di slicing.
- Ruotare i modelli, in modo che le superfici triangolari siano posizionate sulla piastra di costruzione.
- Contrassegnare tutte le parti, fare clic con il pulsante destro del mouse e selezionare Moltiplica modelli selezionati. Immettere 1 nel prompt Numero di copie e fare clic su OK. Posizionare un totale di quattro modelli sulla piastra di costruzione.
- Impostare lo spessore della fetta su 0,1 mm, lo spessore della parete su 1 mm, la densità di riempimento su 40% e deselezionare la casella Genera supporto .
- Fare clic sul pulsante Slice | Salva in Rimovibile per salvare il file di stampa su un'unità USB.
- Caricare il PLA non conduttivo nella stampante e avviare il file di stampa.
- Al termine della stampa, rimuovere i modelli dalla piastra di costruzione e verificare la presenza di deformazioni negli angoli inferiori.
- Nel software di slicing, mantenere i parametri del materiale e sostituire i modelli con Collector_Flange (file supplementare 1 e file supplementare 5) e Leaflet_Template (file supplementare 2).
- Ruotare la flangia, in modo che la superficie circolare piana sia contro la piastra di costruzione. Inoltre, ruotare il modello di volantino, in modo che la superficie quadrata sia posizionata direttamente sulla piastra di costruzione.
- Contrassegnate la flangia e moltiplicate il modello come al punto 1.1.4. Digitare 1 per ricevere 1 copia e 1 originale del modello di flangia sulla piastra di costruzione.
- Contrassegnare il modello di foglio illustrativo e moltiplicare per 8 per ricevere un totale di nove modelli di foglio illustrativo, seguendo le procedure descritte al punto 1.1.4.
- Impostare lo spessore della fetta su 0,1 mm, lo spessore della parete su 1 mm, la densità di riempimento su 80% e deselezionare la casella Genera supporto.
- Fare clic sul pulsante Sezione | Salva in Rimovibile per salvare il nuovo file di stampa su un'unità USB.
- Caricare il PLA conduttivo nella stampante e avviare il processo di stampa.
- Dopo il completamento della stampa, rimuovere i modelli dalla piastra di costruzione. Rimuovere accuratamente le singole fibre di filamento nella parte inferiore del foglietto negativo con un tagliafilo se queste sono presenti nei modelli di foglio illustrativo (poiché non sono state utilizzate strutture di supporto).
- Aprire il software di affettatura (vedere la Tabella dei materiali) e configurare la testina di stampa attiva per l'acido polilattico non conduttivo (PLA) e un ugello da 0,4 mm.
- Soluzione di filatura
ATTENZIONE: Il tetraidrofurano (THF) e la dimetilformammide (DMF) sono solventi nocivi che non devono essere inalati o contattare la pelle. Si consiglia vivamente di indossare guanti resistenti ai solventi e occhiali protettivi durante la manipolazione. Quando li maneggi, lavora sotto un cofano di scarico in quanto sono estremamente volatili.- Posizionare una bilancia sotto il cofano di scarico e posizionare una bottiglia di vetro con tappo a vite da 200 ml su di essa. Tarare la bilancia.
- Versare 50 mL di DMF e 50 mL di THF nella bottiglia di vetro. Nota il peso dei solventi.
- Posizionare una barra magnetica all'interno della bottiglia, posizionare la bottiglia su un agitatore magnetico e accenderla.
- Moltiplicare il peso indicato per 0,15 (= 15% p/v) e trasferire lentamente la quantità corrispondente di poliuretano (PU) nella bottiglia di vetro contenente la miscela di solvente (DIN 1310).
- Chiudere il flacone e mescolare per almeno 12 ore a temperatura ambiente per ottenere una soluzione omogenea.
2. Configurazione dell'elettrofilatura
- Assemblea
NOTA: Poiché le impalcature a volantino create con il collettore presentato sono relativamente piccole, si consiglia l'uso opzionale di un mandrino a tamburo di grande diametro (D: 110 mm). Ciò consente la creazione di scaffold più grandi e multistrato, che saranno utili per la valutazione microscopica, biocompatibile e biomeccanica.- Assembla il collettore utilizzando le parti stampate in 3D e sei viti M3 x 15.
- Utilizzare tre viti per fissare le aste metalliche a una delle flange.
- Far scorrere un Specimen_mount_B tra le barre di metallo. Assicuratevi che gli spazi per le maschere puntino nella direzione opposta della flangia.
- Riempire i tre slot del Specimen_mount_B con modelli di volantino della valvola cardiaca.
- Posiziona Specimen_mount_A in cima e riempi gli spazi con i modelli.
- Fai scorrere un altro Specimen_mount_A e riempi gli spazi con i modelli.
- Fissa i modelli mettendo in cima la seconda Specimen_mount_B .
- Metti la seconda flangia sopra e usa le viti M3 per fissarla.
NOTA: Assicurarsi che i modelli di volantino siano tutti orientati nella stessa direzione (bordo dritto del foglietto parallelo alle aste metalliche). - Posizionare il collettore a foglio assemblato nella configurazione di elettrofilatura e fissare saldamente le flange all'asse del motore (ad esempio, viti M6 e dadi alari) (Figura 1).
ATTENZIONE: poiché il PLA conduttivo è più fragile del normale PLA, utilizzare una chiave dinamometrica a 1,4 Nm quando si fissano bulloni che esercitano pressione sul materiale per evitare lo scatto. - Posizionare un portaago a 30 cm dal collettore.
- Fissare un ago calibro 14 (G) con una punta piatta nel supporto dell'ago e fissarlo all'altezza dell'asse del collettore.
- Collegare un tubo flessibile e resistente ai solventi (ad esempio, politetrafluoroetilene (PTFE)) alla porta Luer-lock dell'ago.
NOTA: DMF e THF dissolvono molte materie plastiche. È necessario utilizzare materiali resistenti ai solventi quando si lavora con questi solventi, ad esempio strumenti in metallo e vetro. Quando sono necessari strumenti in plastica (ad esempio siringhe o tubi), assicurarsi di utilizzare materiali resistenti ai solventi. - Guidare il tubo alla pompa della siringa per un successivo collegamento della siringa riempita di polimero.
- Collegamento dell'alimentatore (PSU)
ATTENZIONE: durante la configurazione, assicurarsi che l'alimentatore sia scollegato dalla fonte di alimentazione principale.- Collegare due cavi schermati ad alta tensione all'anodo e al catodo dell'alimentatore.
- Utilizzando una clip a coccodrillo, collegare il cavo collegato al catodo (- polo) all'ago da 14 G. Controllare la connessione tra clip e ago. Quindi, guidare il cavo ad alta tensione, in modo che funzioni al di fuori dell'area di rotazione per evitare interferenze.
- Collegare il collettore all'anodo (+ polo) utilizzando una clip a coccodrillo e il secondo cavo ad alta tensione. Utilizzare un collettore rotante o un contatto scorrevole utilizzando un cavo spogliato per creare un contatto sulla flangia del collettore.
- Preparazione della siringa
NOTA: questo passaggio deve essere eseguito immediatamente prima dell'inizio del processo di rotazione.- Riempire una siringa Luer-lock da 20 ml con la soluzione rotante preparata al punto 1.2.
- Collegare la siringa al tubo resistente ai solventi e spingere manualmente la soluzione nel sistema di tubazioni fino a quando una goccia è visibile sulla punta dell'ago.
- Introdurre la siringa nella pompa della siringa. Dopo aver acceso la pompa, inserire i seguenti parametri: diametro: 19,129 mm; volume: 5 ml; velocità 3 mL/h.
3. Processo di elettrofilatura
- Esecuzione del test del motore
NOTA: la produzione del raccoglitore mediante la stampa 3D potrebbe portare a un movimento decentrato del raccoglitore. Pertanto, una corsa di prova con velocità di rotazione inferiori ma senza alta tensione è altamente raccomandata.- Aprire il software di controllo del motore facendo doppio clic sull'icona sul computer.
- Connettersi al controllo motore facendo clic sul pulsante Connetti .
- Dopo la connessione, selezionare la modalità operativa Velocità profilo e fare clic sulla scheda Operazione situata nell'angolo in alto a sinistra dello schermo.
- Selezionate la scheda Velocità profilo sotto il pulsante Arresto rapido incorniciato da una linea rossa. Digitare le seguenti impostazioni: Velocità target: 200 rpm; accelerazione profilo: 100; decelerazione del profilo: 200; sosta rapida: 5000.
NOTA: il senso di rotazione deve essere verso l'alto sul lato dell'ago, che può essere regolato modificando il segno nel campo "velocità target" da "+" a "-". - Avviare l'esecuzione del test e verificare la presenza di eventuali squilibri nel raccoglitore. Se il raccoglitore funziona senza problemi, procedere con il protocollo. In caso contrario, arrestare il motore e regolare nuovamente il collettore come descritto al punto 2.1.9.
- Arrestare il motore facendo clic sul pulsante attivato e modificare la velocità target a 2.000 giri/min.
- Processo di produzione
NOTA: L'elettrofilatura è un processo con un'elevata dipendenza dai parametri ambientali. Risultati ottimali di elettrofilatura sono stati ottenuti tra il 15-20% di umidità relativa a una temperatura compresa tra 21 e 24 °C.- Primo strato
NOTA: Durante la fase di configurazione, una goccia secca di PU potrebbe essersi formata sulla punta dell'ago. Rimuovere la goccia utilizzando uno strumento lungo e non conduttivo, se necessario.- Nel software di controllo del motore, fare clic sul pulsante Abilita operazione per accendere il motore.
- Accendere l'alimentatore ad alta tensione e regolare la tensione sia per l'anodo che per il catodo: meno polo (ago): 18 kV; più palo (collettore): 1,5 kV.
- Avviare la pompa della siringa a una portata di 3 mL/h.
- Imposta un timer su 20 min.
- Osservare la punta dell'ago per la formazione di un cono sartoriale. A seconda della forma del cono sulla punta dell'ago, regolare la tensione al catodo con incrementi di ±100 V fino a quando non viene stabilito un cono sartoriale stabile.
NOTA: se la goccia è sospesa, la tensione è troppo bassa. Tuttavia, il flusso instabile può indicare che la tensione è impostata troppo alta. - Attendere 20 minuti affinché i modelli di cuspide siano adeguatamente coperti con fibre.
- Spegnere la pompa della siringa.
- Spegnere l'alimentatore ruotando l'interruttore di alimentazione.
- Arrestare il motore facendo clic sul pulsante Attiva attiva attiva nel software di controllo motore.
ATTENZIONE: per evitare lesioni da parti mobili nel sistema, attendere che il collettore si sia completamente fermato per aprire la camera di prova.
- Secondo strato
- Nel software di controllo del motore, modificare il campo di input Velocità target a 10 giri / min.
- Ripetere i passaggi 3.2.1.1-3.2.1.9.
- Terzo strato
NOTA: Prima che gli scaffold siano completamente asciutti, sono estremamente sensibili alle sollecitazioni meccaniche. Prestare molta attenzione quando si eseguono i passaggi 3.2.3.2-3.2.3.6. Evitare di toccare le impalcature / fibre durante questi passaggi, poiché l'impalcatura potrebbe essere resa inutile.- Aprire con attenzione le viti che collegano le flange del collettore all'asse del motore e rimuovere il collettore a foglio (Figura 2B) dal dispositivo di elettrofilatura.
- Usando un bisturi, tagliare le fibre elettrofilate lungo il contorno esterno di ciascun modello di volantino (Figura 2C).
- Rimuovere la flangia su un lato del collettore.
- Estrarre gli inserti stampati in 3D e separare i modelli di volantini dai supporti triangolari non conduttivi.
- Ruotare tutti i modelli di volantini di 90° e rimontare il collettore.
- Inserire il collettore nella configurazione di elettrofilatura e fissarlo saldamente.
- Ancora una volta, verificare eventuali squilibri prima di continuare il processo di rotazione.
- Nel software di controllo motore, modificare il campo di ingresso Velocità target a 2.000 giri/min.
- Ripetere i passaggi 3.2.1.1-3.2.1.9.
NOTA: Dopo aver terminato il processo di elettrofilatura, si consiglia vivamente di lavare il tubo e l'ago con DMF puro per evitare l'intasamento del tubo.
- Scaffold colorati fluorescenti (opzionale)
NOTA: I coloranti fluorescenti vengono utilizzati per rendere visibili le fibre sotto un microscopio a fluorescenza convenzionale. Questo è necessario solo durante l'implementazione del metodo e per il controllo di qualità dopo l'applicazione di nuove impostazioni. L'uso di coloranti fluorescenti non è raccomandato quando si producono scaffold utilizzando impostazioni stabilite.- Dividere la soluzione di filatura preparata al punto 1.2 in tre porzioni uguali in bottiglie separate.
- Utilizzando una scala, misurare 1 mg di colorante fluorescente per ogni grammo (0,1 wt%) di soluzione polimerica. Ripetere per tutti e tre i coloranti fluorescenti (cioè Fluoresceina, Texas Red, 4',6-diamidino-2-fenilindolo [DAPI]).
- Aggiungere il colorante alla soluzione rotante, chiudere il coperchio della bottiglia e mescolare per 2-3 ore o fino all'omogeneizzazione.
NOTA: Per evitare che i coloranti fluorescenti si sbiadiscano, proteggere il più possibile la soluzione rotante dalla luce, ad esempio posizionando un coperchio opaco sopra l'agitatore magnetico. Il processo per gli scaffold tinti fluorescenti è molto simile al processo standard descritto nei passaggi 3.2.1-3.2.3. - Al punto 3.2.1, sostituire la siringa standard con una siringa riempita con la soluzione rotante contenente il primo colorante fluorescente.
- Nel passaggio 3.2.2, sostituire il tubo e l'ago attualmente utilizzati con quelli nuovi o puliti. Successivamente, posizionare una siringa con la soluzione rotante contenente il secondo colorante fluorescente nella pompa della siringa.
- Nel passaggio 3.2.3, sostituire nuovamente il tubo e l'ago con quelli nuovi o puliti e sostituire la siringa con uno riempito con una soluzione rotante contenente il terzo colorante fluorescente.
NOTA: per evitare ritardi durante il processo di produzione, è utile utilizzare tre set di tubi e aghi. In alternativa, il tubo e l'ago possono essere lavati accuratamente con THF e DMF tra la produzione di strati fino a quando non rimane nel sistema alcuna soluzione rotante contenente colorante fluorescente.
- Primo strato
4. Post-elaborazione e acquisizione del campione
- Scaffold di post-elaborazione
- Rimuovere il collettore dal dispositivo di elettrofilatura.
- Usando un bisturi, tagliare ogni modello libero alla base come descritto al punto 3.2.3.2.
- Aprire il raccoglitore, come descritto sopra, e posizionare i modelli, in base verso il basso, su un vassoio.
- Posizionare il vassoio in un armadio di asciugatura per una notte a 40 °C.
- Dopo che i campioni sono stati completamente asciugati, utilizzare un bisturi per tagliare con cura lungo i bordi del modello di volantino per rimuovere le fibre in eccesso.
- Successivamente, sbucciare con cura l'impalcatura del volantino del modello e posizionarlo su un vassoio per un'ulteriore elaborazione.
Risultati
Questo protocollo è finalizzato allo sviluppo di un'impalcatura a triplo strato destinata all'uso nell'ingegneria tissutale cardiovascolare delle valvole cardiache. Imita la configurazione del collagene dei tre strati nella valvola cardiaca umana nativa. Ogni strato è costituito da fibre con un diametro complessivo di 4,1 ± 1,6 μm (Figura 1).
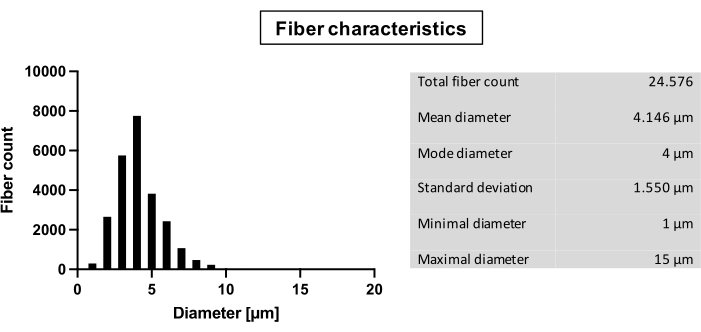
Figura 1: Caratteristiche della fibra. Analisi delle fibre: conteggio totale delle fibre; Diametro in μm: media, modalità, deviazione standard, diametro minimo, diametro massimo. Fare clic qui per visualizzare una versione più grande di questa figura.
I modelli di foglio illustrativo sono progettati per adattarsi a una protesi valvolare aortica Ø 24 mm (Figura 2C). Dopo l'essiccazione, le impalcature del volantino hanno mantenuto la loro forma di una cuspide della valvola cardiaca 3D (Figura 3A).

Figura 2: Configurazione dell'elettrofilatura. (A) Collettore assemblato stampato in 3D nella configurazione rotativa; (B) rendering CAD del collettore stampabile in 3D; (C) rendering CAD del foglietto della valvola cardiaca negativo mostrato al punto B; triangolo indica la parte ingrandita. Abbreviazione: CAD = computer-aided design. Fare clic qui per visualizzare una versione più grande di questa figura.
L'imaging SEM è stato utilizzato per valutare gli strati allineati e non allineati (TEMP F3512-21). Le fotografie sono state scattate con ingrandimento 100x, 500x e 2.000x in tre diverse posizioni su un'impalcatura. Gli scaffold in fibra allineati appaiono con una superficie liscia e un orientamento rigoroso nella direzione circonferenziale (Figura 3B). L'analisi visiva dell'immagine 2.000x rispetto all'orientamento della fibra conferma l'allineamento primario delle fibre (Figura 3C). Gli scaffold in fibra non allineati mostrano una superficie altrettanto liscia rispetto alle fibre allineate. L'orientamento delle fibre è disordinato, con molte intersezioni prominenti tra le fibre (Figura 3D). Successive analisi visive confermano la assenza di allineamento delle fibre senza orientamento primario visibile (Figura 3E).

Figura 3: Opuscolo elettrofilato e imaging SEM. (A) Foglietto multistrato elettrofilato e raccoglitore di volantini stampato in 3D; (B) immagine SEM di fibre non allineate (ingrandimento 1.000x); (C) Analisi dell'orientamento delle fibre non allineate; (D) immagine SEM di fibre allineate (ingrandimento 1.000x); (E) Analisi dell'orientamento delle fibre allineate. Barre di scala = 10 mm (A), 100 μm (B, D). Abbreviazione: SEM = microscopia elettronica a scansione. Fare clic qui per visualizzare una versione più grande di questa figura.
L'imaging di scaffold multistrato tinti fluorescenti ha rivelato tre singoli strati con orientamenti distinti delle fibre (Figura 4D). Lo strato inferiore (Figura 4A; blu) mostra fibre allineate in orientamento orizzontale con pochissima intersezione tra le fibre. Lo strato intermedio (Figura 4B; verde) mostra fibre non allineate senza orientamento della fibra primaria. Lo strato superiore (Figura 4C; rosso) mostra fibre allineate con orientamento perpendicolare. L'analisi visiva degli strati superiore e inferiore rivela un angolo medio tra i due strati di 89°, che è conforme alla rotazione di 90° del collettore durante il processo di filatura (Figura 4E).
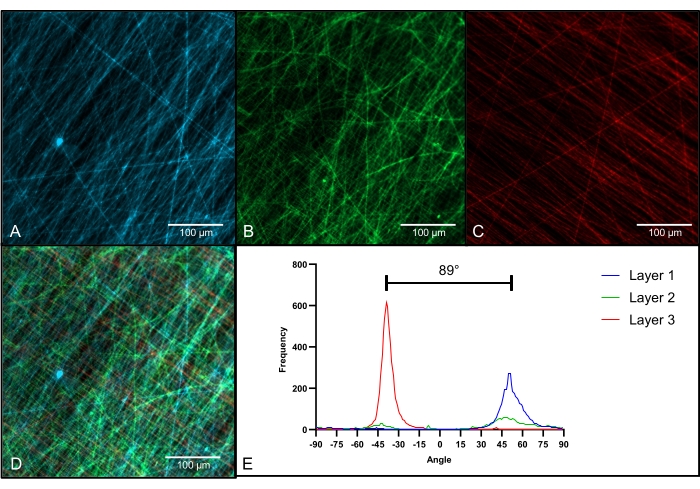
Figura 4: Microscopia a fluorescenza di scaffold multistrato. (A) Immagine a fluorescenza del primo strato con orientamento primario dal basso a sinistra in alto a destra; (B) Immagine a fluorescenza del secondo strato con orientamento della fibra non allineato; (C) Immagine di fluorescenza del terzo strato con orientamento primario dal basso a destra in alto a sinistra; (D) Immagine di fluorescenza di tutti e tre gli strati combinati in un'unica impalcatura; (E) Analisi dell'orientamento delle fibre per tutti e tre gli strati (Strato 1: blu; Strato 2: verde; Strato 3: rosso); ingrandimento = 400x (A-D); barre di scala = 100 μm (A-D). Fare clic qui per visualizzare una versione più grande di questa figura.
La misurazione dello spessore è stata effettuata su 21 campioni (Figura 5A) (TEMP F3510-21). Tutti i campioni sono stati creati applicando gli stessi parametri. La temperatura e l'umidità potrebbero differire tra 20,3 °C e 26,1 °C e tra il 35% e il 55% di umidità, rispettivamente. I risultati hanno mostrato un aumento relativamente lineare dello spessore di ~ 2,65 μm al minuto.
Un altro esperimento ha mostrato la coerenza dei risultati dopo 60 minuti di rotazione sotto parametri corrispondenti (Figura 5B). L'umidità e la temperatura potrebbero differire tra il 35% e il 50% di umidità e tra 20,3 °C e 26,1 °C, rispettivamente. I risultati sono stati ponteggi di spessore compreso tra 126 e 181 μm. Lo spessore medio era di 151,11 ± 13,17 μm. L'aumento di spessore è stato in media di ~ 2,52 μm al minuto.
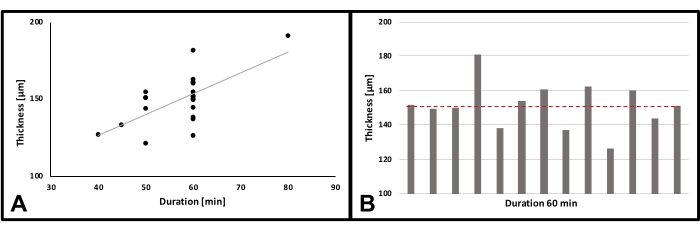
Figura 5: Misurazione dello spessore. (A) Spessore degli scaffold per volta filato; n = 21; Coefficiente di correlazione (r) = 0,653; p** = 0,00132; B) spessore dei campioni dopo 60 min; n = 13; linea rossa: media. Fare clic qui per visualizzare una versione più grande di questa figura.
Le prove di trazione per impalcature in fibra allineate e non allineate sono state eseguite in due direzioni, lungo la direzione circonferenziale e perpendicolare ad essa. Ogni malta consisteva di 15 esemplari. I campioni sono stati prelevati dalle impalcature degli aerei secondo DIN 53504: 2017-03. Lo spessore è stato misurato in tre punti diversi su ciascun campione e utilizzato per calcolare i valori di forza massima per mm quadrato.
I valori di spessore sono compresi tra 0,03 e 0,2 mm. Il confronto della resistenza alla trazione finale ha rivelato una differenza significativa (p < 0,001) tra gli orientamenti per gli scaffold in fibra allineati (Figura 6A). I ponteggi hanno raggiunto una resistenza massima di 12,26 ± 2,59 N/mm2 lungo l'orientamento circonferenziale. La resistenza alla trazione è stata ridotta a 3,86 ± 1,08 N/mm2 in direzione perpendicolare.
Gli scaffold in fibra non allineati non mostrano alcuna differenza nella resistenza alla trazione finale per i diversi orientamenti (F1: 7,19 ± 1,75 N / mm2, F2: 7,54 ± 1,59 N / mm2; p = 0,60). L'analisi comparativa dell'allungamento a rottura per gli scaffold in fibra allineati ha rivelato differenze significative (p < 0,001) nella distensibilità tra le direzioni (Figura 6B). L'estensibilità ha raggiunto 187,01 ± il 39,37% in direzione circonferenziale rispetto a 107,16 ± il 30,04% in direzione perpendicolare.
Al contrario, l'allungamento a rottura per le stuoie in fibra non allineate ha rivelato un'estensibilità uniforme in entrambe le direzioni (F1: 269,74 ± 24,78 % ; F2: 285,01 ± 25,58 %; p = 0,69). Le curve di sollecitazione-deformazione rappresentative mostrano enormi differenze nel comportamento del materiale, a seconda della direzione in cui viene applicata la forza di trazione. I tappetini in fibra non allineati hanno mostrato un comportamento elastico lineare, mentre i tappetini in fibra allineati hanno mostrato non linearità nella direzione assiale.
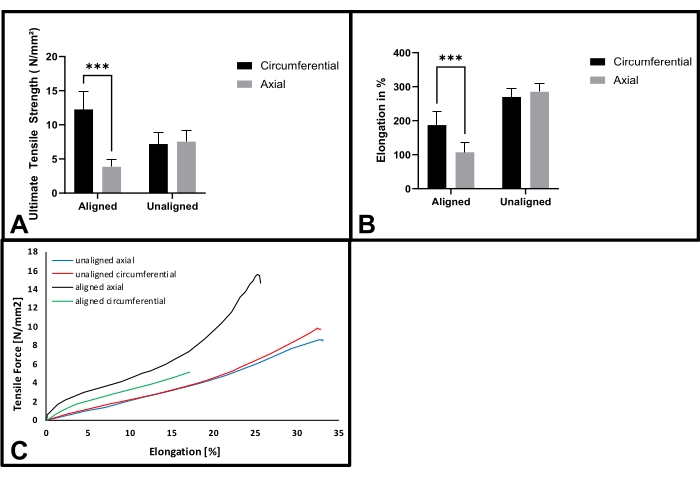
Figura 6: Prove di trazione di fibre allineate e non allineate. (A) Resistenza alla trazione finale per stuoie di fibre allineate e non allineate in direzioni circonferenziali e assiali; n = 15; (B) Allungamento a rottura per stuoie di fibre allineate e non allineate in direzione circonferenziale e assiale; n = 15; (C) Curve di sollecitazione-deformazione rappresentative di ponteggi allineati e non allineati, tirati rispettivamente in direzione assiale e circonferenziale. (***p < 0,001). Fare clic qui per visualizzare una versione più grande di questa figura.
| Metriche di produzione | |||||||||
| Nome | Materiale | Importo | Tempo totale | Peso totale [g] | Costo [€ al kg] | Costo totale | |||
| 1 | Specimen_Mount_A | PLA normale | 2 | 18:19 | 159 | 51,33 € | 8,16 € | ||
| 2 | Specimen_Mount_B | PLA normale | 2 | 19:42 | 161 | 51,33 € | 8,26 € | ||
| 3 | Flangia collettore | PLA conduttivo | 2 | 10:40 | 95 | 99,98 € | 9,50 € | ||
| 4 | Leaflet_Inlet | PLA conduttivo | 9 | 05:32 | 31 | 99,98 € | 3,10 € | ||
| Totale | 29,02 € | ||||||||
Tabella 1: Metriche di produzione. Tabella che specifica la quantità, il tempo di produzione, la quantità di materiale necessario e i costi per le parti stampate in 3D. Abbreviazione: PLA = acido polilattico.
File supplementare 1: flangia del collettore adattabile. Step-file per adattare e stampare la flangia del collettore. Fare clic qui per scaricare questo file.
File supplementare 2: Modello di opuscolo. STL-file per stampare il modello di volantino. Fare clic qui per scaricare questo file.
File supplementare 3: Supporto per campioni A. STL-file per stampare il supporto del campione A. Fare clic qui per scaricare questo file.
File supplementare 4: Supporto per campioni B. STL-file per stampare il supporto del campione B. Fare clic qui per scaricare questo file.
File supplementare 5: flangia del collettore. STL-file per stampare la flangia del collettore. Fare clic qui per scaricare questo file.
File supplementare 6: Biella metallica. Disegno tecnico per la costruzione di bielle metalliche. Fare clic qui per scaricare questo file.
Discussione
Il protocollo descritto presenta due innovazioni nel campo dell'ingegneria tissutale (cardiovascolare): la produzione a basso costo di fantasmi completamente stampati in 3D per l'elettrofilatura e l'utilizzo di un collettore versatile per produrre volantini valvolari cardiaci adattabili e multistrato.
Recentemente, la stampa 3D è diventata uno strumento prezioso per la produzione di apparecchiature di laboratorio, ad esempio bioreattori o configurazioni di produzione e test11,12. Pertanto, è stato possibile produrre la configurazione di elettrofilatura presentata in questo studio in un breve lasso di tempo e per un budget accessibile (Tabella 1). Ciò rimane in linea con i risultati precedenti per la produzione a basso costo di configurazioni di elettrofilatura utilizzando la stampa 3D13.
Inoltre, al meglio delle conoscenze degli autori, questa è la prima volta che un materiale di stampa 3D conduttivo è stato utilizzato per creare un collettore di elettrofilatura per i volantini delle valvole cardiache. Finora, i collettori stampati in 3D sono stati fabbricati mediante sinterizzazione lasermetallica 14 o utilizzando la stampa polimerica non conduttiva e la successiva post-elaborazione con un rivestimento conduttivo15. In contrasto con questo nuovo approccio, queste procedure sono in uno svantaggio significativo in quanto sono più costose, richiedono molto più tempo o richiedono più lavoro manuale.
L'elettrofilatura dipende da una moltitudine di variabili che influenzano la morfologia delle fibre create. Sebbene sul mercato siano disponibili diverse configurazioni di elettrofilatura commerciale, molti gruppi di ricerca utilizzano configurazioni altamente personalizzate per soddisfare le loro esigenze specifiche16. Tenendo conto di ciò, i valori descritti in questo protocollo (tensione, distanza e velocità di rotazione) potrebbero dover essere adattati per le singole configurazioni e dovrebbero essere visti come un punto di partenza piuttosto che valori fissi. Inoltre, è noto che i parametri ambientali possono avere un'influenza significativa sui risultati dell'elettrofilatura17,18. Pertanto, si consiglia vivamente di controllare almeno la temperatura e l'umidità all'interno del carro di elettrofilatura. Risultati ottimali di elettrofilatura sono stati ottenuti tra il 15-20% di umidità relativa a una temperatura compresa tra 21 e 24 °C. Per seguire questo protocollo, è essenziale la seguente apparecchiatura: un motore in grado di accelerare un collettore del peso di circa 300 g a una velocità di rotazione di 2.000 giri / min, una pompa a siringa adatta a piccole portate volumetriche di 1-3 mL / h e un alimentatore bipolare in grado di ±20 kV in corrente continua (DC).
In linea con studi precedenti, è stato possibile visualizzare la struttura fibrosa degli scaffold elettrofilati mediante microscopia a fluorescenza19. È stato possibile dimostrare con successo la struttura multistrato dell'impalcatura, compresi i diversi orientamenti delle fibre. Soprattutto quando si lavora con più strati o più materiali, l'introduzione di coloranti fluorescenti dovrebbe essere considerata come una procedura standard per un rigoroso controllo di qualità. Potrebbe migliorare la valutazione visiva dei risultati dopo le modifiche ai parametri o al protocollo del flusso di lavoro. L'applicazione di colorante in scaffold da utilizzare per la valutazione in vivo o in vitro non può essere raccomandata. Questo è importante per evitare interferenze con i metodi analitici stabiliti.
Imitare la morfologia naturale della valvola cardiaca è di grande importanza per produrre una replica ingegnerizzata tessutalmente da utilizzare come protesi valvolare cardiaca (Figura 4B). È stato dimostrato che la geometria specifica della valvola ha un impatto elevato sul rimodellamento in vivo 20. In questo contesto, la stampa 3D della geometria del volantino per l'elettrofilatura è di vantaggio, poiché le iterazioni sono facili e veloci da implementare. Anche la produzione di geometrie valvolari personalizzate è concepibile ed è possibile il successivo sviluppo di modelli 3D individuali e personalizzati di anomalie valvolari cardiache, ad esempio, a scopo didattico.
L'ulteriore miglioramento delle proprietà delle valvole cardiache ingegnerizzate nei tessuti è al centro degli attuali sforzi di ricerca, poiché diversi gruppi di ricerca hanno lavorato allo sviluppo di scaffold multistrato con orientamenti di fibre definiti. Masoumi et al. hanno fabbricato scaffold compositi da uno strato di poliglicerolo sebacato stampato e tappetini in fibra di policaprolattone (PCL) elettrofilati21. Pertanto, un triplo strato potrebbe essere creato da due strati elettrofilati orientati separati da un foglio di poliglicerolo sebacato microfabbricato. Tuttavia, a differenza delle impalcature a portata di mano, non erano né in una forma 3D né imitavano adeguatamente lo strato intermedio (spongiosa). Un altro approccio alla produzione di una valvola cardiaca bioispirata ingegnerizzata con tessuti è stato perseguito da Jana et al.22,23. Hanno prodotto con successo scaffold a triplo strato con fibre orientate utilizzando collettori in alluminio per l'elettrofilatura a base di PCL. Ancora una volta, queste impalcature presentavano anche imperfezioni morfologiche, in quanto hanno solo un aspetto 2D e l'impalcatura finale è pervasa da raggi.
Anche se il protocollo fornisce informazioni dettagliate su come vengono prodotti i lembi della valvola cardiaca 3D a triplo strato, ci sono molti altri passaggi necessari per creare una vera e propria protesi valvolare cardiaca. Uno stent di 24 mm di diametro è raccomandato per i foglietti qui descritti. Complementari allo stent utilizzato, i foglietti possono essere dotati di strutture di supporto aggiuntive per le cuciture. Per consentire la massima flessibilità, i foglietti mostrati qui non sono personalizzati per un design specifico dello stent. Questo può essere fatto semplicemente modificando il modello utilizzando un software CAD.
Sebbene utilizzato per l'ingegneria tissutale delle valvole cardiache, il metodo presentato sarà prontamente applicabile per le configurazioni di elettrofilatura in ortopedia24, urologia25, otorinolaringoiatria26 e altri. La produzione di costrutti 3D sofisticati e / o personalizzati è fattibile mediante l'implementazione di altri collettori stampati in 3D. Sebbene il materiale del collettore sia cambiato, il principio dell'elettrofilatura rimane intatto27. Pertanto, l'uso di polimeri diversi è teoricamente possibile, sebbene possa essere necessario regolare i parametri di elettrofilatura.
Nel complesso, il protocollo presentato descrive un modo semplice ed economico per produrre volantini per valvole cardiache multistrato. L'applicazione della stampa 3D consente un rapido adattamento e modifiche del collettore e degli inserti. Ciò consente la produzione di protesi specifiche per il paziente senza un complicato processo di fabbricazione, ad esempio, di collettori metallici. È possibile creare più campioni in un'unica esecuzione in condizioni identiche. Pertanto, i test distruttivi del materiale possono essere eseguiti sui campioni con il vantaggio di avere (quasi) identici quelli rimanenti per costruire la valvola effettiva. L'inclusione dei file di stampa come file supplementari in questo studio ha lo scopo di supportare il progresso degli scaffold delle valvole cardiache multistrato. Questa nuova tecnica di elettrofilatura ha anche un alto potenziale per altri campi della medicina rigenerativa, poiché i collettori modificati e altri modelli di filatura stampati in 3D sono facili da implementare.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dal Clinician Scientist Program In Vascular Medicine (PRIME), finanziato dalla Deutsche Forschungsgemeinschaft (DFG, German Research Foundation), numero di progetto MA 2186/14-1.
Materiali
| Name | Company | Catalog Number | Comments |
| BTC-FR2.5TN.D09 | ZwickRoell GmbH & Co. KG | Traction engine (Tensile tests) | |
| C5-E Motor Controller | Nanotec Electronic GmbH & Co. KG | Motor controll unit | |
| CH1: CPN 30 kV | 0.3 mA | iseg Spezialelectronik GmbH | Power Supply Unit Anode | |
| CH1: CPN 30 kV | 0.3 mA | iseg Spezialelektronik GmbH | Power Supply Unit Kathode | |
| Conductive Composite PLA | ProtoPasta | Conductive PLA | |
| Cura 4.7.1 | Ultimaker BV | Slicing Software Ultimaker, step 1.1.2 | |
| DAPI Stock Solution c = 0.1 mg/mL | Sigma-Aldrich Chemie GmbH | DAPI | |
| Disposable Scalpel No. 23 | FEATHER | Scalpel | |
| Fluorescein (C.I. 45350) M 376.28 g/mol | Carl Roth GmbH + Co. KG | Fluorescein | |
| Fume Hood as per DIN 12924 Class 2 | Köttermann GmbH | Fume Hood | |
| Leica Applicatin Suite X 3.5.5.19976 | Leica Microsystems GmbH | Software for Confocal Laser Scanning Microscope | |
| Luerlock Syringe 20 mL | BD Plastipak | Luerlock Syringe | |
| Metal needle plane 2.50/2.00 x 20 mm | Unimed S.A. | Needle with plane tip | |
| Montage-complet-tubes; inner diameter x outer diameter: 1/16" x 1/8", length 1.000 mm | Bohlender GmbH | F740-28 | Solvent resistant tubes |
| N,N-Dimethylformamide ≥99.8% | Sigma-Aldrich Chemie GmbH | Dimethylformamide | |
| Pellethane 2363 80AE | Velox GmbH Hamburg | Polyurethane | |
| PLA | Ultimaker BV | PLA | |
| Plug&Drive Studio (1.0.4) | Nanotec Electronic GmbH & Co. KG | Motor operation software | |
| SEM Evo LS 10 | Zeiss MicroImaging GmbH | Scanning Electron Microscope | |
| SHT 31-D | Adafruit Industries | Temperature and Humidity Sensor | |
| SolidWorks 2020 CAD Software | Dassault Systèmes | Commercial CAD Software | |
| Sulforhodamine 101 50 mg | Sigma - Aldrich | S 7635 | Texas Red |
| Syringe Pump Model: Fusion 100 | Chemyx Inc. | Syringe Pump | |
| TCS SP8 inverted CEL BMi8 | Leica Microsystems GmbH | Confocal Laser Scanning Microscope | |
| testXpert V11.02 | ZwickRoell GmbH & Co. KG | Software Tensile Test | |
| Tetrahydrofuran ≥99.9% | Sigma-Aldrich Chemie GmbH | Tetrahydrofuran | |
| Type 1511530000202 #980361 | Binder Labortechnik GmbH | Heating Cabinet | |
| Ultimaker 3 Extended | Ultimaker BV | 3D Printer |
Riferimenti
- Van Camp, G. Cardiovascular disease prevention. Acta Clinica Belgica. 69 (6), 407-411 (2014).
- Iung, B., Vahanian, A. Epidemiology of valvular heart disease in the adult. Nature Reviews Cardiology. 8 (3), 162-172 (2011).
- Fioretta, E. S., et al. Cardiovascular tissue engineering: From basic science to clinical application. Experimental Gerontology. 117 (1), 1-12 (2019).
- Xue, J., Wu, T., Dai, Y., Xia, Y. Electrospinning and electrospun nanofibers: methods, materials, and applications. Chemical Reviews. 119 (8), 5298 (2019).
- Grande, D., Ramier, J., Versace, D. L., Renard, E., Langlois, V. Design of functionalized biodegradable PHA-based electrospun scaffolds meant for tissue engineering applications. New Biotechnology. 37, 129-137 (2017).
- Tara, S., et al. Well-organized neointima of large-pore poly(l-lactic acid) vascular graft coated with poly(l-lactic-co-ε-caprolactone) prevents calcific deposition compared to small-pore electrospun poly(l-lactic acid) graft in a mouse aortic implantation model. Atherosclerosis. 237 (2), 684-691 (2014).
- Voorneveld, J., Oosthuysen, A., Franz, T., Zilla, P., Bezuidenhout, D. Dual electrospinning with sacrificial fibers for engineered porosity and enhancement of tissue ingrowth. Journal of Biomedical Material Research. 105 (6), 1559-1572 (2017).
- Kishan, A. P., Cosgriff-Hernandez, E. M. Recent advancements in electrospinning design for tissue engineering applications: A review. Journal of Biomedical Materials Research. 105 (10), 2892-2905 (2017).
- Sacks, M. S., David Merryman, W., Schmidt, D. E. On the biomechanics of heart valve function. Journal of Biomechanics. 42 (12), 1804-1824 (2009).
- Buchanan, R. M., Sacks, M. S. Interlayer micromechanics of the aortic heart valve leaflet. Biomechanics and Modeling in Mechanobiology. 13 (4), 813-826 (2014).
- Gensler, M., et al. 3D printing of bioreactors in tissue engineering: A generalised approach. PLoS One. 15 (11), 0242615 (2020).
- Grab, M., et al. Customized 3D printed bioreactors for decellularization-High efficiency and quality on a budget. Artificial Organs. 45 (12), 1477-1490 (2021).
- Huang, J., Koutsos, V., Radacsi, N. Low-cost FDM 3D-printed modular electrospray/electrospinning setup for biomedical applications. 3D Printing in Medicine. 6 (1), 8 (2020).
- Fukunishi, T., et al. Preclinical study of patient-specific cell-free nanofiber tissue-engineered vascular grafts using 3-dimensional printing in a sheep model. Journal of Thoracic and Cardiovascular Surgery. 153 (4), 924-932 (2017).
- Jana, S., Lerman, A. In vivo tissue engineering of a trilayered leaflet-shaped tissue construct. Regenerative Medicine. 15 (1), 1177-1192 (2020).
- Hasan, A., et al. Electrospun scaffolds for tissue engineering of vascular grafts. Acta Biomaterialia. 10 (1), 11-25 (2014).
- Wang, X., Ding, B., Yu, J., Yang, J. Large-scale fabrication of two-dimensional spider-web-like gelatin nano-nets via electro-netting. Colloids and Surfaces B: Biointerfaces. 86 (2), 345-352 (2011).
- Yang, G. -. Z., Li, H. -. P., Yang, J. -. H., Wan, J., Yu, D. -. G. Influence of working temperature on the formation of electrospun polymer nanofibers. Nanoscale Research Letters. 12 (1), 55 (2017).
- Ekaputra, A. K., Prestwich, G. D., Cool, S. M., Hutmacher, D. W. Combining electrospun scaffolds with electrosprayed hydrogels leads to three-dimensional cellularization of hybrid constructs. Biomacromolecules. 9 (8), 2097-2103 (2008).
- Motta, S. E., et al. Geometry influences inflammatory host cell response and remodeling in tissue-engineered heart valves in-vivo. Scientific Reports. 10 (1), 19882 (2020).
- Masoumi, N., et al. Tri-layered elastomeric scaffolds for engineering heart valve leaflets. Biomaterials. 35 (27), 7774-7785 (2014).
- Jana, S., Lerman, A. Behavior of valvular interstitial cells on trilayered nanofibrous substrate mimicking morphologies of heart valve leaflet. Acta Biomaterialia. 85, 142-156 (2019).
- Jana, S., Franchi, F., Lerman, A. Trilayered tissue structure with leaflet-like orientations developed through in vivo tissue engineering. Biomedical Materials. 15 (1), 015004 (2019).
- Zhou, Y., Chyu, J., Zumwalt, M. Recent progress of fabrication of cell scaffold by electrospinning technique for articular cartilage tissue engineering. International Journal of Biomaterials. 2018, 1953636 (2018).
- Zamani, M., Shakhssalim, N., Ramakrishna, S., Naji, M. Electrospinning: application and prospects for urologic tissue engineering. Frontiers in Bioengineering and Biotechnology. 8, 579925 (2020).
- Heilingoetter, A., Smith, S., Malhotra, P., Johnson, J., Chiang, T. Applications of Electrospinning for Tissue Engineering in Otolaryngology. Annals of Otology, Rhinology & Laryngology. 130 (4), 395-404 (2020).
- Xue, J., Xie, J., Liu, W., Xia, Y. Electrospun nanofibers: new concepts, materials, and applications. Accounts of Chemical Research. 50 (8), 1976-1987 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon