Method Article
Ingegnerizzazione di assiemi tendinei per sondare la diafonia cellulare nella malattia e nella riparazione
In questo articolo
Riepilogo
Qui, presentiamo un sistema modello di assemblaggio per imitare il crosstalk cellulare tendineo tra il tessuto del nucleo tendineo portante e un compartimento estrinseco contenente popolazioni cellulari attivate da malattie e lesioni. Come importante caso d'uso, dimostriamo come il sistema possa essere implementato per sondare l'attivazione delle cellule endoteliali estrinseche rilevanti per la malattia.
Abstract
I tendini consentono la locomozione trasferendo le forze muscolari alle ossa. Si basano su un nucleo tendineo resistente che comprende fibre di collagene e popolazioni di cellule stromali. Questo nucleo portante è avvolto, nutrito e riparato da uno strato di tessuto simile a quello sinoviale che comprende il compartimento tendineo estrinseco. Nonostante questo design sofisticato, le lesioni tendinee sono comuni e il trattamento clinico si basa ancora sulla fisioterapia e sulla chirurgia. I limiti dei sistemi modello sperimentali disponibili hanno rallentato lo sviluppo di nuovi trattamenti modificanti la malattia e regimi clinici di prevenzione delle recidive.
Gli studi in vivo sull'uomo si limitano a confrontare tendini sani con tessuti malati o rotti allo stadio terminale campionati durante l'intervento chirurgico di riparazione e non consentono lo studio longitudinale della malattia tendinea sottostante. I modelli animali in vivo presentano anche importanti limiti per quanto riguarda la complessità fisiologica opaca, l'onere etico per gli animali e gli ingenti costi economici associati al loro utilizzo. Inoltre, i modelli animali in vivo sono poco adatti per il sondaggio sistematico di farmaci e percorsi di interazione multicellulari e multi-tessuto. Anche i sistemi di modelli in vitro più semplici non sono stati all'altezza. Uno dei motivi principali è l'incapacità di replicare adeguatamente il carico meccanico tridimensionale necessario per studiare in modo significativo le cellule tendinee e la loro funzione.
Il nuovo sistema di modelli 3D qui presentato allevia alcuni di questi problemi sfruttando gli espianti del nucleo del tendine caudino murino. È importante sottolineare che questi espianti sono facilmente accessibili in gran numero da un singolo topo, mantengono modelli di carico 3D in situ a livello cellulare e presentano una matrice extracellulare simile a quella in vivo. In questo protocollo, vengono fornite istruzioni dettagliate su come aumentare gli espianti del nucleo tendineo con idrogel di collagene carichi di cellule endoteliali derivate dai muscoli, fibroblasti derivati dai tendini e macrofagi derivati dal midollo osseo per sostituire le popolazioni di cellule attivate da malattie e lesioni all'interno del compartimento tendineo estrinseco. È stato dimostrato come gli assembloidi tendinei risultanti possano essere stimolati meccanicamente o attraverso stimoli microambientali definiti per studiare l'emergente diafonia multicellulare durante la malattia e la lesione.
Introduzione
Nella loro funzione di trasferire le forze muscolari alle ossa per consentire il movimento, i tendini affrontano alcune delle sollecitazioni meccaniche più estreme che si verificano nel corpo umano 1,2,3. A causa dell'invecchiamento della società, dell'aumento della prevalenza dell'obesità e della crescente popolarità di attività sportive meccanicamente impegnative, si prevede che la prevalenza di malattie e lesioni tendinee aumenterà nei paesi sviluppati 4,5,6. Lo sviluppo di nuovi regimi terapeutici basati sull'evidenza e modificanti la malattia per combattere questo aumento è stato ostacolato dalle limitazioni dei sistemi modello 1,7,8 attualmente disponibili.
Idealmente, i modelli di riparazione delle malattie e delle lesioni consentirebbero di studiare il modo in cui l'organo bersaglio elabora un insieme definito di parametri di input (imitando i fattori scatenanti della malattia, Tabella 1) in parametri di output misurabili (che rappresentano i segni distintivi della malattia, Tabella 2) controllando al contempo i fattori confondenti. Gli studi che utilizzano tali sistemi modello sarebbero quindi in grado di identificare i processi fisiologici (pato-) alla base della riparazione di malattie e lesioni e acquisire conoscenze che potrebbero essere sfruttate per prevenire o ridurre i segni distintivi di malattie e lesioni nelle cliniche. Applicando questo principio ai tendini, un utile sistema modello dovrebbe ricapitolare le parti centrali della risposta tendinea in vivo alla malattia e alla lesione, che comprendono i seguenti segni distintivi: microdanno, infiammazione, neovascolarizzazione, ipercellularità, turnover accelerato della matrice e decompartimentazione 9,10,11,12,13,14,15 . Utilizzando questi tratti distintivi come base, è possibile dedurre i seguenti requisiti per un sistema di modelli di riparazione delle malattie tendinee e delle lesioni.
Si ipotizza che il sovraccarico meccanico sia un fattore centrale nella patogenesi delle lesioni tendinee e delle malattie ed è quindi un approccio sperimentale comunemente usato per creare microdanni16. La capacità di carico meccanico controllabile è, quindi, un prerequisito fondamentale per i modelli di riparazione delle malattie tendinee e delle lesioni. Idealmente, il sistema del modello consente tre modalità principali: carico singolo da stiramento a danno, carico a fatica e scarico 8,17,18. In seguito alla deformazione meccanica, le cellule residenti nei tessuti subiscono una complessa combinazione di forze di tensione, forze di taglio (dovute allo scorrimento delle fibre di collagene che circondano le cellule) e forze di compressione che si verificano durante lo scarico o in prossimità dell'entesi19,20. I sistemi di modellazione dovrebbero ricreare questi complessi modelli di carico il più fedelmente possibile.
Un modo alternativo per introdurre il microdanno della matrice è quello di sfruttare i fattori di stress biochimici che imitano le predisposizioni sistemiche per le malattie e le lesioni tendinee, come le citochine (pro)infiammatorie, lo stress ossidativo o le alte concentrazioni di glucosio 21,22,23. Di conseguenza, un microambiente di nicchia controllabile è vantaggioso per un sistema modello di riparazione di malattie tendinee e lesioni.
Un prerequisito comune affinché i sistemi modello siano in grado di ricapitolare l'infiammazione, la neovascolarizzazione e l'ipercellularità è la presenza selettiva di popolazioni cellulari che guidano questi processi24. Per i processi infiammatori, queste popolazioni includono neutrofili, cellule T e macrofagi, mentre le cellule endoteliali e i periciti sarebbero necessari per studiare la neovascolarizzazione 25,26,27,28,29. I fibroblasti tendinei non sono solo vitali per la riparazione del tendine ma, come cellule proliferative e migranti, sono anche parzialmente responsabili dell'ipercellularità locale osservata nelle malattie tendinee 30,31,32,33,34,35,36.
Oltre ai cambiamenti nelle popolazioni cellulari residenti, la composizione della matrice tendinea è alterata anche nelle malattie e nelle lesioni tendinee 7,37,38,39,40. Per presentare i giusti segnali microambientali rilevanti per la malattia, i sistemi modello dovrebbero essere in grado di integrare una composizione di matrice extracellulare abbinata alla malattia o allo stadio di lesione mirato, ad esempio, consentendo combinazioni proporzionali rilevanti di collagene-1, collagene-3 e fibronectinacellulare 41.
La compartimentazione dei tendini sani nel nucleo tendineo e nei compartimenti estrinseci (cioè endotenone, epitenone e paratenone) è fondamentale per la loro funzione e spesso disturbata nei tendini malati o feriti 1,42,43,44,45,46,47 . L'incorporazione della compartimentazione tendinea 3D nei sistemi di modelli tendinei non è quindi solo necessaria per simulare più da vicino i processi alla base della de- e ri-compartimentazione, ma aiuta anche a stabilire i corretti gradienti spazio-temporali di citochine e nutrienti48,49.
Infine, la modularità è un altro asset centrale dei sistemi modello, che consente ai ricercatori di combinare il corretto contributo relativo e l'interazione tra i fattori di stress precedentemente descritti durante i processi indagati 8,17.
Oltre a selezionare le modalità di input ottimali, un passo importante è essere in grado di misurare, osservare e tenere traccia dei cambiamenti nell'output risultante. Le proprietà meccaniche del sistema modello (cioè la lunghezza della regione delle dita dei piedi, il modulo elastico lineare, la massima deformazione di trazione, la massima sollecitazione di trazione, la resistenza alla fatica e il rilassamento delle sollecitazioni) sono centrali qui, in quanto caratterizzano la funzione principale del tendine 50,51,52. Per collegare questi cambiamenti funzionali ai cambiamenti a livello tissutale, è importante abilitare metodi che rilevano il danno strutturale della matrice (collagene) e monitorano la proliferazione e il reclutamento di popolazioni cellulari rilevanti per la malattia e la riparazione 30,53,54,55,56,57,58,59,60.
Per studiare l'emergente crosstalk cellula-cellula e cellula-matrice, si dovrebbe essere in grado di isolare o marcare le proteine in quantità adeguate per la quantificazione (ad esempio, ELISA, proteomica, immunoistochimica, citometria a flusso)14,21,61,62. Dovrebbe essere possibile anche l'analisi dell'espressione genica specifica della popolazione o almeno del compartimento (ad esempio, l'ordinamento cellulare attivato dalla fluorescenza [FACS], il sequenziamento di RNA a singola cellula/bulk e la reazione a catena della polimerasi quantitativa in tempo reale (RT-qPCR))21,24,27,63. Il sistema modello dovrebbe consentire di misurare il maggior numero possibile dei parametri di output sopra menzionati sullo stesso campione e su più campioni in modo sufficientemente veloce da sbloccare studi ad alto rendimento.
Tra i sistemi modello attualmente disponibili per studiare le malattie tendinee umane e la riparazione delle lesioni, il corpo umano stesso è, ovviamente, il più rappresentativo. È anche il meno compatibile con l'intervento sperimentale. Mentre i pazienti con lesioni tendinee acute sono abbondantemente disponibili per gli studi clinici, i pazienti con tendinopatia precoce (la malattia tendinea più comune) sono in gran parte privi di sintomi e spesso non vengono diagnosticati clinicamente fino a quando non si manifestano cambiamenti più gravi 14,64,65. Ciò rende difficile individuare il momento critico in cui l'omeostasi tendinea deraglia e i meccanismi alla base di questo deragliamento 16,66,67,68,69. Inoltre, l'estrazione di biopsie da tendini sani è eticamente impegnativa, in quanto può causare danni persistenti. I resti del tendine del tendine del tendine del ginocchio dalla chirurgia di ricostruzione del legamento crociato anteriore sono spesso usati come controlli sani, ma probabilmente differiscono nella funzione, nelle proprietà meccaniche, nelle popolazioni cellulari e nella composizione della matrice rispetto alla cuffia dei rotatori, al tendine d'Achille e ai tendini rotulei comunemente colpiti da malattie e lesioni tendinee 70,71,72,73.
I modelli animali in vivo sono più accessibili e trattabili, ma il loro utilizzo impone un onere etico significativo agli animali e un costo economico ai ricercatori. Inoltre, la maggior parte degli animali modello popolari non sviluppa spontaneamente lesioni tendinopatiche (ad esempio, ratti, topi, conigli) o mancano dei primer e dei ceppi geneticamente modificati necessari per tracciare le vie di comunicazione multicellulare coinvolte (ad esempio, cavalli, conigli).
I semplici sistemi di modelli 2D in vitro si trovano dall'altra parte dello spettro di complessità/trattabilità e consentono uno studio controllato ed efficiente in termini di tempo di specifiche vie di comunicazione intercellulare in risposta a una serie di trigger più controllabili 8,74. Tuttavia, questi sistemi semplificati comunemente non riescono a ricapitolare il carico meccanico multidimensionale (cioè tensione, compressione e taglio) che è fondamentale per la funzionalità del tendine. Inoltre, le rigidità (troppo) elevate della plastica delle colture tissutali tendono a sovrascrivere qualsiasi segnale di matrice fornito da rivestimenti destinati a simulare lo stato di malattia di interesse75,76.
Per ovviare a questo inconveniente, sono stati sviluppati sistemi di modelli 3D sempre più sofisticati per fornire una matrice caricabile la cui composizione può essere almeno parzialmente abbinata allo stato patologico desiderato 77,78,79. Tuttavia, questi sistemi non solo faticano a replicare accuratamente le complesse composizioni della matrice extracellulare in vivo e i modelli di carico cellulare, ma generalmente mancano di caricabilità a lungo termine e delle interfacce compartimentali necessarie per studiare le vie di comunicazione intercompartimentali che coordinano la malattia tendinea e la riparazione delle lesioni 48,49,80.
I sistemi modello di espianto di tendini ex vivo hanno il netto vantaggio di una composizione di matrice simile a quella in vivo incorporata che comprende nicchie pericellulari, barriere intercompartimentali e gradienti spaziotemporali di citochine/nutrienti e ricapitola modelli di carico complessi quando allungati8. A causa dei limiti di diffusione dei nutrienti dipendenti dalle dimensioni, gli espianti da modelli animali più grandi (ad esempio, cavalli) sono difficili da mantenere in vita per lo studio a lungo termine della malattia tendinea e della riparazione delle lesioni 81,82,83. Nel frattempo, gli espianti più piccoli di specie murine (ad esempio, tendine d'Achille, tendine rotuleo) sono difficili da bloccare in modo riproducibile e caricare meccanicamente. Le loro dimensioni limitano anche la quantità di materiale che può essere raccolto per letture a livello di cellula, proteina e gene senza raggruppare i campioni e ridurre la produttività. In questo senso, i fascicoli del tendine caudale murino offrono il potenziale per sbloccare lo studio ad alto rendimento della malattia tendinea e della riparazione delle lesioni in quanto sono prontamente disponibili in grandi quantità da un singolo topo, preservano la complessa composizione della matrice pericellulare in vivo e ricapitolano i modelli di carico cellulare. Durante il processo di estrazione, tuttavia, perdono la maggior parte del loro compartimento estrinseco e le popolazioni vascolari, immunitarie e fibroblastiche in esso contenute che ora sono considerate responsabili della malattia tendinea e della riparazione 8,18.
Per colmare questa lacuna, è stato sviluppato un sistema modello che combina i vantaggi degli espianti di nuclei derivati dal tendine caudale murino con i vantaggi dei sistemi di modelli basati su idrogel 3D. Questo sistema modello è costituito da un idrogel carico di cellule (collagene-1) gettato attorno agli espianti del tendine della coda84,85. In questo documento, le fasi di produzione necessarie sono fornite in dettaglio insieme a letture utili che possono essere ottenute co-colturando gli espianti del nucleo (compartimento intrinseco) all'interno di un idrogel di collagene di tipo 1 carico di cellule endoteliali (compartimento estrinseco).
Protocollo
Tutti i metodi qui descritti sono stati approvati dalle autorità competenti (numero di licenza del Cantone di Zurigo ZH104-18 e ZH058-21). Una panoramica è presentata nella Figura 1.
1. Isolamento dei componenti dell'assemblaggio tendineo da topi di 12-15 settimane (i.e., B6/J-Rj)
- Sopprimere i topi attraverso l'asfissia indotta dal gas CO2 . Per massimizzare la resa, non processare più di 3 topi alla volta e procedere con l'isolamento cellulare subito dopo l'eutanasia.
- Garantire la morte per induzione bilaterale dello pneumotorace.
- Sterilizzare la pelle del topo con etanolo all'80% e spostare il topo in una cappa sterile di biosicurezza.
- Isolare gli espianti del nucleo del tendine della coda.
- Usa un bisturi (n. 21) per separare la coda dal topo tagliandolo alla base.
- Partendo dalla punta della coda, afferrala con le pinzette e muovila per rompere la pelle. Quindi, allontana delicatamente le pinzette dalla coda per esporre gli espianti del nucleo tendineo.
- Posizionare gli espianti del nucleo tendineo nel terreno di coltura standard (DMEM/F12 + 10% FBS + 1% penicillina/streptomicina + 1% amfotericina + 1% aminoacidi non essenziali) e separarli dalla parte della coda tirata via utilizzando una lama di bisturi nuova (n. 21).
- Ripetere i passaggi 1.4.2. e 1.4.3. fino a quando l'intera coda non viene lavorata e gli espianti del tendine diventano più corti di 25 mm.
- Tagliare gli espianti isolati in pezzi lunghi 25 mm utilizzando una lama di bisturi fresca (n. 21).
- Misurare il diametro medio degli espianti di carote con un microscopio ottico collegato a un software di analisi delle immagini tramite una fotocamera digitale C-mount collegabile.
- Usa punta e clicca per selezionare lo strumento di misurazione della linea sul lato destro.
- Misurare il diametro dell'espianto in tre punti diversi e calcolarne il diametro medio.
- Per facilitare il serraggio e le prove meccaniche successive, procedere solo con espianti di carote aventi un diametro medio superiore a 100 μm.
- Lo scarico combinato con l'esposizione a condizioni di coltura standard (37 °C, 20% O2, supplementazione sierica) modifica l'espressione genica entro 6 ore dall'isolamento e provoca la degradazione entro 7 giorni21. Per iniziare con uno stato quasi-omeostatico, produrre gli assembloidi tendinei e iniziare gli esperimenti immediatamente dopo l'isolamento del nucleo tendineo.
- A seconda della configurazione sperimentale, sono necessari espianti di tendini devitalizzati come gruppo di controllo. Per devitalizzare gli espianti di monconi tendinei, congelarli in un piccolo contenitore riempito di azoto liquido per 5 secondi utilizzando una pinzetta e poi scongelarli per 5 secondi a temperatura ambiente (RT). Ripetere questo ciclo di gelo-disgelo 3 volte e procedere con il passaggio 4 ("Serraggio degli espianti del nocciolo").
ATTENZIONE: L'azoto liquido può causare ustioni da freddo, asfissia e infragilisce molti materiali ordinari. Utilizzare solo contenitori progettati per liquidi a bassa temperatura e indossare indumenti protettivi (ad es. visiera, guanti adeguati, scarpe chiuse).
- Isolare i fibroblasti tendinei.
- Usa un bisturi (n. 21) per praticare un'incisione trasversale al centro del piede del topo. Fai due tagli perpendicolari al piede lungo i lati delle zampe posteriori e fino ai fianchi da ciascuna estremità di questa incisione.
- Usa le pinzette per fissare il lembo di pelle ritagliato al piede e staccare la pelle che copre i muscoli del polpaccio. Quando si isolano le cellule endoteliali dallo stesso topo, rimuovere invece tutta la pelle.
- Separare il tendine d'Achille dall'osso calcagno con una lama di bisturi fresca (n. 21). Fissare l'estremità libera del tendine d'Achille con le pinzette e separare l'altra estremità dal muscolo gastrocnemio.
- Lavare il tendine d'Achille una volta in PBS e utilizzare il bisturi (n. 21) per rimuovere tutto il tessuto muscolare rimanente fino a quando non rimane solo il tessuto tendineo bianco. Se le cellule endoteliali sono isolate dallo stesso topo, lasciare il tendine d'Achille nella PBS e continuare con il passaggio 1.6. primo.
- Raggruppare i tendini d'Achille di un animale in una provetta di plastica da 15 mL contenente 10 mL di terreno di digestione tendineo (DMEM/F12 + 1% penicillina/streptomicina + 1% amfotericina + 2 mg/mL di collagenasi 1) e digerire per 6-8 ore a 37 °C sotto agitazione lenta e costante utilizzando un agitatore orbitale a bassa velocità a 15 giri/min.
- Centrifugare la soluzione tendinea digerita a 500 x g per 5 minuti a RT, aspirare il surnatante e risospendere in 8 mL di terreno di coltura standard (DMEM/F12 + 10% FBS + 1% penicillina/streptomicina + 1% amfotericina + 1% aminoacidi non essenziali) e colare in un matraccio di coltura T25 in condizioni di coltura standard (37 °C, 20 % O2 ) per 7 giorni senza cambiare terreno. Dopodiché, cambia il supporto una volta alla settimana.
- Dividere le cellule all'80% di confluenza in un matraccio di coltura T150 (1:6). Congelare le cellule al passaggio 2 in 2 mL di terreno di congelamento sterile filtrato (70% DMEM/F12 + 20% FBS + 10% DMSO) distribuito a due criotubi da 1,5 mL e mantenerli a -80 °C fino a nuovo utilizzo. Usa la tripsina per rimuovere le cellule dalla plastica della coltura tissutale.
- Isolare le cellule endoteliali derivate dai muscoli.
- Se i fibroblasti tendinei non sono isolati dallo stesso topo, iniziare con i passaggi 1.5.1 e 1.5.2.
- Usa le forbici per separare le zampe posteriori dal corpo tagliando l'articolazione dell'anca.
- Lavare le zampe posteriori una volta in PBS freddo (~ 4 °C), rimuovere i muscoli (quadricipite femorale, estensore lungo delle dita, soleo e gastrocnemio) con un bisturi (n. 21) e posizionare i muscoli in una capsula di Petri su ghiaccio.
- Utilizzare una lama di bisturi fresca (n. 21) per tritare il tessuto muscolare in pezzi più piccoli di 1 mm3 mantenendo la capsula di Petri sul ghiaccio.
- Raggruppare il tessuto muscolare tritato da entrambe le zampe posteriori in una provetta di plastica da 50 mL contenente 12,5 mL di terreno di digestione muscolare (PBS + 2 mg/mL di collagenasi IV + 2 mg/mL di dispasi II + 2 mM di CaCl2).
- Mettere il tubo di plastica a bagnomaria a 37 °C per 10 minuti. Agitare energicamente la soluzione e rimetterla per altri 10 minuti. Ripetere fino a quando la soluzione appare omogenea e rimangono solo pezzi (bianchi) di tendine e fascia (ca. 4 x 10 min). Nel frattempo, continuare con l'isolamento dei fibroblasti tendinei o l'isolamento dei macrofagi.
- Aggiungere 12,5 ml di PBS freddo + 10% FBS nella provetta di plastica per fermare la digestione.
- Utilizzare un portapipette alimentato a batteria dotato di una pipetta da 50 ml per aspirare la sospensione dal tubo di plastica. Dotare il tubo di plastica di un filtro cellulare da 400 μm e filtrare la sospensione per rimuovere i detriti. Ripetere il processo con un colino cellulare da 100 μm.
- Centrifugare la sospensione filtrata a 400 x g per 5 minuti a RT. Risospendere in 10 mL di PBS freddo + 10% FBS e centrifugare nuovamente.
- Risospensione in 8 mL di terreno di coltura endoteliale (miscela 1:1 di DMEM/F12 e kit endopan 3 + 10 U/mL di eparina + 20% FBS + 1% penicillina/streptomicina + 1% amfotericina + 30 mg/mL di integratore per la crescita endoteliale) integrato con puromicina (4 mg/mL) per la selezione della popolazione.
- Seminare le cellule di un topo in un matraccio di coltura T25 precedentemente rivestito con 2 mL di una soluzione sterile di gelatina allo 0,2% per 2 ore a 37 °C e poi essiccato per una notte a RT dopo aver rimosso la soluzione in eccesso. Preparare i flaconi il giorno prima dell'isolamento.
- Dopo 24 ore in condizioni di coltura standard (37 °C, 20% O2 ), rimuovere il terreno di integrazione di puromicina, lavare le cellule attaccate una volta con PBS e coltivarle in 8 mL di terreno di coltura endoteliale.
- Far passare le cellule 1:5 all'80% di confluenza in palloni rivestiti di gelatina e usarli negli esperimenti fino a P2. Utilizzare una soluzione di distacco cellulare diversa dalla tripsina (Tabella dei materiali) per rimuovere le cellule dalla plastica della coltura tissutale e non congelarle.
- Isolare i macrofagi derivati dal midollo osseo.
- Se i fibroblasti tendinei o le cellule endoteliali non sono isolati dallo stesso topo, eseguire prima i passaggi 1.5.1, 1.5.2, 1.6.2 e 1.6.3.
- Dopo aver rimosso la pelle, il tendine e i tessuti muscolari, lavare le ossa rimanenti (femore e tibia) una volta in PBS freddo (~4 °C).
- Mettere le ossa in PBS fresco e freddo (~4 °C) e utilizzare un bisturi (n. 21) per tagliare gradualmente le epifisi fino a quando il midollo osseo non è esposto. Appare come un punto rosso su entrambi i lati dell'osso.
- Dotare una siringa di un ago per iniezione da 0,4 mm x 25 mm (G27) e riempirla con 10 mL di terreno di coltura macrofagico (DMEM/F12 + 10% FBS + 1% penicillina/streptomicina + 1% amfotericina + 1% aminoacidi non essenziali).
- Tenere un osso dopo l'altro su una provetta di plastica da 50 ml, inserire l'ago per iniezione a circa 1 mm di profondità nel midollo osseo esposto sulla parte superiore e sciacquare il midollo osseo svuotando la siringa. Il midollo osseo svuotato appare come una struttura tubolare rossastra quando è sospeso nel mezzo.
- Sciogliere il midollo osseo pipettandolo delicatamente su e giù ripetutamente utilizzando un puntale per pipette da 1 ml. Utilizzare un portapipette a batteria dotato di una pipetta da 50 mL per filtrare la sospensione cellulare attraverso un colino cellulare da 100 μm nella provetta di plastica da 50 mL e centrifugarla a 350 x g per 5 minuti a RT.
- Rimuovere il surnatante, risospendere il pellet in 10 mL di tampone di lisi di globuli rossi (RBC) e centrifugare nuovamente a 350 x g per 10 minuti a temperatura ambiente.
- Risospendere il pellet in 5 mL di terreno di coltura macrofagica (DMEM/F12 + 10% FBS + 1% penicillina/streptomicina + 1% amfotericina + 1% aminoacidi non essenziali) e seminarlo in piastre di Petri non trattate con un diametro di 100 mm (5-8 x 106 cellule per piatto).
- Dopo 4 ore, aggiungere 5 mL di terreno di coltura macrofagica integrato con 40 ng/mL di fattore stimolante le colonie di macrofagi (m-CSF) al terreno di coltura cellulare senza m-CSF (miscela 1:1) per ottenere una concentrazione finale di 20 ng/mL m-CSF.
- Dopo 6 giorni, utilizzare le cellule negli esperimenti o congelarle fino a un ulteriore utilizzo. Utilizzare una soluzione di distacco cellulare diversa dalla tripsina (Tabella dei materiali) per rimuovere le cellule dalla plastica della coltura tissutale.
NOTA: Una volta isolate, le cellule non si espandono più. I metodi di isolamento cellulare qui descritti funzionano anche con topi e ratti al di fuori della fascia di età indicata.
- Per verificare il fenotipo delle popolazioni cellulari isolate con la citometria a flusso, continuare con il passaggio 6.3.4.
2. Isolamento del collagene da ratti Wistar o Sprague-Dawley
- Seguire il protocollo di isolamento descritto in dettaglio altrove86. Funziona anche con i topi, anche se con una resa molto più bassa.
- Determinare la concentrazione della soluzione risultante con un saggio di idrossiprolina, valutarne la purezza con SDS-page e conservare la soluzione a 4 °C fino all'utilizzo negli esperimenti.
3. Produzione dei componenti del sistema di coltura
- Stampa in 3D i supporti dei morsetti, la stazione di montaggio e gli stampi della camera.
- Caricare il file .stl allegato (file supplementare 1) per i supporti dei morsetti, la stazione di montaggio e gli stampi della camera nel software di affettatura. Per adattare i numeri degli oggetti in base alle esigenze, utilizzare punta e clicca per selezionare gli oggetti e copiare e incollare per moltiplicarli.
- Premere Esporta codice G (Ctrl-R) per generare il codice G, quindi esportarlo (Ctrl-G).
- Carica il codice G in una stampante 3D.
- Utilizzare filamenti non colorati e biocompatibili per il processo di stampa (ad esempio, acido polilattico).
- Tagliare filettature da 3 mm nei fori del supporto del morsetto che trasporterà le viti utilizzando un tagliafilo (File supplementare 2 e File supplementare 3, fori 1 e 3).
- Inserire le spine di centraggio in acciaio inossidabile nel foro sul retro del supporto del morsetto (File supplementare 2 e File supplementare 3, foro 4).
- Sterilizzare i supporti dei morsetti e la stazione di montaggio con luce UV per almeno 1 ora prima dell'uso. Non riutilizzare i supporti per morsetti stampati in 3D.
- In alternativa, produrre i supporti dei morsetti e la stazione di montaggio con polieterimmide utilizzando i piani allegati (File supplementare 2, File supplementare 3 e File supplementare 4), che è più costoso ma consente metodi di sterilizzazione migliori (ad esempio, sterilizzazione in autoclave) e un uso ripetuto.
- Fondere le camere utilizzando gli stampi stampati in 3D.
- Riempire gli stampi della camera con silicone.
- Degassare il silicone in una camera a vuoto (90 mbar) per 30 min.
- Lasciare polimerizzare la soluzione a RT per una notte o su una piastra a 70 °C per 1 ora, a seconda della resistenza al calore dei filamenti utilizzati per gli stampi.
- Rimuovere con cautela le camere polimerizzate dagli stampi e tagliare via il silicone superfluo con un bisturi (n. 21).
- OPZIONALE: Se gli assiemi e, quindi, le camere circostanti devono essere caricati meccanicamente, rinforzare i fori nelle camere in silicone con tubi cavi in acciaio inossidabile.
- Lavorare i morsetti metallici in acciaio inossidabile utilizzando il piano allegato (File supplementare 5).
- Prima di ogni utilizzo, lavare i morsetti in acciaio inossidabile, i supporti dei morsetti in polieterimmide, le viti e la camera in silicone.
- Sonicare per 10 minuti in etanolo all'80% (EtOH) e acqua ad osmosi inversa al 20% (ROW).
- Sonicare per 10 minuti in 50% EtOH e 50% Isopropanolo.
- Risciacquare 3 volte con ROW.
- Sonicare per 10 minuti in un concentrato detergente alcalino allo 0,5% (cioè 3 mL in 600 mL di ROW).
- Sonicare per 10 minuti in un concentrato detergente alcalino allo 0,5%.
- Lasciare agire in un concentrato detergente alcalino allo 0,5% agitando per 1 ora e 50 min.
- Risciacquare 3 volte con ROW.
- Sonicare per 10 minuti di fila.
- Asciugare i componenti all'aria e sterilizzarli in autoclave.
4. Bloccaggio degli espianti del nucleo
- Posizionare i supporti per morsetti corrispondenti insieme a un morsetto metallico ciascuno nella stazione di montaggio.
- Posizionare dei pezzi di carta autoclavata bagnati (4 mm x 25 mm) sopra le pinze metalliche e poi tagliare la carta lungo i bordi interni delle pinze con un bisturi (n. 21). Taglia altri 2 pezzi di carta più piccoli (4 mm x 1,5 mm) da un altro pezzo di carta e mantienili umidi.
- Usando una pinzetta appuntita, posizionare 8 espianti di anime sulla carta tra i morsetti metallici con i loro punti finali sui morsetti metallici.
- Coprire le estremità degli espianti di anime con i pezzi di carta più piccoli (4 mm x 1,5 mm) pronti e quindi posizionare dei morsetti metallici sopra di essi. Utilizzare un cacciavite e le piccole viti (M3 x 6 mm) per fissare gli espianti del nucleo tra i morsetti metallici e il supporto del morsetto.
- Trasferire con cautela gli espianti del nucleo bloccato nelle camere di coltura in silicone e riempirle con 2 mL di terreno di coltura cellulare standard (DMEM/F12 + 10% FBS + 1% penicillina/streptomicina + 1% amfotericina + 1% aminoacidi non essenziali).
- OPZIONALE: Se gli assiemi o le camere circostanti devono essere caricati meccanicamente, fissarli con viti aggiuntive (M3 x 16 mm) nel foro 3 (File supplementare 2 e File supplementare 3, foro 3).
5. Preparazione e colata dell'idrogel di collagene
- Rimuovere le cellule bersaglio dalla plastica di coltura tissutale con una soluzione di distacco cellulare, centrifugarle a 400 x g per 5 minuti a RT e risospenderle in 1 mL di terreno di coltura standard.
- Per un assembloide, sono necessari 10 μL di PBS (20x), 1,28 μL di NaOH 1 M (125x), 8,72 μL di acqua bidistillata (ddH2O, 23x), 80 μL di collagene-1 (2,5x o 1,6 mg/mL finale) e 100 μL (2x) di terreni di coltura standard (per assemloidi privi di cellule //nucleo) o sospensione cellulare. Preparare questi componenti in due soluzioni separate e mescolarli solo immediatamente prima della colata.
- Soluzione reticolante: raggruppare il PBS, il NaOH, il ddH20 e la sospensione cellulare di un massimo di 12 assemloidi (+10% di margine di sicurezza) in una soluzione reticolante e conservarla in una provetta di plastica da 15 mL su ghiaccio. Regolare la concentrazione della sospensione cellulare per ottenere le seguenti concentrazioni finali dopo aver miscelato le due soluzioni: 250.000 cellule/mL di fibroblasti tendinei, 500.000 cellule/mL di cellule endoteliali derivate dai muscoli o 370.000 cellule/mL di macrofagi derivati dal midollo osseo.
- Soluzione di collagene-1: Raggruppare la soluzione di collagene-1 necessaria per un massimo di 12 assembramenti (+10% di margine di sicurezza) in un'altra provetta di plastica da 15 ml e tenerla in ghiaccio.
- Una volta che la soluzione reticolante e la soluzione di collagene-1 sono pronte sul ghiaccio, aspirare il terreno di coltura cellulare dalle camere di coltura contenenti gli espianti del nucleo bloccato.
- Aggiungere la soluzione di collagene-1 alla soluzione reticolante con una pipetta da 1000 μL e miscelare le due soluzioni pipettando rapidamente su e giù senza creare bolle. Coprire i singoli espianti del nucleo tendineo con 200 μL della soluzione miscelata pipettandola nelle scanalature fornite dalle camere in silicone.
- Lasciare polimerizzare gli idrogel per 50 minuti a 37 °C.
- Riempire con cura le camere di coltura in silicone con 1,5 mL del rispettivo terreno di co-coltura pipettandolo negli angoli delle camere.
- Per la co-coltura di fibroblasti di base, riempire DMEM/F12, 10% FBS, 1% aminoacidi non essenziali, 1% penicillina/streptomicina, 1% amfotericina, 200 μM di acido L-ascorbico, 20 ng/mL di fattore stimolante le colonie di macrofagi.
- Per la cocoltura di nucleo// macrofagi, riempire DMEM/F12, 10% FBS, 1% aminoacidi non essenziali, 1% penicillina/streptomicina, 1% amfotericina, 200 μM di acido L-ascorbico, 20 ng/mL di fattore stimolante le colonie di macrofagi.
- Per la co-coltura di cellule endoteliali di base, riempire una miscela 1:1 di DMEM/F12 e il kit endopan 3 + 10 U/mL di eparina + 20% FBS + 1% penicillina/streptomicina + 1% amfotericina + 30 mg/mL di integratore per la crescita endoteliale.
- Coltura gli assembloidi nelle condizioni della coltura adatte per l'ipotesi. Per simulare un ambiente di nicchia simile a una lesione, ad esempio, coltivarli a 37 °C e al 20% di O2 . Cambiare il terreno di coltura due volte in 1 settimana. Per prevenire le infezioni, mettere le camere in una grande capsula di Petri o in una scatola sterile prima di metterle in un'incubatrice.
NOTA: il tempo di coltura dipende dall'ipotesi e dalla configurazione della co-coltura. Ad esempio, gli assembloidi di fibroblasti in un ambiente di nicchia simile a una lesione diventano meccanicamente instabili dopo circa 3 settimane.
6. Metodi di lettura disponibili
- Eseguire la microscopia a fluorescenza, compresi i saggi di vitalità e morfologia.
- In generale, gli assiemi possono essere visualizzati come montaggi completi. Per fare ciò, rimuovere gli asimbloidi dai morsetti tagliandoli con le forbici vicino ai morsetti e trasferendoli su una piastra a 12 pozzetti.
- Lavare i sembloidi una volta con PBS.
- Se viene eseguita un'analisi di vitalità, colorare ciascun assieme con 100 μL di 4 x 10−6 M omodimero di etidio in PBS (EthD-1) per 20 minuti a 37 °C al buio.
- Lavare i sembloidi 3 volte con PBS, quindi fissarli con 500 μL di formaldeide al 4% ciascuno per 20 minuti a RT.
ATTENZIONE: La formaldeide al 4% ha effetti allergenici, cancerogeni e mutageni, è tossica per la riproduzione e può causare tossicità per lo sviluppo (tossica per la riproduzione) o danni agli organi. Indossare indumenti e guanti protettivi, protezione per gli occhi e maschera o altra protezione respiratoria. - Lavare gli assembloidi 3 volte con PBS e continuare con il protocollo di colorazione scelto. Una selezione di colorazioni è stata descritta in precedenza 84,85.
NOTA: Evitare colorazioni che utilizzano fluorofori con una lunghezza d'onda di emissione vicina a quella dell'autofluorescenza del collagene (circa 480 nm).
- Secondo le istruzioni del produttore, eseguire l'isolamento dell'RNA specifico per compartimento per la RT-qPCR o il sequenziamento dell'RNA a livello di genoma.
- Rimuovere gli assembloidi dai morsetti con le forbici.
- OPZIONALE: Utilizzare una pinzetta per separare gli espianti del nucleo dal compartimento estrinseco dell'idrogel.
- Pool 20-24 espianti di nuclei da 20 mm o 2 idrogel di collagene carichi di cellule per isolare quantità sufficienti di RNA.
- Utilizzare 1 mL di trizolo freddo e disgregazione meccanica (ad esempio, perle metalliche o macinazione criogenica) per distruggere la matrice extracellulare degli espianti del nucleo in pool o degli idrogel di collagene in pool.
ATTENZIONE: Tossicità orale, cutanea e inalatoria. Provoca irritazione della pelle e degli occhi. Maneggiare solo con guanti e in un armadio di sicurezza chimica. - Continuare con l'isolamento dell'RNA dal lisato cellulare utilizzando kit standard di estrazione dell'RNA come descritto in precedenza o come descritto nelle istruzioni del produttore84,85.
- Citometria a flusso compartimentale specifica.
- Rimuovere gli assembloidi dai morsetti con le forbici.
- OPZIONALE: Utilizzare le pinzette per separare gli espianti del nucleo dal compartimento estrinseco dell'idrogel.
- Digerire i compartimenti in 1 mL di PBS con collagenasi I (3 mg/mL) e dispasi II (4 mg/mL) per 4 ore a 37 °C sotto agitazione costante.
- Centrifugare la soluzione digerita a 500 x g per 5 minuti a RT e aspirare il surnatante.
- Risospendere il pellet in 100 μL di tampone FACS (1% FBS in PBS) contenente gli anticorpi coniugati con fluorofori di scelta. Una selezione di anticorpi funzionanti coniugati con fluorofori è stata descritta in precedenza 84,85.
- Incubare la soluzione colorante per 30 minuti a RT.
- Diluire la soluzione colorante con 1,4 mL di tampone FACS e centrifugarla per 5 minuti a 500 x g a RT.
- Risospendere il pellet in 350 μL di tampone FACS e filtrare la soluzione attraverso un tappo filtrante in rete di nylon da 100 μm prima di analizzarla con il citometro a flusso scelto secondo le istruzioni del produttore.
- Analizzare il surnatante.
- Sostituire il terreno di co-coltura con terreno di co-coltura privo di siero 3 giorni prima della raccolta del surnatante.
- Eseguire l'analisi immediata e differita del surnatante arricchito e non diluito con i kit di saggio di immunoassorbimento enzimatico (ELISA) e di scoperta su scala meso (MSD). Per l'analisi ritardata, conservare il surnatante in provette di plastica da 1,5 mL a -80 °C.
- Valutare le proprietà meccaniche dell'assemblaggio.
- Utilizzare un dispositivo di allungamento su misura per applicare forze meccaniche e misurare le proprietà meccaniche22. I perni di centraggio in acciaio inossidabile e le viti in acciaio inossidabile rendono i morsetti collegabili anche ad altri dispositivi di allungamento.
- Poiché le proprietà meccaniche dell'assillo sono in gran parte determinate da quelle dell'espianto del nucleo incorporato 18, misurare le proprietà meccaniche dell'espianto del nucleo prima di incorporarlo in un idrogel per ridurre il rischio di distruggere l'idrogel appena colato nel processo di misurazione.
Risultati
Isolamento dei componenti (Figura 1 e Figura 2)
Prima di utilizzare gli espianti di base e le popolazioni cellulari in co-coltura di assemblaggio, questi componenti devono essere controllati al microscopio (Figura 1). Gli espianti del nucleo devono avere un diametro uniforme (100-200 μm) e non presentare pieghe o rughe visibili. Le cellule endoteliali dovrebbero presentare una forma allungata a contatto con altre cellule, cosa che non fanno quando vengono seminate a una densità troppo bassa a causa di una bassa resa iniziale dall'isolamento. In questo caso, le cellule endoteliali assumono una forma più tondeggiante con estensioni citoscheletriche e proliferano notevolmente più lentamente. Dividili 1:5 dopo 7-10 giorni. I fibroblasti tendinei isolati dai tendini d'Achille assumono una morfologia più tondeggiante rispetto alle loro controparti umane entro 1-2 passaggi (10-14 giorni ciascuno) quando sono stati divisi 1:6. I macrofagi sono molto più piccoli dei fibroblasti o delle cellule endoteliali e non proliferano dopo l'isolamento. A seconda del lotto, la loro forma può variare da piramidale a rotonda.
I fenotipi dei componenti cellulari sono stati verificati con citometria a flusso. Un anticorpo CD31 coniugato è stato utilizzato come marcatore per le cellule endoteliali (Figura 2A). Impostando la soglia di fluorescenza sulla base di un campione di controllo non colorato (grigio), il 90,1% delle cellule endoteliali del passaggio 1 (P1) e il 48,7% delle cellule endoteliali del passaggio 2 (P2) sono state identificate come CD31-positive. Per caratterizzare i fibroblasti tendinei (Figura 2B) è stata utilizzata una linea murina geneticamente modificata che co-esprimeva il marcatore dei fibroblasti tendinei Scleraxis insieme a una proteina fluorescente verde (ScxGFP) e a un anticorpo CD146 coniugato (Figura 2B)35,60. Dopo un passaggio (P1), il 37,3% dei fibroblasti era ScxGFP+CD146-, lo 0,2% era ScxGFP+CD146+, il 4,3% era ScxGFP-CD146+ e il 58% era ScxGFP-CD146-. Dopo due passaggi (P2), la percentuale di cellule ScxGFP+CD146- è scesa al 27,6%, la percentuale di cellule ScxGFP+CD146+ è aumentata al 6,9%, la percentuale di cellule ScxGFP-CD146+ è aumentata al 10,6% e la percentuale di cellule ScxGFP-CD146- è diminuita al 54,9%. Per identificare e caratterizzare i macrofagi, è stato utilizzato un anticorpo F4/80 in combinazione con un anticorpo CD86 e un anticorpo CD206 (Figura 2C). Dopo l'isolamento e la coltura, il 96,4% delle cellule derivate dal midollo osseo era F4/80-positivo. Tra queste cellule F4/80-positive, l'8,6% era CD206+CD86-, il 23,6% era CD206+CD86+, il 28,3% era CD206-CD86+ e il 39,4% era CD206-CD86-. La velocità di reticolazione del collagene può variare da lotto a lotto e deve essere testata prima di iniziare gli esperimenti.
Aspetto dell'assiembioide (Figura 3)
In condizioni di coltura simili a lesioni (36 °C, 20% O2 ), l'espianto del nucleo è rimasto elastico meccanicamente, non è cambiato nell'aspetto e ha continuato ad essere visivamente distinguibile e fisicamente separabile dall'idrogel circostante per almeno 21 giorni (Figura 3A, B). L'idrogel circostante è stato compattato nel tempo, con la velocità di compattazione che dipendeva dalla popolazione cellulare seminata al suo interno. I fibroblasti derivati dal tendine d'Achille hanno contratto l'idrogel circostante più velocemente e lo hanno fatto radialmente quando si trovavano in un idrogel fuso attorno a un espianto del nucleo e in tutte le direzioni quando non lo facevano (Figura 3B,C). Inizialmente, anche gli idrogel privi di cellule posti attorno a un espianto di nucleo si sono compattati. Questa contrazione è stata probabilmente causata dalla migrazione delle cellule dall'espianto del nucleo, indicando un'interfaccia intercompartimentale dinamica. Poiché gli idrogel privi di cellule senza un espianto di nucleo incorporato non si sono compattati in modo rilevabile, il contributo del restringimento indotto dalla perdita d'acqua sembra essere trascurabile (Figura 3B e Scheda supplementare 6).
La mancanza di compattazione dell'idrogel può, quindi, essere utilizzata per rilevare errori nell'assemblaggio dell'assiembioide (cioè basse concentrazioni cellulari) e dovrebbe essere verificata prima di continuare con metodi di lettura più costosi. Durante la definizione di questo metodo, gli errori comuni che riducono la concentrazione cellulare includevano la morte delle cellule nell'idrogel estrinseco perché erano state lasciate troppo a lungo nella soluzione di reticolazione relativamente dura (pH elevato, bassa temperatura) e l'essiccazione degli espianti del nucleo perché il tempo tra l'aspirazione media e l'iniezione dell'idrogel era troppo lungo, o perché l'espianto del nucleo era bloccato troppo in alto per essere incorporato nel collagene.
Microscopia a fluorescenza confocale: analisi di vitalità e morfologia (Figura 3)
Una volta rimossi dai morsetti con le forbici (Figura 3B), gli assiemi possono essere fissati, colorati e ripresi con un microscopio confocale nel loro insieme senza sezionamento. Qui, gli assembloidi di cellula endoteliale del nucleo, del nucleo di // macrofagi e di nucleo // di fibroblasti sono stati colorati con DAPI (NucBlue) e Etidio Homodimer (EthD-1) per analizzare la vitalità e DAPI e F-actina per analizzare la morfologia e la diffusione cellulare nell'idrogel di collagene 3D (Figura 3D). La vitalità degli assembloidi delle cellule endoteliali del core (Figura 3E) è stata quantificata ed è risultata generalmente inferiore dopo l'assemblaggio dell'assembloide rispetto a quanto precedentemente riportato per gli assembloidi del core // dei macrofagi e del core // dei fibroblasti84. Tuttavia, la vitalità è rimasta stabile durante la coltura dell'assembloide almeno fino al giorno 7.
Microdanneggiamento indotto meccanicamente e misurazione delle proprietà meccaniche (Figura 4)
Le viti e i perni fissati ai supporti dei morsetti consentono il fissaggio dei gruppi bloccati ai dispositivi di allungamento uniassiale. Il dispositivo di allungamento su misura utilizzato in questo caso è dotato di una cella di carico da 10 N ed è stato descritto in pubblicazioni precedenti (Figura 4A)22. Tutti i campioni sono stati pre-condizionati con cinque cicli di allungamento all'1% di deformazione prima delle misurazioni.
La registrazione dell'intera curva sforzo-deformazione di espianti o assiloidi del nucleo (Figura 4B) consentirebbe di quantificare il modulo elastico lineare (α), la sollecitazione massima (β) e la deformazione massima (у). Tuttavia, danneggia anche irreversibilmente l'espianto del nucleo o l'assemblaggio, il che rende impossibile valutare lo sviluppo longitudinale della sollecitazione massima (β) e della deformazione massima (у) per gli stessi campioni (Figura 4B). In questo caso, il modulo elastico lineare è stato utilizzato come misura della capacità del campione di resistere alle forze, poiché questa misurazione richiede l'allungamento del campione a solo il 2% di deformazione, che è stato dimostrato in precedenza non causare riduzioni permanenti del modulo elastico lineare18. In particolare, gli assembloidi delle cellule endoteliali del nucleo sono stati esposti alla procedura di serraggio a una deformazione del 2% (approssimativamente la fine della regione elastica lineare) o del 6% (approssimativamente la deformazione massima). Il microdanno risultante è stato valutato misurando il modulo elastico lineare prima e dopo la procedura (Figura 4C).
In linea con gli esperimenti precedentemente condotti che sfruttavano espianti di core mono-colturati, gli assembloidi di cellule endoteliali hanno mantenuto il loro modulo elastico lineare per almeno 14 giorni quando coltivati in condizioni di nicchia quasi-omeostatiche (29 °C, 3% O2 ) ed esposti a ceppi non superiori al 2%18,21. Per quanto riguarda la stimolazione meccanica di base, l'allungamento statico applicato attraverso le pinze sembrava imitare sufficientemente i livelli di deformazione nativa sperimentati dalle unità del nucleo tendineo in vivo per prevenire i processi catabolici generalmente associati allo scarico della matrice87. Infatti, il declino progressivo e statisticamente significativo del modulo elastico lineare osservato negli assembloidi di cellule endoteliali del nucleo esposti a una deformazione del 6% potrebbe essere attribuito allo scarico della matrice derivante dal microdanno della matrice indotto meccanicamente.
Quando si eseguono questi esperimenti, è importante evitare che l'assiduo si secchi. In questo caso, sono stati racchiusi in carta sterilizzata in autoclave e bagnata, ma potrebbero essere praticati anche altri metodi a seconda della loro compatibilità con il dispositivo di allungamento utilizzato. Poiché l'attrito tra i morsetti metallici e l'espianto dell'anima è limitato, aggiungere piccoli pezzi di carta tra il metallo e l'espianto dell'anima durante il bloccaggio per evitare lo slittamento e monitorare attentamente il processo di allungamento per rilevare ed escludere espianti e assemblaggi dell'anima scivolati.
Analisi del trascrittoma compartimentale specifico e del secretoma specifico dell'assembloide (Figura 5 e Figura 6)
Nella prima serie di esperimenti di monocoltura di base qui presentati, è stata valutata la stabilità dell'espressione genica di base dopo l'isolamento dell'espianto per disaccoppiare l'isolamento dagli effetti sperimentali (Figura 5A). Sebbene sia necessario un numero di replicazioni più elevato per conclusioni precise, l'espressione di Vegfa e Mmps è aumentata fortemente negli espianti di nuclei appena isolati entro poche ore dall'isolamento dell'espianto, quando coltivati in condizioni di nicchia simili a lesioni (37 °C, 20% O2 ).
La neovascolarizzazione è un segno distintivo centrale della malattia e della riparazione tendinea che potrebbe, in parte, essere guidata da cellule endoteliali attivate da fattori pro-angiogenici (ad esempio, il fattore di crescita endoteliale vascolare, Vegfa) secreti dal nucleo tendineo in ipossia88. Esaminando la prima fase di questo potenziale crosstalk (Figura 5B), l'espressione sia di Vegfa che del marcatore di ipossia anidrasi carbonica 9 (Ca9) è risultata aumentare statisticamente significativa negli espianti monocolturati a bassa tensione di ossigeno (3% O2 ) rispetto a quelli monocolturati ad alta tensione di ossigeno (20% O2). Nel frattempo, la minore tensione dell'ossigeno non sembra causare cambiamenti nell'espressione dei marcatori dei fibroblasti tendinei come la sclerassi (Scx) e il collagene-1 (Col1a1). Insieme, questi risultati identificano le cellule core-residenti come contributori plausibili alla segnalazione pro-angiogenica in una nicchia ipossica.
Successivamente, l'attivazione delle cellule endoteliali da parte della segnalazione del core pro-angiogenico è stata valutata in co-coltura di cellule endoteliali in condizioni di tensione di ossigeno alta (20% O2 ) e bassa (3% O2 ). Fortunatamente, la composizione modulare degli assembloidi consente l'analisi del trascrittoma compartimentale dopo la coltura, separando fisicamente l'espianto centrale dall'idrogel di collagene estrinseco (Figura 6A). Nell'espianto del nucleo (Figura 6D), è stato nuovamente confermato che l'espressione di Vegfa aumenta in condizioni di bassa tensione dell'ossigeno, sebbene l'effetto su altri marcatori ipossici come Fgf2 sia stato meno chiaro e richieda un numero di replicazioni più elevato per conclusioni precise. Inoltre, l'espressione di marcatori pro-infiammatori come Tnf-α e marcatori per la degradazione della matrice extracellulare come Mmp3 sono diminuiti nel nucleo in condizioni di bassa tensione di ossigeno. Nell'idrogel estrinseco inizialmente seminato con cellule endoteliali (Figura 6E), la presenza di un espianto di nucleo vivo (aC) ha diminuito l'espressione di Vegfa in condizioni di bassa tensione di ossigeno, ma non in presenza di un'elevata tensione di ossigeno. Inoltre, la presenza di un espianto di nucleo devitalizzato (dC) a bassa tensione di ossigeno non ha diminuito l'espressione di Vegfa . In condizioni di bassa tensione dell'ossigeno, l'espressione di Tnf-α nell'idrogel estrinseco era paragonabile intorno a aC/dC, ma aumentava in presenza di un'elevata tensione di ossigeno intorno agli espianti del nucleo vivo. L'espressione di Fgf2 è diminuita in tutte le condizioni rispetto all'idrogel estrinseco carico di cellule endoteliali coltivato attorno a un espianto di nucleo devitalizzato ad alta tensione di ossigeno, ma la maggior parte a bassa tensione di ossigeno. L'espressione di Mmp3 era più alta intorno agli espianti di nuclei vivi in condizioni di alta tensione di ossigeno e più bassa intorno agli espianti di nuclei devitalizzati in condizioni di bassa tensione di ossigeno. Nel complesso, le cellule endoteliali co-coltivate sembrano rispondere sia all'espianto attivo del nucleo, che è in grado di avviare diafonia, sia alle variazioni dei livelli di ossigeno. Un'analisi più completa del trascrittoma faciliterebbe la delucidazione dei rispettivi contributi.
La modularità del sistema assembleroide consente l'integrazione di cellule geneticamente modificate contenenti geni reporter fluorescenti. Qui, le cellule endoteliali isolate dai topi Pdgfb-iCreER mG89 sono state seminate nel compartimento dell'idrogel. Queste cellule co-esprimono la subunità b (Pdgfb) del fattore di crescita derivato dalle piastrine marcatore delle cellule endoteliali insieme alla proteina fluorescente verde potenziata (EGFP), che fa apparire le cellule endoteliali che esprimono Pdgfb verdi al microscopio (Figura 6C). Utilizzando questo metodo, è stato confermato che la presenza di cellule endoteliali esprimenti Pdgfb è stata mantenuta per 7 giorni in coltura (37 °C) e sembrava essere indipendente dalla tensione dell'ossigeno (20% O2 rispetto al 3% O2 ).
Per analizzare il secretoma degli assebloidi, il terreno di coltura utilizzato rispettivamente per la co-coltura di cellule // nucleo // fibroblasti, nucleo // macrofago o nucleo // cellule endoteliali è stato sostituito con la sua controparte priva di siero tre giorni prima di aspirare e congelare il surnatante ora arricchito con il secretoma (Figura 6A). Questo tempo di arricchimento è stato sufficiente per rilevare citochine come il fattore di crescita dell'endotelio vascolare (VEGF) con un test MSD, come mostrato qui per gli espianti del nucleo e gli assembloidi del nucleo // fibroblasti coltivati in condizioni di nicchia simili a lesioni (Figura 6B).
Considerazioni importanti quando si analizzano i secretomi e i trascrittomi degli espianti e degli assembloidi riguardano l'uso di controlli adeguati. Gli espianti di noccioli appena isolati hanno un valore limitato, in quanto in particolare la loro espressione di Vegfa e Mmps aumenta fortemente entro poche ore dall'isolamento (Figura 5A). Gli espianti appaiati nel tempo circondati da un idrogel inizialmente privo di cellule sono più adatti come controlli per l'espressione genica del compartimento centrale. Per l'idrogel estrinseco, gli idrogel carichi di cellule coltivati senza un espianto di nucleo sono controlli inferiori rispetto agli idrogel carichi di cellule coltivati attorno a espianti di nucleo devitalizzati (File supplementare 7), principalmente perché si compattano in forme tondeggianti invece di idrogel allungati che modificano notevolmente la morfologia cellulare (Figura 3A).
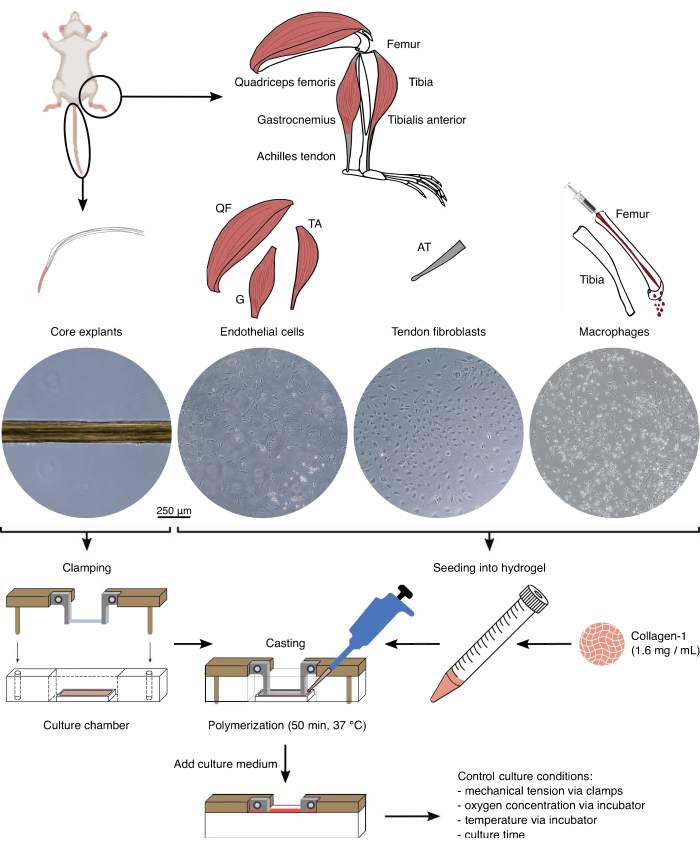
Figura 1: Isolamento e assemblaggio di componenti assemblati per modellare la diafonia in vivo . Gli espianti del nucleo tendineo sono stati estratti dalle code dei topi, tagliati e bloccati. I muscoli delle gambe di topo (cioè quadricipite femorale (QF), gastrocnemio (G) e tibiale anteriore (TA)) sono stati digeriti per isolare le cellule endoteliali che sono state poi coltivate su plastica di coltura tissutale. Anche i tendini d'Achille (AT) sono stati digeriti per isolare i fibroblasti tendinei, che sono stati poi coltivati su plastica per colture tissutali. Il midollo osseo della tibia e del femore è stato espulso dalle ossa. Quindi, i monociti isolati sono stati coltivati su plastica di coltura tissutale e differenziati in macrofagi naïve. Le immagini al microscopio ottico (10x) mostrano l'aspetto degli espianti del nucleo, delle cellule endoteliali, dei fibroblasti tendinei e dei macrofagi immediatamente prima della loro integrazione negli assebloidi. Durante l'assemblaggio, le cellule coltivate su plastica sono state messe in sospensione e poi seminate in una soluzione di collagene-1 (1,6 mg/mL). Quindi, la miscela cellula-idrogel è stata colata attorno all'espianto del nucleo bloccato e polimerizzata per 50 minuti a 37 °C prima di aggiungere il terreno di coltura. Le condizioni di coltura sono state controllate tramite le pinze (tensione meccanica) e le impostazioni dell'incubatore (concentrazione di ossigeno, temperatura). Fare clic qui per visualizzare una versione più grande di questa figura.
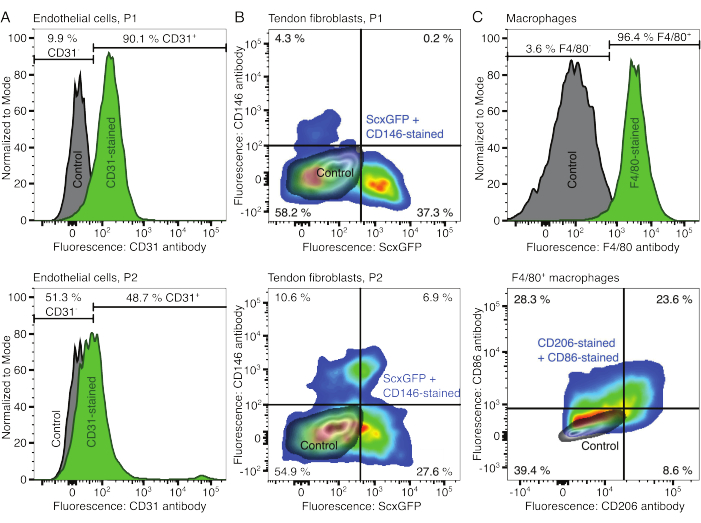
Figura 2: Caratterizzazione dei componenti dell'assemblaggio cellulare. (A) Analisi citofluorimetrica rappresentativa di cellule endoteliali derivate dal muscolo dopo un passaggio (P1, riga superiore) e due passaggi (P2, riga inferiore). La conta per le cellule non colorate (grigie) e CD31 colorate (verde) è stata normalizzata a modale. Le percentuali sono indicate per il gruppo colorato con CD31. (B) Analisi citofluorimetrica rappresentativa di fibroblasti derivati dal tendine d'Achille dopo un passaggio (P1, fila superiore) e due passaggi (P2, riga inferiore). Gli assi riportano l'intensità di fluorescenza delle cellule non colorate (grigie) e delle cellule che esprimono sia ScxGFP che colorate con anticorpi CD146 (colori arcobaleno). (C) Analisi citofluorimetrica rappresentativa dei macrofagi derivati dal midollo osseo dopo coltura. Nella riga superiore, i conteggi per le cellule non colorate (grigie) e F4/80 colorate (verdi) sono stati normalizzati in modale. Le percentuali sono indicate per il gruppo colorato F4/80. Il grafico nella riga inferiore riporta le intensità di fluorescenza delle cellule non colorate (grigio) e il sottogruppo F4/80+ delle cellule colorate con anticorpi CD206 e anticorpi CD86 (colori arcobaleno). Fare clic qui per visualizzare una versione più grande di questa figura.
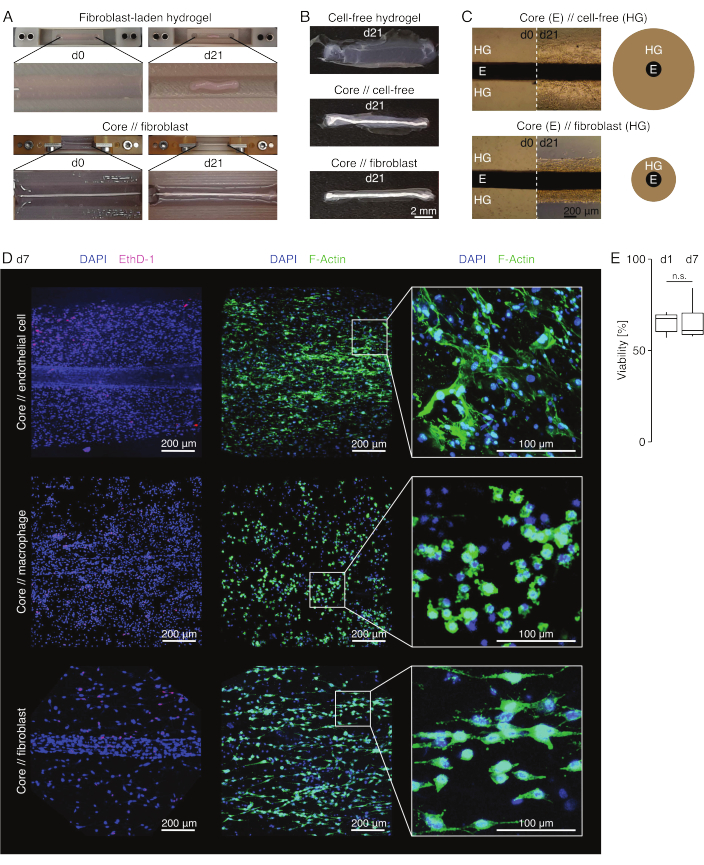
Figura 3: Imaging e aspetto dell'assembloide. (A) Fotografie rappresentative scattate al giorno 0 (d0) e al giorno 21 (d21) della coltura (37 °C, 20% O2 ) mostrano una contrazione multidimensionale di un idrogel contenente fibroblasti estrinseci senza un espianto del nucleo incorporato e una forte compattazione radiale di un idrogel contenente fibroblasti estrinseci attorno a un espianto del nucleo. (B) Fotografie rappresentative scattate al giorno 21 (d21) di coltura (37 °C, 20% O2 ) mostrano differenze nella velocità di compattazione tra idrogel privi di cellule, idrogel privi di cellule gettati attorno a un espianto di nucleo e idrogel carichi di fibroblasti tendinei fusi attorno a un espianto di nucleo. (C) Le immagini rappresentative al microscopio ottico (10x) prese al giorno 0 (d0) e al giorno 21 (d21) di coltura (37 °C, 20% O2 ) indicano cambiamenti longitudinali nella presenza di popolazioni cellulari e nella velocità di compattazione dell'idrogel di collagene (HG) attorno all'espianto del nucleo (E) nella co-coltura di assembloidi di fibroblasti privi di cellule e di fibroblasti. La rappresentazione schematica mostra le differenze nella compattazione dell'idrogel tra la co-coltura dell'assilloide // nucleo // senza cellule e la co-coltura dell'assilloide del nucleo // fibroblasti. (D) Immagini rappresentative al microscopio confocale prese al giorno 7 (d7) della co-coltura di cellula endoteliale centrale, nucleo // macrofago e nucleo // co-coltura di assembloidi fibroblasti (37 °C, 20 % O2 ). Le immagini nella riga di sinistra raffigurano assembloidi con nuclei cellulari colorati in blu (DAPI) e cellule morte colorate in rosa (Ethidium homodimer-1). Le altre due righe raffigurano assimbloidi con nuclei cellulari colorati in blu (DAPI) e filamenti di actina in verde (F-actina). (E) Boxplot che descrivono la vitalità quantificata di assiemi di cellule endoteliali al giorno 1 (d1) e al giorno 7 (d7) di co-coltura. N = 5. Le cerniere superiore e inferiore corrispondono al primo e al terzo quartile (25° e 75° percentile) e quella centrale alla mediana. I baffi si estendono dalla cerniera superiore/inferiore al valore più grande/più piccolo non oltre 1,5 volte l'intervallo interquartile. Valori P: n.s.p > 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.
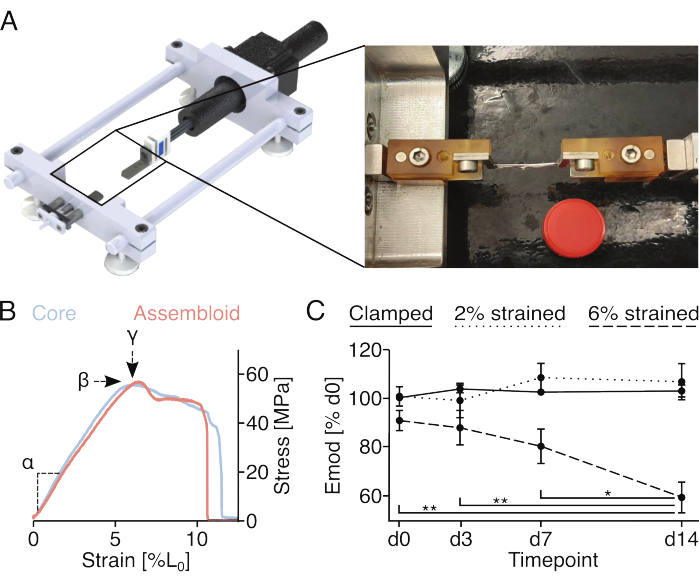
Figura 4: Stimolazione meccanica degli assimbloidi e misurazione delle proprietà meccaniche degli assiebloidi. (A) Rappresentazione grafica del dispositivo di allungamento su misura comprendente le piattaforme di supporto del morsetto, un sensore di forza e un motore passo-passo. L'immagine fotografica mostra un gruppo montato sul dispositivo di allungamento con morsetti. Il coperchio di una provetta di plastica da 15 mL (Ø: 17 mm) utilizzata per la bilancia. (B) Grafico che illustra le curve di sollecitazione/deformazione rappresentative per gli espianti di carote (azzurro) e gli assiebloidi (rosso chiaro). Il modulo elastico lineare (α), la sollecitazione massima (β) e la deformazione massima (у) possono essere estratti dai dati per caratterizzare meccanicamente l'espianto o l'assieme del nucleo. (C) Grafico che mostra il modulo elastico lineare (Emod) degli assembloidi di cellule endoteliali del nucleo co-coltivati (29 °C, 3% O2 ) in un corso di 14 giorni dopo essere stati bloccati (linea continua), bloccati e allungati al 2% di deformazione L0 (linea tratteggiata) o bloccati e allungati al 6% di deformazione L0 (linea tratteggiata) all'inizio dell'esperimento. N = 5. I punti dati sono stati normalizzati al modulo elastico lineare del modulo iniziale prima dell'allungamento e sono tutti visualizzati come media (±sem). Valori P: *p < 0,05, **p < 0,01. Fare clic qui per visualizzare una versione più grande di questa figura.
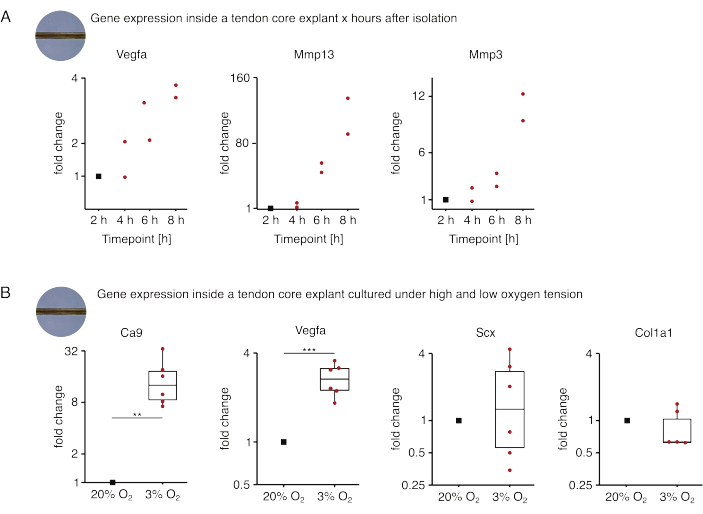
Figura 5: Cambiamenti nel trascrittoma centrale dopo l'isolamento e la coltura in diverse condizioni di nicchia. (A) Grafico a dispersione che mostra i cambiamenti di piega nell'espressione genica di Vegfa, Mmp13 e Mmp3 in espianti di core murini mono-colturati (37 °C, 20% O2 ore) 2 ore, 4 ore, 6 ore e 8 ore dopo averli isolati dalla coda. I cambiamenti di piega nei rispettivi punti temporali sono stati normalizzati all'espressione genica 2 ore dopo l'isolamento. N = 2. (B) Boxplot che descrivono i cambiamenti di piega nell'espressione genica di Ca9, Vegfa, Scx e Col1a1 in espianti di core mono-coltivati a bassa tensione di ossigeno (3% O2 ) normalizzati e confrontati con quelli mono-coltivati ad alta tensione di ossigeno (20% O2 ). N = 5-6. Le cerniere superiore e inferiore dei boxplot corrispondono al primo e al terzo quartile (25° e 75° percentile) e quello centrale alla mediana. I baffi si estendono dalla cerniera superiore/inferiore al valore più grande/più piccolo non oltre 1,5 volte l'intervallo interquartile. I punti dati utilizzati per la normalizzazione sono rappresentati come punti neri e i singoli punti dati come punti rossi. Valori P: **p < 0,01, ***p < 0,001. Fare clic qui per visualizzare una versione più grande di questa figura.
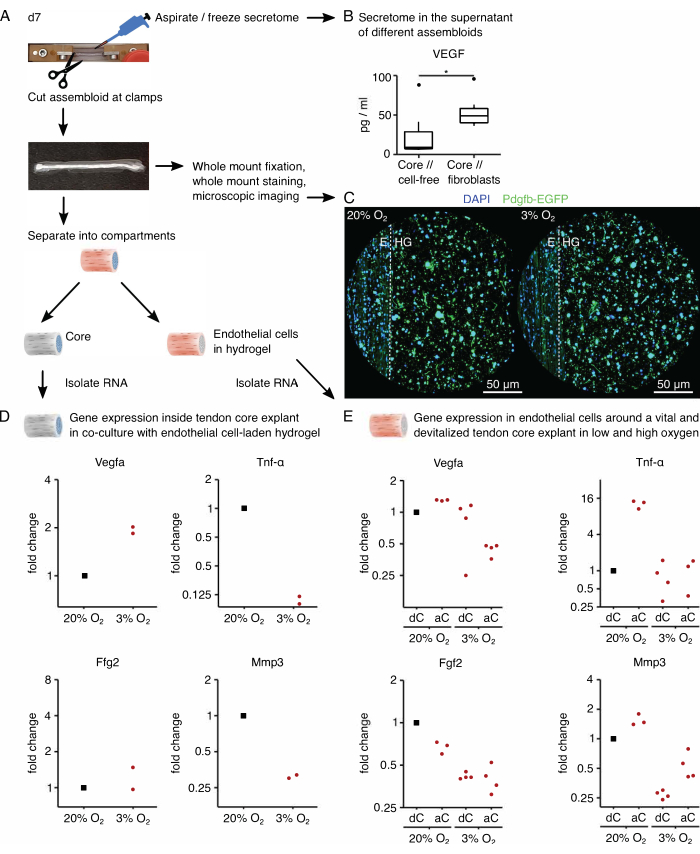
Figura 6: Analisi del secretoma specifico dell'assembloide e del trascrittoma specifico del compartimento. (A) Fotografia rappresentativa che mostra l'assembloide al giorno 7 (d7), quando sono stati prelevati campioni di secretoma e trascrittoma, e rappresentazione del flusso di lavoro sottostante. (B) Concentrazione di VEGF (pg/mL) nel surnatante di assembloidi di fibroblasti core // cell-free e core // dopo 7 giorni di co-coltura (37 °C, 20% O2 ) rappresentati come boxplot. N = 6. (C) Immagini rappresentative al microscopio confocale di assiemi di cellule endoteliali dopo 7 giorni di co-coltura (37 °C) ad alta tensione di ossigeno (20% O2) e bassa tensione di ossigeno (3% O2 ). I nuclei cellulari sono colorati in blu (DAPI) e le cellule endoteliali incorporate co-esprimono la proteina fluorescente verde potenziata (EGFP) insieme alla subunità b del fattore di crescita derivato dalle piastrine marcatore delle cellule endoteliali (Pdgfb). La linea tratteggiata indica l'interfaccia compartimentale tra l'espianto del nucleo (E) e l'idrogel carico di cellule endoteliali (HG). (D) Grafico a dispersione che illustra i cambiamenti di piega nell'espressione genica di Vegfa, Tnf-α, Fgf2 e Mmp3 nel compartimento centrale da assembloidi di cellule endoteliali del nucleo co-coltivate a bassa tensione di ossigeno (3% O2 ) normalizzate e confrontate con quelle coltivate ad alta tensione di ossigeno (20% O2 ). N = 2. (E) Grafico a dispersione che illustra i cambiamenti di piega nell'espressione genica di Vegfa, Tnf-α, Fgf2 e Mmp3 nel compartimento estrinseco di asembloidi di cellule endoteliali con un nucleo vivo (aC) o un nucleo devitalizzato (dC) co-coltivato sotto alta tensione di ossigeno (20% O2 ) e bassa tensione di ossigeno (3% O2). I cambiamenti di piega nelle rispettive condizioni sono stati normalizzati al compartimento estrinseco di un nucleo // assillo di cellula endoteliale con un nucleo devitalizzato (dC) co-coltivato sotto alta tensione di ossigeno (20% O2 ). N = 3-4. In B, le cerniere superiore e inferiore dei boxplot corrispondono al primo e al terzo quartile (25° e 75° percentile) e quello centrale alla mediana. I baffi si estendono dalla cerniera superiore/inferiore al valore più grande/più piccolo non oltre 1,5 volte l'intervallo interquartile. I valori anomali sono rappresentati come punti neri. Valori P: *p < 0,05. In D ed E, i punti dati utilizzati per la normalizzazione sono rappresentati come punti neri e i singoli punti dati sono rappresentati come punti rossi. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Requisiti di input per i sistemi modello di malattie e lesioni tendinee. Un elenco di fattori scatenanti primari e secondari della malattia tendinea abbinati a una selezione di parametri di input la cui trattabilità è fondamentale per modellare la malattia e la lesione tendinea. Clicca qui per scaricare questa tabella.
Tabella 2: Requisiti di output per i sistemi modello di malattie tendinee e lesioni. Una selezione di segni distintivi della malattia tendinea abbinata a una selezione di parametri di output la cui quantificabilità è centrale per l'interpretazione del comportamento del modello di malattia tendinea e lesione. Clicca qui per scaricare questa tabella.
File supplementare 1: file .stl per i portamorsetti, la stazione di montaggio e gli stampi della camera. Fare clic qui per scaricare il file.
File supplementare 2: Schema del supporto del morsetto destro. Fare clic qui per scaricare il file.
File supplementare 3: Schema del supporto del morsetto sinistro. Fare clic qui per scaricare il file.
File supplementare 4: Pianta della piattaforma di montaggio Fare clic qui per scaricare questo file.
Fascicolo supplementare 5: Planimetria dei morsetti metallici. Fare clic qui per scaricare il file.
File supplementare 6: Immagine che mostra il restringimento dell'idrogel senza cellule. Fare clic qui per scaricare il file.
File supplementare 7: Immagine che mostra l'espianto di un nucleo devitalizzato. Fare clic qui per scaricare il file.
Discussione
Nel complesso, il sistema di modelli di assiemi qui presentato presenta diversi passaggi critici da evidenziare. Innanzitutto, il sistema di modelli è buono solo quanto la qualità dei suoi componenti. È fondamentale controllare al microscopio l'espianto del nucleo e le popolazioni di cellule da seminare prima di iniziare il processo di assemblaggio. Allo stesso modo è importante verificare il fenotipo delle popolazioni cellulari isolate almeno una volta con la citometria a flusso. Soprattutto quando un nuovo lotto di collagene-1 viene utilizzato per la prima volta, è vantaggioso controllare la velocità di reticolazione in una prova prima di incorporare le cellule in esso. L'assemblaggio assemblato richiede molta movimentazione manuale, il che aumenta il rischio di infezioni. Per ridurre al minimo il rischio di infezioni, lavorare in una cappa sterile di biosicurezza con flusso d'aria laminare, sostituire spesso i guanti e decontaminare i guanti e lo spazio di lavoro con etanolo all'80%. Per motivi simili, non utilizzare i supporti per morsetti stampati in 3D più di una volta. Prima del processo di incorporazione vero e proprio, è importante mantenere tutti i componenti dell'idrogel (soluzione reticolante, soluzione di collagene-1) sul ghiaccio per evitare una reticolazione prematura. Di conseguenza, è necessario lavorare rapidamente una volta che le cellule sono state aggiunte alla soluzione reticolante per limitare la morte cellulare a causa dell'alto pH e della bassa temperatura della soluzione reticolante. Per prevenire la morte cellulare correlata all'essiccazione nell'espianto del nucleo, aspirare il terreno che copre gli espianti del nucleo bloccati immediatamente prima di mescolare la soluzione reticolante con la soluzione di collagene-1. Per garantire il posizionamento centrale dell'espianto del nucleo all'interno dell'idrogel, è ideale gettare l'idrogel attorno a un espianto del nucleo bloccato e leggermente teso. Per fare ciò, utilizzare la spina di centraggio e la vite a bullone M3 x 16 mm per fissare i supporti del morsetto a un set di piastre (stampate in 3D) con fori alle lunghezze appropriate. Dopo il tempo di polimerizzazione di 50 minuti, l'espianto del nucleo incorporato può essere nuovamente detensionato a seconda delle condizioni di coltura desiderate. La quantità di tensione che l'assiemoloide sperimenta durante la coltura ha un profondo impatto sui risultati sperimentali e deve essere mantenuta uniforme tra i campioni e le condizioni21.
Ciononostante, il grande impatto del (non-)carico meccanico sui risultati sperimentali è uno dei principali vantaggi del modello di assemblaggio rispetto alla maggior parte delle alternative di ingegneria tissutale, soprattutto perché la composizione della matrice mantenuta dell'espianto del nucleo dovrebbe anche ricreare i complessi modelli di carico in vivo a livello cellulare90. Mentre in pratica è stata dimostrata solo la misurazione del modulo elastico lineare, della massima deformazione a trazione e della massima sollecitazione a trazione degli assimbloidi, i protocolli per le misurazioni della resistenza a fatica e del rilassamento delle sollecitazioni sono stati descritti altrove per gli espianti del nucleo tendineo e dovrebbero essere applicabili agli assimbloidi 91,92. Oltre ai modelli di carico simili a quelli in vivo, la modularità multilivello dell'assiembioide è probabilmente il suo più grande vantaggio. Grazie alle singole camere di coltura, è possibile impostare separatamente una serie controllabile di condizioni di nicchia per ciascun campione (ad esempio, temperatura, tensione dell'ossigeno, concentrazione di glucosio, integrazione, stimolatori, inibitori e allungamento statico con una piastra). Successivamente, la rigidità della matrice e la composizione della matrice del compartimento estrinseco sono personalizzabili attraverso la composizione dell'idrogel e, ad esempio, consentirebbero di studiare l'impatto di un microambiente tissutale sempre più malato incorporando più collagene-3 e fibronectina cellulare 93,94,95. Le popolazioni cellulari valutate nel compartimento estrinseco sono facilmente adattabili selezionando quali cellule seminare, ma possono anche essere modificate nell'espianto del nucleo tendineo sfruttando linee cellulari geneticamente modificate consolidate e linee murine (ad esempio, deplezione delle cellule ScxLin)96. La diversa composizione della matrice e delle cellule dei due compartimenti fornisce inoltre un'esclusiva struttura 3D compartimentata che è un altro segno distintivo del tendine centrale 1,30,46.
Quando si utilizza questo sistema, è importante considerare le conseguenze della modularità del sistema per la granularità dei parametri di risultato. Mentre la proliferazione e il reclutamento cellulare possono essere valutati separatamente per ciascun compartimento, le proprietà meccaniche, i componenti del secretoma e i prodotti di degradazione sono attualmente misurabili solo per l'assemblaggio completo. Per quanto riguarda la produttività, una persona adeguatamente formata può preparare fino a 50 assiemi in una normale giornata lavorativa, con il principale collo di bottiglia rappresentato dalla procedura di serraggio. Sebbene alcuni dei metodi di lettura si escludano a vicenda, è possibile valutare ripetutamente le proprietà meccaniche e i componenti del secretoma sullo stesso campione, nonché la composizione della popolazione cellulare (citometria a flusso), il trascrittoma cellulare (RT-qPCR, sequenziamento dell'RNA) o la distribuzione della matrice e della cellula (immunocitochimica/microscopia a fluorescenza) agli endpoint. In precedenti pubblicazioni, questi metodi sono stati utilizzati per caratterizzare estensivamente le interazioni intercellulari e cross-compartimentali in assembloidi di fibroblasti e macrofagi esposti a una nicchia simile a una lesione 84,85. In questo lavoro, è stata esplorata la capacità del sistema modello di assemblaggio di sondare l'interazione intercompartimentale tra il nucleo e le cellule endoteliali estrinseche sotto diversi stimoli microambientali.
La modularità del sistema di modelli consente un futuro perfezionamento del metodo, necessario per superare le seguenti limitazioni dell'attuale iterazione del progetto. L'analisi citofluorimetrica presentata in questo lavoro e i dati di sequenziamento dell'RNA a singola cellula pubblicati di recente hanno rivelato che i tenociti residenti nel nucleo tendineo e le popolazioni derivate dal tendine d'Achille sono più eterogenee di quanto precedentemente ipotizzato 24,34,59,84,97. Inoltre, il comportamento migratorio delle popolazioni cellulari inizialmente residenti nel core o nell'idrogel offusca la compartimentazione dell'assemblaggio durante la coltura. Entrambi i fattori insieme rendono difficile attribuire le differenze trascrittomiche a specifici tipi di cellule e separare i processi basati sulla proliferazione da quelli basati sulla migrazione. Questa limitazione potrebbe essere superata raffinando la popolazione in ingresso con la selezione cellulare attivata dalla fluorescenza (FACS) in base alla composizione cellulare di tendini sani o malati caratterizzati in recenti studi in vivo, migliorando la lettura implementando il sequenziamento dell'RNA a singola cellula e integrando marcatori di proliferazione come una colorazione EdU (5-etinil-2'-deossiuridina) durante la microscopia.
Gli assembloidi qui presentati condividono anche una debolezza con la maggior parte dei sistemi in vitro attualmente disponibili che simulano organi malati scollegati dal resto del corpo98,99. Tuttavia, la piattaforma basata su camera di coltura utilizzata qui posiziona bene il sistema modello per l'integrazione in una piattaforma multiorgano in cui gli assembloidi che imitano organi diversi sono collegati e le interazioni interorgano possono essere studiate.
Al suo interno, il sistema modello si basa su tendini posizionali dei roditori, il che si traduce in una serie unica di inconvenienti. In primo luogo, la traducibilità dei risultati è ostacolata dai topi wild-type che non si sviluppano o non soffrono di malattie tendinee 8,100,101. L'integrazione di tessuti e cellule provenienti da esseri umani o da ceppi murini di nuova concezione che presentano aspetti di malattia tendinea potrebbe alleviare questo problema102. Il passaggio a un assemblaggio basato sull'uomo è particolarmente interessante, in quanto consentirebbe studi con tessuti derivati da pazienti provenienti da tendini diversamente malati (ad esempio, tendinite, tendinosi o peritendinite) e persino donatori resistenti al trattamento che potrebbero sbloccare programmi di trattamento più personalizzati. In secondo luogo, gli espianti di tendini caudali murini non gestiscono particolarmente bene il microdanno indotto dal sovraccarico, il che limita l'applicabilità del sistema modello per lo studio del danno tendineo acuto.
Per tutti questi motivi, gli assembloidi di espianto // idrogel sono in una posizione privilegiata per studiare la biologia del nucleo tendineo, le interazioni struttura-funzione della matrice e le interazioni intercompartimentali tra specifiche popolazioni cellulari in risposta a microdanni indotti da nicchie. Le informazioni raccolte da questi studi ad alto rendimento potrebbero dare una direzione alla ricerca in vivo e allo sviluppo di trattamenti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dalla sovvenzione dell'ETH 1-005733
Materiali
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
Riferimenti
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon