このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
慢性サルモネラ感染マウスモデル
要約
持続的で慢性細菌感染マウスモデルを確立するサルモネラネズミチフス菌のコロニー形成。
要約
細菌感染マウスモデルでは、感染症、炎症、免疫学、シグナル伝達、および腫瘍形成などの分野を研究するための強力なモデルシステムです。多くの研究者によって誘発される大腸炎の利用しています
プロトコル
細菌培養、マウスの強制経口投与、およびサルモネラの検出:このプロトコルは、次の3つの部分を含む。
1 サルモネラの成長条件。
- 37℃で一晩インキュベートサルモネラ LB培地(LB)プレートを、準備します。
- LBプレートからクローンを選択し、12 mlチューブに7 mlのLBに入れ、そして37℃で約5時間振とうする。
- 約18時間振盪せずに37℃で定常期の文化とインキュベート0.05 mlを50 mlのLBに接種する。
- 比100:3(:HBSS LB)を使用して、HBSS中の細菌を一時停止、10分間6000rpmで室温で一晩細菌培養を回転させる。次に例を示します。
すべての50 mlのLB培養液を1.5mlのHBSSに懸濁される。 - 動物の強制経口投与の場合は、さらに1:10の比で細菌培養を希釈する。次に例を示します。
毎1.5 mlのLB培養液を15mlのHBSSに懸濁される。
(2) サルモネラ感染症のモデル*
- ストレプトマイシン溶液を調製。各マウスは、100μlのHBSSでストレプトマイシンの7.5 mgを与えられます。例えば、10匹のマウスに対して1.2ミリリットルHBSSでストレプトマイシンの合計90mgのを準備。ストレプトマイシン溶液を調製する際は、必ずいくつかの余分なボリュームを持っている。
- 4時間強制経口投与、治療前に水と食料を撤回。
- ストレプトマイシン(対照マウスのためのHBSS100μlの)の7.5 mgのストレプトマイシンによる強制飼養マウス。ストレート食道を作るために人差し指で頭と首を伸ばし、しっかりと親指と中指でマウスの肩の皮膚をつかむ。口の屋根に沿ってと咽頭の背面の右側に向かって供給針のボールチップに指示、その後ゆっくりと食道に伝承し、100μlのソリューションを注入する。いいえ抵抗を感じてはいけません。
- ストレプトマイシンの治療、撤回水と食料20時間後でマウスが細菌に感染して再び前に。
- HBSS中の100μlの懸濁液と各マウスに強制経口投与または強制経口投与による滅菌HBSS(対照)で処理した。強制経口投与手順はストレプトマイシンと同じ)2.3などの強制経口投与したマウスです。
*動物実験は、以前は1で説明した6〜7週齢の特定病原体フリーの雌C57BL / 6マウス(タコニック、ハドソン、NY)を用いて行った。プロトコルは、動物資源上ロチェスター大学委員会の大学(UCAR)により承認された。
3。腸内のサルモネラの検出。
- (約100mg)マウスは糞便収集する。
- 1ミリリットルPBSと激しくボルテックスの1.5マイクロ遠心チューブに糞便サンプルを転送します。
- 800回転で10分間遠心します。きれいな微量遠心チューブに上清を移す。
- 5分を6000rpmで遠心分離。上清を捨て、200μLのPBSでペレットに添加し、ボルテックスしています。
- サルモネラを検出するためにBBL CHROMagarプレート上に使い捨てセルスプレッダーとストリーク200μlのPBS。 サルモネラ種は、(紫にバラ、図1を参照)ふじ色が表示されます。プレート上に200μlの収量が多すぎるコロニー場合、100μlまたはストリークのための50μlを使用してください。
4。代表的な結果。
プロトコルが正しく行われているときは、 ネズミチフス菌の保菌は、6ヶ月の上にマウスの腸内で検出することができます。 サルモネラは 6ヶ月(図1)を介して糞便培養によって検出される可能性がある。このモデルから来る典型的な外として、ボディは消失し、死は4週間、感染後内で発生する重量を量る。感染症に使用されるサルモネラの菌株に依存し、いくつかのマウスは6ヶ月にわたって生き残ることができる。
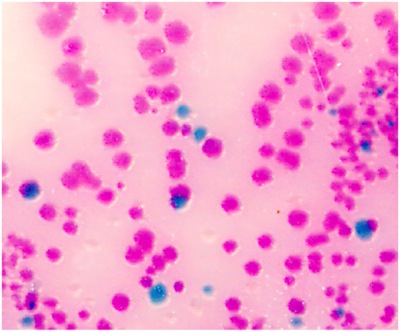
図1 サルモネラ種の腸内菌が原因選択した色原体の存在下で代謝の違いに、カラーで(紫にバラ)ふじ色が表示されます。他の細菌は、どちら抑制または青緑色や無色のコロニーを生成している。
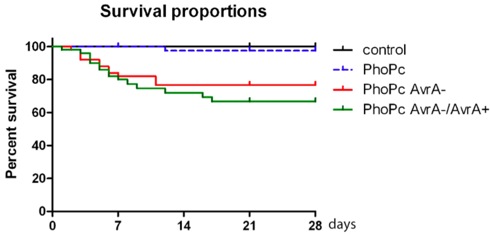
図2。 サルモネラ変異株PHOP C、PHOP Cに感染したマウスの生存割合アブラ-、およびPHOP C AvrA-/AvrA +、4週間(28日)のためのPHOP Cアブラ。
4週間のためのサルモネラに感染したマウスの表1。体重。
| 0 | 1週間 | 2週間 | 3週間 | 4週 | |
| の制御 | 16.78 ± 1.05 | 16.91 ± 1.28 | 18.26 ± 1.23 | 19.31 ± 1.26 | 20.26 ± 1.15 |
| PHOP C | 16.89 ± 1.03 | 17.14 ± 1.19 | 17.43 ± 1.63 * | 18.68 ± 1.78 | 20.05 ± 1.11 |
| PHOP Cアブラ- | 16.91 ± 1.12 | 16.96 ± 1.39 | 17.06 ± 2.14 ** | 18.71 ± 2.18 | 20.15 ± 1.56 |
| PHOP C AvrA-/AvrA + | 16.94 ± 0.96 | 17.17 ± 1.02 | 17.63 ± 1.42 * | 18.44 ± 2.03 | 20.09 ± 1.17 |
*グループP <0.05を制御するための比較
**グループP <0.01を制御するための比較
本研究で使用した表2。 サルモネラ菌株。
| の名前 | 説明 | 参照またはソース |
| サルモネラ 14028s | 野生型S.ネズミチフス菌 | ATCC |
| PHOP C | 変異体の非病原性の複雑なレギュレータ | Millerら、1990 |
| PHOP Cアブラ- | アブラ-突然変異 | コリアー-ハイアムズら、2002 |
| PHOP C AvrA-/AvrA + | PHOP C補完をコードするプラスミドのアブラアブラ付き | コリアー-ハイアムズら、2002 |
ディスカッション
このシステムを使用するには、それは、動物を強制経口投与する方法については、研究者のために必要です。我々は詳細細菌培養を準備し、マウスを強制経口投与するための方法論を。我々はまた、胃腸(GI)管におけるサルモネラの持続性を監視する方法を示します。を含めて、このプロトコルの重要なステップ:
- ストレプトマイシン前処理:ストレプトマイシン、前処理?...
開示事項
謝辞
この作品はJun SunにNIDDK KO1 DK075386助成金と米国癌学会RSG - 09 - 075 - 01 - MBCによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| HBSS | Sigma-Aldrich | ABCD1234 | |
| Luria-Bertani broth | BD Biosciences | 244610 | |
| Feeding needle | Popper & Sons, Inc. | 7920 | |
| Streptomycin | MP Biomedicals | 100556 | |
| BBL CHROMagar Salmonella | BD Biosciences | 214983 | |
| Disposable cell spreaders | Biologix Research Company | 65-1010 |
参考文献
- Duan, Y. beta-Catenin activity negatively regulates bacteria-induced inflammation. Lab Invest. 87 (6), 613-624 (2007).
- Barthel, M. Pretreatment of mice with streptomycin provides a Salmonella enterica serovar Typhimurium colitis model that allows analysis of both pathogen and host. Infection and immunity. 71 (5), 2839-2858 (2003).
- Miller, S. I., Mekalanos, J. J. Constitutive expression of the phoP regulon attenuates Salmonella virulence and survival within macrophages. Journal of bacteriology. 172 (5), 2485-2490 (1990).
- Valdez, Y. Nramp1 expression by dendritic cells modulates inflammatory responses during Salmonella Typhimurium infection. Cell Microbiol. 10 (8), 1646-1661 (2008).
- Woo, H., Okamoto, S., Guiney, D., Gunn, J. S., Fierer, J. A model of Salmonella colitis with features of diarrhea in SLC11A1 wild-type mice. PLoS ONE. 3 (2), e1603-e1603 (2008).
- Dangl, J. L. Molecular call-and-response: how Salmonella learns the gospel from its host. Trends Microbiol. 11 (6), 245-246 (2003).
- Zaharik, M. L., Vallance, B. A., Puente, J. L., Gros, P., Finlay, B. B. Host-pathogen interactions: Host resistance factor Nramp1 up-regulates the expression of Salmonella pathogenicity island-2 virulence genes. Proceedings of the National Academy of Sciences of the United States of America. 99, 15705-15710 (2002).
- Townsend, P., Morton, D. B. Laboratory Animal Care Policies and Regulations: United Kingdom. ILAR J. 37 (2), 68-74 (1995).
- Olfert, E. D., Godson, D. L. Humane endpoints for infectious disease animal models. ILAR J. 41 (2), 99-104 (2000).
- Ye, Z., Petrof, E. O., Boone, D., Claud, E. C., Sun, J. Salmonella effector AvrA regulation of colonic epithelial cell inflammation by deubiquitination. Am J Pathol. 171 (3), 882-892 (2007).
- Grassl, G. A., Valdez, Y., Bergstrom, K. S., Vallance, B. A., Finlay, B. B. Chronic enteric salmonella infection in mice leads to severe and persiste nt intestinal fibrosis. Gastroenterology. 134 (3), 768-780 (2008).
- Sukupolvi, S., Edelstein, A., Rhen, M., Normark, S. J., Pfeifer, J. D. Development of a murine model of chronic Salmonella infection. Infection and immunity. 65 (2), 838-842 (1997).
- . . Biosafety in Microbiological and Biomedical Laboratories (BMBL). , (2007).
- Wu, S., Lu, R., Zhang, Y., Sun, J. Chronic effects of a Salmonella type III secretion effector protein AvrA in vivo. PLoS ONE. , (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved