È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Cronico Salmonella Modello mouse infetti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Stabilire un modello batterica cronica del mouse infettati con persistente Salmonella Colonizzazione typhimurium nell'intestino per 27 settimane.
Abstract
Il modello di infezione batterica del mouse è un sistema potente modello per lo studio di aree come infezioni, infiammazioni, immunologia, trasduzione del segnale, e tumorigenesi. Molti ricercatori hanno approfittato della colite indotta da
Protocollo
Questo protocollo comprende tre parti: rilevamento di coltura batterica, gavage mouse e Salmonella.
1. Salmonella condizione di crescita.
- Preparare la Salmonella brodo Luria-Bertani (LB) piastra, incubare a 37 ° C durante la notte.
- Scegli un clone dalla piastra LB e mettere in 7 ml di LB in una provetta da 12 ml, e si agita a 37 ° C per circa 5 ore.
- Inoculare 50 LB ml con 0,05 ml di una cultura fase stazionaria e incubare a 37 ° C senza agitazione per circa 18 ore.
- Spin coltura batterica durante la notte a temperatura ambiente con 6000 rpm per 10 minuti, sospendere i batteri in HBSS con rapporto di 100:3 (LB: HBSS). Per esempio:
Ogni cultura LB 50 ml saranno sospesi in 1,5 ml HBSS. - Per la sonda gastrica animale, diluire ulteriormente la coltura batterica in rapporto 1:10. Per esempio:
Ogni 1,5 ml di coltura LB saranno sospesi in 15 ml HBSS.
2. Salmonella infezione modello *.
- Preparare la soluzione di streptomicina. Ogni mouse sarà dato 7,5 mg di streptomicina in 100 microlitri HBSS. Per esempio, preparare totale 90 mg di streptomicina in 1,2 ml di HBSS per 10 topi. Hanno sempre qualche volume in più quando si prepara la soluzione di streptomicina.
- Prelevare acqua e cibo 4 ore prima della terapia orale sonda gastrica.
- Topi sonda gastrica con streptomicina con 7,5 mg di streptomicina (100 ml di HBSS per topi di controllo). Afferra la pelle sopra la spalla del mouse saldamente con il pollice e il medio, allungare la testa e il collo con il dito indice per fare l'esofago dritto. Diretto la palla-punta dell'ago alimentazione lungo il tetto della bocca e verso il lato destro della parte posteriore della faringe, poi passare delicatamente giù nell'esofago e iniettare i 100 ul di soluzione. Nessuna resistenza deve essere sentito.
- A 20 ore dopo il trattamento streptomicina, acqua e cibo ritirato ancora prima che i topi infettati con batteri.
- Gavage ogni mouse con 100 microlitri di sospensione HBSS o trattati con HBSS sterile (controllo) mediante sonda gastrica. La procedura di sonda gastrica è lo stesso 2.3) topi sonda gastrica con streptomicina.
* Gli esperimenti sugli animali sono stati eseguiti utilizzando specifici-esenti da organismi patogeni C57BL femmina / 6 topi (Taconic, Hudson, NY) che sono stati 6-7 settimane di età come descritto in precedenza 1. Il protocollo è stato approvato dalla University of Rochester University commissione per le risorse animali (UCAR).
3. Rilevamento di Salmonella nell'intestino.
- Raccogliere il mouse fecale (circa 100 mg).
- Trasferimento del campione fecale di un tubo di 1,5 micro centrifuga con 1 ml di PBS e agitare vigorosamente.
- Centrifugare per 10 min a 800 giri al minuto. Trasferire il supernatante in una provetta per microcentrifuga pulita.
- Centrifugazione a 6000 rpm per 5 min. Sopranatante viene scartato e 200 ul PBS viene aggiunto al pellet e in agitazione.
- Streak i 200 microlitri di PBS con una spatola cellulare usa e getta in un piatto BBL CHROMagar per rilevare Salmonella. Salmonella spp appaiono malva (rosa al viola, vedi Fig.1). Se 200 microlitri rendimenti troppe colonie sulla piastra, utilizzare 100 ul o 50 microlitri per la striscia.
4. Rappresentante dei risultati.
Quando il protocollo è fatto correttamente, Salmonella typhimurium colonizzazione può essere rilevato nell'intestino del mouse di oltre 6 mesi. Salmonella potrebbe essere rilevato dalla cultura fecali oltre 6 mesi (Fig.1). Come venire fuori tipico di questo modello, perdita di peso del corpo e la morte si verificano entro 4 settimane dopo l'infezione. A seconda del ceppi di Salmonella usati per l'infezione, alcuni topi potrebbe non sopravvivere più di 6 mesi.
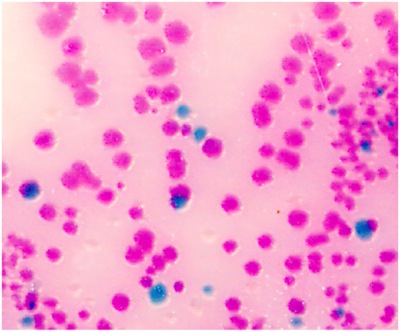
Figura 1. Salmonella intestinale nella specie Salmonella appaiono malva (rosa al viola) a colori, a causa delle differenze metaboliche, in presenza di cromogeni selezionati. Altri batteri sono o inibiti o producono colonie blu-verde o incolore.
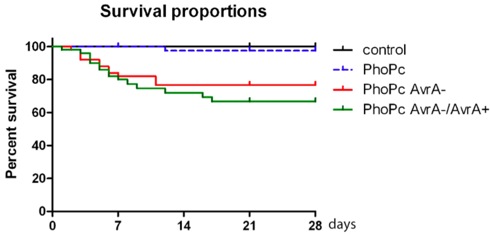
Figura 2. Proporzioni sopravvivenza dei topi infettati con il ceppo mutante di Salmonella PhoP c, c PhoP Avra-e PhoP AvrA-/AvrA + c, c PhoP Avra per 4 settimane (28 giorni).
Tabella 1. Il peso corporeo dei topi infettati da salmonella per 4 settimane.
| 0 | 1 settimana | 2 settimane | 3 settimane | 4 settimane | |
| controllo | 16,78 ± 1,05 | 16,91 ± 1,28 | 18,26 ± 1,23 | 19,31 ± 1,26 | 20,26 ± 1,15 |
| PhoP c | 16,89 ± 1,03 | 17,14 ± 1,19 | 17,43 ± 1,63 * | 18,68 ± 1,78 | 20,05 ± 1,11 |
| PhoP c Avra- | 16,91 ± 1,12 | 16,96 ± 1,39 | 17,06 ± 2,14 ** | 18,71 ± 2,18 | 20,15 ± 1,56 |
| PhoP c AvrA-/AvrA + | 16,94 ± 0,96 | 17,17 ± 1,02 | 17,63 ± 1,42 * | 18,44 ± 2,03 | 20,09 ± 1,17 |
* Rispetto al gruppo di controllo p <0,05
** Rispetto al gruppo di controllo p <0,01
Tabella 2. Ceppi di Salmonella utilizzato in questo studio.
| Nome | Descrizione | Riferimento o fonte |
| Salmonella 14028s | Wild-type S. typhimurium | ATCC |
| PhoP c | Non patogeni regolatore complesso mutante | Miller et al., 1990 |
| PhoP c Avra- | Avra-mutazione | Collier-Hyams et al., 2002 |
| PhoP c AvrA-/AvrA + | PhoP c Avra-Avra completato con codifica plasmide | Collier-Hyams et al., 2002 |
Discussione
Per utilizzare questo sistema, è necessario che il ricercatore per imparare a sonda gastrica degli animali. Noi dettaglio una metodologia per preparare la cultura batterica e sonda gastrica i topi. Mostriamo anche come monitorare la persistenza Salmonella nel tratto gastrointestinale (GI). Le fasi critiche in questo protocollo, tra cui:
- Streptomicina-pretrattamento: Streptomicina-pretrattamento riusciva a liberarsi di qualche commensale della flora intestinale e fanno i topi suscettibili alla infe...
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dal KO1 NIDDK DK075386 concessione e l'American Cancer Society RSG-09-075-01-MBC a giugno Dom
Materiali
| Name | Company | Catalog Number | Comments |
| HBSS | Sigma-Aldrich | ABCD1234 | |
| Luria-Bertani broth | BD Biosciences | 244610 | |
| Feeding needle | Popper & Sons, Inc. | 7920 | |
| Streptomycin | MP Biomedicals | 100556 | |
| BBL CHROMagar Salmonella | BD Biosciences | 214983 | |
| Disposable cell spreaders | Biologix Research Company | 65-1010 |
Riferimenti
- Duan, Y. beta-Catenin activity negatively regulates bacteria-induced inflammation. Lab Invest. 87 (6), 613-624 (2007).
- Barthel, M. Pretreatment of mice with streptomycin provides a Salmonella enterica serovar Typhimurium colitis model that allows analysis of both pathogen and host. Infection and immunity. 71 (5), 2839-2858 (2003).
- Miller, S. I., Mekalanos, J. J. Constitutive expression of the phoP regulon attenuates Salmonella virulence and survival within macrophages. Journal of bacteriology. 172 (5), 2485-2490 (1990).
- Valdez, Y. Nramp1 expression by dendritic cells modulates inflammatory responses during Salmonella Typhimurium infection. Cell Microbiol. 10 (8), 1646-1661 (2008).
- Woo, H., Okamoto, S., Guiney, D., Gunn, J. S., Fierer, J. A model of Salmonella colitis with features of diarrhea in SLC11A1 wild-type mice. PLoS ONE. 3 (2), e1603-e1603 (2008).
- Dangl, J. L. Molecular call-and-response: how Salmonella learns the gospel from its host. Trends Microbiol. 11 (6), 245-246 (2003).
- Zaharik, M. L., Vallance, B. A., Puente, J. L., Gros, P., Finlay, B. B. Host-pathogen interactions: Host resistance factor Nramp1 up-regulates the expression of Salmonella pathogenicity island-2 virulence genes. Proceedings of the National Academy of Sciences of the United States of America. 99, 15705-15710 (2002).
- Townsend, P., Morton, D. B. Laboratory Animal Care Policies and Regulations: United Kingdom. ILAR J. 37 (2), 68-74 (1995).
- Olfert, E. D., Godson, D. L. Humane endpoints for infectious disease animal models. ILAR J. 41 (2), 99-104 (2000).
- Ye, Z., Petrof, E. O., Boone, D., Claud, E. C., Sun, J. Salmonella effector AvrA regulation of colonic epithelial cell inflammation by deubiquitination. Am J Pathol. 171 (3), 882-892 (2007).
- Grassl, G. A., Valdez, Y., Bergstrom, K. S., Vallance, B. A., Finlay, B. B. Chronic enteric salmonella infection in mice leads to severe and persiste nt intestinal fibrosis. Gastroenterology. 134 (3), 768-780 (2008).
- Sukupolvi, S., Edelstein, A., Rhen, M., Normark, S. J., Pfeifer, J. D. Development of a murine model of chronic Salmonella infection. Infection and immunity. 65 (2), 838-842 (1997).
- . . Biosafety in Microbiological and Biomedical Laboratories (BMBL). , (2007).
- Wu, S., Lu, R., Zhang, Y., Sun, J. Chronic effects of a Salmonella type III secretion effector protein AvrA in vivo. PLoS ONE. , (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon