Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chronique Salmonella Modèle de souris infectées
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Établir un modèle de chroniques bactériennes de souris infectées par la persistance Salmonella dans l'intestin pendant 27 semaines.
Résumé
Le modèle de souris infectées par des bactéries est un système puissant modèle pour étudier des domaines tels que l'infection, l'inflammation, l'immunologie, la transduction du signal, et la tumorigenèse. De nombreux chercheurs ont tiré parti de la colite induite par
Protocole
Ce protocole comprend trois parties: la détection de culture bactérienne, gavage chez la souris, et la salmonelle.
1. Condition de la croissance de Salmonella.
- Préparer la Salmonella bouillon Luria-Bertani (LB) plaque, incuber à 37 ° C pendant la nuit.
- Choisissez un clone de la plaque de LB et mis en 7 LB ml dans un tube de 12 ml et agiter à 37 ° C pendant environ 5 heures.
- Inoculer 50 ml LB avec 0,05 ml d'une culture en phase stationnaire et incuber à 37 ° C sans agitation pendant environ 18 heures.
- Spin nuit culture bactérienne à la température ambiante à 6000 rpm pendant 10 minutes, de suspendre les bactéries dans HBSS utilisant 100:3 ratio (LB: HBSS). Par exemple:
Chaque culture LB 50 ml sera suspendu dans 1,5 ml de HBSS. - Pour le gavage des animaux, diluer la culture bactérienne au ratio de 01:10. Par exemple:
Chaque culture de 1,5 ml LB sera suspendu dans 15 ml de HBSS.
2. Salmonella-infection modèle *.
- Préparer la solution de streptomycine. Chaque souris sera donné 7,5 mg de streptomycine dans 100 ul de HBSS. Par exemple, préparer au total 90 mg de streptomycine dans 1,2 ml de HBSS pour les 10 souris. Toujours avoir un peu de volume supplémentaire lors de la préparation de la solution de streptomycine.
- Retirer de l'eau et de nourriture 4 heures avant le traitement par gavage oral.
- Gavage des souris avec de la streptomycine avec 7,5 mg de streptomycine (100 pi de HBSS pour les souris témoins). Prenez la peau sur l'épaule de la souris fermement avec le pouce et le majeur, étirer la tête et du cou avec l'index pour faire l'œsophage droite. Diriger la balle à pointe de l'aiguille d'alimentation sur le toit de la bouche et vers le côté droit du dos du pharynx, puis doucement descendre dans l'œsophage et injecter la solution 100 ul. Aucune résistance devrait se faire sentir.
- À 20 heures après le traitement à la streptomycine, l'eau prélevée et de la nourriture à nouveau avant que les souris sont infectées par des bactéries.
- Gavage chaque souris avec 100 ul de suspension dans HBSS ou traitées avec du HBSS stérile (contrôle) par gavage oral. La procédure de gavage est le même que 2,3) gavage des souris avec de la streptomycine.
Les expérimentations animales ont été réalisées par * à l'aide pathogènes spécifiques sans C57BL / 6 femelles souris (Taconic, Hudson, NY), qui étaient vieilles de 6-7 semaines, comme décrit précédemment 1. Le protocole a été approuvé par l'Université de Rochester University Comité des Ressources Animales (UCAR).
3. Détection des salmonelles dans l'intestin.
- Recueillir la souris fécales (environ 100 mg).
- Transférer l'échantillon fécal à un tube de 1,5 centrifugeuse micro avec 1ml de PBS et vortexer vigoureusement.
- Centrifuger pendant 10 min à 800 rpm. Transférer le surnageant dans un tube de centrifugeuse propre.
- Centrifugation à 6000 rpm pendant 5 min. Surnageant est jeté et 200 ul de PBS est ajouté aux pastilles et vortexés.
- Streak le PBS 200 pi avec un épandeur portable jetable sur une plaque BBL CHROMagar pour détecter la bactérie Salmonella. Salmonella apparaissent mauves (rose au violet, voir Fig.1). Si 200 ul rendements trop nombreuses colonies sur la plaque, utiliser 100 ul ou 50 ul de la série.
4. Des résultats représentatifs.
Lorsque le protocole est fait correctement, Salmonella typhimurium colonisation ne peut être détecté dans l'intestin de la souris sur 6 mois. Salmonella pourrait être détectée par la culture fécale plus de 6 mois (Fig.1). Comme une des caractéristiques viennent de ce modèle, le corps la perte de poids et les décès surviennent dans les 4 semaines après l'infection. Dépendant du souches de Salmonella utilisés pour l'infection, certaines souris peuvent pas survivre plus de 6 mois.
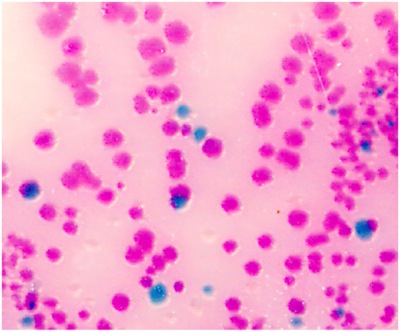
Figure 1. Salmonella intestinales chez les espèces de Salmonella apparaissent mauves (rose au violet) en couleur, en raison de différences métaboliques, en présence de chromogènes sélectionné. D'autres bactéries sont soit inhibé ou produire des colonies bleu-vert ou incolore.
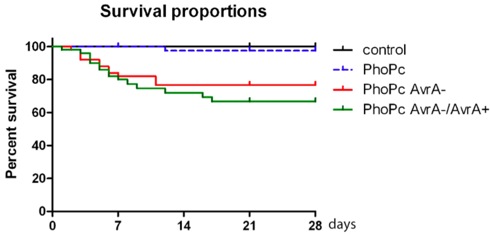
Figure 2. Proportions de survie de souris infectées par la bactérie souche mutante PhoP c, c PhoP Avra-et PhoP c AvrA-/AvrA +, c PhoP Avra pendant 4 semaines (28 jours).
Le poids corporel Tableau 1. De souris infectées par des salmonelles pendant 4 semaines.
| 0 | 1 semaine | 2 semaines | 3 semaines | 4 semaines | |
| le contrôle | 16,78 ± 1,05 | 16,91 ± 1,28 | 18,26 ± 1,23 | 19,31 ± 1,26 | 20,26 ± 1,15 |
| PhoP c | 16,89 ± 1,03 | 17,14 ± 1,19 | 17,43 ± 1,63 * | 18,68 ± 1,78 | 20,05 ± 1,11 |
| PhoP c Avra- | 16,91 ± 1,12 | 16,96 ± 1,39 | 17,06 ± 2,14 ** | 18,71 ± 2,18 | 20,15 ± 1,56 |
| PhoP c AvrA-/AvrA + | 16,94 ± 0,96 | 17,17 ± 1,02 | 17,63 ± 1,42 * | 18,44 ± 2,03 | 20,09 ± 1,17 |
* Par rapport au groupe contrôle p <0,05
** Par rapport au groupe témoin p <0,01
Tableau 2. Souches de Salmonella utilisé dans cette étude.
| Nom | Descriptif | Référence ou source |
| Salmonella 14028s | Wild-type S. typhimurium | ATCC |
| PhoP c | Non-pathogènes régulateur complexe mutant | Miller et al., 1990 |
| PhoP c Avra- | Avra-mutation | Collier-Hyams et al., 2002 |
| PhoP c AvrA-/AvrA + | PhoP c Avra-avec Avra encodage complété plasmidique | Collier-Hyams et al., 2002 |
Discussion
Pour utiliser ce système, il est nécessaire pour le chercheur d'apprendre à gavage des animaux. Nous détaillons une méthode pour préparer une culture bactérienne et gavage des souris. Nous montrons aussi comment contrôler la persistance de Salmonella dans le tractus gastro-intestinal (GI). Les étapes essentielles de ce protocole, y compris:
- Streptomycine prétraitement: streptomycine prétraitement pourrait se débarrasser de certains flore intestinale commensale et de faire des souris...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par le NIDDK KO1 DK075386 subvention et l'American Cancer Society RSG-09-075-01-MBC à juin dim.
matériels
| Name | Company | Catalog Number | Comments |
| HBSS | Sigma-Aldrich | ABCD1234 | |
| Luria-Bertani broth | BD Biosciences | 244610 | |
| Feeding needle | Popper & Sons, Inc. | 7920 | |
| Streptomycin | MP Biomedicals | 100556 | |
| BBL CHROMagar Salmonella | BD Biosciences | 214983 | |
| Disposable cell spreaders | Biologix Research Company | 65-1010 |
Références
- Duan, Y. beta-Catenin activity negatively regulates bacteria-induced inflammation. Lab Invest. 87 (6), 613-624 (2007).
- Barthel, M. Pretreatment of mice with streptomycin provides a Salmonella enterica serovar Typhimurium colitis model that allows analysis of both pathogen and host. Infection and immunity. 71 (5), 2839-2858 (2003).
- Miller, S. I., Mekalanos, J. J. Constitutive expression of the phoP regulon attenuates Salmonella virulence and survival within macrophages. Journal of bacteriology. 172 (5), 2485-2490 (1990).
- Valdez, Y. Nramp1 expression by dendritic cells modulates inflammatory responses during Salmonella Typhimurium infection. Cell Microbiol. 10 (8), 1646-1661 (2008).
- Woo, H., Okamoto, S., Guiney, D., Gunn, J. S., Fierer, J. A model of Salmonella colitis with features of diarrhea in SLC11A1 wild-type mice. PLoS ONE. 3 (2), e1603-e1603 (2008).
- Dangl, J. L. Molecular call-and-response: how Salmonella learns the gospel from its host. Trends Microbiol. 11 (6), 245-246 (2003).
- Zaharik, M. L., Vallance, B. A., Puente, J. L., Gros, P., Finlay, B. B. Host-pathogen interactions: Host resistance factor Nramp1 up-regulates the expression of Salmonella pathogenicity island-2 virulence genes. Proceedings of the National Academy of Sciences of the United States of America. 99, 15705-15710 (2002).
- Townsend, P., Morton, D. B. Laboratory Animal Care Policies and Regulations: United Kingdom. ILAR J. 37 (2), 68-74 (1995).
- Olfert, E. D., Godson, D. L. Humane endpoints for infectious disease animal models. ILAR J. 41 (2), 99-104 (2000).
- Ye, Z., Petrof, E. O., Boone, D., Claud, E. C., Sun, J. Salmonella effector AvrA regulation of colonic epithelial cell inflammation by deubiquitination. Am J Pathol. 171 (3), 882-892 (2007).
- Grassl, G. A., Valdez, Y., Bergstrom, K. S., Vallance, B. A., Finlay, B. B. Chronic enteric salmonella infection in mice leads to severe and persiste nt intestinal fibrosis. Gastroenterology. 134 (3), 768-780 (2008).
- Sukupolvi, S., Edelstein, A., Rhen, M., Normark, S. J., Pfeifer, J. D. Development of a murine model of chronic Salmonella infection. Infection and immunity. 65 (2), 838-842 (1997).
- . . Biosafety in Microbiological and Biomedical Laboratories (BMBL). , (2007).
- Wu, S., Lu, R., Zhang, Y., Sun, J. Chronic effects of a Salmonella type III secretion effector protein AvrA in vivo. PLoS ONE. , (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon