このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
定量リアルタイムPCR(定量PCR)アレイを用いたプレマイクロRNAとマイクロRNAのプロファイリング
要約
我々は、事前にマイクロRNAの設定と分析サーモ科学マトリックスマルチチャンネルピペットで手でだけでなく、ロボットを使用してQPCR用96穴の配列のデモンストレーションを行います。
要約
定量リアルタイムPCR(QPCR)は、遺伝子発現レベルのプロファイリングで、正確かつ有用なツールとして浮上している。その多くの利点の一つは、各アッセイのために入力の少量を使用しながら、遺伝子発現プロファイリングの他の方法に比べて検出下限値です。自動化された定量PCRのセットアップは、より再現性を可能にすることで、このフィールドを改善しました。その便利で迅速なセットアップは、各実験で同時に多くの異なる遺伝子のプロファイリングを有効にする、ハイスループットの実験が可能になります。内部プレートのコントロールと共にこのメソッドは、他の技法に共通する実験変数を減らすことができます。我々は最近、186プライマーペアのセットを使用して事前にマイクロRNA(プレmiRNA)のプロファイリングのための定量PCRアッセイを開発した。マイクロRNAは、転写後レベルで多くの標的mRNAを調節する能力を持つ小型の、非コードRNAの新たなクラスとして浮上している。これらの小さなRNAは、まず前駆体のmiRNA(プレmiRNAの)に切断されている主なmiRNA(PRI - miRNA)の転写産物として、RNAポリメラーゼIIによって転写される。プリmiRNAはダイサーは成熟miRNAを生成するヘアピンループを切断する細胞質にエクスポートされます。 miRNAレベルの増加は、前駆体および成熟miRNAレベルの両方で観察することができ、これらのフォームの両方のプロファイリングに便利です。成熟miRNAのいくつかの市販のアッセイがありますが、しかし、彼らの高いコストは、このプロファイリング手法から研究者を阻止することができる。ここで、我々は、プレmiRNAをプロファイリングの費用対効果の高い、信頼性、SYBRベースの定量PCR法を説明します。プリmiRNAレベルの変化はしばしば成熟したmiRNAの変化を反映し、成熟したmiRNA発現の有用な指標となることができます。彼らは非冗長情報を貢献し、マイクロRNAプロセシングへの洞察を提供することができますしかし、プレmiRNAのと成熟miRNAの両方の同時プロファイリングは最適かもしれません。さらに、ここで説明する手法は、特定の経路や病原体の他のライブラリのセットのプロファイルを含むように拡張することができます。
プロトコル
完全にテカン自由エボロボット(A)、またはマトリックス電子マルチチャンネルピペット(B)と手で自動化さとして定量PCRプレmiRNAプロファイリングアレイを設定することができます。
1)マスターミックス、プライマープレートやサンプルを準備します。
- 0.5pMで96ウェルフォーマット(2枚の合計)は186のプライマーペアを含むプライマープレートを-80℃で保存してください。使用前に軽く室温、ボルテックスと遠心でプレートを解凍。
- マスターミックスを調製するために、室温でSYBRグリーン2倍のPCRミックスを解凍。各反応は2ulプライマーと8ulマスターミックスを使用しています。反応あたりマスターミックスの組成は4ul SYBRミックス、3ul PCRグレードの水、10〜20 ngのサンプルのDNAまたはcDNAである。
- 各96ウェルプライマープレートのセットアップについては、4つのマスターミックスのチューブが必要になります。サンプルを4連で4プレートあたりのサンプル(singlicate)、プレートごとに2つのサンプル(重複)または単一のサンプルを実行することができます。
- 4〜2ミリリットルエッペンドルフチューブの各々にSYBR、水とサンプルを組み合わせることにより、マスターミックスを調製する。各チューブは廃棄物をピペッティングするための過剰でき、約100反応のための十分なマスターミックスが含まれている必要があります。ミックスする渦。
自由テカンエボロボットを使用してプリmiRNAのアッセイのA.セットアップ。
- ロボットの初期化とEvowareプログラムのロードに続いて、ピペッティングの精度に干渉する気泡のシステムをクリアする30mlsそれぞれで三回フラッシュします。
- 以下を含むようにロボットのプラットフォームを設定します。
- 標識した384ウェルプレート
- 96ウェルプライマープレート(1)
- マスターミックス
- 2%の漂白剤を含むトラフ
- 満たされたシステムの流体容器
- 空の廃棄物容器
- 二回"Run"を選択することで自動化されたロボットの実行を開始します。
- プログラムの終了時に、ライトサイクラー480シーリングホイルで384ウェルプレートとシールを取り除き、軽く遠心する。場所は、ホテルの位置1に384ウェルプレートを密封。
- 2.2ステップと、新しいマスターミックスと新しい384ウェルプレートでプライマープレート2の繰り返しに移動します。
- ホテルの位置2に密閉プレートを置きます。
- ホテルからライトサイをロードするための新しいEvowareのプログラムを開いて、二度"実行"を選択します。
- 自由エボは、自動的にライトサイに各プレートをロードし、以下のSYBR -緑色のI / HRMサイクリングプログラムを実行します。
事前に(1サイクル):
50 4.8のランプ速度で5分〜° /秒
95 4.8のランプ速度で5分〜° /秒
アンプ(45サイクル):
95 4.8ランプの速度で15秒℃です° /秒
62 2.5ランプの速度で30秒℃です° /秒
(このステップの間に単一のデータ収集)
融解曲線:
95 4.8ランプの速度で5秒℃です° /秒
1 2.5のランプ速度で分° /秒、60℃
95℃0.11 ° /秒の昇温速度で連続
° Cごとに5買収
クール:
50 25の昇温速度で30秒℃です° /秒
- 自由エボは、自動的にライトサイに各プレートをロードし、以下のSYBR -緑色のI / HRMサイクリングプログラムを実行します。
マトリックス電子マルチチャンネルピペットを使用してプリmiRNAのアッセイのB.セットアップ:
- リザーバにマスターミックスのチューブ1の内容を置きます。
- 2 8ulとマスターミックスの16ulを吸引パージ工程に続いてのステップを分配する電子ピペットを設定します。
- マスターミックス1の場合、よくA1から始まる、384ウェルプレート(384ウェル先端の間隔で設定)の他のすべてのウェルに8ulを分注する。 (すなわち井戸A1、C1、E1、等)第二8ulは調剤については、廃棄物の容器とDisposeのヒント以上パージして(すなわち井戸A3、C3、E3、等)の3列目に移動します。
- あなたがよくA23に到達するまで、残りの5サイクルのためにこのパターンに従ってください。
- マスターミックス3(よくB1、D1、F1、などで始まり);マスターミックス4(B2で始まり、D2、F2、など(よくA2、C2、E2、などで始まる)、マスターミックス2に繰り返します。 。)。
- プライマープレートのaliquottingの場合は、2ulを吸引し、パージ工程を以下のと2ulディスペンスする電子ピペットを設定します。廃棄物容器およびDisposeのヒント以上384ウェルプレート、井戸A1、C1、E1、等パージに96ウェルプライマープレート(AH)のカラム1からのプライマーの2ulを分注する。 B1、D1、F1;とB2、D2、F2などのウェルA2、C2、E2の繰り返し
- フル384ウェルプレートが小分けされるまで、各プライマーの列ごとに2列の上に移動、96ウェルプライマーの行の2月12日のために繰り返します。
- ライトサイクラーシーリング箔と簡単に遠心によるシールプレート。
- SYBRグリーンI / HRMの検出フォーマットを使用して、以下の設定にしたがってサイクラー480とサイクルプレートに入れますプレート:
事前に(1サイクル):
50 4.8のランプ速度で5分〜° /秒
95 4.8のランプ速度で5分〜° /秒
アンプ(45サイクル):
昇温速度で15秒、95℃4.8 ° /秒
62 2.5ランプの速度で30秒℃です° /秒
(このステップの間に単一のデータ収集)
融解曲線:
95 4.8ランプの速度で5秒℃です° /秒
1 2.5のランプ速度で分° /秒、60℃
95℃0.11 ° /秒の昇温速度で連続
° Cごとに5買収
クール:
50 25の昇温速度で30秒℃です° /秒 - 新しく調製したマスターミックスを使用して、新鮮な384ウェルプレートにaliquotting、プライマープレート2を使用して繰り返します。
成功の秘訣:
PCRアレイを設計する重要な特性はすべての186のプライマーペアが同じアニーリング温度を持っていることである、板が同一の最適なPCRの実行プログラムの設定で実行することができますので。
それぞれの新しい配列が前に実行されているサンプルは、3つのコントロールを使用してチェックする必要があります。これらのコントロールは以下のとおりです。
プライマーのコンタミネーションを排除するために水または0.1 X TEで実行されたすべてのプライマーの1失点。
1にはキャリーオーバーのないことを確認するために、水/ TEおよび陽性コントロールを交互に実行する。
図3は、実行間の再現性を確保するために、同一の陽性コントロールを使用して実行されます。
マスターミックスを新たに調製する必要がある、とプレートが最適な結果を得るために24時間以内に実行する必要があります
プライマープレート箔は、ウェル間のコンタミネーションのリスクを減らすために徐々に削除する必要があります。
固定のヒントを持つロボットを使用する場合、2%の漂白剤の洗浄は、水のフラッシュに続いて各ピペッティングステップの間でのヒントを、洗浄する必要があります。これは、他の方法でデータを汚染し、明確な結果につながる可能性のキャリーオーバーを、防止し、排除します。
プレートはライトサイ経由で実行された後、それはPCRのセットアップルームで再び開かれるべきではない。これはPCRの汚染を防ぐことができます。
代表的な結果:
定量PCRの結果は、典型的にライトサイクラー解析ソフトウェアから決定CT値で表されます。正常な実行は、通常、正のサンプルのサンプルのため、通常は20から35の間にCTの範囲で構成されています。いい走りで水のサンプルは> 40のCTで常にあり、37以上のサンプルやCTで特定のwellはネガティブまたは検出されないと見なされます。原則として、<10のCTをもたらすサンプルも信頼性が低いとさらなる分析から除外されます。私たちのアッセイで定量PCRのデータと内部統制のインクルージョンを分析する方法はいくつかのサンプル入力の変動を制御するに役立つがあります。プリのmiRの配列は、しばしば異なる試料からのCT値を正規化するために、リファレンス遺伝子として使用されているU6コントロールプライマーが含まれています。この正規化された値は、デルタCT値(DCT)と呼ばれています。結果は、しばしば生のCT、DCTの値としてグラフ化されたり、さらに標準化された値に分析することができます。
図1では、timecourseの実験からの4つの異なるサンプルの完全なプレmicroRNAの配列の分析は、ヒートマップ形式で表示されます。各プレマイクロRNAの相対的な発現が示され、三大、異なるクラスターが出現しています。 (図1A)が期待どおりに分析プレmiRの大半は、小さな、些細な変更を受けた。しかし、事前にマイクロRNAのごく一部が有意に減少した(図1B)またはtimecourse実験を通して(図1C)劇的に増加した。各プレマイクロRNAの発現のレベルはベースラインレベルとして0Hタイムポイント(サンプル1)に正規化された。いくつかのインスタンスでは、クラスタ化されたプレマイクロRNAの一部は、(:のlet - 7aは、図1B EX)ヒートマップの分析で一緒にクラスタ化することに気づくかもしれません。実験に応じて、クラスタは、ウイルス感染に依存していることに共通の分子やシグナル伝達経路によって調節されている事前マイクロRNAまたはプレmiRの細胞型特異的な発現をemergeすることがあります。
我々はまた、開発したプレmicroRNAのアッセイは、ヒトプレmiRはに加えて、ヘルペスウイルス(KSHV)とエプスタインバーウイルス(EBV)の関連カポジ肉腫でエンコードされた既知のウイルスのプレマイクロRNAと遺伝子の数が含まれます。これらは、細胞株および使用するサンプルのウイルスの状況に応じて、正または負の対照として使用することができます。図2では、4連で実行されるKSHV陰性サンプルから平均CTSが表示されます。重要なのは、KSHV LANAは、高感度の定量PCRアレイでは、このサンプルでは検出されなかった。しかし、U6 - 内部統制とlet - 7A - 高度に発現されたヒトプレマイクロRNAは、検出可能なレベルで発現された。最後に、予想通り、PCRグレードの水のネガティブコントロールは、定量PCRの製品を得られなかった。
成功した定量PCRの実行の別の指標は、サンプル中の汚染の可能性への洞察を与えることができる良好な融解曲線分析、である。 PCRが完了した後、溶融温度を確立するには、プレートがゆっくりと加熱される。別々のDNA鎖として、SYBRの緑がリリースされ、蛍光シグナルが減少する。このDRの温度オペアンプは、グラフ化され発生し、そしてサンプルの融解温度として知られています。 DNA配列に応じて、サンプルがお互いからとはDNAが存在しないので、溶融温度を持ってはならない水ネガティブコントロール、異なる温度で溶融。各プライマー対のPCR産物は、同様の温度で溶融してください。例えば、図3は、重複して同じサンプルを使用して、異なる2つのプライマーの融解曲線分析を示しています。それは、溶融温度が2つのプライマーペアごとに異なるが、サンプルは、各レプリケートするためのまったく同じ温度で溶融されていることは明らかです。不良または汚染の可能性のあるサンプルの兆候は、入力の二つの異なる情報源の存在を示唆し、いくつかの融解ピークが含まれる場合があります。
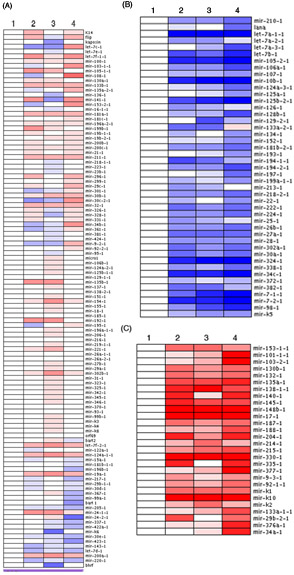
図1。プレmicroRNAの署名は、新たな定量PCRベースの配列を使用してプロファイリングを通して現れる。平均deltaCTU6を計算し、標準化された値は、ヒートマップとして表示される3つの異なるクラスターをもたらし、ArrayMinerTMソフトウェアに読み込まれました。 ()式の中で小さな変化のプレマイクロRNAが示されている。そのレベルは大幅に減少していたプレマイクロRNAは、(B)または(C)の増加も示されている。赤が増加発現レベルを表し、青は発現の低いレベルに対応しています。
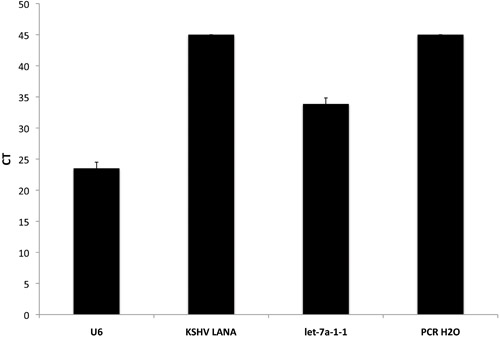
図2。定量PCRベースのプレマイクロRNAの配列の内部統制を含める。 3種類の遺伝子と、テンプレートなしのコントロールのための生のCT値が表示されます。 PCR H2Oが私たちのネガティブコントロールとして機能しながらU6は、内部ポジティブコントロールとして使用されます。せ- 7A - 1 - 1はKSHV LANAを使用する細胞株または組織のウイルスの状況に基づいて、正または負の対照として使用することができますが、通常は多くの異なる種類の細胞で発現するマイクロRNAです。
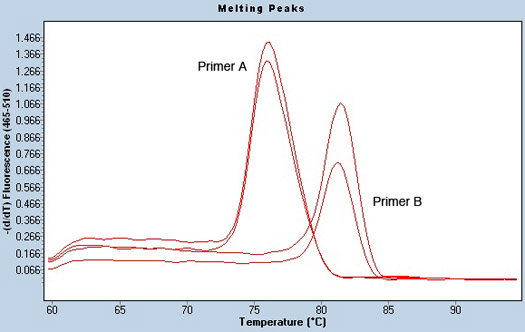
図3。プレマイクロRNAのプライマーとサンプルの汚染がないのピーク解析を溶解。融解曲線は、ライトサイクラーソフトウェアでのTmの呼び出しの解析を用いて得られた。重複で実行される同じサンプルに対して2つの異なるプライマー(プライマーAおよびB)が表示されます。各プライマーの融解温度が異なるです。しかし、サンプルはサンプルのコンタミネーションがないことを示す、1つのピークのみを持っています。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
QPCRが研究にサンプル間の遺伝子発現レベルを比較するだけでなく、ウイルスの場合に陽性を判断するために使用できる高感度のアッセイである。定量PCRアレイを用いての利点は、短期間で各サンプルのために多くのプライマーを(私たちの場合は、186プライマーペア)を実行する機能です。このようなテカン自由エボとしてピペッティングロボットを使用して、追加テストを設定するため?...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
この作品は、NIHの助成金DE018304、R01DE018281によってサポートされていました。 KTは、メッドを通じて、ハワードヒューズ医学研究所(HHMI)からグラッドイニシアティブにノースカロライナ大学チャペルヒル校にT32 GM07092 - 34でと助成金によってサポートされています。 PCはT32 CA009156によってサポートされています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Freedom Evo 150 | Tecan Group Ltd. | 30017587 | |
| Matrix Electronic Multichannel Pipette | Thermo Fisher Scientific, Inc. | 2001-MTX | (or any comparable Thermo Scientific multichannel that can pipette the volumes described above) |
| Matrix Integrity Filter Tips, Sterile | Thermo Fisher Scientific, Inc. | 7435 | (or comparable tip for multichannel used) |
| Lightcycler 480 SYBR Green 1 Master | Roche Group | 04 707 516 001 | |
| Lightcycler 480 Instrument II | Roche Group | 05015243001 | 384-well version |
| Lightcycler 480 Multiwell Plate 384, white | Roche Group | 04729749001 | |
| LightCycler 480 Sealing Foil | Roche Group | 04729757001 | |
| LightCycler 480 Multiple Plate Analysis Software | Roche Group | 05075122001 | |
| Eliminase Decontaminant | Decon Laboratories | 04-355-31 |
参考文献
- Bustin, A. A. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clinical Chem. 55 (4), 611-622 (2009).
- Frégeau, C. J. Automated Processing of Forensic Casework Samples using Robotic Workstations Equipped with Nondisposable Tips - Contamination Prevention. J. Forensic Sci. 53 (3), 53-533 (2008).
- O'hara, A. J. Pre-micro RNA Signatures Delineate Stages of Endothelial Cell Transformation in Kaposi Sarcoma. PLoS Pathog. 5 (4), e1000389-e1000389 (2009).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved