Method Article
マウス膝窩リンパ節の生体内イメージング
要約
2光子顕微鏡の最近の進歩により、リアルタイムを有効にしているのその場の動物モデルでのライブの組織のイメージングことにより、生理学的および病理学の両方の条件で細胞の挙動を調べるために我々の能力を高める。ここでは、マウス膝窩リンパ節の生体内イメージングを実行するために必要な準備を概説しています。
要約
リンパ節(LNS)は、戦略的適応免疫応答を準備するために末梢組織からの外来抗原の捕捉とプレゼンテーションを可能にするために体全体に配置されており、二次リンパ器官である。自然免疫と適応免疫応答の間の並置、LNは、免疫細胞の相互作用1,2を研究する理想的なサイトです。リンパ球(T細胞、B細胞およびNK細胞)、樹状細胞(DC)、マクロファージは、LNの骨髄由来細胞成分の大部分を構成しています。これらの細胞は、戦略的に自己抗原および潜在的な外来抗原3-5の効率的な監視を可能にするためにLNに配置されている。リンパ球が正常に同族抗原に遭遇するプロセスは、近年の激しい調査の対象となり、抗原受容体、接着分子、ケモカイン、およびそのような線維網状ネットワーク2,6-12として間質構造体を含む分子の連絡先の統合を含む。 前の唯一の形態、位置、およびアーキテクチャに関する答えを提供してin vivoイメージング、静的な画像に頼った捜査官、で高解像度のリアルタイム蛍光灯の開発に。これらの質問は、免疫細胞の挙動の理解に根本的なものですが、この手法の本質的な制限が解読リンパ球人身売買や動的な細胞の挙動に影響を与える環境手がかりに分析を許可されていません。最近、生体内の開発は二光子レーザー走査顕微鏡(2P-LSM)は、捜査官は現場 12月16日 のライブLNS内でダイナミックな動きと個々の細胞の相互作用を表示することができました。特に、我々と他のものは、そのコンパクトな、緻密な自然は、多様な組織のサブ構造11,17-18で大きな組織領域上の多重データ取得の利点を提供して膝LN、内のイメージ細胞挙動との相互作用にこの手法を適用している。それは私のこのテクニックは植血液の中断を必要とする組織のイメージング技術、リンパの流れ、およびシステムの最終的に細胞のダイナミクス上の追加の利点を提供していることに注意することが重要です。さらに、外植組織は、組織が外植後のイメージングのための生きたままでいる時間の非常に限られたウィンドウを持っています。動物の環境条件の適切な水分補給と監視により、撮像時間が大幅にこの生体内技術で拡張することができます。ここでは、生体内イメージングを行う目的で、マウス膝窩LNの準備の詳細な手法を提案する。
プロトコル
1。マウス·ホルダ·アセンブリ
- 下向きに100 mmのプラスチックシャーレの蓋の上に100 mmのガラスシャーレの蓋を重ねる。ガラスはほとんどプラスチック皿の中心点に触れなければならない。ステンシルとしてガラスを使用して、プラスチック製の皿の上にマークをトレースします。
- 三日月型のプラットフォームを作成するには、100 mmのプラスチックシャーレの蓋の部分を削除するには、ハンドドリル(すなわち、ドレメル)を使用します。この三日月形のプラスチック製のふたは、マウスの上部の胴(図1a)のサポートとして機能します。金属製のツイストタイでガスマスクを確保するために三日月形の蓋にある2つの穴を開けます。スーパー接着剤または同等の強力な接着剤(図1b)を用いて、ガラスペトリ皿の縁にプラスチック製の蓋を固定します。
- 接着剤2ドーム型キャップPCRチューブ(ヒンジで切断)離れて膝の皮膚フラップを固定する目的で底皿の中央に1cmのふた。
2。マウスの準備
注意:十分な練習では、1つは20-30分で、マウスの準備や手術の手順を実行することができるはずです。
- IACUC承認されたプロシージャを使用して、1L/minの流量で空気の混合物:1:1 O 2の混合イソフルランとマウス(誘導のための2から2.5パーセント、手術/イメージングのための1.5から2パーセント)を麻酔。マウスを麻酔したら、テープで鼻を介してガスマスクを固定します。マウスは、TOE及び/またはテールピンチへの応答の欠如によって完全に麻酔をかけているかどうかを判断します。イソフルランのレベルは、動物が完全に60から80回/分の間に安定した、非苦しい呼吸で鎮静されていることを確認するに応じて調整することができます。
- 右後足とマウスの鼠径部の毛を削除するには、電動トリマーを使用しています。
- 抜け毛をはらっゆっくりと綿棒で剃った領域にNairさんのローションのささやかなコートを適用します。最初のアプリケーションの1分後に、Nairさんを削除し、湿った露出した皮膚をきれいにペーパータオル。マウスが先に進む前に、清潔で乾燥していることを確認します。
- 伸筋腱を公開するには、右膝にはさみで小さな2〜3mmの切開を行います。
- マウス本体と脚が配置され、マウスホルダーの中心に沿ってVetbond適用されます。慎重に右膝窩を公開するために、ダウンして右膝で、ホルダーの上にマウスを固定します。イメージング分野の安定化を助けるために2皮弁ホルダーの間にVetbondで右膝の腱を固定します。
- ホルダーの上位プラットフォームにストレッチやテープ腕と左脚。
- 代わりに、ガスマスクを確保するためにツイストタイを使用しています。
- 解剖顕微鏡下でホルダーを配置します。 LNは、絶対にまだマウスの呼吸運動の独立したままでなければなりません。足の安定性を最適化するために手術を行っている間そのため、注意が必要である。最大に貢献していきますテール(典型的に頭の上)の位置を決定する右脚とテープの下にテールの安定性。
3。手術
- 解剖スコープ下にある間、スペースヒータや加熱パッドを使用してマウスの体温を維持します。膝窩LNの成功イメージングするためには、常に露出した組織に温かいPBSを適用することにより、組織の水分を保持するだけでなく、手術中の適切な体温を維持することが重要です。
- Betadineで皮膚を消毒する。滅菌したハサミを使用して、右ふくらはぎに皮膚を通して正中切開を行い、右大腿部の優れた部分に垂直に切断し続けています。
- いずれかの側に皮膚フラップを作成するために垂直切開線の上部にある2つの水平方向の皮膚切開を行います。
- Vetbondの両方の皮膚フラップダウン撤回と接着剤。 Vetbondを適用する前にピンと張った皮膚を引っ張るとさらに足の安定性を促進しますが、(vesseすなわち変化皮膚の緊張が血流を閉塞しないことを確認してくださいlは、色や直径)。 LNを公開する前に、足の安定性を確保するために、皮膚の他の分野ダウン糊に進みます。マウスのサイズは、余分な皮膚が接着剤にダウンがどの程度必要であるかを決定します。一般的に、より大きなマウスは皮膚がホルダーに接着することが必要になります。
- LNは、ホルダーの上にマウスの位置に応じて、膝窩静脈の右側または左側のいずれかに膝窩内にある必要があります。ミクロ解剖ピンセットや鉗子を使用して、周囲の脂肪組織や筋肉からLNを慎重に分離します。出血や外傷を最小限に抑えるために、独立した組織へのマイクロ解剖ピンセットで溶射技術を使用しています。慎重に求心性と遠心性血管や求心性リンパ管の整合性を損なうことなく膝LNを公開します。
- 追加された組織を安定させるために、正方形のカバーガラスは、血管閉塞を回避しながら、ぎりぎりLNに触れて、湿ったLN上に配置されることがあります。カバーガラスはSECURかもしれませんマウスのいずれかの側に粘土をモデリングするとED。
- 様々なサイズ(例えばTRITC-デキストラン、70kDaの最小値)の蛍光血管色素は、撮影時のLNの構造的関係と整合性を強調するために、この時点で静脈内に導入することができる。
4。 2光子イメージングの取得**
- LNが十分に露出されると安定性が達成されたら、速やかに37℃に保た環境顕微鏡チャンバー℃でプログラマブルな温度フィードバック制御ヒーティングパッドを装備顕微鏡ステージ上に全体のマウス·ホルダ·アセンブリを転送水没LNをするのに十分な滅菌暖かい(37℃)PBSまたはHBSSを追加します。ボリュームは、マウスのサイズと配置に応じて変更されます。また、温かいPBSまたはHBSSは、蠕動ポンプに取り付けられた微細なガラスピペットを介して解剖LNに直接適用され、浸レンズ対物レンズの列にテープで固定することができます。液体の流れがそのようにすべきである安定した水柱は、レンズと組織の間で維持することができます。
- 37℃でPBSまたはHBSS温度を維持°Cのフィードバックプローブを用いて加熱パッドを使用します。独立した温度プローブは、36.5から37.5℃の範囲でPBSの温度を確認するには、マウスホルダーに配置する必要があります直腸プローブはまた、イメージングセッションを通して、実験マウスの中核体温を監視するために使用されることがあります。
- 目的の下にガイドLNの配置を支援するために落射蛍光灯を使用しています。希望する細胞間相互作用(通常は各xyzの画像スタックの間に10秒〜1分)に適した時間間隔を用いた蛍光画像スタックを取得します。
- 目視検査したり、動物のモニタリングシステムを用いて頻繁に顕微鏡チャンバー内に動物の状態を監視します。マウスが完全につま先および/または爪のピンチへの応答の欠如により麻酔し、60〜80 Bの間の安定した、非苦しい呼吸であるかどうかを判断reaths /分。イソフルランのレベルは、動物が完全に鎮静されていることを確認するに応じて調整することができます。適切な監視と水和して、動物は4-6時間のために撮影されるか、あるいは長くすることができます。
- イメージング実験の後、IACUC承認された安楽死のプロトコルを使用して、CO 2チャンバーで動物を安楽死させる。動物は安楽死の前に麻酔から出てくることを許してはならない。
**この手術はまた、2P-LSM以外の生体内イメージングの他の形態のために役に立つかもしれません。
5。代表的な結果
様々な循環免疫細胞移入後に異なるレートでLNに動員されています。 CD4 +およびCD8 +リンパ球、これらの細胞は2〜4時間6,17-18後、膝窩LNに到着した実質的な数字のIV転送後、高内皮細静脈(HEV)分を介してLNに到着し始める。 Bセルのためにlsは、かなりの数が8から24時間19後、蓄積されます。活性化樹状細胞は、足蹠注射3,11,16-17以下の排出膝窩LN 8から16時間以内に表示されるように開始する必要があります。図2aには、他のランドマークがない、そのようなB細胞濾胞として構造が2P-LSM 19歳未満に見える丸い球状の細胞の蓄積によって容易に識別できることを示しています。このようなユビキチン-GFPの脾細胞(図2、補足動画1と2)の内因性蛍光レポーターを使用して、1つは、非刺激性の生理学的条件の下で週に日、これらのリンパ球の移行や行動を追跡することができます。マルチチャンネルの高感度検出器と、それは構造情報だけでなく、17,19、複数の携帯パートナー間の相互作用のダイナミクスを含む多重イメージングのデータセットを取得することが可能です。
手術手技が適切に実行され、環境条件が注意深く監視され、lymphocy図2C、2Dおよび他13-14,16で示すようにTESは、特徴的な移動速度を示すべきである。リンパ球はまた、血管(のような容器染料の導入によって強調表示された)のようなので、追加のマークは、全体的な画像品質(すなわち、適切な温度制御を判断するのに役立ちますが、イメージングを受けたLNのサブ領域に応じて移動速度の違いを示すことができる、LN等への最小限の外傷)3,6,20。

図1。マウス膝窩LNイメージングのためのマウスホルダーの建設 )は、マウス·ホルダ·アセンブリの概略図; b)の代表的な生体マウスの準備、c)に完成したマウス·ホルダ·アセンブリと、d)手術の暴露後窩LNの景色をクローズアップ。
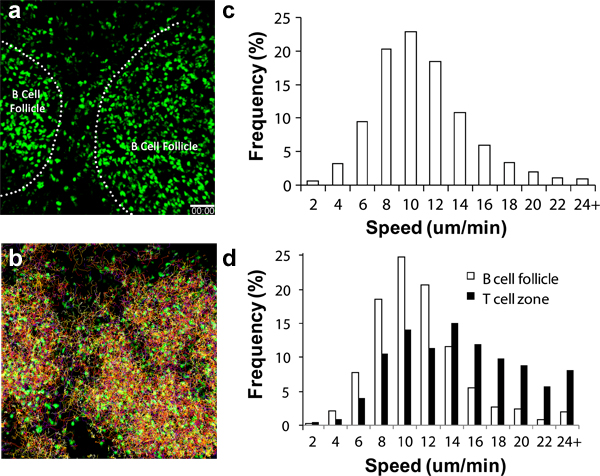
図2。 GFP +リンパ球の移行解析膝窩LNに(a)はC57BL / 6レシピエントマウスに膝LNの2P-LSMの撮像シーケンスから取得した3Dスナップショットは、養子前の画像への1×10 7 GFP +リンパ球が1日に転送されます。破線は、B細胞濾胞の境界を示し、(b)の連続撮影1時間の間にリンパ球遊走の曲、全体のリンパ球遊走速度のc)の分布。 B細胞濾胞(オープンバーで見出される細胞のd)の差動細胞の移行速度分布;速度= 10.04±4.26μm/分を(解析15125トラックの合計)平均= 8.79±3.90μm/分の速度を意味し、合計1525トラックを分析)とT細胞ゾーン(黒棒、平均速度= 13.77±5.93μm/分、分析した1250トラックの合計)。スケールバー=50μmである。
補足ビデオ1、図2で説明したマウス膝窩のLNのタイムラプス生体2P-LSMのイメージング。 1×10 7リンパ球の合計が単離されたFROMユビキチン-GFP +ドナーマウスと養子、24時間イメージングする前に、C57BL / 6レシピエントマウスに静脈内転送されます。 xyのシリーズは(750μmのX 750μm)の蛍光画像は20秒ごとに繰り返されたXYZ画像のスタック(750μmのX 750ミクロン×65μm)を、得るために固定のZスタック(5μmのステップ、13ステップ)を介して撮影された60分の合計は、速度解析(図2C、2D)のxyzt撮像シーケンスの結果。再生速度= 450X。スケールバー=50μmである。タイムスタンプ=分:秒。 補足ビデオを見るにはここをクリックしてください 。
補足ビデオ2ズーム·イン、B細胞の毛包でのサプリメンタル·ビデオ1の撮像シーケンスの観点から- 。T細胞ゾーンの境界線。再生速度= 450X。スケールバー=25μmである。タイムスタンプ=分:秒C補足ビデオを見るにはここをなめる。
ディスカッション
特に現場のイメージング技術、2P-LSM の高解像度での最近の進歩は、 生体内での動的な細胞挙動の研究への関心の高まりを伴っています。ライブマウスの膝窩LN上の4Dイメージング技術は、undisrupted組織微小環境内で免疫細胞の動的挙動のそのような分析を可能にします。可視スペクトル全体にまたがる複数の検出器と2P-LSMを使用すると、複数の細胞集団の同時イメージングデータ収集を可能にします。これは現在(有機蛍光細胞色素を用いた差動標識細胞集団の移入の使用と組み合わせてin vivoで細胞特異的な蛍光レポーターマウス(例えば、ユビキチン-EGFP-RFP、または-ECFP) での使用によって達成することができます例えば、CFSE 、SNARF-1、セルトラッカーオレンジ)LN内の細胞のメカニズムと機能を調べることができます。差動追跡cとの間の相互作用の直接観測に加えてエルの人口は、多重イメージングのデータセットには、さらに細胞の挙動と機能を解明するために市販の画像処理ソフトウェアのプログラム(例えばImaris、ビットプレーン社製)でさらに分析を受けることができます。可能性の広範な配列は、in vivoおよびin silicoでのテクニックでこれらを使用して細胞の相互作用のメカニズムを研究するために存在しています。
ここで説明する実験的なアプローチの主な制限は、手術のアプローチに内在する技術的な複雑さです。このテクニックは、関連する解剖と正確な技術的手続きと、このプロトコルで必要とされるスキルに精通するための厳しい訓練を必要とします。さらに複雑な要因は、撮像中に組織の安定性を最適化し、撮像実験の前と間にLNにサーマル、レーザー損傷を防止するため、LNの探査中に組織の損傷を最小限に抑えることの難しさがあります。これらの要因のいずれかへの摂動は、より少なくより最適なリンパ節になりますocyte運動したがって、イメージングデータの解析結果としての適切な解釈に干渉します。
開示事項
著者らは、開示には何もありません。
謝辞
この作品は、NCI 1R01CA154656、NIAID 1R21AI092299、がん研究所、聖剣帯財団、ダナ財団、ガブリエルのエンジェル財団、アメリカの現代(ヒョンデ)自動車の "ホープ·オン·ホイール"プログラムからの助成金によってサポートされています。
資料
試薬会社概要カタログ番号鉗子、グレーフェアイリス、カバーカバー
| Name | Company | Catalog Number | Comments |
| イソフルラン、USP | バクスターヘルスケア株式会社 | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Nairさん - 脱毛ローション | Nairさん | ||
| PBS、1X | Cellgro | 21-040-CV | |
| 暖房パッド | ワトロー | ||
| 暖房パッドコントローラ | ワトロー | ||
| 航空O 2 | Airgasの | ||
| 温度プローブ | ハーバード装置 | ||
| ピンセットデュモン第5位 | 世界の精密機器株式会社 | 14101 | |
| 世界の精密機器株式会社 | 14141 | ||
| はさみ | Roboz手術器具(株)、(株) | RS-5880 | |
| コーニング | 70165-102 | ||
| コーニング | 430167 | ||
| Betadine溶液(10%Povidine-ヨウ素外用ソリューション) | パデュー製品、LP | NDC 67618-150-08 |
参考文献
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved