Method Article
Imagem intravital do Linfonodo Popliteal Rato
Neste Artigo
Resumo
Recentes avanços em 2-fotão microscopia permitiram em tempo real Em Imagiologia in situ de tecidos vivos em modelos animais, aumentando assim a nossa capacidade para investigar o comportamento celular em condições fisiológicas e patológicas. Aqui, destacamos os preparativos necessários para realizar imagens intravital do linfonodo poplíteo do rato.
Resumo
Os gânglios linfáticos (LNS) são órgãos linfóides secundários, os quais são estrategicamente localizados ao longo do corpo para permitir a captura e apresentação de antigénios estranhos dos tecidos periféricos para prime a resposta imunitária adaptativa. Justapostos entre inata e adaptativa respostas imunes, a LN é um local ideal para estudar células imunes 1,2 interações. Linfócitos (células T, células B e células NK), células dendríticas (DCS), e macrófagos compreendem a maior parte das derivadas da medula óssea elementos celulares do LN. Estas células estão estrategicamente posicionados na LN para permitir uma eficiente fiscalização antígenos próprios e potenciais antígenos estranhos 3-5. O processo pelo qual os linfócitos com sucesso encontrar antígenos cognatas é um assunto de investigação intensa nos últimos anos, e envolve uma integração de contactos moleculares, incluindo receptores de antigénios, moléculas de adesão, quimiocinas, e estruturas do estroma, tais como a rede de fibro-reticular 2,6-12 . Antes do desenvolvimento de alta resolução em tempo real fluorescente in vivo de imagens, os pesquisadores contavam com imagem estática, que só oferece respostas sobre morfologia, posição e arquitetura. Enquanto essas questões são fundamentais na nossa compreensão do comportamento de células imunes, as limitações intrínsecas com esta técnica não permite uma análise de decifrar o tráfico de linfócitos e pistas ambientais que afetam o comportamento dinâmico da célula. Recentemente, o desenvolvimento de intravital dois fótons de microscopia de varredura a laser (2P-LSM) permitiu que os investigadores para ver os movimentos dinâmicos e interações de células individuais dentro LNs ao vivo em 12-16 situ. Em particular, nós e outros têm aplicado esta técnica para o comportamento da imagem celular e interacções dentro do LN poplítea, onde a sua natureza, compacto denso oferece a vantagem de aquisição de dados multiplex ao longo de um grande área de tecido com o tecido diversas sub-estruturas 11,17-18 . É iÉ importante notar que esta técnica oferece benefícios adicionais sobre as técnicas tecido explantado de imagem, as quais requerem a interrupção do sangue, fluxo linfático, e, finalmente, a dinâmica celulares do sistema. Além disso, os tecidos explantados têm uma janela de tempo muito limitado em que o tecido permanece viável para geração de imagens após explante. Com a hidratação adequada e monitoramento das condições ambientais do animal, o tempo de imagens pode ser significativamente ampliado com esta técnica intravital. Aqui, apresentamos um método detalhado de preparação LN rato poplítea com a finalidade de realizar imagens intravital.
Protocolo
1. Assembléia Titular do mouse
- Sobrepor a tampa de um 100-mm placa de Petri de vidro no topo de uma tampa prato de 100 mm de plástico Petri virado para baixo. O vidro deve ser quase sem tocar no ponto central do prato de plástico. Usar o vidro como um estêncil, traçar uma marca para o prato de plástico.
- Usar uma broca de mão (isto é, Dremel) para remover uma porção de uma tampa prato de 100 mm de plástico para criar uma plataforma em forma de crescente. Esta tampa de plástico em forma de crescente irá servir como um suporte para a parte superior do tronco do rato (Figura 1a). Faça dois furos na tampa em forma de crescente para garantir a máscara de gás com um laço de torção metal. Fixar a tampa de plástico para a borda da placa de Petri de vidro usando super cola ou um adesivo equivalentemente forte (Figura 1b).
- Cole as tampas de duas abobadado-tampão de PCR tubos (cortado na dobradiça) 1 cm de distância do centro do prato de fundo para o propósito de ancoragem retalhos poplíteos.
2. Preparação do mouse
Nota: Com a prática, deve ser capaz de realizar a preparação do mouse e passos cirúrgicos em 20-30 minutos.
- Anestesiar o rato com isoflurano (2 a 2,5% para a indução, 1,5 a 2% para a cirurgia / imaging) misturado em 1:1 O 2: mistura de ar com um caudal de 1l/min usando um procedimento IACUC-aprovado. Uma vez que o mouse está anestesiado, garantir uma máscara de gás sobre o nariz com fita adesiva. Determinar se o mouse está totalmente anestesiado pela falta de resposta aos pés e / ou pitadas de cauda. O nível de isoflurano pode ser ajustada em conformidade para assegurar que o animal está totalmente sedado, com uma constante, não-trabalhado taxa respiratória entre 60-80 respirações / min.
- Use um cortador elétrico para remover os pêlos na perna traseira direita e região inguinal do rato.
- Escove o cabelo solto longe e suavemente aplique uma camada de loção Nair modesto para a área raspada com um cotonete. Após um minuto de aplicação inicial, remover o Nair e limpar a pele exposta com uma humidadetoalha de papel. Verifique se o mouse está limpa e seca antes de prosseguir.
- Fazer uma incisão milímetros de pequenas dimensões 2 a 3, com uma tesoura no joelho direito para expor o tendão extensor.
- Aplicar Vetbond ao longo do centro do titular do rato em que o corpo do rato e da perna será posicionado. Cuidadosamente garantir o mouse sobre o titular, com o joelho direito para baixo, para expor a fossa poplítea direita. Fixe o tendão do joelho direito com Vetbond entre os 2 suportes de retalhos cutâneos para ajudar a estabilizar o campo de imagem.
- Estiramento ea fita dos braços e das pernas esquerda para a plataforma superior do suporte.
- Use um laço de torção para garantir a máscara de gás no local.
- Coloque o suporte sob o microscópio de dissecção. O LN deve permanecer absolutamente imóvel, independente do movimento de respiração do mouse. Por conseguinte, devem ser tomadas precauções durante a realização da cirurgia, para optimizar a estabilidade da perna. Determinar a posição da cauda (tipicamente acima da cabeça), que vai contribuir para a maiorestabilidade para a perna direita e fita a cauda para baixo.
3. Cirurgia
- Enquanto no âmbito dissecção, manter a temperatura do mouse corpo usando um aquecedor ou uma almofada de aquecimento. Para imagem bem sucedida da LN poplítea, é crítico para sustentar a temperatura do corpo adequada em toda a cirurgia, bem como para preservar a humidade do tecido através da aplicação constante de PBS morno para o tecido exposto.
- Esterilizar a pele com Betadine. Utilizando uma tesoura estéreis, fazer uma incisão na linha média através da pele à direita meados de vitelo, e continuar o corte verticalmente para cima para a porção superior da coxa direita.
- Faça duas incisões na pele horizontal na parte superior da linha de incisão vertical para criar as abas de pele de cada lado.
- Recolha e cola abaixo de ambos os retalhos cutâneos com Vetbond. Puxar a pele esticada antes de aplicar Vetbond continuará a promover a estabilidade da perna, no entanto, certifique-se que a tensão da pele não obstruir o fluxo de sangue (ou seja, alterações na vessëcor l ou diâmetro). Continuar a cola para baixo outras áreas da pele para assegurar a estabilidade da perna antes de expor o LN. O tamanho do mouse irá determinar o quanto a pele extra é necessário para cola para baixo. Tipicamente, os ratinhos maiores irá exigir mais pele para ser colada ao titular.
- O LN deve estar dentro da fossa poplítea, quer para a direita ou esquerda da veia poplítea, dependendo do posicionamento do mouse sobre o titular. Separe cuidadosamente a LN dos tecidos adiposos e dos músculos que cercam usando micro-dissecção pinças e pinças. Para minimizar a hemorragia e trauma, utilizar as técnicas de espalhamento com micro-dissecando pinças para tecidos separados. Cuidadosamente expor o LN poplítea sem comprometer a integridade dos vasos sanguíneos aferentes e eferentes e os vasos linfáticos aferentes.
- Para a estabilidade do tecido adicionada, uma tampa de vidro quadrada pode ser posicionada sobre o LN molhada, quase sem tocar o LN evitando ao mesmo tempo de oclusão do vaso. A tampa de vidro pode ser secured com a modelagem de argila em ambos os lados do rato.
- Corantes fluorescentes vasos de vários tamanhos (por exemplo, TRITC-dextrano, mínimo de 70kDa) pode ser introduzido por via intravenosa, neste ponto para ajudar a realçar a relação estrutural e integridade da LN durante imagem.
4. 2-Photon Aquisição de imagem **
- Uma vez que o LN é adequadamente exposto e para a estabilidade é conseguida, prontamente transferir todo o conjunto de porta do rato para a fase microscópio equipado com uma temperatura de almofada de feedback programável de aquecimento controlado, em uma câmara de microscópio ambiental mantida a 37 ° C. Adicionar o suficiente estéril quente (37 ° C) ou PBS HBSS para submergir o LN. O volume irá mudar, dependendo do tamanho e da colocação do rato. Alternativamente, PBS morno ou HBSS pode ser aplicado directamente ao LN dissecados através de uma pipeta de vidro fino equipado a uma bomba peristáltica e colada à coluna da lente objectiva de imersão. O fluxo do líquido deve ser tal que umacoluna de água estável pode ser mantida entre a lente eo tecido.
- Manter a temperatura PBS ou HBSS a 37 ° C utilizando uma almofada de aquecimento com uma sonda de realimentação. Uma sonda de temperatura separado deve ser colocado no suporte do rato para confirmar a temperatura da PBS na gama de 36,5-37,5 ° C. Uma sonda rectal podem também ser utilizados para monitorizar a temperatura corporal do rato ao longo da sessão experimental de imagem.
- Use uma lâmpada epi-fluorescente para ajudar a orientar a colocação LN no âmbito do objectivo. Adquira pilhas de imagens fluorescentes usando intervalos de tempo que são apropriados para a interação desejada celular (tipicamente minutos 10 segundos a 1 entre cada pilha imagem xyz).
- Monitorizar o estado do animal na câmara de microscópio com frequência por inspecção visual ou usando um sistema de monitorização animal. Determinar se o mouse está totalmente anestesiado pela falta de resposta aos pés e / ou pitadas de unha, e uma constante, a taxa de não-trabalhado respiratória entre 60-80 breaths / min. O nível de isoflurano pode ser ajustada em conformidade para assegurar que o animal está totalmente sedado. Com acompanhamento adequado e hidratação, os animais podem ser visualizados por 4-6 horas, ou possivelmente mais.
- Após a experiência de imagem, euthanize do animal em uma câmara de 2 CO usando IACUC-aprovado protocolo eutanásia. O animal não deve ser autorizado a sair da anestesia antes da eutanásia.
** Este procedimento cirúrgico pode também ser útil para outras formas de imagiologia intravital com excepção 2P-LSM.
5. Os resultados representativos
Várias células imunológicas circulantes são recrutados para o LN em taxas diferentes após a transferência adotiva. Para T CD4 + e CD8 +, estas células começam a chegar no LN através das altas endoteliais vénula (HEV) minutos após iv de transferência com números substanciais que chegam à LN poplítea após 2 a 4 horas 6,17-18. Para B cells, um número substancial irá acumular-se depois de 8 a 24 horas 19. DCs ativadas devem começar a aparecer nos drenagem poplítea LN 8 a 16 horas após a injeção pata 3,11,16-17. Figura 2a mostra que, mesmo sem outros marcos, estruturas como folículos de células B pode ser percebido facilmente pelo acúmulo de células redondas esférico visível sob 2P-LSM 19. Usando um repórter fluorescente endógeno, tais como os esplenócitos ubiquitina-GFP (Figura 2, videos Suplementar 1 e 2), pode-se controlar estas migrações de linfócitos e comportamentos de dias até uma semana sob-estimulatórias não condições fisiológicas. Com multi-canal detectores de alta sensibilidade, é possível adquirir um conjunto de dados de imagem multiplex que engloba informações estruturais, bem como a dinâmica de interação entre os vários parceiros celulares 17,19.
Quando as técnicas cirúrgicas estão devidamente executadas e as condições ambientais cuidadosamente monitorizados lymphocy,TES deve exibir velocidade de migração característica, como demonstrado na Figura 2c, 2d e noutros locais 13-14,16. Os linfócitos também podem apresentar diferenças na velocidade de migração em função das sub-regiões da imagem LN passando, assim marcos adicionais, tais como vasos sanguíneos (como destaque para a apresentação de corantes de navios) vai ajudar a determinar a qualidade de imagem global (ou seja, controle de temperatura adequada , um mínimo de trauma para LN, etc) 3,6,20.

Figura 1. Construção de um titular do mouse para mouse poplítea LN imagem a) Esquema de montagem titular rato;. B) Representante de preparação do mouse intravital; c) montagem titular Concluído mouse; d) Close-up vista para o LN poplítea após a exposição cirúrgica.
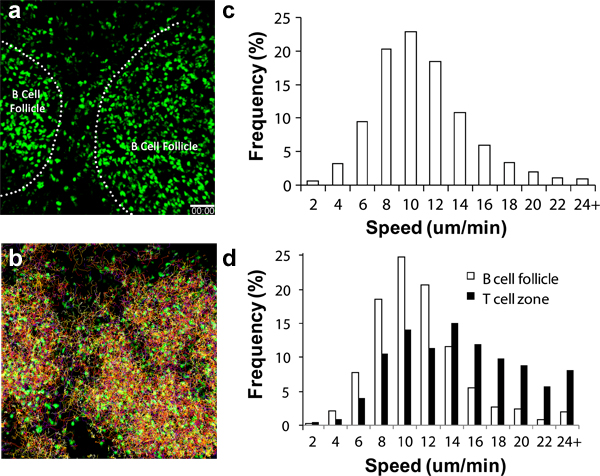
Figura 2. Análise de migração de GFP + linfócitosno LN poplítea. (a) instantâneo 3D tomadas a partir de 2P-LSM sequência de imagens da LN poplítea em um rato receptor C57BL / 6 adotivamente transferida com 1x10 GFP + 7 linfócitos 1 dia antes da criação de imagens. Linha traço indica a fronteira de folículos das células B, (b) Faixas de migração de linfócitos durante 1 hora de imagiologia contínua; Distribuição c) da velocidade de migração global de linfócitos. Velocidade média = 10,04 ± 4,26 mM / min (total de 15,125 faixas analisadas), d) Diferencial de distribuição velocidade celular migração de células encontradas no folículo de células B (bares abertos; velocidade média = 8,79 ± 3,90 mM / min; total de 1.525 faixas analisadas ) e células T de zona (bares fechados, a velocidade média = 13,77 ± 5,93 mM / min; total de 1.250 faixas analisadas). Barra de escala = 50 mM.
Suplementar vídeo 1. Tempo-lapso intravital imagiologia 2P-LSM de um rato LN poplítea como descrito na Figura 2. Um total de 1x10 7 linfócitos foram isolados from um ubiquitina-GFP do rato dador + e adotivamente transferido por via intravenosa em um rato receptor C57BL / 6 24 horas antes de imagem. Uma série de xy (750 uM x 750 mm) imagens de fluorescência foram tomadas através fixo z pilhas (5 passos mM, 13 passos) para se obter um xyz pilha de imagem (750 uM x 750 uM x 65 mm), que foi repetido a cada 20 segundos para um total de 60 minutos, resultando numa sequência de imagens xyzt para análise de velocidade (Figuras 2c, 2d). Reprodução = velocidade 450X. Barra de escala = 50 mM. Carimbo de tempo = min: seg. Clique aqui para assistir vídeo suplementar .
Suplementar vídeo 2 Zoomed-, tendo em conta a sequência de imagens de vídeo em suplementar 1 no folículo célula B -. T fronteira da zona de célula. Reprodução = velocidade 450X. Barra de escala = 25 mM. Carimbo de tempo = min:. Seg Clamber aqui para assistir ao vídeo suplementar.
Discussão
Recentes avanços em alta resolução nas técnicas de imagem in situ, em especial 2P-LSM, têm sido acompanhadas por um interesse crescente no estudo do comportamento celular dinâmica in vivo. A técnica de imagem 4D no LN poplítea de um rato vivo permite que tais análises do comportamento dinâmico de células imunes no tecido ininterrupto micro-ambiente. A utilização de 2P-LSM com detectores múltiplos abrangendo todo o espectro visível permite simultânea de imagens de recolha de dados de populações de células múltiplas. Isto pode agora ser alcançado através da utilização de in vivo de células específicas ratinhos repórter fluorescentes (por exemplo, ubiquitina-EGFP,-RFP, ou-eCFP) combinados com a utilização de transferência adoptiva de populações de células diferencialmente rotulados com orgânicos corantes de células fluorescentes (por exemplo, CFSE , Snarf-1, e Cell Rastreador Orange) para examinar os mecanismos celulares e função dentro da LN. Além da observação direta das interações entre c diferencialmente rastreadopopulações ell, o conjunto de dados de imagem multiplex pode sofrer uma análise mais aprofundada com o comercialmente disponíveis programas de processamento de imagem de software (por exemplo Imaris, BitPlane Inc.) para elucidar o comportamento das células e função. Uma ampla gama de possibilidades existe para estudar mecanismos de interação celulares usando estes in vivo e in silico técnicas.
A principal limitação da abordagem experimental aqui descrito é a complexidade técnica inerente à abordagem da cirurgia. Esta técnica requer um rigoroso treinamento para se familiarizar com a anatomia relevante e os procedimentos técnicos precisos e habilidades exigidos por este protocolo. Outros factores que complicam incluem a dificuldade em minimizar danos nos tecidos durante a exploração LN, optimizar a estabilidade do tecido durante a imagem, e prevenir a lesão térmica e de laser para o LN antes e durante a experimentação de imagem. Perturbação de qualquer um desses fatores irá resultar em menos do que ideal linfamotilidade ocyte e, portanto, interferir com a correcta interpretação do resultado de análises de dados de imagem.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho é suportado por concessões do NCI 1R01CA154656, NIAID 1R21AI092299, Cancer Research Institute, da Fundação St. Baldrick, a Fundação Dana, Gabrielle Angel Foundation, e Hyundai Motors da América "esperança sobre rodas" Programa.
Materiais
Reagente Empresa Número Catálogo
| Name | Company | Catalog Number | Comments |
| O isoflurano, USP | Baxter Healthcare Corporation | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Nair - loção depilação | Nair | ||
| PBS, 1X | Cellgro | 21-040-CV | |
| Almofada de aquecimento | Watlow | ||
| Aquecimento Pad Controlador | Watlow | ||
| Ar e O 2 | Airgas | ||
| Sonda de temperatura | Harvard Apparatus | ||
| Pinças Dumont # 5 | World Precision Instruments, Inc | 14101 | |
| Fórceps, Graefe Iris, 7 cm de curvatura | World Precision Instruments, Inc | 14141 | |
| Tesouras | Roboz Surgical Instrument Co., Inc | RS-5880 | |
| Capa de 100x20 milímetros placa de cultura de células de vidro | Corning | 70165-102 | |
| Capa de 100x20 milímetros placa de cultura de poliestireno celular | Corning | 430167 | |
| Solução Betadine (10% da solução de iodo-Povidine tópico) | Purdue Products, LP | NDC 67618-150-08 |
Referências
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados