Method Article
Прижизненные изображения с помощью мыши подколенный лимфатический узел
В этой статье
Резюме
Последние достижения в области 2-фотонного микроскопа позволило в режиме реального времени В Месте изображений живых тканей на животных моделях, тем самым повышая нашу способность исследовать клеточный поведения и физиологических и патологических состояниях. Здесь мы приводим препараты, необходимые для выполнения прижизненных изображений мыши подколенных лимфатических узлов.
Аннотация
Лимфатические узлы (LNS) являются вторичных лимфоидных органах, которые стратегически расположенных по всему телу, чтобы обеспечить захват и представление чужеродных антигенов из периферических тканей к главному адаптивного иммунного ответа. Сопоставляются между врожденной и адаптивной иммунной реакции, LN является идеальным местом для изучения взаимодействия клеток иммунной 1,2. Лимфоциты (Т-лимфоциты, В-лимфоциты и NK клеток), дендритные клетки (ДК) и макрофаги составляют большую часть костного мозга, полученных клеточных элементов LN. Эти клетки расположены в стратегически Л.Н., чтобы эффективный надзор за себя антигенов и потенциальных чужеродных антигенов 3-5. Процесс, при котором лимфоциты успешно сталкиваются родственные антигенам является предметом интенсивных исследований в последние годы, и включает в себя интеграцию молекулярной контактов, включая антиген рецепторов, молекул адгезии, хемокинов и стромальных структур, таких как фиброзно-ретикулярной сети 2,6-12 . До развития высокого разрешения в режиме реального времени в естественных условиях флуоресцентного изображения, исследователи опирались на статических изображений, которые предлагает только ответы по морфологии, положение и архитектуры. Хотя эти вопросы являются основополагающими в нашем понимании иммунной поведение клетки, внутренние ограничения с этой техникой не позволяет расшифровать анализ лимфоцитов торговли и окружающей среды ключи, которые влияют на динамическое поведение клетки. В последнее время развитие прижизненный двухфотонной лазерной сканирующей микроскопии (2P-МНК) позволило исследователям для просмотра динамического движения и взаимодействия отдельных клеток в живых LNS на месте 12-16. В частности, мы и другие применили этот метод к изображению сотовой поведения и взаимодействия в подколенной Л.Н., где ее компактные, плотные природа дает преимущество приобретения мультиплексирования данных на большой площади ткани с разнообразными ткани субструктур 11,17-18 . Это яВажно отметить, что эта техника предоставляет дополнительные преимущества за эксплантированных ткани методов визуализации, которые требуют нарушения крови, лимфы и, наконец, клеточной динамики системы. Кроме того, эксплантированных ткани имеют очень ограниченный промежуток времени, в которой ткань остается жизнеспособной для работы с изображениями после эксплантов. При правильной гидратации и мониторинга состояния окружающей среды животных, изображения времени могут быть существенно расширены с этой прижизненной техники. Здесь мы представляем подробный способ приготовления Л. мыши подколенной с целью проведения прижизненного изображения.
протокол
1. Ассамблея мыши держатель
- Перекрытие обложке 100-мм стекло чашки Петри на вершине 100-мм пластиковую чашку Петри крышкой вниз. Стекло должно быть едва касаясь центральной точки пластиковые тарелки. Использование стекла в качестве трафарета, проследить знак на пластиковую тарелку.
- Использование ручной дрелью (т.е. Dremel), чтобы удалить часть 100-мм пластиковой крышкой блюдо создать в форме полумесяца платформы. Это в форме полумесяца пластиковой крышкой будет служить опорой для верхней части туловища с помощью мыши (рис. 1а). Просверлите два отверстия в форме полумесяца крышкой для обеспечения противогаз с галстуком поворот металла. Закрепите пластиковой крышкой на краю стеклянной посуде Петри с помощью супер клей или клей самое сильное (рис. 1б).
- Клей крышки двух куполообразной крышкой пробирки для ПЦР (сокращение на шарнире) 1 см друг от друга в центре нижней блюдо для крепления подколенной кожные лоскуты.
2. Мышь подготовка
Примечание: При достаточной практике, должны быть в состоянии выполнять подготовку мыши и хирургические шаги в 20-30 минут.
- Анестезию мыши с ИФ (от 2 до 2,5% для индукции от 1,5 до 2% за операцию / изображений) смешивают в соотношении 1:1 O 2: смеси на расход 1L/min использованием IACUC утвержденной процедурой. Когда мышь находится под наркозом, обеспечить противогаз за нос ленту. Определить, если мышь находится полностью под наркозом в связи с отсутствием ответа на носок и / или хвост соль. Уровень ИФ может быть скорректирована для обеспечения животных полностью в отключке, с постоянной, не трудился частота дыхания 60-80 вдохов / мин.
- Используйте электрический триммер для удаления волос на правой задней ноги и паховые области мышью.
- Удалить щеткой отстающий волосы и аккуратно применять скромные слой лосьона Наир на бритой области с ватного тампона. Через минуту из первоначальной заявки, удалите Наир и очистить загрязненные участки кожи влажнойбумажным полотенцем. Убедитесь, что мышь является чистым и сухим, прежде чем продолжить.
- Сделайте небольшой 2 до 3 мм разрез ножницами на правое колено, чтобы разоблачить разгибателей сухожилие.
- Применить Vetbond по центру мыши держатель, где тело мыши и ноги будут размещены. Тщательно обеспечить мыши на держатель, с правым коленом вниз, чтобы разоблачить правой подколенной ямки. Закрепить право коленного сухожилия с Vetbond между 2 держателя кожный лоскут, чтобы помочь стабилизировать изображение поля.
- Натяжные и лентой руки и левую ногу на верхнюю площадку владельца.
- Используйте поворот галстук для обеспечения противогаз на месте.
- Поместите держатель под микроскопом рассечение. Л.Н. должна оставаться абсолютно все равно, независимо от дыхания движения мыши. Таким образом, меры предосторожности должны быть приняты во время выполнения операций для оптимизации устойчивости ноги. Определить положение хвоста (как правило, выше головы), которая будет способствовать наибольшейустойчивость к правой ноге, а лента хвостом вниз.
3. Хирургия
- В то время как при вскрытии масштаба, поддерживать температуру тела мыши использовании обогревателя или грелку. Для успешной визуализации подколенной Л.Н., очень важно для поддержания надлежащей температуры тела всей операции, а также для сохранения влаги ткань, постоянно применением теплой PBS к воздействию ткани.
- Стерилизовать кожу Бетадин. Используя стерильные ножницы, сделать срединный разрез через кожу в нужное середины икры, и продолжать резки вертикально вверх к верхней части правого бедра.
- Сделайте две горизонтальные разрезы кожи в верхней части вертикальной линии разреза для создания кожных лоскутов с обеих сторон.
- Уберите и клей вниз и кожных лоскутов с Vetbond. Натяжение кожи тугой до применения Vetbond будет способствовать дальнейшему укреплению стабильности ногу, однако, убедитесь, что натяжение кожи не закрывают кровотока (например, изменения в Vesseцвет л или диаметру). Продолжайте клей вниз другие участки кожи, чтобы обеспечить стабильность в ногу, прежде чем подвергать LN. Размеры мыши определить, сколько дополнительных кожи необходимо, чтобы клей вниз. Как правило, больше мышей потребует более коже быть приклеены к держателю.
- Л.Н. должна находиться в пределах подколенной ямке или справа или слева от подколенной вены, в зависимости от размещения мыши на держателе. Аккуратно отделить от окружающих Л.Н. жировой ткани и мышц с использованием микро-рассечение пинцет и щипцы. Чтобы свести к минимуму кровотечения и травмы, используйте splaying методы микро-рассечение пинцет для разделения тканей. Тщательно подвергать подколенной Л.Н. без ущерба для целостности афферентных и эфферентных кровеносных сосудов и приносящие лимфатические сосуды.
- Для повышения устойчивости тканей, площадь остекления может быть установлен более влажный Л.Н., едва касаясь Л.Н., избегая при этом судно окклюзии. Покровного стекла может быть SECURред с пластилин по обе стороны от мыши.
- Флуоресцентные краски судно различных размеров (например, TRITC-декстран, минимум 70kDa) могут быть введены внутривенно в этот момент, чтобы помочь выделить структурные взаимосвязи и целостности Л.Н. во время съемки.
4. 2-Фотон изображений Приобретение **
- После того, Л.Н. надлежащим образом подвергаются и стабильность будет достигнута, оперативно передавать всю сборку держатель мыши на предметный столик микроскопа оснащен программируемой температуры обратной контролируемых грелку в экологическом камера микроскоп хранится при температуре 37 ° C. Добавьте достаточно стерильная теплой (37 ° C) PBS или HBSS погружаться LN. Объем будет меняться в зависимости от размера и расположения указателя мыши. Кроме того, теплая или PBS HBSS могут быть применены непосредственно к расчлененным Л.Н. через тонкую стеклянную пипетку, установленного на перистальтического насоса и приклеенный к колонке объектив погружения. Потока жидкости должно быть таким,стабильный толщу воды можно поддерживать между объективом и ткани.
- Поддерживать PBS или HBSS температуре 37 ° C помощью грелки с обратной связью датчик. Отдельный датчик температуры должен быть помещен в держатель мыши, чтобы подтвердить температура PBS в диапазоне от 36,5 до 37,5 ° C. Ректальный зонд может также быть использован для мониторинга основных температура тела экспериментальных мышей по всему изображений сессии.
- Используйте эпи-флуоресцентная лампа, чтобы руководство Л.Н. помещения под цели. Получить люминесцентные стеков изображения, используя временные интервалы, которые подходят для желаемого сотовой взаимодействия (обычно от 10 секунд до 1 минуты между каждой стопки изображений XYZ).
- Мониторинг состояния животного в микроскоп камеры часто путем визуального осмотра или с помощью системы мониторинга животного. Определить, если мышь находится полностью под наркозом в связи с отсутствием ответа на носок и / или ногтей щепотки, а также устойчивый, не трудился частота дыхания 60-80 бreaths / мин. Уровень ИФ могут быть скорректированы для того, чтобы животное полностью успокоительное средство. При правильном мониторинга и гидратации, животные могут быть отображены в течение 4-6 часов, или, возможно, дольше.
- После визуализации эксперимента, усыпить животное в CO 2 камеры использованием IACUC утвержденных эвтаназии протокола. Животное не должно быть позволено выйти из наркоза до эвтаназии.
** Эта хирургическая процедура также может быть полезна для других форм прижизненной визуализации кроме 2P-LSM.
5. Представитель Результаты
Различные циркулирующих иммунных клеток на работу в Н. с разной скоростью передачи после приемных. Для CD4 + и CD8 + лимфоцитов, эти клетки начинают поступать в LN через высокие эндотелиальные венулы (HEV) минут после внутривенного переводе с значительное число прибывающих в подколенной Л.Н. после 2 до 4 часов 6,17-18. Для B челLS, значительное число будет накапливаться после 8 до 24 часов 19. Активированный домена должны начать появляться в дренаж подколенной Л.Н. 8 до 16 часов после инъекции 3,11,16-17 подушечку. На рис.2 видно, что даже при отсутствии других ориентиров, структур, таких как В-клеток фолликулов можно выявить легко, круглые сферические накопление клеток видна под 2P-LSM 19. Использование эндогенных люминесцентные репортер, таких как убиквитин-GFP спленоцитов (рис. 2, Справочная Видео 1 и 2), можно отслеживать эти лимфоциты миграции и поведение в течение нескольких дней до недели, не связанных с стимулирующих физиологических условиях. В многоканальных детекторов высокого чувствительность, можно приобрести набор данных мультиплекс изображений, который включает в себя структурную информацию, а также динамику взаимодействия между несколькими партнерами сотовой 17,19.
При хирургических методов выполняются правильно и условий окружающей среды тщательно контролироваться, lymphocyTES должен обладать характерной скорости миграции, как показано на рисунке 2, в 2D и в других местах 13-14,16. Лимфоциты могут наблюдаться различия в миграции скорость в зависимости от суб-регионов Л.Н. проходит изображений, так что дополнительных ориентиров, таких как кровеносные сосуды (как подчеркивается введением судна красителей) поможет определить общее качество изображения (например, надлежащий контроль температуры , минимальная травма Л.Н. и др.) 3,6,20.

Рисунок 1. Строительство мыши держатель для мыши подколенной Л.Н. изображений) Схемы мыши сборки держателя. Б) представитель прижизненной подготовке мыши, в) Выполнен монтаж мыши держатель, г) крупным планом вид на подколенной Л.Н. после хирургического воздействия.
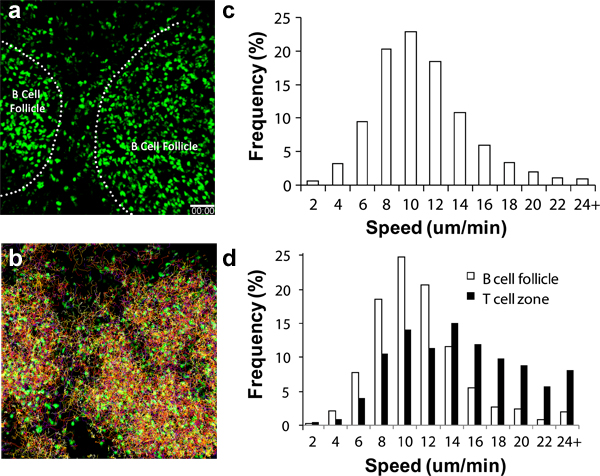
Рисунок 2. Миграция анализ GFP + лимфоцитовв подколенной LN. (а) 3D снимок взят из 2Р-LSM отображающей последовательности подколенной LN в C57BL / 6 получателя мыши восприимчиво передается с 1x10 7 GFP + лимфоцитов за 1 день до съемки. Пунктирная линия обозначает границу фолликулы В-клеток (б) Следы миграции лимфоцитов в течение 1 часа непрерывного изображения, в) распределение общих лимфоцитов скорость миграции. Средняя скорость = 10,04 ± 4,26 мкм / мин (в общей сложности 15 125 треков проанализирована), г) дифференциального клеточное распределение скорости миграции клеток в клетки фолликулов B (открытый бар, средняя скорость = 8,79 ± 3,90 мкм / мин, общее число треков проанализировали 1525 ) и Т-клеток зоны (закрытые бары, средняя скорость = 13,77 ± 5,93 мкм / мин, в общей сложности 1250 треков проанализированы). Шкала бар = 50 мкм.
Справочная Видео 1. Покадровый прижизненный 2P-LSM изображений Л.Н. мыши подколенной как показано на рис 2. В общей сложности 1x10 7 лимфоциты выделяют птОМ убиквитин-GFP + мышь доноров и восприимчиво переданы внутривенно мыши C57BL / 6 получателя за 24 часа до съемки. Серия ху (750 мкм х 750 мкм), флуоресцентные изображения были взяты через стек фиксированного г (5 мкм шагов, 13 шагов), чтобы получить стек хуг томография (750 мкм х 750 мкм х 65 мкм), который повторяется каждые 20 секунд в общей сложности 60 минут, в результате чего xyzt последовательность изображений для быстрого анализа (рис. 2в, 2г). Скорость воспроизведения = 450x. Шкала бар = 50 мкм. Штамп времени = мин: сек. Нажмите здесь, чтобы посмотреть дополнительную видео .
Справочная Видео 2 увеличенный вид изображения последовательности Справочная Видео 1 в B фолликула клетки -. Т-клеток пограничной зоне. Скорость воспроизведения = 450x. Шкала бар = 25 мкм. Штамп времени = мин. Сек Cлизать здесь, чтобы посмотреть дополнительное видео.
Обсуждение
Последние достижения в высоком разрешении на месте методы визуализации, особенно 2P-LSM, были сопровождается ростом интереса к изучению динамических сотовой поведение в естественных условиях. Техника визуализации 4D на подколенной Л.Н. живой мыши позволяет такие анализы в динамическое поведение иммунных клеток в тканях бесперебойное микро-среды. Использование 2P-МНК с несколькими детекторами, охватывающих весь видимый спектр позволяет одновременно изображения сбора данных нескольких клеточных популяций. Это теперь может быть достигнута за счет использования в естественных условиях клетки конкретного флуоресцентных мышей репортер (например, Убиквитин-EGFP, RFP-или-eCFP) в сочетании с использованием приемных передачи дифференциально помечены клеточных популяций с использованием органических флуоресцентных красителей клеток (например, CFSE , Snarf-1 и ячеек Tracker оранжевый) для изучения клеточных механизмов и функций в LN. В дополнение к прямому наблюдению взаимодействия с дифференциально гусеничныхлокоть населения, мультиплекс данных изображений может подвергаться дальнейшему анализу с помощью коммерчески доступных изображений программное обеспечение для обработки программ (например, Imaris, BitPlane Inc) для дальнейшего выяснения поведения клеток и функции. Широкий спектр возможностей существует для изучения клеточных механизмов взаимодействия с использованием их в естественных условиях и в кремнии методами.
Основным ограничением экспериментальный подход, описанный здесь, технической сложности, присущие операции подход. Этот метод требует упорных тренировок, чтобы ознакомиться с соответствующей анатомии и точные технические процедуры и навыки в соответствии с требованиями этого протокола. Еще больше осложняет факторы включают трудности в сведении к минимуму повреждение тканей при исследовании Л.Н., оптимизация ткани стабильность во время съемки, а также предотвращение теплового и лазерного повреждения LN до и во время съемки экспериментов. Возмущение в любой из этих факторов приведет к менее чем оптимальным лимфатическихocyte подвижность и, следовательно, мешают правильной интерпретации изображений в результате анализа данных.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Работа выполнена при поддержке грантов NCI 1R01CA154656, NIAID 1R21AI092299, НИИ онкологии, Фонд святого Baldrick, в Dana фонда, Габриэль Ангел фонда и Hyundai Motors Америки "Надежда на колесах» программы.
Материалы
Реагенты О компании Номер по каталогу
| Name | Company | Catalog Number | Comments |
| Изофлюран, USP | Корпорация Baxter Healthcare | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Наира - лосьон для удаления волос | Наира | ||
| PBS, 1X | CellGro | 21-040-CV | |
| Грелки | Watlow | ||
| Отопительные панели контроллера | Watlow | ||
| Воздушные и O 2 | Airgas | ||
| Датчик температуры | Гарвардского аппарата | ||
| Пинцет Дюмон # 5 | World Precision Instruments, Inc | 14 101 | |
| Щипцы, Грефе Iris, 7 см изогнутый | World Precision Instruments, Inc | 14 141 | |
| Ножницы | Roboz хирургические инструменты Ко, Inc | RS-5880 | |
| Обложка 100x20 мм стеклянной посуде культуры клеток | Corning | 70165-102 | |
| Обложка 100x20 мм полистирола блюдо культуре клеток | Corning | 430167 | |
| Бетадин раствор (10% Povidine-йод раствор для наружного применения) | Purdue продукты, LP | NDC 67618-150-08 |
Ссылки
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены