Method Article
Imagen intravital del nodo linfático poplíteo ratón
En este artículo
Resumen
Los recientes avances en microscopía de dos fotones han permitido en tiempo real En Imágenes in situ de los tejidos vivos en modelos animales, lo que mejora nuestra capacidad para investigar el comportamiento celular, tanto en condiciones fisiológicas y patológicas. Aquí, se exponen los trabajos preparatorios necesarios para realizar las imágenes intravital del nodo linfático poplíteo del ratón.
Resumen
Los ganglios linfáticos (LNS) son los órganos linfoides secundarios, los cuales están estratégicamente ubicadas en todo el cuerpo para permitir la captura y presentación de antígenos extraños de los tejidos periféricos a la animación de la respuesta inmune adaptativa. Yuxtapuesta entre la respuesta inmune innata y adaptativa, la LN es un sitio ideal para estudiar las interacciones de las células inmunitarias 1,2. Los linfocitos (células T, células B y células NK), las células dendríticas (DC) y los macrófagos constituyen el grueso de la médula ósea derivados de los elementos celulares de la LN. Estas células se colocan estratégicamente en la LN que permita un control eficiente de los antígenos propios y el potencial de antígenos extraños 3-5. El proceso por el cual los linfocitos encuentran antígenos afines con éxito es un tema de intensa investigación en los últimos años, y consiste en una integración de los contactos moleculares, incluyendo receptores de antígenos, moléculas de adhesión, quimiocinas, y las estructuras del estroma, como la red de fibro-reticular 2,6-12 . Antes del desarrollo de la alta resolución en tiempo real fluorescente de imágenes in vivo, los investigadores se basaron en las imágenes estáticas, que sólo ofrece respuestas sobre la morfología, la posición y la arquitectura. Si bien estas preguntas son fundamentales en nuestra comprensión del comportamiento de las células inmunitarias, las limitaciones intrínsecas de esta técnica no permite un análisis para descifrar el tráfico de linfocitos y pistas ambientales que afectan el comportamiento celular dinámico. Recientemente, el desarrollo de intravital microscopía de dos fotones del láser de barrido (2P-LSM) ha permitido a los investigadores ver los movimientos dinámicos y las interacciones de las células individuales dentro de LN en directo in situ 12-16. En particular, y otros han aplicado esta técnica para el comportamiento de la imagen celular y las interacciones dentro de la poplítea LN, donde su naturaleza compacta, densa ofrece la ventaja de múltiplex de adquisición de datos sobre un área grande del tejido con diversos tejidos sub-estructuras 11,17-18 . Se is importante señalar que esta técnica ofrece beneficios adicionales más explantados técnicas de tejido de imágenes, que requieren la interrupción de la sangre, el flujo de la linfa, y en última instancia, la dinámica celular del sistema. Además, los tejidos explantados tener una ventana de tiempo muy limitado en el que el tejido permanece viable para las imágenes después del explante. Con una hidratación adecuada y el seguimiento de las condiciones ambientales de los animales, el tiempo de formación de imágenes puede ser ampliado considerablemente con esta técnica intravital. A continuación, presentamos un método detallado de la preparación del ratón LN poplítea con el fin de realizar imágenes intravital.
Protocolo
1. Ratón Titular de la Asamblea
- Superponer la cubierta de un plato 100-mm Petri de vidrio en la parte superior de una tapa 100-mm placa Petri de plástico hacia abajo. El vidrio debe estar tocando apenas el punto central de la placa de plástico. Para usar el vidrio como una plantilla, trace una marca en el plato de plástico.
- Utilizar un taladro de mano (es decir, Dremel) para eliminar una porción de una tapa plato 100-mm de plástico para crear una plataforma forma de media luna. Esta tapa de plástico forma de media luna servirá como un apoyo para la parte superior del torso del ratón (Figura 1a). Haga dos agujeros en la tapa de la forma de media luna para conseguir la máscara de gas con una tira de alambre de metal. Fijar la tapa de plástico hasta el borde del plato de Petri de vidrio usando pegamento o un adhesivo equivalentemente fuerte (Figura 1b).
- Pegue las tapas de los dos tubos de tapa abovedada-PCR (cortado en la bisagra) 1 cm de distancia del centro de la placa inferior con el fin de anclar solapas poplíteos piel.
2. Preparación del ratón
Nota: Con suficiente práctica, uno debe ser capaz de realizar la preparación del ratón y pasos de la cirugía en 20-30 minutos.
- Anestesie el ratón con isoflurano (2 a 2,5% para la inducción, 1,5 a 2% para la cirugía / imagen) mezclado en 1:1 S 2: mezcla de aire a un caudal de 1L/min utilizando un procedimiento IACUC aprobado. Una vez que el ratón está anestesiado, asegurar una máscara de gas sobre la nariz con cinta adhesiva. Determinar si el ratón es completamente anestesiado por la falta de respuesta a los pies y / o pellizcos de la cola. El nivel de isoflurano puede ajustarse en consecuencia para garantizar que el animal está completamente sedado, con una constante, no trabajó la frecuencia respiratoria entre 60-80 respiraciones por minuto.
- Use una cortadora eléctrica para eliminar el vello en la pata derecha trasera y la zona inguinal del ratón.
- Cepillar el pelo suelto y suavemente aplique una capa moderada de loción Nair a la zona afeitada con un hisopo de algodón. Después de un minuto de la solicitud inicial, quitar la Nair y limpiar la piel expuesta con un paño húmedouna toalla de papel. Asegúrese de que el mouse esté limpia y seca antes de continuar.
- Haga una pequeña incisión de 2 a 3 mm con unas tijeras en la rodilla derecha para exponer el tendón extensor.
- Aplicar Vetbond a lo largo del centro del soporte del ratón donde el cuerpo del ratón y de la pierna posicionado. Con cuidado, garantizar el ratón en el soporte, con la rodilla derecha hacia abajo, para exponer el hueco poplíteo derecho. Asegure el tendón de la rodilla derecha con Vetbond entre los 2 titulares de colgajo de piel para ayudar a estabilizar el campo de la imagen.
- Estiramiento y la cinta de los brazos y la pierna izquierda a la plataforma superior del soporte.
- Utilice una tira de alambre para asegurar la máscara de gas en su lugar.
- Coloque el soporte bajo el microscopio de disección. La LN debe permanecer absolutamente inmóvil, con independencia del movimiento de la respiración del ratón. Por lo tanto, se deben tomar precauciones al realizar la cirugía para optimizar la estabilidad de la pierna. Determinar la posición de la cola (típicamente por encima de la cabeza) que contribuirá a la mayorla estabilidad a la pierna derecha y la cinta de la cola hacia abajo.
3. Cirugía
- Mientras que en el ámbito de disección, mantener la temperatura corporal del ratón usando un calentador o una almohadilla térmica. Para imágenes de éxito de la LN poplítea, es fundamental para mantener la temperatura corporal adecuada en toda la cirugía, así como para conservar la humedad del tejido mediante la constante aplicación de PBS caliente a los tejidos expuestos.
- Esterilizar la piel con Betadine. Con unas tijeras estériles, hacer una incisión a través de la piel en la mitad de la pantorrilla derecha, y continúe cortando verticalmente hasta la parte superior del muslo derecho.
- Hacer dos incisiones en la piel horizontales en la parte superior de la línea de incisión vertical para crear colgajos de piel a cada lado.
- Retirar y la cola a ambos colgajos de piel con Vetbond. Al tirar de la piel tensa antes de aplicar Vetbond promoverá aún más la estabilidad de la pierna, sin embargo, asegúrese de que la tensión de la piel no ocluir el flujo sanguíneo (es decir, cambios en el vessel color o diámetro). Continuar pegamento abajo otras áreas de la piel para asegurar la estabilidad de la pierna antes de exponer la LN. El tamaño del ratón, se determinará la cantidad de piel extra que se necesita para pegar abajo. Por lo general, los ratones más grandes requerirán más piel que se pega al titular.
- El LN deben encontrarse dentro de la fosa poplítea ni a la derecha oa la izquierda de la vena poplítea, dependiendo de la ubicación del ratón sobre el soporte. Retire con cuidado la LN a partir de tejidos adiposos y los músculos que rodean utilizando micro-disección pinzas y fórceps. Para minimizar el sangrado y el trauma, el uso de las técnicas sReproducción con micro-disección de pinzas para separar los tejidos. Descubra con cuidado el LN poplítea sin poner en peligro la integridad de los vasos sanguíneos aferentes y eferentes y los vasos linfáticos aferentes.
- Para la estabilidad del tejido añadido, una cubierta de vidrio cuadrado puede ser colocado sobre la LN húmeda, apenas tocando la LN, evitando la oclusión del vaso. La cubierta de vidrio puede ser segured con el modelado de arcilla a ambos lados del ratón.
- Los tintes fluorescentes vasos de diferentes tamaños (por ejemplo TRITC-dextrano, mínimo de 70kDa) puede ser introducido por vía intravenosa en este punto para ayudar a destacar la relación estructural y la integridad de la LN durante la exploración.
4. 2-Photon Imaging Acquisition **
- Una vez que el LN está adecuadamente expuesta y la estabilidad se logra, sin demora transferir el conjunto de ratón titular todo sobre la platina del microscopio equipado con una almohadilla de temperatura retroalimentación programable calentamiento controlado en una cámara ambiental microscopio mantuvo a 37 ° C. Agregue bastante estéril tibia (37 ° C), PBS o HBSS para sumergir la LN. El volumen cambiará según el tamaño y la colocación del ratón. Alternativamente, PBS caliente o HBSS se puede aplicar directamente a la LN diseccionaron a través de una pipeta de vidrio fino provisto de una bomba peristáltica y pegada a la columna de la lente objetivo de inmersión. El flujo del líquido debe ser tal que unacolumna de agua estable puede mantenerse entre la lente y el tejido.
- Mantener la temperatura PBS o HBSS a 37 ° C utilizando una almohadilla de calentamiento con una sonda de realimentación. Una sonda de temperatura separada debe ser colocado en el soporte de ratón para confirmar la temperatura de la PBS en el intervalo de 36,5 a 37,5 ° C. Una sonda rectal también puede ser utilizado para controlar la temperatura corporal central del ratón experimental durante todo el período de formación de imágenes.
- Utilice una lámpara de epi-fluorescencia para ayudar a guiar la colocación de LN en el marco del objetivo. Adquirir las pilas fluorescentes de imágenes utilizando intervalos de tiempo que sean apropiados para la interacción celular deseada (normalmente 10 segundos a 1 minuto entre cada pila de imágenes xyz).
- Controlar el estado del animal en la cámara de microscopio con frecuencia por inspección visual o mediante el uso de un sistema de vigilancia de los animales. Determinar si el ratón es completamente anestesiado por la falta de respuesta a los pies y / o pellizcos de las uñas, y una constante, no trabajó la frecuencia respiratoria entre 60-80 breaths por minuto. El nivel de isoflurano puede ajustarse en consecuencia para garantizar que el animal está completamente sedado. Con un control adecuado y la hidratación, los animales se pueden obtener imágenes durante 4-6 horas, o incluso antes.
- Después del experimento de imágenes, la eutanasia al animal en una cámara de CO 2 con el protocolo aprobado por el IACUC la eutanasia. El animal no se debe permitir que emergen de la anestesia antes de la eutanasia.
** Este procedimiento quirúrgico puede ser también útil para otras formas de formación de imágenes intravital distinto 2P-LSM.
5. Los resultados representativos
Varias células inmunes circulantes son reclutados a la LN a un ritmo diferente después de la transferencia adoptiva. Para CD4 + y CD8 +, estas células comienzan a llegar en la LN a través de los altos endoteliales vénula (HEV) minutos después de la transferencia IV con un número importante que llegan a la LN poplítea después de 2 a 4 horas 6,17-18. Para B celLS, un número sustancial se acumulan después de 8 a 24 horas 19. Los países en desarrollo activados debe comenzar a aparecer en los que drenan poplítea LN 8 a 16 horas después de la inyección pata 3,11,16-17. Figura 2a muestra que, incluso sin otras señales, tales como estructuras de los folículos de células B se puede discernir fácilmente por la acumulación de células redondas esférico visible bajo 2P-LSM 19. El uso de un reportero endógena fluorescente tal como los esplenocitos ubicuitina-GFP (Figura 2, vídeos complementarios 1 y 2), se puede realizar un seguimiento de estas migraciones de linfocitos y comportamientos para los días hasta una semana en condiciones no fisiológicas estimulantes. Con los detectores de múltiples canales de alta sensibilidad, es posible adquirir un conjunto de datos de imagen múltiple que abarca la información estructural, así como la dinámica de interacción entre múltiples socios celulares 17,19.
Cuando las técnicas quirúrgicas se ejecutan correctamente y las condiciones ambientales cuidadosamente controlados, lymphocytes debe exhibir la velocidad de migración característica, como se muestra en la Figura 2c, 2d y en otros lugares 13-14,16. Los linfocitos también pueden presentar diferencias en la velocidad de la migración en función de las sub-regiones de la imagen LN sufriendo, puntos de referencia para adicionales, tales como los vasos sanguíneos (como se destaca en la introducción de colorantes de buques) ayudará a determinar la calidad de imagen en general (es decir, el control de la temperatura adecuada , un mínimo trauma a la LN, etc) 3,6,20.

Figura 1. Construcción de un soporte para el ratón del ratón poplítea LN imagen a) Esquema de montaje del ratón titular;. B) Representante de preparación del ratón intravital, c) conjunto completo soporte de ratón, d) Cerrar los puntos de vista de la LN poplítea después de la exposición quirúrgica.
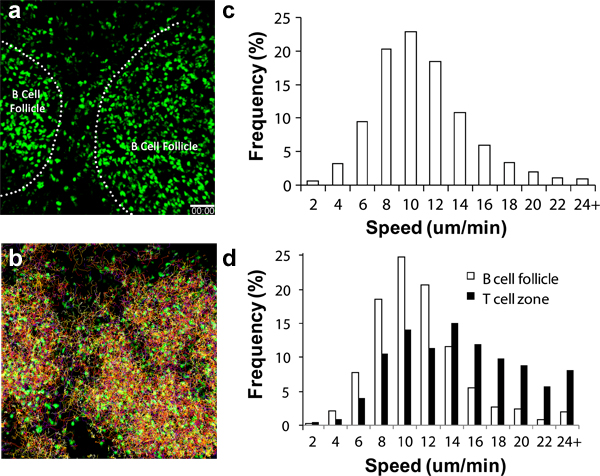
Figura 2. Migración análisis de las buenas prácticas agrarias + linfocitosen la LN poplítea. (a) de instantáneas en 3D tomada de secuencia de imágenes 2P-LSM de la LN poplítea en un ratón receptor C57BL / 6 adoptively transferido a 1x10 7 GFP + linfocitos un día antes de la imagen. Línea de trazos indica la frontera de los folículos de células B, (b) temas de la migración de linfocitos durante 1 hora continua de imágenes; c) Distribución de la velocidad en general la migración de linfocitos. La velocidad media = 10,04 ± 4,26 m por minuto (un total de 15.125 pistas analizadas), d) distribución diferencial de la velocidad de migración celular de las células que se encuentran en el folículo de células B (barras abiertas, con una media de velocidad = 8,79 ± 3,90 m / min; total de 1.525 pistas analizadas ) y la zona de las células T (barras cerradas, con una media de velocidad = 13,77 ± 5,93 m / min, de un total de 1.250 pistas analizadas). Barras de escala = 50 micras.
Suplementario de vídeo 1. Lapso de tiempo intravital 2P-LSM imagen de un ratón LN poplítea como se describe en la Figura 2. Un total de 1x10 7 linfocitos fueron aislados from una ubiquitina-GFP + ratón donante y adoptively transferido por vía intravenosa en el ratón receptor C57BL / 6 24 horas antes de la exploración. Una serie de XY (750 micras x 750 micras) imágenes de fluorescencia fueron tomadas a través de pilas z fijo (5 pasos m, 13 pasos) para producir una pila xyz de imágenes (750 micras x 750 micras x 65 micras), que se repite cada 20 segundos para un total de 60 minutos, dando como resultado una secuencia de imágenes para el análisis xyzt velocidad (Figuras 2c, 2d). Velocidad de reproducción = 450x. Barras de escala = 50 micras. Sello de tiempo = min: seg. Haga clic aquí para ver el vídeo complementario .
Suplementario vídeo 2 Zoomed-en vista de la secuencia de imágenes en vídeo de consulta 1 en el folículo de las células B -. Células T frontera zona. Velocidad de reproducción = 450x. Barras de escala = 25 micras. El sello de hora = min: seg. Clamen aquí para ver el vídeo complementario.
Discusión
Los avances recientes en alta resolución de las técnicas de imagen in situ, especialmente 2P-LSM, se han acompañado de un creciente interés en el estudio del comportamiento dinámico celular in vivo. La técnica de imagen 4D en la LN poplíteo de un ratón vivo permite este tipo de análisis en el comportamiento dinámico de las células inmunes en el tejido ininterrumpido de micro-medio ambiente. El uso de 2P-LSM con detectores múltiples que abarcan todo el espectro visible permite imágenes simultáneas de recopilación de datos de poblaciones de células múltiples. Esto ahora puede lograrse mediante la utilización in vivo de células específicas de ratones reportero fluorescentes (por ejemplo ubiquitina-eGFP, PP, o ECFP-) combinados con el uso de la transferencia adoptiva de poblaciones de células marcadas diferencialmente utilizando colorantes orgánicos de células fluorescentes (por ejemplo CFSE , SNARF-1, y la célula Rastreador de Orange) para examinar los mecanismos celulares y la función dentro de la LN. Además de la observación directa de las interacciones entre diferencialmente rastreados clas poblaciones de ell, el conjunto de datos de imagen múltiple pueden someterse a un nuevo análisis con imágenes de los programas disponibles en el mercado de software de procesamiento (por ejemplo, Imaris, Bitplane Inc.) Para aclarar aún más el comportamiento y la función celular. Una amplia gama de posibilidades que existe para estudiar los mecanismos celulares de interacción que utilizan estos in vivo e in silico técnicas.
La principal limitación del método experimental descrito aquí es la complejidad técnica inherente en el enfoque de la cirugía. Esta técnica requiere de un riguroso entrenamiento para familiarizarse con la anatomía pertinente y los procedimientos específicos y destrezas técnicas que requiere este protocolo. Para complicar aún más factores incluyen la dificultad para reducir al mínimo el daño tisular durante la exploración LN, la optimización de la estabilidad de los tejidos durante la exploración, y la prevención de lesiones térmicas y láser a la LN, antes y durante la experimentación de imágenes. Perturbación a cualquiera de estos factores dará lugar a menos que óptimo linfáticola motilidad ocyte y por lo tanto va a interferir con la correcta interpretación de los datos resultantes de imagen análisis.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo es apoyado por subvenciones del Instituto Nacional del Cáncer 1R01CA154656, el NIAID 1R21AI092299, Instituto de Investigación del Cáncer, la Fundación San Baldrick, la Fundación Dana, la Fundación Ángel de Gabrielle, y Hyundai Motors de América "La esperanza-on-Wheels" del programa.
Materiales
Reactivo Empresa Número de catálogo
| Name | Company | Catalog Number | Comments |
| Isoflurano, USP | Baxter Healthcare Corporation | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Nair - crema de depilación | Nair | ||
| PBS, 1X | Cellgro | 21-040-CV | |
| Usar una almohadilla eléctrica | Watlow | ||
| Calefacción Pad Controller | Watlow | ||
| Aire y O 2 | Airgas | ||
| La temperatura de la sonda | Aparato de Harvard | ||
| Pinzas Dumont n º 5 | World Precision Instruments, Inc. | 14101 | |
| Pinza Graefe Iris, 7 cm curva | World Precision Instruments, Inc. | 14141 | |
| Tijeras | Roboz quirúrgica Instrument Co., Inc. | RS-5880 | |
| Cubierta de plato 100x20 mm de vidrio de cultivo celular | Corning | 70165-102 | |
| Cubierta de plato 100x20 mm de poliestireno de cultivo celular | Corning | 430167 | |
| La solución de Betadine (10% povidona yodada Solución Tópica) | Productos de Purdue, LP | NDC 67618-150-08 |
Referencias
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados