Method Article
Imaging intravitale del Nodo poplitea Lymph mouse
In questo articolo
Riepilogo
I recenti progressi nella microscopia a due fotoni hanno permesso in tempo reale In Immagini in situ di tessuti vivi in modelli animali, in modo da migliorare la nostra capacità di indagare il comportamento cellulare sia in condizioni fisiologiche e patologiche. Qui si delineano i preparativi necessari per eseguire l'imaging intravitale del nodo poplitea linfa mouse.
Abstract
I linfonodi (LNS) sono organi linfatici secondari, che sono strategicamente ubicati in tutto il corpo per consentire la cattura e la presentazione di antigeni estranei dai tessuti periferici per innescare la risposta immunitaria adattativa. Giustapposti tra le risposte immunitarie innate e adattative, la LN è un luogo ideale per studiare le interazioni delle cellule immunitarie 1,2. Linfociti (cellule T, cellule B e cellule NK), cellule dendritiche (DC), e macrofagi comprendono la maggior parte di midollo osseo derivati da elementi cellulari del LN. Queste cellule sono strategicamente posizionati nel LN per consentire sorveglianza efficace di antigeni self e potenziali antigeni estranei 3-5. Il processo con cui i linfociti successo incontrano gli antigeni affini è un oggetto di intensi studi negli ultimi anni, e prevede l'integrazione di contatti molecolari tra cui recettori degli antigeni, molecole di adesione, chemochine, e strutture stromali come la fibro-reticolare rete 2,6-12 . Prima dello sviluppo ad alta risoluzione in tempo reale fluorescente imaging in vivo, gli investigatori invocati immagine statica, che offre solo una risposta per quanto riguarda la morfologia, la posizione e l'architettura. Anche se queste domande sono fondamentali nella nostra comprensione del comportamento delle cellule immunitarie, i limiti intrinseci a questa tecnica non consente analisi per decifrare il traffico dei linfociti e gli indizi ambientali che influenzano il comportamento dinamico delle cellule. Recentemente, lo sviluppo di intravitale due fotoni microscopia a scansione laser (2P-LSM) ha permesso ai ricercatori di visualizzare i movimenti dinamici e le interazioni delle cellule individuali all'interno LNs dal vivo in situ 12-16. In particolare, noi e altri hanno applicato questa tecnica al comportamento immagine cellulare e le interazioni all'interno del popliteo LN, dove la sua compatta, la natura densa offre il vantaggio di acquisizione dati multiplex su una superficie del tessuto di grandi dimensioni con diversi tessuti sotto-strutture 11,17-18 . E is importante notare che questa tecnica offre ulteriori vantaggi rispetto alle tecniche di imaging espiantati tessuto, che richiedono interruzione del sangue, flusso linfatico, e in ultima analisi, le dinamiche cellulari del sistema. Inoltre, i tessuti espiantati hanno una finestra di tempo molto limitato in cui il tessuto rimane vitale per l'imaging dopo espianto. Con una corretta idratazione e il monitoraggio delle condizioni ambientali dell'animale, il tempo di imaging può essere significativamente esteso con questa tecnica intravitale. Qui, presentiamo un metodo dettagliato di preparazione topo LN popliteo per lo svolgimento delle immagini intravitale.
Protocollo
1. Mouse Holder Assembly
- Sovrapporre il coperchio di 100-mm piatto di vetro Petri su una 100-mm coperchio di plastica capsula Petri rivolto verso il basso. Il vetro deve essere appena tocca il punto centrale del piatto di plastica. Utilizzando il vetro come stencil, tracciare un segno sul piatto di plastica.
- Utilizzare un trapano a mano (cioè Dremel) per rimuovere una porzione di un coperchio 100-mm piatto di plastica per creare una forma di mezzaluna piattaforma. Questa forma di mezzaluna coperchio di plastica servirà come supporto per il torso superiore del topo (Figura 1a). Praticare due fori sul coperchio a forma di mezzaluna per fissare la maschera antigas con una fascetta di metallo torsione. Fissare il coperchio di plastica al bordo del piatto di vetro Petri con super colla o un adesivo equivalente forte (Figura 1b).
- Colla i coperchi di due cupola-PCR tappo provette (tagliati a cerniera) 1 cm di distanza dal centro del piatto inferiore allo scopo di ancoraggio lembi cutanei poplitei.
2. Preparazione del mouse
Nota: Con la pratica sufficiente, si dovrebbe essere in grado di eseguire la preparazione del mouse e fasi chirurgiche in 20-30 minuti.
- Anestetizzare il mouse con isoflurano (2 al 2,5% per l'induzione, 1,5 al 2% per l'intervento / imaging) miscelati in 1:01 O 2: miscela aria ad una velocità di flusso di 1L/min utilizzando un IACUC approvato procedura. Una volta che il mouse è anestetizzato, fissare una maschera antigas sul naso con nastro adesivo. Determinare se il mouse è completamente anestetizzato dalla mancanza di risposta ai piedi e / o pizzichi coda. Il livello di isoflurano può essere regolata di conseguenza per assicurare l'animale è completamente sedato, con una costante, non lavorò frequenza respiratoria tra 60-80 respiri al minuto.
- Utilizzare un trimmer elettrico per eliminare i peli sulla zampa posteriore destra e la zona inguinale del mouse.
- Spazzolare via i capelli sciolti e delicatamente applicare una mano modesta di lozione Nair sulla zona rasata con un batuffolo di cotone. Dopo un minuto di applicazione iniziale, togliere la Nair e pulire la pelle esposta con un panno umidotovagliolo di carta. Assicurarsi che il mouse sia pulita e asciutta prima di procedere.
- Fai una piccola incisione 2-3 mm con le forbici al ginocchio destro per esporre il tendine estensore.
- Applicare Vetbond lungo il centro del supporto topo dove il corpo e la gamba del mouse viene posizionato. Fissare con cura il mouse sul supporto, con il ginocchio destro verso il basso, per esporre la fossa poplitea destra. Fissare il tendine ginocchio destro con Vetbond tra i titolari della pelle 2 ribalte per contribuire a stabilizzare il settore imaging.
- Stretch nastro e le braccia e la gamba sinistra alla piattaforma superiore del supporto.
- Utilizzare una fascetta torsione per fissare la maschera antigas al suo posto.
- Collocare il supporto sotto il microscopio di dissezione. Il LN deve rimanere immobile, indipendente dal movimento del mouse respirazione. Pertanto, devono essere prese precauzioni durante operazioni chirurgiche per ottimizzare la stabilità della gamba. Determinare la posizione della coda (tipicamente sopra la testa) che contribuiranno alla massimastabilità alla gamba destra e il nastro la coda verso il basso.
3. Chirurgia
- Mentre nel campo di applicazione dissezione, mantenere la temperatura corporea del mouse utilizzando una stufetta o una piastra elettrica. Per immagine positiva del LN poplitea, è fondamentale per sostenere la corretta temperatura del corpo durante la chirurgia così come per preservare l'umidità del tessuto costantemente applicando caldo PBS al tessuto esposta.
- Sterilizzare la pelle con Betadine. Utilizzando forbici sterili, praticare un'incisione mediana attraverso la pelle a destra a metà polpaccio, e continuare a tagliare verticalmente fino alla parte superiore della coscia destra.
- Fare due incisioni cutanee orizzontali nella parte superiore della linea di incisione verticale per creare lembi cutanei su entrambi i lati.
- Ritrarre e colla premuti entrambi i lembi cutanei con Vetbond. Tirando la pelle tesa prima di applicare Vetbond permetterà di promuovere ulteriormente la stabilità della gamba, tuttavia, accertarsi che la tensione della pelle non occlude il flusso sanguigno (ossia a cambiamenti nella vessel colore o diametro). Continuare ad incollaggio altre aree della pelle per assicurare la stabilità della gamba prima di esporre la LN. La dimensione del mouse determinare la quantità di pelle è richiesta per incollaggio. In genere, i topi più grandi richiederà più la pelle da incollare al titolare.
- La LN devono ricadere all'interno della fossa poplitea sia a destra oa sinistra della vena poplitea, a seconda della posizione del mouse sul supporto. Separare con attenzione il LN dai tessuti adiposi e muscoli circostanti che utilizzano micro-dissezione pinzette e pinze. Per ridurre al minimo il sanguinamento e trauma, utilizzare le tecniche dispiegamento con micro-dissezione pinzette ai tessuti separati. Con attenzione esporre la LN poplitea senza compromettere l'integrità dei vasi sanguigni afferenti ed efferenti e dei vasi linfatici afferenti.
- Per la stabilità del tessuto aggiunto, un vetro di copertura quadrato può essere posizionato sopra la LN umida, appena toccando il LN evitando l'occlusione del vaso. Il vetro di copertura può essere SECURed modellare con argilla su entrambi i lati del mouse.
- Coloranti fluorescenti vaso di varie dimensioni (ad esempio TRITC-destrano, minimo di 70kDa) possono essere introdotti per via endovenosa a questo punto per aiutare evidenziare il rapporto strutturale e l'integrità del LN durante l'imaging.
4. 2-Photon Imaging Acquisition **
- Una volta che la LN sia adeguatamente esposta e la stabilità viene raggiunta, a trasferire rapidamente l'intero gruppo porta mouse sul microscopio scena munito di un pad programmabile retroazione riscaldamento a temperatura controllata in una camera ambientale microscopio mantenuta a 37 ° C. Aggiungi abbastanza sterile calda (37 ° C) o PBS HBSS far immergere la LN. Il volume cambia a seconda della dimensione e la posizione del mouse. In alternativa, calda o PBS HBSS può essere applicato direttamente al LN sezionato attraverso una pipetta di vetro fine montata una pompa peristaltica e registrato alla colonna della lente obiettivo ad immersione. Il flusso del liquido deve essere tale dacolonna d'acqua può essere mantenuta stabile tra la lente e il tessuto.
- Mantenere la temperatura HBSS o PBS a 37 ° C usando un tampone di riscaldamento con una sonda di retroazione. Una sonda di temperatura separata deve essere inserito nel supporto mouse per confermare la temperatura del PBS nell'intervallo di 36,5-37,5 ° C. Una sonda rettale può anche essere usato per monitorare la temperatura corporea del mouse sperimentale per tutta la sessione di imaging.
- Utilizzare un epi-lampada fluorescente per aiutare il posizionamento LN guida sotto l'obiettivo. Acquisire serie di immagini fluorescenti che utilizzano intervalli di tempo che sono appropriate per l'interazione cellulare desiderata (in genere da 10 secondi a 1 minuto tra ogni serie di immagini xyz).
- Monitorare lo stato dell'animale nella camera microscopio frequentemente mediante ispezione visiva o utilizzando un sistema di monitoraggio animale. Determinare se il mouse è completamente anestetizzato dalla mancanza di risposta ai piedi e / o pizzichi di chiodi, e una costante, non lavorò frequenza respiratoria tra i 60-80 breaths / min. Il livello di isoflurano può essere regolato di conseguenza per assicurare che l'animale è completamente sedato. Con un adeguato monitoraggio e l'idratazione, gli animali possono essere esposte per 4-6 ore, o forse più.
- Dopo l'esperimento di imaging, l'eutanasia l'animale in una camera di CO 2 con IACUC approvato protocollo di eutanasia. L'animale non dovrebbe essere permesso di uscire da anestesia prima all'eutanasia.
** Questa procedura chirurgica può essere utile anche per altre forme di imaging intravitale diverso da 2P-LSM.
5. Risultati rappresentativi
Diverse le cellule immunitarie circolanti vengono reclutati alla LN a ritmi diversi a seguito di trasferimento adottivo. Per CD4 + e CD8 + linfociti, queste cellule cominciano ad arrivare nel LN attraverso le venule endoteliali alte (HEV) minuti dopo il trasferimento iv con i numeri consistenti che arrivano nella LN popliteo dopo 2 a 4 ore 6,17-18. Per B cells, un numero considerevole si accumulano dopo 8 a 24 ore 19. Dendritiche attivate dovrebbe iniziare ad apparire nei drenanti poplitea LN 8 a 16 ore dopo l'iniezione footpad 3,11,16-17. La figura 2a mostra che anche senza altri punti di riferimento, strutture come follicoli di cellule B possono essere individuate facilmente l'accumulo rotonda cella sferica visibile sotto 2P-LSM 19. L'utilizzo di un giornalista endogena fluorescente come i ubiquitina-GFP splenociti (Figura 2, video supplementari 1 e 2), si può tenere traccia di queste migrazioni di linfociti e comportamenti per giorni fino a una settimana in condizioni non-stimolatori condizioni fisiologiche. Con il multi-canale rivelatori ad alta sensibilità, è possibile acquisire un set di dati di imaging multiplex che comprende informazioni sulla struttura e le dinamiche di interazione tra più partner cellulari 17,19.
Quando le tecniche chirurgiche siano eseguiti correttamente e le condizioni ambientali attentamente monitorato, lymphocytes deve presentare caratteristiche di velocità di migrazione, come mostrato nella Figura 2c, 2d e altrove 13-14,16. I linfociti si possono presentare anche differenze nella velocità di migrazione a seconda delle sub-regioni della LN in fase di imaging, così ulteriori punti di riferimento come i vasi sanguigni (come evidenziato dalla introduzione di coloranti nave) contribuirà a determinare la qualità complessiva imaging (ad esempio il controllo della temperatura corretta , minimo trauma alla LN, ecc) 3,6,20.

Figura 1. Costruzione di un supporto per mouse per il mouse popliteo LN Imaging a) Schema di montaggio del mouse titolare;. B) preparazione del mouse Rappresentante intravitale; c) Completato il montaggio supporto per mouse; d) Close-up vista della LN popliteo dopo l'esposizione chirurgica.
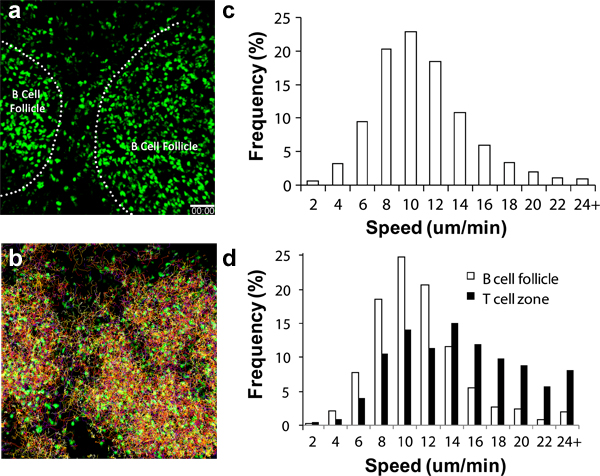
Figura 2. Analisi migrazione di GFP + linfocitinel LN poplitea. (a) istantanea 3D presa da 2P-LSM sequenza di immagini del LN poplitea in C57BL / 6 topo ricevente adoptively trasferito con 1x10 7 GFP + linfociti 1 giorno prima di imaging. Linea tratteggiata indica il confine di follicoli di cellule B, (b) tracce di migrazione dei linfociti durante 1 ora di continuo immagini; c) la distribuzione complessiva di velocità di migrazione dei linfociti. Velocità media = 10,04 ± 4,26 micron al minuto (per un totale di 15.125 brani analizzati), d), differenziale cellulare distribuzione velocità di migrazione delle cellule presenti nel follicolo delle cellule B (bar aperto; velocità media = 8.79 ± 3.90 micron / min; totale 1.525 brani analizzati ) e delle cellule T della zona (bar chiusi, velocità media = 13,77 ± 5.93 micron / min; di un totale di 1.250 brani analizzati). Scala bar = 50 micron.
Supplemental Video 1. Time-lapse intravitale 2P-LSM immagini di un topo LN popliteo come descritto nella Figura 2. Un totale di 1x10 7 linfociti sono stati isolati from uno ubiquitina-GFP + topo donatore e adoptively trasferito per via endovenosa in un topo ricevente C57BL / 6 24 ore prima di imaging. Una serie di xy (750 um x 750 um) immagini di fluorescenza sono state prese attraverso fisso z pile (5 passi micron, 13 passi) per generare un pila xyz immagini (750 um x 750 um x 65 um), che è stata ripetuta ogni 20 secondi per un totale di 60 minuti, risultando in una sequenza di imaging xyzt per l'analisi della velocità (figure 2c, 2d). La velocità di riproduzione = 450X. Scala bar = 50 micron. Time stamp = min: sec. Clicca qui per guardare il video supplementare .
Supplementare Video 2 vista ingrandita della sequenza di imaging in Video supplementare 1 al follicolo cellula B -. Cellule T confine di zona. La velocità di riproduzione = 450X. Scala bar = 25 micron. Data e ora = min: sec. Cleccare qui per guardare il video supplementare.
Discussione
I recenti progressi ad alta risoluzione a tecniche di imaging in situ, in particolare 2P-LSM, sono stati accompagnati da un crescente interesse per lo studio della dinamica il comportamento cellulare in vivo. La tecnica di imaging 4D sulla LN poplitea di un topo vivo permette tali analisi nel comportamento dinamico di cellule immunitarie nel tessuto senza disfunzioni micro-ambiente. L'uso di 2P-LSM con rivelatori multipli che coprono l'intero spettro visibile permette la raccolta simultanea di dati di immagini di popolazioni di cellule multiple. Questo può essere realizzato attraverso l'uso in vivo di cellule specifiche topi reporter fluorescenti (ad esempio Ubiquitina eGFP-,-RFP, o-ECFP) combinato con l'uso di trasferimento adottivo di popolazioni cellulari differenzialmente marcato utilizzando coloranti organici cellulari fluorescenti (ad es CFSE , SNARF-1, e Cell Tracker Orange) per esaminare i meccanismi cellulari e la funzione all'interno della LN. In aggiunta l'osservazione diretta delle interazioni tra differenziale rintracciato cell popolazioni, il dataset di immagini multiplex può essere sottoposto a ulteriori analisi con programmi di elaborazione immagini disponibili in commercio software (ad esempio Imaris, Bitplane Inc.) per chiarire ulteriormente il comportamento delle cellule e la funzione. Una vasta gamma di possibilità di interazione per studiare i meccanismi cellulari che utilizzano questi in vivo e in silico.
La limitazione principale del metodo sperimentale qui descritto è la complessità tecnica inerente l'approccio chirurgico. Questa tecnica richiede una formazione rigorosa di acquisire familiarità con l'anatomia pertinente e le precise modalità tecniche e le competenze specifiche richieste dal presente protocollo. Ulteriori fattori di complicazione sono la difficoltà nel ridurre al minimo i danni ai tessuti durante l'esplorazione LN, ottimizzando la stabilità dei tessuti durante l'imaging, e prevenire lesioni termiche e laser per la LN prima e durante la sperimentazione di imaging. Perturbazione a uno di questi fattori si tradurrà in meno non ottimale linfamotilità ocyte e quindi interferire con la corretta interpretazione della conseguente analisi dei dati di imaging.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è supportato da finanziamenti NCI 1R01CA154656, NIAID 1R21AI092299, Cancer Research Institute, St. Baldrick della Fondazione, Dana Foundation, Gabrielle Angelo Foundation, e Hyundai Motors of America "Hope-on-Wheels" Program.
Materiali
Reagente Azienda Numero di catalogo
| Name | Company | Catalog Number | Comments |
| Isoflurano, USP | Baxter Healthcare Corporation | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Nair - rimozione lozione per capelli | Nair | ||
| PBS, 1X | Cellgro | 21-040-CV | |
| Riscaldamento pad | Watlow | ||
| Riscaldamento Pad controller | Watlow | ||
| Air e O 2 | Airgas | ||
| Sonda di temperatura | Harvard Apparatus | ||
| Pinzette Dumont # 5 | World Precision Instruments, Inc | 14.101 | |
| Pinza, Graefe Iris, 7 cm curvo | World Precision Instruments, Inc | 14.141 | |
| Forbici | Roboz Surgical Instrument Co., Inc | RS-5880 | |
| Copertina del piatto di vetro 100x20 millimetri coltura cellulare | Corning | 70165-102 | |
| Copertina del piatto di polistirolo 100x20 millimetri coltura cellulare | Corning | 430.167 | |
| Betadine soluzione (10% Povidine soluzione di iodio-topica) | Prodotti Purdue, LP | NDC 67618-150-08 |
Riferimenti
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon