Method Article
Bildgebung des dem Maus-Kniekehlen-Lymphknoten
In diesem Artikel
Zusammenfassung
Jüngste Fortschritte in der 2-Photonen-Mikroskopie sind in Echtzeit ermöglichte In Situ Darstellung von lebendem Gewebe in Tiermodellen, wodurch die Fähigkeit, das Zellverhalten sowohl physiologischen und pathologischen Bedingungen zu untersuchen. Hier skizzieren wir die Vorbereitungen erforderlich, um die Bildgebung des Maus-Kniekehlen-Lymphknoten durchzuführen.
Zusammenfassung
Lymphknoten (LK) sind sekundären lymphatischen Organen, die strategisch im ganzen Körper befinden, um zum Einfangen und Präsentation von fremden Antigenen aus peripheren Geweben, um die adaptive Immunantwort zu entlüften lassen. Gegenübergestellt zwischen angeborenen und adaptiven Immunantwort ist die LN ein idealer Ort, um Immunzellen Wechselwirkungen 1,2 studieren. Lymphozyten (T-Zellen, B-Zellen und NK-Zellen), umfassen dendritische Zellen (DCs), Makrophagen und den Großteil der Knochenmark-abgeleitete zellulären Elemente des LN. Diese Zellen sind strategisch positioniert in der LN, um eine effiziente Überwachung der Selbst-Antigene und potentielle fremde Antigene 5.3 zu ermöglichen. Der Prozess, durch den Lymphozyten erfolgreich begegnen verwandten Antigenen ist ein Gegenstand intensiver Forschung in den letzten Jahren, und eine Integration der molekularen Kontakte einschließlich Antigen-Rezeptoren, Adhäsionsmoleküle, Chemokine, und Stroma-Strukturen, wie das Fibro-retikuläre Netzwerk 2,6-12 . Vor der Entwicklung von hochauflösenden Echtzeit-Fluoreszenz-in-vivo-Bildgebung, Ermittler auf statischen Bildern verlassen, die nur bietet Antworten zur Morphologie, Lage und Architektur. Während diese Fragen grundlegend für unser Verständnis von Immunzellen Verhalten sind, wird die intrinsische Einschränkungen mit dieser Technik nicht zulassen Analyse zu entziffern Lymphozyten-Handel und Umwelt Hinweise, die dynamische Verhalten von Zellen beeinflussen. Vor kurzem hat die Entwicklung der intravitalen Zwei-Photonen-Laser-Scanning-Mikroskopie (2P-LSM) hat es Ermittlern, um die dynamischen Bewegungen und Interaktionen der einzelnen Zellen innerhalb von Live-LNs in situ 12-16 zu sehen. Insbesondere haben wir und andere diese Technik, um Bild zellulären Verhalten und die Interaktionen innerhalb der Kniekehle angewendet LN, wo die kompakte, dichte Natur bietet den Vorteil der Multiplex-Datenerfassung über einen großen Bereich mit verschiedensten Gewebe Gewebe Sub-Strukturen 11,17-18 . Es iist wichtig zu beachten, dass diese Technik zusätzliche Vorteile über explantierten Gewebe bildgebenden Verfahren, die Störung der Blut-, Lymph-Fluss, und letztlich die zellulären Dynamik des Systems erfordern bietet. Darüber hinaus haben explantierten Gewebes eine sehr begrenzte Zeitfenster, in dem das Gewebe bleibt lebensfähig Bildgebung nach Explantat. Mit ausreichende Flüssigkeitszufuhr und die Überwachung des Tieres Umgebungsbedingungen kann die Belichtungszeit wesentlich mit dieser intravitalen Technik erweitert werden. Hier stellen wir eine detaillierte Verfahren zur Herstellung von Maus poplitealen LN für die Ausübung ihrer intravitalen Bildgebung.
Protokoll
1. Maus-Halter-Anordnung
- Überlagern Sie die Abdeckung eines 100-mm-Glas-Petrischale auf der Spitze eines 100-mm-Kunststoff-Petrischale Deckel nach unten zeigt. Das Glas sollte kaum berühren Sie den Mittelpunkt der Plastikschale. Mit dem Glas als Schablone, verfolgen eine Markierung auf der Plastikschale.
- Verwenden Sie eine Handbohrmaschine (dh Dremel), um einen Teil eines 100-mm-Deckel Plastikschale, eine sichelförmige Plattform zu schaffen, zu entfernen. Diese sichelförmigen Kunststoffdeckel wird als Träger für den Oberkörper der Maus (1a) dienen. Bohren Sie zwei Löcher auf der halbmondförmigen Deckel, um die Gasmaske mit einem Metall Bindedraht zu sichern. Sichern Sie den Plastikdeckel an den Rand des Glases Petrischale mit Sekundenkleber oder eine gleich starke Klebstoff (Abbildung 1b).
- Kleber die Deckel von zwei gewölbte Kappe PCR-Röhrchen (Schnitt im Scharnier) 1 cm voneinander entfernt auf die Mitte des Bodens Gericht für den zur Verankerung Kniekehle Hautlappen.
2. Maus-Vorbereitung
Hinweis: Bei ausreichender Übung, man sollte in der Lage sein, um die Maus Vorbereitung und des chirurgischen Schritte in 20-30 Minuten durchführen.
- Betäuben die Maus mit Isofluran (2 bis 2,5% für Induktion, 1,5 bis 2% für Chirurgie / Imaging) in 1:1 O 2 gemischt: Luft-Gemisch bei einer Fließgeschwindigkeit von 1L/min mit Hilfe eines anerkannten Verfahrens IACUC. Sobald sich die Maus betäubt, sichern eine Gasmaske über die Nase mit Klebeband. Bestimmen Sie, ob die Maus ist vollständig betäubt durch den Mangel an Reaktion auf Zehen-und / oder Schwanz drückt. Die Höhe der Isofluran kann entsprechend angepasst werden, um sicherzustellen, das Tier vollständig betäubt, mit einem stetigen, nicht gearbeitet Atemfrequenz zwischen 60-80 Atemzüge / min.
- Verwenden Sie einen elektrischen Trimmer die Haare auf dem rechten Hinterbein und inguinalen Bereich der Maus zu entfernen.
- Bürsten Sie losen Haare und üben Sie sanften einen bescheidenen Schicht Nair Lotion auf die rasierte Fläche mit einem Wattestäbchen. Nach einer Minute der ersten Anwendung, entfernen Sie den Nair und reinigen Sie die betroffene Haut mit einem feuchtenPapiertuch. Achten Sie darauf, die Maus ist sauber und trocken sein, bevor Sie fortfahren.
- Machen Sie eine kleine 2 bis 3 mm Schnitt mit der Schere am rechten Knie, um die Strecksehne aussetzen.
- Anwenden Vetbond entlang der Mittellinie der Maus Halter, in dem die Maus Körper und Beine angeordnet werden. Sorgfältig sichern die Maus auf den Halter, mit dem rechten Knie nach unten, um die richtige Kniekehle aussetzen. Sichern Sie das rechte Knie Sehne mit Vetbond zwischen den zwei Hautlappen Halter zur Stabilisierung des Bildfeldes.
- Stretch-und Tape die Arme und das linke Bein auf der oberen Plattform des Halters.
- Verwenden Sie einen Bindedraht, um die Gasmaske zu fixieren.
- Platzieren Sie die Halterung unter dem Dissektionsmikroskop. Der LN muss unbedingt noch bleiben, unabhängig von der Atmung Bewegung der Maus. Daher müssen Vorkehrungen getroffen werden, während der Durchführung der Operation, um die Stabilität des Beines zu optimieren. Bestimmen der Position des Schwanzes (typischerweise über dem Kopf), die einen hohen beitragenStabilität auf dem rechten Bein und der Schwanz Band nach unten.
3. Chirurgie
- Während unter der Dissektion Umfang, pflegen Maus Körpertemperatur mit Hilfe eines Heizgerätes oder ein Heizkissen. Für eine erfolgreiche Bildgebung der Kniekehle LN, ist es wichtig, die richtige Körpertemperatur während der Operation sowie ermöglicht, um Feuchtigkeit der Gewebe durch die ständige Anwendung warmer PBS auf die freiliegende Gewebe zu erhalten.
- Sterilisieren Sie die Haut mit Betadine. Mit einer sterilen Schere, machen Sie einen Medianschnitt durch die Haut an der rechten Seite zur Mitte der Wade, und weiter Schneiden vertikal bis zu den oberen Anteil des rechten Oberschenkels.
- Machen Sie zwei horizontalen Hautschnitte an der Spitze der vertikalen Schnittführung zu Hautlappen auf beiden Seiten zu schaffen.
- Einfahren und kleben Sie beide Hautlappen mit Vetbond. Durch Ziehen an der Haut straff vor dem Auftragen Vetbond wird weiter zu fördern Bein Stabilität, aber stellen Sie sicher, dass die Spannung der Haut nicht verschließen Blutfluss (dh Veränderungen in der Vessel Farbe oder Durchmesser). Weiter die Verklebung anderen Bereichen der Haut, um die Stabilität des Schenkels vor dem Freilegen der LN zu gewährleisten. Die Größe der Maus wird bestimmen, wie viel zusätzliche Haut zu kleben benötigt wird, nach unten. Typischerweise wird größer Mäuse erfordern mehr Haut auf den Inhaber geklebt werden.
- Der LN muss innerhalb der Kniekehle liegen entweder nach rechts oder links von der V. poplitea, abhängig von der Platzierung der Maus an der Halterung. Sie vorsichtig die LN aus den umliegenden Fettgewebe und Muskeln mit Mikro-Pinzetten und Zangen sezieren. Um Blutungen und Traumata zu minimieren, verwenden Sie die Spreizung Techniken mit Mikro-Pinzetten sezieren, um getrennte Gewebe. Vorsichtig setzen die Kniekehle LN, ohne dabei die Integrität der zu-und abführenden Blutgefäße und die afferenten Lymphgefäße.
- Für zusätzliche Stabilität Gewebe kann ein Quadrat Deckglas über die feuchte LN positioniert werden, nur berühren kaum den LN bei gleichzeitiger Vermeidung Gefäßverschluss. Das Deckglas kann secur seinED-Modelle aus Ton auf beiden Seiten der Maus.
- Fluoreszierende Farbstoffe Behälter verschiedener Größen (zB TRITC-Dextran, mindestens 70 kDa) kann intravenös an dieser Stelle eingeführt werden, um die strukturellen Beziehungen zu markieren und die Integrität des LN während der Bildgebung.
4. 2-Photonen-Imaging Acquisition **
- Sobald die LN ausreichend ausgesetzt ist und die Stabilität erreicht wird, unverzüglich versetzen die gesamte Maus-Anordnung auf dem Mikroskoptisch mit einem programmierbaren Temperatur Rückkopplung gesteuerten Heizkissen in einer Umwelt Mikroskop Kammer bei 37 ° C angebracht Fügen Sie genug sterile warme (37 ° C) PBS oder HBSS zu tauchen LN. Das Volumen ändert sich je nach Größe und Platzierung der Maus. Alternativ kann warmer PBS oder HBSS direkt an dem zerschnittenen LN aufgebracht werden durch ein feines Glaspipette ausgestattet mit einer Peristaltikpumpe und mit Klebeband an der Spalte der Immersionslinse Ziel. Die Strömung der Flüssigkeit sollte sein, dass einStabile Wasser Spalte zwischen der Linse und dem Gewebe gehalten werden.
- Pflegen Sie die PBS oder HBSS Temperatur bei 37 ° C mit einem Heizkissen mit einem Feedback-Sonde. Eine separate Temperaturfühler muss in der Maus Halter platziert werden, um die Temperatur des PBS im Bereich von 36,5 bis 37,5 zu bestätigen ° C Eine rektale Sonde kann auch verwendet werden, um die Körperkerntemperatur des experimentellen Maus in der Imaging-Sitzung zu überwachen.
- Verwenden Sie einen epi-Leuchtstofflampe zu Führung LN Platzierung unter dem Ziel zu helfen. Erwerben Sie Fluoreszenzbildstapeln mit Zeitintervallen, die für den gewünschten zellulären Interaktionen (typischerweise 10 Sekunden bis 1 Minute zwischen jedem xyz Bildstapel) sind.
- Überwachen Sie den Status des Tieres in der Kammer Mikroskop häufig durch eine Sichtprüfung oder durch Verwendung eines Tieres Monitoring-System. Bestimmen Sie, ob die Maus ist vollständig betäubt durch den Mangel an Reaktion auf Zehen-und / oder Nagel drückt, und eine stetige, nicht gearbeitet Atemfrequenz zwischen 60-80 breaths / min. Die Höhe der Isofluran kann entsprechend angepasst werden, um sicherzustellen, dass das Tier vollständig sediert. Mit geeigneter Monitoring-und Flüssigkeitszufuhr, Tiere können für 4-6 Stunden abgebildet werden, oder möglicherweise länger.
- Nach der Imaging-Experiment, einschläfern das Tier in einer CO 2-Kammer unter Verwendung IACUC zugelassenen Euthanasie Protokoll. Das Tier darf nicht aus der Narkose vor der Euthanasie auftauchen werden.
** Dieses chirurgische Verfahren kann auch nützlich sein für andere Formen der Bildgebung intravitalen andere als 2P-LSM.
5. Repräsentative Ergebnisse
Verschiedene zirkulierenden Immunzellen an die LN mit unterschiedlicher Geschwindigkeit nach adoptiven Transfer rekrutiert. Für CD4 + und CD8 +-Lymphozyten, beginnen diese Zellen in der LN durch die hohen endothelialen Venole (HEV) Minuten nach iv Transfer mit einer beträchtlichen Zahl der Ankunft in der Kniekehle LN nach 2 bis 4 Stunden 6,17-18 ankommen. Für B cells, wird eine erhebliche Anzahl nach 8 bis 24 Stunden 19 ansammeln. Aktivierte DCs sollten beginnen, in den ableitenden poplitealen LN 8 bis 16 Stunden nach der Injektion Wegelagerer 3,11,16-17 erscheinen. Abbildung 2a zeigt, dass auch ohne andere Sehenswürdigkeiten, Bauwerke wie B-Zell-Follikel leicht durch die runde kugelförmige Ansammlung Zelle sichtbar unter 2P-LSM 19 zu erkennen. Mit Hilfe eines endogenen fluoreszierenden Reporter wie die Ubiquitin-GFP Splenozyten (Abbildung 2, Supplemental Videos 1 und 2), kann man diese Lymphozyten-Migrationen und Verhaltensweisen für Tag verfolgen, bis zu einer Woche unter nicht-stimulatorischen physiologischen Bedingungen. Mit Multi-Channel hochempfindlichen Detektoren ist es möglich, ein Multiplex-Imaging-Dataset, das strukturelle Informationen sowie Interaktionsdynamiken umfasst unter mehreren zellulären Partnern 17,19 zu erwerben.
Wenn die chirurgischen Techniken korrekt ausgeführt werden und die Umgebungsbedingungen sorgfältig überwacht, lymphocyTES sollte zeigen charakteristische Geschwindigkeit der Migration, wie in Abbildung 2c, 2d und anderswo 13-14,16 demonstriert. Lymphozyten können zeigen auch Unterschiede in der Migrations-Geschwindigkeit in Abhängigkeit von den Teilregionen des LN Bildgebung unterzogen, so wird zusätzliche Attraktionen, wie Blutgefäße (wie durch die Einführung des Schiffes Farbstoffen markiert) dazu beitragen, den gesamten Imaging-Qualität (dh richtige Temperierung bestimmen , minimale Traumatisierung LN, etc.) 3,6,20.

Abbildung 1. Bau einer Halterung für Maus Maus poplitealen LN Imaging a) Schematische Darstellung der Maus Halterbaueinheit;. B) repräsentative intravitalen Maus Vorbereitung, c) Abgeschlossene Maus Halterbaueinheit, d) Nahaufnahmen von der Kniekehle LN nach chirurgischer Freilegung.
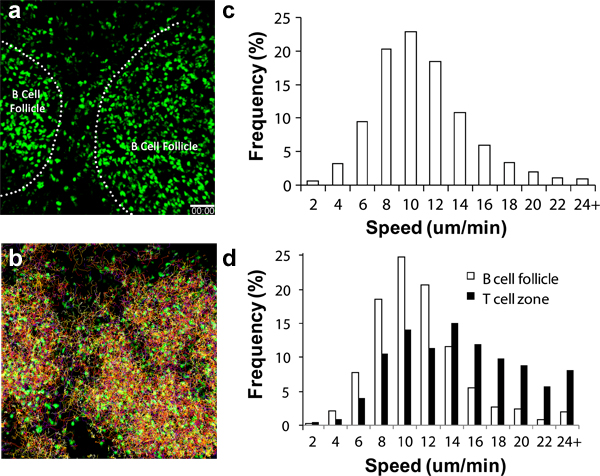
Abbildung 2. Migration Analyse von GFP +-Lymphozytenin der Kniekehle LN. (a) 3D-Momentaufnahme von 2P-LSM Bildgebungssequenz der Kniekehle LN in einer C57BL / 6 Empfängermaus getroffen adoptiv mit 1x10 7 GFP +-Lymphozyten 1 Tag vor Bildgebung übertragen. Dash Linie zeigt die Grenze des B-Zell-Follikel, (b) Tracks von Lymphozytenmigration während 1 Stunde kontinuierlicher Bildgebung; c) Verteilung der insgesamt Lymphozytenmigration Geschwindigkeit. Die mittlere Geschwindigkeit = 10,04 ± 4,26 um / min (insgesamt 15.125 Tracks analysiert), d) Differentielle zelluläre Migration Geschwindigkeit Verteilung der Zellen in der B-Zell-Follikel gefunden (offene Balken; mittlere Geschwindigkeit = 8,79 ± 3,90 um / min; insgesamt 1.525 Tracks analysiert ) und T-Zell-Zone (gefüllte Balken; mittlere Geschwindigkeit = 13,77 ± 5,93 um / min; insgesamt 1.250 Spuren ausgewertet). Balken = 50 um.
Zusätzliche Video 1. Zeitraffer-intravitale 2P-LSM Bildgebung einer Maus poplitealen LN wie in 2 beschrieben. Insgesamt wurden 1x10 7-Lymphozyten wurden isoliert from ein Ubiquitin-GFP + Donor-Maus und adoptiv intravenös in einer C57BL / 6 Empfängermaus 24 Stunden vor dem bildgebenden übertragen. Eine Reihe von XY (750 um x 750 um) Fluoreszenz-Bilder wurden durch feste Z-Stapel (5 um Schritte, 13 Schritte) getroffen, um eine Zuordnung beim Imaging-Stapel (750 um x 750 um x 65 um), die alle 20 Sekunden wiederholt wurde nachgeben für insgesamt 60 Minuten, was zu einer xyzt Bildgebungssequenz für Geschwindigkeit Analyse (Figuren 2c, 2d). Abspiel-Geschwindigkeit = 450x. Balken = 50 um. Zeitstempel = min: sec. Klicken Sie hier, um zusätzliche Video anzuschauen .
Zusätzliche Video 2 vergrößerten Ansicht der Bildgebungssequenz in Supplemental Video 1 an der B-Zell-Follikel -. T-Zell-Zone Grenze. Abspiel-Geschwindigkeit = 450x. Balken = 25 um. Zeitstempel = min: Sek. Clecken Sie hier, um ergänzende Video zu sehen.
Diskussion
Jüngste Fortschritte in der hochauflösenden in-situ-Bildgebung, insbesondere 2P-LSM, wurden von einem wachsenden Interesse an der Untersuchung von dynamischen zellulären Verhaltens in vivo begleitet worden. Das 4D-Bildgebung auf der Kniekehle LN einer lebenden Maus erlaubt solche Analysen in das dynamische Verhalten von Immunzellen im Gewebe ungestörten Mikro-Umgebung. Die Verwendung von 2P-LSM mit mehreren Detektoren, die den gesamten sichtbaren Spektrum ermöglicht die gleichzeitige Bilddaten Sammlung mehrerer Zellpopulationen. Dies kann nun durch die Verwendung von In-vivo-Zelle, fluoreszierenden Reporter-Mäuse (zB Ubiquitin-eGFP, RFP-, oder-eCFP) unter Verwendung der adoptive Transfer von unterschiedlich markierten Zellpopulationen unter Verwendung von organischen Farbstoffen kombiniert fluoreszierende Zelle erreicht werden (zB CFSE , SNARF-1, and Cell Tracker Orange), zelluläre Mechanismen und Funktion innerhalb der LN zu untersuchen. Zusätzlich zu der direkten Beobachtung der Wechselwirkungen zwischen differentiell erfasst cell Populationen kann das Multiplex-Bilddatenstatz weiteren Analyse mit kommerziell erhältlichen Bildverarbeitung Software-Programme (zB Imaris, Bitplane Inc.) zu weiteren Aufklärung des Verhaltens von Zellen und Funktion zu unterziehen. Ein breiter Fächer von Möglichkeiten existiert, um zelluläre Mechanismen für die Interaktion mit diesen in vivo und in-silico-Techniken zu studieren.
Die wichtigste Einschränkung der experimentellen hier beschriebene Ansatz ist die technische Vielschichtigkeit der Chirurgie Ansatz. Diese Technik erfordert hartes Training, um sich mit der Anatomie und die genauen technischen Verfahren und Fähigkeiten durch dieses Protokoll benötigt. Weitere erschwerende Faktoren wie die Schwierigkeit, bei der Minimierung von Gewebeschäden während LN Erforschung, Optimierung Gewebe Stabilität während der Bildgebung und Verhinderung von thermischer und Laser Verletzungen des LN vor und während der Bildgebung Experimentieren. Störung an einem dieser Faktoren wird in weniger als optimalen Lymphe führenocyte Motilität und wird daher mit der richtigen Interpretation der daraus resultierenden Bilddaten Analysen stören.
Offenlegungen
Die Autoren haben noch nichts offen zu legen.
Danksagungen
Diese Arbeit wird durch Zuschüsse aus NCI 1R01CA154656, NIAID 1R21AI092299, Cancer Research Institute, St. Baldrick Stiftung, Dana Foundation, Gabrielle 's Angel-Stiftung, und Hyundai Motors of America "Hope-on-Wheels"-Programm unterstützt.
Materialien
Reagenz Unternehmen Katalog-Nummer
| Name | Company | Catalog Number | Comments |
| Isofluran, USP | Baxter Healthcare Corporation | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Nair - Haarentfernung Lotion | Nair | ||
| PBS 1X | Cellgro | 21 bis 040-CV | |
| Heizkissen | Watlow | ||
| Heiz-Pad-Controller | Watlow | ||
| Luft-und O 2 | Airgas | ||
| Temperaturfühler | Harvard Apparatus | ||
| Pinzetten Dumont # 5 | World Precision Instruments, Inc | 14101 | |
| Pinzetten, Graefe Iris, 7 cm gebogen | World Precision Instruments, Inc | 14141 | |
| Scheren | Roboz Surgical Instrument Co., Inc. | RS-5880 | |
| Cover von 100x20 mm Glas Zellkulturschale | Corning | 70165-102 | |
| Cover von 100x20 mm Polystyrol Zellkulturschale | Corning | 430167 | |
| Betadine Lösung (10% Providine-Jod Topical Solution) | Purdue Products, LP | NDC 67618-150-08 |
Referenzen
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten