Method Article
Imagerie intravitale du ganglion lymphatique poplité souris
Dans cet article
Résumé
Les progrès récents dans la microscopie 2-photons ont permis en temps réel Dans Imagerie in situ des tissus vivants dans des modèles animaux, améliorant ainsi notre capacité à enquêter sur le comportement cellulaire dans des conditions à la fois physiologiques et pathologiques. Ici, nous décrivons les préparatifs nécessaires pour effectuer l'imagerie intravitale du ganglion lymphatique poplité souris.
Résumé
Les ganglions lymphatiques (LNS) sont les organes lymphoïdes secondaires, qui sont stratégiquement situés à travers le corps pour permettre le piégeage et la présentation des antigènes étrangers à partir de tissus périphériques pour amorcer la réponse immunitaire adaptative. Juxtaposé entre innées et adaptatives des réponses immunitaires, la LN est un site idéal pour étudier les interactions cellules immunitaires 1,2. Lymphocytes (cellules T, cellules B et cellules NK), cellules dendritiques) et les macrophages constituent l'essentiel de la moelle osseuse provenant d'éléments cellulaires de la LN. Ces cellules sont stratégiquement positionnés dans le LN pour permettre une surveillance efficace des antigènes du soi et le potentiel des antigènes étrangers 3-5. Le processus par lequel les lymphocytes succès rencontrent des antigènes apparentés est un sujet d'intenses recherches ces dernières années, et implique une intégration des contacts moléculaires, y compris des récepteurs d'antigènes, des molécules d'adhésion, les chimiokines, et les structures du stroma comme le réseau fibro-réticulaire 2,6-12 . Avant le développement de la haute résolution en temps réel fluorescente imagerie in vivo, les enquêteurs comptaient sur l'imagerie statique, ce qui ne propose que des réponses concernant la morphologie, la position et l'architecture. Bien que ces questions sont fondamentales dans notre compréhension du comportement des cellules du système immunitaire, les limites intrinsèques de cette technique ne permet pas l'analyse de déchiffrer le trafic des lymphocytes et des indices environnementaux qui influent sur le comportement dynamique des cellules. Récemment, le développement de intravitale à deux photons microscopie à balayage laser (2P-LSM) a permis aux enquêteurs de voir les mouvements dynamiques et les interactions des cellules individuelles dans les ganglions vivantes en 12-16 in situ. En particulier, nous et d'autres ont appliqué cette technique à un comportement d'image cellulaire et interactions au sein de la poplitée LN, où sa compacte, la nature dense offre l'avantage de multiplex d'acquisition de données sur une zone de tissu avec des tissus divers grande sous-structures 11,17-18 . Il is important de noter que cette technique offre des avantages supplémentaires sur les techniques d'imagerie des tissus explantés, qui exigent la perturbation du sang, circulation de la lymphe, et, finalement, la dynamique cellulaires du système. En outre, les tissus explantés ont une fenêtre de temps très limitée dans laquelle le tissu reste viable pour l'imagerie après explantation. Avec une bonne hydratation et la surveillance des conditions environnementales de l'animal, l'imagerie en temps peut être considérablement étendu avec cette technique intravitale. Ici, nous présentons une méthode détaillée de la préparation de la souris poplitée LN dans le but d'effectuer l'imagerie intravitale.
Protocole
1. Assemblée porte-souris
- Superposez le couvercle d'un plat en verre de 100 mm sur le dessus de Petri de 100 mm couvercle de boîte de Petri en plastique vers le bas. Le verre doit être touchant à peine le point de centre de l'assiette en plastique. Utilisation de la vitre comme un pochoir, tracer une marque sur le plat en plastique.
- Utilisation d'une perceuse à main (c.-à-dermiques) pour enlever une partie d'un couvercle plat de 100 mm plastique pour créer une plate-forme en forme de croissant. Ce couvercle en plastique en forme de croissant se servir de support pour la partie supérieure du torse de la souris (figure 1a). Percez deux trous sur le couvercle en forme de croissant pour assurer le masque à gaz avec une attache en métal. Fixez le couvercle en plastique sur le bord du plat en verre de Petri en utilisant la super glue ou un adhésif de manière équivalente forte (figure 1b).
- Coller les couvercles en forme de dôme de deux tubes PCR bouchon (coupés à la charnière) 1 cm de distance au centre de la cuvette inférieure dans le but de rabats d'ancrage de la peau poplités.
2. Préparation de la souris
Remarque: Avec une expérience pratique suffisante, il faut être en mesure d'effectuer la préparation de la souris et les étapes chirurgicales en 20-30 minutes.
- Anesthésier la souris avec l'isoflurane (2 à 2,5% pour l'induction, de 1,5 à 2% pour la chirurgie / imagerie) mélangé à l'échelle 1:1 O 2: mélange l'air à un débit de 1l/min en utilisant une procédure IACUC approuvé. Une fois que la souris est anesthésiée, sécuriser un masque à gaz sur le nez avec du ruban adhésif. Déterminer si la souris est entièrement anesthésié par l'absence de réponse aux pieds et / ou pincées queue. Le niveau de l'isoflurane peut être ajustée en conséquence pour s'assurer que l'animal est complètement sous sédation, avec une constante, non-travaillé fréquence respiratoire entre 60-80 respirations par minute.
- Utilisez une tondeuse électrique pour enlever les poils sur la patte arrière droite et la région inguinale de la souris.
- Toute trace de cheveux dénoués et en douceur, appliquer une couche modeste de la lotion sur la zone Nair rasée avec un coton-tige. Après une minute de la demande initiale, retirez le Nair et nettoyer la peau exposée avec un chiffon humideserviette en papier. Assurez-vous que la souris est propre et sèche avant de continuer.
- Faire une petite incision de 2 à 3 mm avec des ciseaux au niveau du genou droit d'exposer le tendon extenseur.
- Appliquer Vetbond le long du centre du support de souris, où le corps de la souris et la jambe sera positionné. Fixez soigneusement la souris sur le support, avec le genou droit vers le bas, afin d'exposer la fosse poplitée droite. Fixez le tendon du genou droit avec Vetbond entre les 2 supports lambeau de peau pour aider à stabiliser le champ d'imagerie.
- Stretch et ruban adhésif sur les bras et la jambe gauche à la plate-forme supérieure de la porte.
- Utilisez une attache pour fixer le masque à gaz en place.
- Placez le support sous le microscope à dissection. La LN doit rester absolument immobile, indépendante du mouvement respiratoire de la souris. Par conséquent, des précautions doivent être prises pendant la chirurgie afin d'optimiser la stabilité de la jambe. Déterminer la position de la queue (typiquement au-dessus de la tête) qui contribuera à la plus grandela stabilité à la jambe droite et la bande de la queue vers le bas.
3. Chirurgie
- Alors que dans le cadre du champ d'application de dissection, de maintenir la température du corps de la souris en utilisant un appareil de chauffage ou un coussin chauffant. Pour l'imagerie réussie de la LN poplitée, il est essentiel de maintenir la température du corps adéquate tout au long de la chirurgie ainsi que pour préserver l'humidité du tissu par l'application constante chaude PBS pour les tissus exposés.
- Stériliser la peau avec de la Bétadine. L'aide de ciseaux stériles, faire une incision médiane à travers la peau à droite à mi-mollet, et continuez à couper verticalement vers le haut à la partie supérieure de la cuisse droite.
- Faire deux incisions cutanées horizontales en haut de la ligne d'incision verticale pour créer lambeaux cutanés de chaque côté.
- Rentrer et collez-le deux lambeaux cutanés avec Vetbond. Tirer la peau tendue avant d'appliquer Vetbond permettra de promouvoir davantage la stabilité jambe, mais assurez-vous que la tension de la peau n'a pas obstruer la circulation sanguine (à savoir les changements de la vesseL Couleur ou diamètre). Continuer à coller par d'autres secteurs de la peau pour assurer la stabilité de la jambe avant d'exposer la LN. La taille de la souris permettra de déterminer combien la peau supplémentaire est nécessaire pour la colle vers le bas. En règle générale, les grandes souris, il faudra plus de peau à être collé à la porte.
- La LN doit se situer dans la fosse poplitée, soit à droite ou à gauche de la veine poplitée, en fonction de la mise en place de la souris sur le support. Soigneusement séparer la LN à partir de tissus adipeux et les muscles qui entourent l'aide de micro-dissection des pincettes et des pinces. Afin de minimiser les saignements et les traumatismes, utiliser les techniques écarteurs avec des micro-dissection pince à épiler pour les tissus distincts. Dégager prudemment la LN poplitée sans compromettre l'intégrité des vaisseaux sanguins afférents et efférents et les vaisseaux lymphatiques afférents.
- Pour la stabilité des tissus ajouté, un couvercle en verre carré peut être positionné au-dessus de la LN humide, à peine de toucher la LN, tout en évitant occlusion du vaisseau. Le couvercle en verre peut être sécured avec la pâte à modeler de chaque côté de la souris.
- Colorants fluorescents de navires de différentes tailles (par exemple TRITC-dextran, minimum de 70 kDa) peuvent être introduits par voie intraveineuse à ce point pour aider à mettre en évidence la relation structurelle et l'intégrité du LN lors de l'imagerie.
4. 2-Photon Imaging Acquisition **
- Une fois que la LN est suffisamment exposée et la stabilité est obtenue, transférer rapidement l'ensemble de la souris tout support sur la platine du microscope muni d'un tampon de température retour chauffage programmable contrôlé dans une chambre de l'environnement microscope maintenue à 37 ° C. Ajouter assez stérile chaude (37 ° C) ou PBS HBSS à submerger la LN. Le volume change en fonction de la taille et l'emplacement de la souris. Alternativement, chaleureux PBS ou HBSS peut être appliqué directement sur la LN disséquée à travers une pipette en verre bien adapté à une pompe péristaltique et scotchée à la colonne de l'objectif objectif à immersion. Le débit du liquide doit être telle que lecolonne d'eau stable peut être maintenu entre la lentille et le tissu.
- Maintenir la température de PBS ou HBSS à 37 ° C à l'aide d'un coussin chauffant avec une sonde de rétroaction. Une sonde de température distincte doit être placé dans le support de la souris pour confirmer la température de la PBS dans la plage de 36,5 à 37,5 ° C Une sonde rectale peut également être utilisé pour surveiller la température centrale du corps de la souris expérimentale long de la session d'imagerie.
- Utilisez une lampe fluorescente epi-pour aider le placement LN guide sous l'objectif. Acquérir piles d'images fluorescentes à l'aide des intervalles de temps qui sont appropriés pour l'interaction cellulaire désiré (généralement de 10 secondes à 1 minute entre chaque pile d'images xyz).
- Surveiller l'état de l'animal dans la chambre du microscope souvent par inspection visuelle ou en utilisant un système de surveillance des animaux. Déterminer si la souris est entièrement anesthésié par l'absence de réponse aux pieds et / ou pincées ongles, et une constante, non-travaillé le rythme respiratoire de 60-80 breaths par minute. Le niveau de l'isoflurane peut être ajustée en conséquence pour s'assurer que l'animal est complètement sous sédation. Avec un suivi adéquat et une hydratation, les animaux peuvent être visualisés pendant 4-6 heures, ou peut-être plus.
- Après l'expérience d'imagerie, euthanasier l'animal dans un chambre de CO 2 en utilisant le protocole approuvé par l'euthanasie IACUC. L'animal ne doit pas être autorisé à sortir de l'anesthésie avant l'euthanasie.
** Cette procédure chirurgicale peut aussi être utile pour d'autres formes d'imagerie intravitale autre que 2P-LSM.
5. Les résultats représentatifs
Diverses cellules immunitaires circulantes sont recrutés à la LN à des taux différents suivant le transfert adoptif. Pour CD4 + et CD8 + lymphocytes, ces cellules commencent à arriver dans la LN dans les hautes endothéliales veinules (HEV) minutes après le transfert iv avec un nombre substantiel qui arrivent dans la LN poplitée après 2 à 4 heures 6,17-18. Pour cel Bls, un nombre important s'accumulent au bout de 8 à 24 heures 19. PED activés devraient commencer à apparaître dans les drainant poplités LN 8 à 16 heures après l'injection du coussinet plantaire 3,11,16-17. La figure 2a montre que, même sans autres repères, des structures telles que les follicules de cellules B peuvent être discernées facilement par l'accumulation de cellules sphériques ronde visible sous 2P-LSM 19. L'utilisation d'un journaliste endogène fluorescent tel que les splénocytes ubiquitine-GFP (figure 2, Vidéos supplémentaires 1 et 2), on peut suivre ces migrations lymphocytes et les comportements pour les jours jusqu'à une semaine dans des conditions non-stimulation des conditions physiologiques. Avec des détecteurs multicanaux à haute sensibilité, il est possible d'acquérir un ensemble de données d'imagerie multiplex qui englobe l'information structurelle ainsi que la dynamique d'interaction entre les multiples partenaires cellulaires 17,19.
Lorsque les techniques chirurgicales sont correctement exécutées et les conditions environnementales soigneusement contrôlée, lymtes doit présenter la vitesse de migration caractéristique, comme le montre la figure 2c, 2d et ailleurs 13-14,16. Les lymphocytes peuvent également présenter des différences dans la vitesse de migration en fonction des sous-régions de l'imagerie LN objet, points de repère afin supplémentaires telles que les vaisseaux sanguins (comme l'a souligné par l'introduction de colorants navires) vous aidera à déterminer la qualité d'image globale (à savoir le contrôle de température appropriée , un traumatisme minime à LN, etc) 3,6,20.

Figure 1. Construction d'un titulaire de la souris pour souris poplitée Imaging LN a) Schéma de montage porte-souris;. B) la préparation de la souris Représentant intravitale; c) Assemblée Terminé porte-souris; d) gros plans de la LN poplitée après l'exposition chirurgicale.
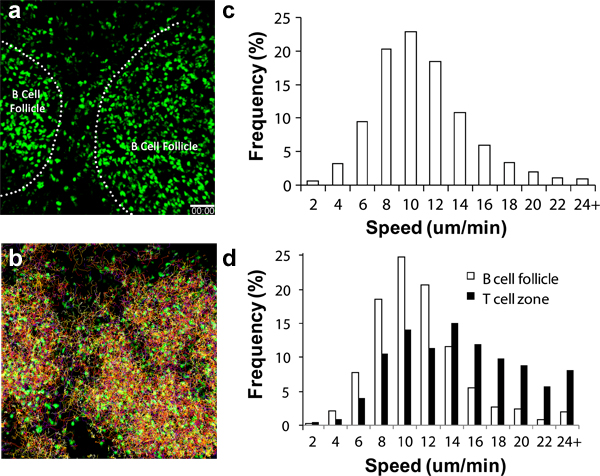
Figure 2. L'analyse des migrations de GFP + lymphocytesdans la LN poplitée. (a) aperçu 3D prises de la séquence d'imagerie 2P-LSM de l'LN poplitée dans une souris receveuse C57BL / 6 adoptive transféré avec 1x10 7 lymphocytes + 1 jour avant la GFP à l'imagerie. Ligne Dash désigne la frontière des follicules de cellules B; (b) Titres de la migration des lymphocytes au cours de 1 heure de l'imagerie en continu; c) Distribution de la vitesse de migration globale des lymphocytes. Vitesse moyenne = 10,04 ± 4,26 um / min (total de 15,125 pistes analysées), d) Différentiel distribution cellulaire vitesse de migration des cellules présentes dans le follicule des cellules B (open bars; la vitesse moyenne = 8,79 ± 3,90 um / min; total 1.525 pistes analysées ) et des lymphocytes T zone (barres fermées; la vitesse moyenne = 13,77 ± 5,93 um / min; total de 1.250 titres analysés). Échelle = 50 microns.
Vidéo supplémentaire 1. Time-lapse intravitale 2P-LSM imagerie d'un LN souris poplitée comme décrit dans la figure 2. Un total de 1x10 7 lymphocytes ont été isolés enom une souris ubiquitine-GFP + et des bailleurs de fonds transférés par voie intraveineuse adoptive dans une souris receveuse C57BL / 6 24 heures avant l'imagerie. Une série de xy (750 mm x 750 um) des images en fluorescence ont été prises par le biais fixe z piles (5 étapes um, 13 étapes) pour obtenir une pile XYZ Imaging (750 mm x 750 mm x 65 um), qui a été répétée toutes les 20 secondes pour un total de 60 minutes, ce qui entraîne une séquence d'imagerie pour l'analyse xyzt vitesse (figures 2c, 2d). La vitesse de lecture = 450x. Échelle = 50 microns. Horodatage = min: sec. Cliquez ici pour visionner la vidéo supplémentaire .
Vidéo supplémentaire 2 zoom-en vue de la séquence d'imagerie en vidéo supplémentaire 1 au niveau du follicule des cellules B -. Frontière T zone de cellule. La vitesse de lecture = 450x. Échelle = 25 um. Horodatage = min: sec. Clécher ici pour visionner la vidéo supplémentaire.
Discussion
Les progrès récents en haute résolution dans les techniques d'imagerie in situ, en particulier 2P-LSM, ont été accompagnées par un intérêt croissant pour l'étude du comportement dynamique cellulaire in vivo. La technique d'imagerie 4D sur le LN poplitée d'une souris direct permet de telles analyses dans le comportement dynamique des cellules immunitaires dans le tissu sans perturbation micro-environnement. L'utilisation de 2P-LSM avec des détecteurs multiples s'étendant tout le spectre visible permet simultanée de collecte de données d'imagerie de populations de cellules multiples. Cela peut maintenant être atteint grâce à l'utilisation des cellules in vivo spécifiques souris rapporteurs fluorescents (par exemple l'ubiquitine-eGFP,-DP, ou-ECFP) combiné avec l'utilisation du transfert adoptif de populations de cellules marquées de façon différentielle en utilisant des cellules fluorescentes colorants organiques (p. ex CFSE , Snarf-1, et Cell Tracker Orange) d'examiner les mécanismes cellulaires et de la fonction au sein de la LN. En plus de l'observation directe des interactions entre différentielle suivi cpopulations aune, le jeu de données d'imagerie multiplexe peut subir une analyse plus approfondie avec les programmes d'imagerie disponibles dans le commerce de logiciels de traitement (par exemple Imaris, Bitplane Inc) pour élucider le comportement des cellules et la fonction. Un large éventail de possibilités existe pour étudier les mécanismes d'interaction cellulaire en utilisant ces in vivo et in silico techniques.
La principale limitation de l'approche expérimentale décrite ici est la complexité technique inhérente à l'approche chirurgicale. Cette technique nécessite une formation rigoureuse de se familiariser avec l'anatomie pertinente et les procédures précises et des compétences techniques requises par le présent protocole. Facteurs compliquant encore, la difficulté à minimiser les dommages des tissus lors de l'exploration LN, l'optimisation de la stabilité des tissus lors de l'imagerie, et la prévention des blessures thermique et laser à la LN avant et pendant l'expérimentation d'imagerie. Perturbation de l'un de ces facteurs se traduira par moins-que-optimale lymphatiquemotilité ocyte et donc d'interférer avec une interprétation correcte des données d'imagerie résultant des analyses.
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Ce travail est soutenu par des subventions de NCI 1R01CA154656, le NIAID 1R21AI092299, Cancer Research Institute, Fondation Saint-Baldrick, Dana Foundation, Gabrielle Angel Foundation, et Hyundai Motors of America "Hope-sur-roues» du programme.
matériels
Réactif Société (10% povidine-iode solution topique)
| Name | Company | Catalog Number | Comments |
| L'isoflurane, USP | Baxter Healthcare Corporation | NDC 10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| Nair - lotion démaquillante cheveux | Nair | ||
| PBS 1X, | Cellgro | 21-040-CV | |
| Watlow | |||
| Chauffage Manette | Watlow | ||
| Air et O 2 | Airgas | ||
| Harvard Apparatus | |||
| Pince à épiler Dumont # 5 | Monde Precision Instruments, Inc | 14101 | |
| Pince, Graefe Iris, 7 cm incurvée | Monde Precision Instruments, Inc | 14141 | |
| Ciseaux | Roboz chirurgical Instrument Co., Inc | RS-5880 | |
| Couverture de plat en verre 100x20 mm de culture cellulaire | Corning | 70165-102 | |
| Couverture de plat en polystyrène mm 100x20 culture cellulaire | Corning | 430167 | |
| Produits de Purdue, LP | NDC 67618-150-08 |
Références
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon