Method Article
呼吸器病原体に対する宿主細胞応答を研究するために偏ヒト気道上皮Calu-3細胞の液体に覆われた文化の確立
要約
本報告書における調査結果と結論は著者のものであり、必ずしも疾病管理予防センターの見解を示すものではない。
要約
気道上皮細胞の頂端及び基底外側表面は、生体内で病原体の曝露に指向性の応答を示しています。このように、根尖と基底外側表面を形成し、分極呼吸器病原体に対する細胞応答を調べるためのin vitroモデル理想。そのようなモデルは、正常ヒト気管支上皮細胞(NHBE)が区別されます。しかしながら、このシステムは、分離肺組織サンプル、ノウハウや組織から培養上皮細胞、気液界面の文化を生成するには時間が必要です。
ヒト気管支腺由来Calu-3細胞は、インフルエンザウイルス、ライノウイルスなどの呼吸器侮辱1〜近位気道上皮細胞は、薬理学的化合物2-6、7-9とし、細菌、ウイルスの病原体の応答を調べるための代替モデルであると重症急性呼吸器症候群-関連コロナ10-14。最近では、ワットeはCalu-3細胞はNHBE 15,16と一貫性のある方法で呼吸器合胞体ウイルス(RSV)感染に感受性であることを実証した。ここでは、詳細Calu-3細胞の偏光、液体に覆われた文化(LCC)の設立は、LCCに培養し、我々が提示されている細胞を維持し、成長して培養Calu-3細胞の技術的な詳細に焦点を当て偏Calu-3細胞の呼吸器ウイルス感染を行う方法。
一貫して偏Calu-3 LCCを取得するには、Calu-3細胞は、トランスウェルインサートで培養する前に注意深く継代培養することが必要。 Calu-3、単層培養では、90%コンフルエントに下回っている必要があります凍結ストックからより少ない10回継代培養されるべきであり、定期的に新鮮な培地を供給する必要があります。一度トランスウェルで培養し、Calu-3 LCCは、慎重に取り扱う必要があります。不規則なメディアの変化と細胞層またはプレートの機械的または物理的破壊に悪影響を与えるための偏光数時間または数日。偏光は、経上皮電気抵抗(TEER)を評価することによって監視され、心尖部と基底外側コンパートメント17,18間にフルオレセインナトリウムの受動的な平衡を評価することによって検証されます。 Ω×cm 2でまたは1,000上記一度TEER高原は、Calu-3 LCCは呼吸器病原体に対する細胞応答を調べるために使用する準備が整いました。
プロトコル
1。トランスウェル培養における使用のための培養Calu-3細胞
安全対策:無菌培養技術を用いたバイオセーフティキャビネット内のすべての手順を実行します。
- 冷凍保存から細胞を解凍するには、次のように
- 20パーセントの熱不活性化ウシ胎児血清(FBS)、0.1mMの非必須アミノ酸、2mM L-グルタミン、および10 mMのHEPES緩衝液(pH7.4)(EMEM-20%+ S)を含むイーグル最小必須培地を準備します。 ℃の0.2μm孔サイズのフィルターを用いて調製した培地滅菌フィルタ、および37〜水浴中で暖かい現場気道上皮環境での複数の反射であるためには、媒体は、抗生物質や抗真菌剤で補充されていません。
- 37℃の水浴中で急速にCalu-3細胞(<1分)の凍結クライオバイアルを解凍します。
- 50ミリリットル滅菌コニカルチューブに解凍した細胞を移し、温めの30ミリリットルEMEM-20%+ Sを追加
- ペレット1,000-1,200で5分間×gでの遠心分離により細胞冷凍せずに、低ブレーキ速度を持つ。
- 優しく上清を除去し、優しく上下にピペッティングによって暖めEMEM-20%+ S 5mlに細胞を再懸濁する。シード2から5×ウェル当たり10 6個の細胞を、6ウェル組織培養プレートとインキュベートに37℃、空気雰囲気下で、C、7%CO 2の細胞が75%になるまで- 80%コンフルエント。毎日チェックし、最大7日間が必要になることがあります。 3〜4日毎に、細胞から培地を吸引し、新鮮EMEM-20%+ Sと交換してください
- 継代培養細胞へ:
- 暖かい0.05%トリプシン - 37℃の水浴中で0.02%EDTA。過剰培地および血清を除去するために0.02%EDTA - 細胞から培地を吸引除去し、暖められた0.05%トリプシンで一回細胞を洗浄する。洗濯物を取り出して、細胞にウェルあたり温めトリプシンを1ml加える。
- 37℃でインキュベートし、顕微鏡下で7%のCO 2およびモニター細胞の少なくとも75%が組織培養プレートのウェル(S)から切り離されるまで、5分毎に。をこのかもしれない5〜30分かかる。
- 過剰トリプシンを除去するためにEMEM-20%+ Sで細胞を洗浄します。 50ミリリットル滅菌コニカルチューブにトリプシン処理した細胞を移す。 1 6ウェル培養プレートからの細胞の複数のウェルは、1つの50 mlの滅菌コニカルチューブにプールすることができる。 EMEM-20%+ Sおよびペレット1,000-1,200遠心分離によって細胞×gで、冷凍せずに、低速度でブレーキの30ミリリットルを追加します。
- 優しく上清を除去し、優しく上下にピペッティングすることにより新鮮なEMEM-20%+ Sで細胞を再懸濁します。 1.2.7〜ステップ1.2.5で説明したように、彼らは75の間にあるときに、細胞をトリプシン処理するには、上記1.2.3を介して手順1.2.1を使用して、組織培養皿に細胞を継代培養を続けて - 80%コンフルエント。
- 最大6ウェルプレートのウェル1からEMEM-20%+ Sを5 mlの最終容積1のT-25cm 2フラスコに継代培養は、0.5〜1×10 6細胞/フラスコの間に播種。
- 5ミリリットルを使用すると、細胞を剥離するためのT-25cm 2フラスコ、継代ごとにトリプシンを温め1、T-25cm 2フラスコから最大1までEMEM-20%+ S 10mlの最終体積中のT-75cm 2フラスコ、播種5から1の間の×10 6細胞/フラスコ。
- 8ミリリットルを使用すると、2のT-75cm 2フラスコに1、T-75cm 2フラスコから細胞、継代培養をデタッチし、T-75cm 2フラスコあたりトリプシンを温めた。 3新しいフラスコ:最適な細胞成長は、1親フラスコよりも大きい割合で、T-75 cm 2以上継代より大きいフラスコに継代培養細胞ません。
- 一度細胞は継代培養された、完全に削除して、彼らは75から90パーセントの合流点に到達するまで2〜3日ごとに培地を交換してください。細胞は、75から90パーセントのコンフルエンスに到達するために3週間ほどかかる場合があります。偏文化、サブカルチャー細胞は単層として90%コンフルエンスを超えて成長する前の最適な世代のために。
- 十分な細胞がシードにトランスウェルインサート数を任意の数に成長するまで継代培養細胞に進みます。各トランスウェルインサートは、2×10 5個の細胞を必要とする。偏文化を生成する最適なパフォーマンスを得るには、10以上の継代培養を受けた細胞を使用しています。
2。偏Calu-3液体に覆われた文化(LCC)の成長
安全対策:無菌培養技術を用いたバイオセーフティキャビネット内のすべての手順を実行します。
- 37に水浴中で、10%FBS(EMEM-10%)と暖かいを含むEMEMを準備℃に
- 播種用の24ウェルトランスウェルプレートを準備します。滅菌ピンセットを使用して、インサート膜に触れることなく、内部からの板の外側の行にトランスウェルインサートを移動します。細胞はプレートのみの外装行上のウェルに継代培養することがあります。基底外側コンパートメントへの気泡の導入を防ぐために、それぞれの区画の壁にピペットを傾けるとゆっくりウェルに培地を放出することによって、それぞれにEMEM-10%の600μlを添加する。
- T-75cm 2の組織から細胞を剥離する。 Subcultureは温めトリプシンを用いてフラスコ、そして、ステップ1.2に記載されてトリプシン処理した細胞の各2フラスコあたりのEMEM-20%+ S 30mlに洗ってください。
- 徹底的に優しく上下にピペッティングによりEMEM-10%の5ミリリットルで洗浄した細胞を再懸濁する。
- トリパンブルー排除法により生存および総細胞数を決定します。 90パーセント生存可能である - 80%の場合にのみ行ってください。
- 50ミリリットル滅菌コニカルチューブに、EMEM-10%と濃度2×10 6生細胞/ mlになるように細胞を希釈します。
- 各トランスウェルの頂端コンパートメントにセルを追加します。無細胞対照ウェル、つまり、空白になりますウェルA1とD1、細胞なしにEMEM-10%の100μlを添加する。残りの各ウェルに、そっと挿入壁の内部ガイドチャネルに対してピペットを傾けるとゆっくり細胞を放出、再懸濁Calu-3細胞の100μlを添加する。インサート膜にピペットを触れないでください。 Calu-3細胞の均質な懸濁液を維持するために、穏やかに細胞懸濁液を攪拌この播種ステップ中。
- 37℃、7%の空気雰囲気中のCO 2インキュベーターで培養するトランスウェルプレート。物理的な乱れが最小限になりますインキュベーターに入れ、プレート。偏光の効率を向上させるために、互いの上にプレートを積み重ねないでください。
- 偏と実験で使用する準備ができるまでの文化を維持するために、完全に下に2.13〜ステップ2.10で説明したように、トランスウェルに培地を交換してください。細胞が完全に偏光している媒体が完全になるまで、3日間のトランスウェルに継代培養された後、次に以前の給餌後の第4、その後三日の間で交互のサイクルで交換する必要があります。
- 暖かいEMEM-10水浴中%〜37℃
- 優しくトランスウェルインサートから培地を吸引除去する。穏やかな真空と真空トラップに接続されている毛細管ピペットを用いて、または標準の1ミリリットルまず、すべての井戸からアピカル培地を除去後、ピペット、無細胞ウェルA1とD1から吸引中、シード井戸から、とtと鶏は井戸から基底側培地を除去する。培地を吸引しながらインサート膜を触れないでください。
- ピペットチップを導くためにインサートの側面を使用してアピカルコンパートメントに培地を演出し、シードウェルに、無細胞ウェルA1とD1の頂端コンパートメントにEMEM-10%の200μlを添加する。細胞に直接メディアを追加しないでください、とインサート膜に触れないでください。
- 基底外側コンパートメントにEMEM-10%の600μlを添加する。基底外側コンパートメントへの気泡の導入を防ぐために、それぞれの区画の壁にピペットを傾けるとゆっくりウェルに培地を放出することによって、それぞれに媒体を追加します。
3。 Calu-3 LCCの抵抗性の発達を評価する
安全対策:無菌培養技術を用いたバイオセーフティキャビネット内のすべての手順を実行します。
- 後Calu-3のLCC 30分の経上皮電気抵抗(TEER)を評価培地の変化;必要に応じて評価は各媒体変更後に実行することができます。無菌条件下での測定を行う。ベースライン測定値を得るために、無細胞コントロールウェルA1とD1(空白)で測定を開始し、各ウェルの測定を継続します。
- 無菌条件下で、滅菌水で70%のエタノールを含む50mlの遠心管にSTX2電極を転送し、15分滅菌してください。
- キャリブレーションと製造者の指示に従って使用するためvoltohmmeterをテストします。
- エタノール、空気乾燥した5から10秒から電極を外し、滅菌EMEM-10%で電極を洗浄してください。
- 抵抗設定にvoltohmmeterのモードスイッチを設定し、電源をONにしてください。
- そっと1トランスウェル文化の基底外側コンパートメントにアクセスを許可する3ポートのいずれかに電極を配置します。場所電極はとても長いリードはわずかに軽く、外側の井戸の底に触れると垂直のままでいることと短いリードはインサート膜に触れることなく、アピカルコンパートメントの組織培養培地である。
- "メジャーR"ボタンを押すと、安定するのを待ちます。各ウェルの他の2つのポートに対してこのステップを繰り返し、すべての3つのポートからの測定値を記録し、1ウェルあたり3の測定値の合計。細胞のすべてのウェルのための抵抗値を測定し続けています。
- 無菌のdH 2 Oですすぎ、よく乾燥させ、70%エタノール中で5〜10分間浸漬することによって電極を清掃してください。元の容器に保管してください。
- 式(1)を用いて、各ウェルの抵抗値を計算します。
Ω=Ω 実際のサンプル - Ω ブランク 、 式(1)
Ωのサンプルでは、シードでなく、Ω ブランクからの平均測定値が2ウェル、A1とD1からの平均測定値を含む挿入および培地が、細胞は全くされている場所です。 - 方程式を用いて、単位面積抵抗を計算る2。
Ω× 実際の有効膜面積=Ω×cm 2であり 、 式(2)
どこ有効膜面積は24ウェルトランスウェルインサート0.33 cm 2である。
- その偏光は一から三トランスウェル培養で、頂端および側底コンパートメント間の受動フルオレセインナトリウムの拡散を測定し、二次アッセイを行うことにより完了していることを確認。フルオレセインナトリウムアッセイに用いウェルをアッセイの終了後すぐに破棄してください。
- 4.75のKCl;; 2.53 mMのCaCl 2·2H 2 O、2.44のMgSO 4、1.19 mMのKH 2 PO 4、25mMの滅菌水のNaHCO 3、0.45μmの濾過装置と滅菌フィルター(118 mMのNaCl非蛍光バッファを準備)。 4、光から保護℃、少なくとも非蛍光バッファー、滅菌フィルター、アルミホイルで包むと、ストア内の1 mg / mlとなるようにフルオレセインナトリウムを準備します。部屋temperatuに温まる使用前に再評価。
- 抵抗測定を完了した後、丁寧に一から三個々のトランスウェル文化の基底と頂端区画の両方からメディアを取り出します。
- トランスウェル培養液を洗い流す。優しく心尖部のコンパートメントに基底外側コンパートメントおよび100μlの室温の滅菌、D-PBSを600μlの室温の滅菌ダルベッコPBS(D-PBS)を追加します。
- 優しく井戸から、D-PBSを除去します。基底外側コンパートメントに600μlの滅菌非蛍光バッファを追加します。心尖部のコンパートメントに100μlの滅菌1 mg / mlのフルオレセインナトリウムを追加します。
- 1時間37℃で静置します。 CO 2は 、このインキュベーションの間に必要とされない。
- インキュベーションの間、フルオレセインナトリウムを希釈するために非蛍光性緩衝液を用いて、20μg/ mlの、0μg/ mlの間の範囲のフルオレセインナトリウムの検量線を準備してください。フルオレセインナトリウムの少なくとも8つの異なる濃度で、少なくとも600μlの最終ボリューム内の各準備をします。保つ標準曲線希釈液は、吸光度を測定する準備が整うまで、光から保護。
- 各テスト·トランスウェルの基底外側区画から分析のための独立したきれいなチューブに非蛍光バッファサンプルを転送します。プレートから受動フルオレセインナトリウムの拡散を調べ、破棄するために使用されるテストトランスウェルを削除します。インキュベーターに残りのトランスウェルプレートを返す。
- 96ウェル平底プレートに三重の各標準溶液の100μlを置きます。
- 非蛍光バッファ内の各基底外側サンプルの3希釈(1:2、1:20〜1:50)を用意し、二重に、各原液サンプルの、各希釈液100μLを加え、96ウェルにフラット底板。
- 486 nmまたは490 nmでELISAプレートリーダーでサンプルの吸光度を測定します。
- フルオレセインナトリウムstの吸光度の値に対するサンプルの吸光度を比較することにより基底外側区画におけるフルオレセインナトリウムの濃度を決定andard曲線。
4。呼吸器系ウイルスを有する偏Calu-3 LCCを感染させる
安全対策:ウィルスが使用されているため、適切な生物学的安全性レベルでの無菌培養技術を用いて、バイオセーフティキャビネット内のすべてのプロシージャを実行します。
- 希望接種が100μlになるように、無血清EMEMでウイルスを希釈します。
- 無血清EMEMで細胞を洗浄します。優しくその後基底外側媒体をアピカル培地を除去し、すべてのウェルから培地を吸引除去する。穏やかな真空と真空トラップに接続されている毛細管ピペットを用いて、または標準の1ミリリットルピペット、無細胞ウェルA1とD1から吸引媒体とその後シード井戸からは、まず、すべての井戸からアピカル培地を除去した後、削除するすべてのウェルから基底外側の媒体。培地を吸引しながらインサート膜を触れないでください。
- 無細胞ウェルA1とD1の頂端区画し、[tに無血清EMEM 100μLを彼シードウェルは、ピペットの先端を導くためにインサートの側面を使用してアピカルコンパートメントに培地を演出。細胞に直接メディアを追加しないと、インサート膜に触れないでください。
- 基底外側コンパートメントに無血清EMEMの600μlを添加する。コンパートメントの壁にピペットを傾けるとゆっくりウェルに培地を放出することによって、それぞれのトランスウェルに培地を追加します。
- 優しく井戸から無血清培地を吸引除去する。
- 感染していないか、または偽感染井戸を皮切りに、トランスウェルの頂端コンパートメントに適切なウイルス希釈液を追加します。感染していない井戸のため、適切なトランスウェルの頂端コンパートメントに無血清EMEMで希釈したウイルスフリーの準備を100μlを加え、模擬感染ウェルに、適切なトランスウェルの頂端コンパートメントに無血清EMEM100μlを追加して、用ウイルス感染は、無血清EMEMでウイルスを希釈し、適切なトランスウェルの頂端コンパートメントに100μlを添加する。
- すべての基底外側コンパートメントに無血清EMEMの600μlを添加する。
- 37℃、2時間では7%のCO 2。
- その後、感染した井戸から、最初の感染していないと偽感染井戸から、井戸から培地を吸引する。基底外側清続いた最初の頂端の上清を、削除します。
- 頂端区画及び基底外側コンパートメントにおけるEMEM-10%の600μlのEMEM-10%200μlの培地を交換してください。
結果
図1に示すようにすると異なる頂端面と基底外側を開発、分極Calu-3細胞を、トランスウェル培養系において液体に覆われた培養物(LCC)として成長。ここで説明する方法に従って、Calu-3 LCCの経上皮電気抵抗(TEER)は播種後3週間以内にΩ×cm 2でまたは1,000上記の高原、 図2に示されているそのうちの一例に達する。タイトジャンクションは、アピカルと基底外側コンパートメント間の小分子の受動的な平衡を防ぐ偏細胞間に形成された。したがって、修正されたフルオレセインナトリウムの平衡化アッセイはCalu-3 LCC 15,17,18の偏光を確認するために使用されます。 LCCの増加Calu-3細胞単層のTEERとして、受動基底外側コンパートメントに平衡フルオレセインの量が減少します。 TEERは1,000Ω×cm 2であり 、均衡でフルオレセインの量になったら基底外側コンパートメントには、 図3に示すよう≤1%が、されているため、Calu-3 LCCはTEERが≥1,000Ω×cm 2であるときには完全に偏光されると考えられている。 Calu-3 LCCのピークTEER測定は実験から実験に異なる場合があります。しかしながら、どんな与えられた実験用一度TEER値高原、完全偏光、感染していないCalu-3 LCCは12週間後の種まき5〜にわたって安定している必要があります。トランスウェル培養しCalu-3に抵抗性の発達の有無を表1に概説されるように、いくつかの要因によって引き起こされることがありますΩ×cm 2でまたは1,000上記Calu-3のLCC高 原のTEERは、モデルが検査するために使用する準備ができたら呼吸器合胞体ウイルス(RSV)などの呼吸器病原体に対する気道上皮細胞応答。細胞のモック感染( 図4)に比べて偏文化の整合性でより急速に低下におけるRSV結果への暴露。
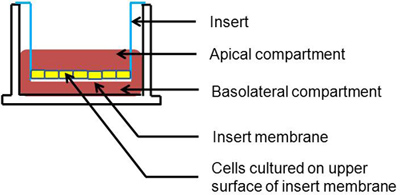
図1。トランスウェル培養細胞の断面表現。細胞はインサート膜の頂端表面上に成長させられる。
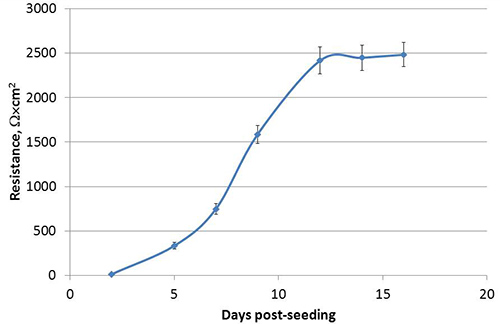
図2。経上皮電気抵抗(TEER)およびトランスウェルインサートにおける播種後Calu-3細胞の分極の開発。各時点で、TEERは中央値ΩX cm 2と ±1の代表的な実験から32個の独立した井戸のSEMとして提示されます。
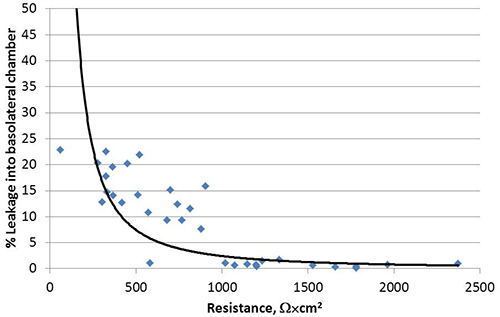
図3。受動平衡化細胞が偏になるとCalu-3細胞単層の基底外側コンパートメントにフルオレセインナトリウムの校正が禁止されます。4つの独立した実験からの累積データが提示されます。各データポイントは、個々の測定値を表す。
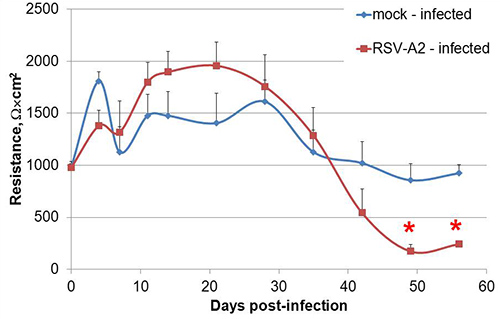
図4。偏Calu-3 LCCのRSV感染は、単層の整合性の低下を加速させます。偏Calu-3細胞は、0日目に、MOI = 1で、RSV-A2に感染させ、極性が8週間後の感染をモニターした。一つの代表的な実験が示されている。データが感染当たり8つの独立した井戸±SEM時点あたりの平均的な抵抗として提示されている。 * P <0.05として、スチューデントのt-検定によって決定モックおよびRSV-A2感染培養の間。
- ウェル内の気泡を取り除く
- 凍結ストックから10倍未満に継代培養されたCalu-3細胞を使用
- Calu-3細胞は、単層のサブカルチャーに100%コンフルエントに到達することを許可しないでください
- 細胞は(細胞がインサートの孔を通って成長してきた可能性があることを示す)だけでなく、インサート下プラスチックの上に成長していないことを確認
- 完全な抵抗性の発達のために2〜3週間後の播種を許可
- 変更、使用インサートの組成と細孔の大きさを確認し、必要に応じて(推奨ポリエステルインサート、0.3μmの細孔径、ノーコーティングは、詳細については資料を参照してください)
- 電極の品質をチェックし、先端から蓄積されたタンパク質を除去するために穏やかにサンディングし、必要に応じて交換
- 細菌の増殖のための培地をチェック
- 開発するための分極が(時折4週程かかるかもしれない)のために追加の時間を許可する
- 凍結ストックから10倍未満に継代培養されたCalu-3細胞を使用
- Calu-3細胞は、単層のサブカルチャーに100%コンフルエントに到達することを許可しないでください
- 一貫して前の授乳後、次に、第3および第4日目の間で交互に、トランスウェル培養で培地を交換
- プレートの外側の行に配置されている挿入時の培養細胞のみ
- トランスウェルインサートの異なるロットを使用
- インキュベーター内でプレートを妨害したり、積み重ねないでください
- トランスウェルプラットフォームながら、バイオセーフティキャビネットの振動が発生することはありませんESは、処理されている
- ウェル内の気泡を取り除く
- メディアを変更したり、TEERの読み取りを行う際にピペットチップを用いた細胞層を乱さないようにする
- アピカルコンパートメントに200μlの培地を使用し、小さい音量が不安定TEERの測定値になることがあり
- 電極の品質をチェックし、先端から蓄積されたタンパク質を除去するために穏やかにサンディングし、必要に応じて交換
トランスウェルで培養Calu-3細胞を生じる可能性がある表1トラブルシューティングの問題。複数の要因が液体に覆われた文化は、この表で強調表示されている可能性が最も高いでCalu-3細胞の完全な偏光に貢献しています。
ディスカッション
トランスウェルインサートにCalu-3 LCCを確立するとき、細胞は全く分極しなかったり、完全に分極ないかもしれない、などTEERによって定義≥1,000Ω×cm 2であり、頂端および側底コンパートメント間≤1%フルオレセインナトリウム色素平衡。また、LCCのCalu-3細胞が完全に分極することがありますが、TEERは、測定値の間に一致しない場合があります。 Calu-3 LCCのTEER測定値の変動は日ごとに正常であるが文化は当然のようにわずか5週間または限り、12週間であるかもしれない、年齢とともに低下するまで、TEERで一度完全に偏光し、劇的なスイングが期待されていません播種後。
偏光するCalu-3 LCCの能力は、細胞が維持され、トランスウェルシステムで使用する前に、継代培養方法に部分的に依存します。継代培養中に単層として90%コンフルエンス超えた存在へと成長した細胞、凍結ストックから10回以上継代培養された、またはされていないこと定期的に新鮮な培地に付属enが完全に分極しにくく、任意の偏光が急速に低下する可能性があります。偏光の不完全または完全な欠如は、材料及びCalu-3のLCCに使用トランスウェルの細孔径のばらつきに起因することができ、同様の組成と細孔径のトランスウェルにおけるロット間のばらつきも偏光に影響を及ぼす可能性があります。より大きな孔径はCalu-3は偏光から文化を防止し、基底外側コンパートメントにTranswell膜を通して成長できるようにすることができます。偏光の欠如はまた、細菌の増殖が原因である可能性があり、Calu-3細胞間のタイトジャンクションのその後の破壊につながる曇った培地で示される。
Calu-3 LCCの変数TEER測定はCalu-3のLCC細胞単層、挿入、またはプレート自体の機械的な混乱によって引き起こされることがあります。ミディアム変更とTEER測定はピペットチップや電気なしで実行されるべきであるドは、細胞に触れるつながる。これらの操作を実行していますが、注意が抵抗を検出するvoltohmmeterの能力を混乱させる頂端および側底コンパートメントに気泡を導入することを避けるために注意するべきです。実際に偏光している文化の中で抵抗を検出するvoltohmmeterの能力は、電極リード上のタンパク質の蓄積によって制限があります。このビルドアップを、穏やかにサンディングで取り除くことができ、または電極を交換することによって補正することができる。
一度Calu-3 LCCが完全に分極とTEERはもはや増加されていない、Calu-3 LCCは呼吸器感染症にホスト肺上皮細胞応答を特徴付けるためのin vitroモデルとして使用するための準備が整いました。このシステムは、Calu-3 LCC BEIの追加の利点と、伝統的にそのようなA549およびHEp-2細胞などの呼吸器病原体を研究するために使用される単層培養した肺癌細胞株に比べて病原体に指向性応答の優れた特性評価を可能にする開発がより迅速に、より簡単に得られ、一次、偏光、微分さNHBEより生成する安価NG。 NHBEと同様に、偏Calu-3タイトジャンクションの形成を実証し、ムチンを産生する。しかし、NHBE異なり、偏Calu-3細胞は基底細胞と線毛円柱上皮細胞の層に分化していない、といくつかの偏Calu-3細胞は繊毛状の突起19を開発しています 。したがって、呼吸侮辱に気道上皮細胞の分極応答を調べるために有用ですが、偏Calu-3 LCCは呼吸侮辱やけがに応じて気道の開発や改造を検討するための理想的なモデルではありません。 in vitroで培養された細胞による粘液産生細胞の感染だけでなく、偏光モデルにおける感染性ウイルスとウイルスの拡散のリリース、および偏Calu-3 LCCと偏光、微分さNHBEが報告されていない間に粘液産生の直接比較に影響を与える可能性がある。 A549およびHEp-2細胞Calu-3細胞より培養しやすく、再、トランスウェルインサート上で成長させたときにしかし、Calu-3のLCCとは異なり、彼らは、偏光の文化を形成しないと、呼吸器系ウイルス感染にインビトロで偏上皮細胞の応答を調べるために、理想的なモデルではありません。
開示事項
特別な利害関係は宣言されません。
謝辞
著者は彼女の技術支援のためのエリザベス·ブランチャードに感謝したいと思います。本報告書における調査結果と結論は著者のものであり、必ずしも疾病管理予防センターの見解を示すものではない。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | |||
| Calu-3 | ATCC | HTB-55 | |
| 0.05%トリプシン - 0.02%のEDTA | GIBCO /インビトロジェン | 25300 | |
| イーグル最小必須培地(EMEM) | GIBCO /インビトロジェン | 07-00100DK | |
| ウシ胎児血清(FBS) | Hyclone社 | SH30070.03 | 熱不活性化、56℃、30分 |
| 100X非必須アミノ酸(10mM)を | GIBCO /インビトロジェン | 11140 | 暗闇の中で4℃で保存 |
| L-グルタミン酸 | GIBCO /インビトロジェン | 25030 | |
| HEPES | GIBCO /インビトロジェン | 15630 | |
| EMEM-10%FBS(EMEM-10%) | 滅菌フィルター、10%血清を熱不活性化FBSを含むEMEMを補う | ||
| EMEM-20%FBS +サプリメント(EMEM-20%+ S) | 最終濃度までEMEMを補足:熱不活性化FBS、20%; 1Xアミノ酸; 2mM L-グルタミン、10mMのHEPES、滅菌フィルター | ||
| 24ウェルトランスウェルプレート | コーニングコスター | 3472 | 3μmの細孔径、ポリエステル |
| トリパンブルー | GIBCO /インビトロジェン | 15250 | |
| エタノール | シグマ | E7023 | 無菌のdH 2 Oを用いて70%までの準備 |
| ダルベッコPBS(D-PBS) | インビトロジェン | 14040 | |
| 非蛍光バッファ | 118 mMのNaCl;4.75のKCl、2.53 mMのCaCl 2×H 2 O、2.44のMgSO 4、1.19 mMのKH 2 PO 4、滅菌水での25mMのNaHCO 3、滅菌フィルター | ||
| フルオレセインナトリウム | シグマ | 6377 | 無菌の非蛍光性緩衝液中の1 mg / mlで、滅菌フィルター、光から保護し、4℃で保存6ヶ月まで |
| 機器 | |||
| Voltohmmeter | ワールド·精密機器 | ||
| STX2電極 | ワールド·精密機器 | ||
| ELISAプレートリーダー | 486または490を測定することができる |
参考文献
- Zhu, Y., Chidekel, A., Shaffer, T. H. Cultured human airway epithelial cells (calu-3): a model of human respiratory function, structure, and inflammatory responses. Critical care research and practice. 2010, (2010).
- Mukherjee, M., Pritchard, D. I., Bosquillon, C. Evaluation of air-interfaced Calu-3 cell layers for investigation of inhaled drug interactions with organic cation transporters in vitro. International journal of pharmaceutics. 426, 7-14 (2012).
- Baginski, L., et al. Investigations into the fate of inhaled salmon calcitonin at the respiratory epithelial barrier. Pharmaceutical research. 29, 332-341 (2012).
- Vllasaliu, D., Alexander, C., Garnett, M., Eaton, M., Stolnik, S. Fc-mediated transport of nanoparticles across airway epithelial cell layers. Journal of controlled release : official journal of the Controlled Release Society. , (2011).
- Vinhas, R., et al. Pollen proteases compromise the airway epithelial barrier through degradation of transmembrane adhesion proteins and lung bioactive peptides. Allergy. 66, 1088-1098 (2011).
- Hein, S., Bur, M., Schaefer, U. F., Lehr, C. M. A new Pharmaceutical Aerosol Deposition Device on Cell Cultures (PADDOCC) to evaluate pulmonary drug absorption for metered dose dry powder formulations. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e. 77, 132-138 (2011).
- Huttunen, S., Toivanen, M., Arkko, S., Ruponen, M., Tikkanen-Kaukanen, C. Inhibition activity of wild berry juice fractions against Streptococcus pneumoniae binding to human bronchial cells. Phytotherapy research: PTR. 25, 122-127 (2011).
- Elm, C., Rohde, M., Vaerman, J. P., Chhatwal, G. S., Hammerschmidt, S. Characterization of the interaction of the pneumococcal surface protein SpsA with the human polymeric immunoglobulin receptor (hpIgR). The Indian journal of medical research. 119, 61-65 (2004).
- Sutherland, T. C., Quattroni, P., Exley, R. M., Tang, C. M. Transcellular passage of Neisseria meningitidis across a polarized respiratory epithelium. Infection and immunity. 78, 3832-3847 (2010).
- Grantham, M. L., et al. Palmitoylation of the influenza A virus M2 protein is not required for virus replication in vitro but contributes to virus virulence. Journal of. 83, 8655-8661 (2009).
- Saedisomeolia, A., Wood, L. G., Garg, M. L., Gibson, P. G., Wark, P. A. Lycopene enrichment of cultured airway epithelial cells decreases the inflammation induced by rhinovirus infection and lipopolysaccharide. The Journal of nutritional biochemistry. 20, 577-585 (2009).
- Yoshikawa, T., Hill, T., Li, K., Peters, C. J., Tseng, C. T. Severe acute respiratory syndrome (SARS) coronavirus-induced lung epithelial cytokines exacerbate SARS pathogenesis by modulating intrinsic functions of monocyte-derived macrophages and dendritic cells. Journal of virology. 83, 3039-3048 (2009).
- Yoshikawa, T., et al. Dynamic innate immune responses of human bronchial epithelial cells to severe acute respiratory syndrome-associated coronavirus infection. PloS one. 5, e8729 (2010).
- Hsu, A. C., et al. Critical role of constitutive type I interferon response in bronchial epithelial cell to influenza infection. PloS one. 7, e32947 (2012).
- Harcourt, J. L., Caidi, H., Anderson, L. J., Haynes, L. M. Evaluation of the Calu-3 cell line as a model of in vitro respiratory syncytial virus infection. Journal of virological methods. 174, 144-149 (2011).
- Zhang, L., Peeples, M. E., Boucher, R. C., Collins, P. L., Pickles, R. J. Respiratory syncytial virus infection of human airway epithelial cells is polarized, specific to ciliated cells, and without obvious cytopathology. Journal of virology. 76, 5654-5666 (2002).
- Geys, J., et al. In vitro study of the pulmonary translocation of nanoparticles: a preliminary study. Toxicology letters. 160, 218-226 (2006).
- Geys, J., Nemery, B., Hoet, P. H. Optimisation of culture conditions to develop an in vitro pulmonary permeability model. Toxicology in vitro : an international journal published in association with BIBRA. 21, 1215-1219 (2007).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical research. 23, 1482-1490 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved