Method Article
Aufbau einer Liquid-bedeckten Kultur Polarized Menschliche Airway Epithelial Calu-3-Zellen, um Host-Zell-Antwort, um Atemwegspathogene Studie
In diesem Artikel
Zusammenfassung
Die Erkenntnisse und Schlussfolgerungen in diesem Bericht sind die der Autoren und stellen nicht notwendigerweise die Ansichten der Centers for Disease Control and Prevention.
Zusammenfassung
Die apikalen und basolateralen Oberflächen Epithelzellen der Atemwege nachzuweisen direktionale Antworten auf Erregers Exposition in vivo. So, ideal in vitro Modellen zur Untersuchung zellulärer Reaktionen auf Atemwegspathogene polarisieren, bilden apikalen und basolateralen Oberflächen. Ein solches Modell ist normale menschliche Bronchialepithelzellen (NHBE) differenziert. Jedoch erfordert dieses System Lungengewebe Proben, Fachkenntnisse Isolierung und Kultivierung epithelialer Zellen aus Gewebe, und die Zeit, um ein Luft-Flüssigkeits-Grenzfläche Kultur erzeugen.
Calu-3-Zellen, aus einer menschlichen Bronchien Adenokarzinom abgeleitet sind eine alternative Modell zur Untersuchung der Reaktion von proximalen Atemwegsepithelzellen die Atmungsorgane Insult 1, pharmakologischen Verbindungen 2-6 und 7-9 bakterielle und virale Pathogene, einschließlich Influenzavirus, Rhinovirus und schwere akute respiratorische Syndrom - assoziierte Coronavirus 10-14. Kürzlich, we gezeigt, dass Calu-3-Zellen anfällig Respiratory Syncytial Virus (RSV)-Infektion in einer Weise, die mit NHBE 15,16 sind. Hier stellen wir ausführlich die Einrichtung einer polarisierten, flüssige verschneiten Kultur (LCC) von Calu-3-Zellen, die sich auf die technischen Details des Anbaus und der Kultivierung Calu-3-Zellen, die Aufrechterhaltung Zellen, die in LCC kultiviert wurden, und wir, die Verfahren zum Durchführen von respiratorischen Virusinfektionen des polarisierten Calu-3-Zellen.
Um eine gleichbleibend zu erhalten polarisierten Calu-3 LCC, Calu-3-Zellen müssen vor Kultivierung in Transwell Einsätze subkultiviert werden. Calu-3 Monolayerkulturen sollte unter 90% Konfluenz zu bleiben, sollte subkultiviert weniger als 10-mal aus gefrorenem Lager ist, und sollten regelmäßig mit frischem Medium versorgt werden. Einmal in Transwells kultiviert, muss Calu-3 LCC mit Vorsicht behandelt werden. Unregelmäßige Medienwechsel und mechanische oder physikalische Unterbrechung der Zellschichten oder Platten negativ beeinflussen Polarisation fürmehrere Stunden oder Tage. Polarisation wird durch Auswertung transepithelialen elektrischen Widerstandes (TEER) überwacht und durch Auswertung des passiven Äquilibrierung von Natriumfluorescein zwischen den apikalen und basolateralen Kompartimenten 17,18 verifiziert. Sobald TEER Plateaus bei oder über 1.000 Ω × cm 2, Calu-3 LCC einsatzbereit, um zelluläre Reaktionen auf Atemwegspathogene untersuchen.
Protokoll
Ein. Kultivierung Calu-3 Zellen zur Verwendung in Transwell Kulturen
Sicherheitshinweise: Führen Sie alle in einer biologischen Sicherheitswerkbank mit sterilen Kultur Technik.
- Um Zellen aus Gefrierlagerung auftauen:
- Planen Eagles Minimum Essential Medium mit 20% hitzeinaktiviertem fötalem Rinderserum (FBS), 0,1 mM nicht-essentielle Aminosäuren, 2 mM L-Glutamin, und 10 mM HEPES pH 7,4 (EMEM-20% + S). Sterile-Filter das vorbereitete Medium unter Verwendung eines 0,2 &mgr; m Porengröße Filter, und warm in einem Wasserbad auf 37 ° C. Genauer reflektierende des in situ Atemwegsepithel Umgebung wird Mediums nicht mit Antibiotika oder Antimykotika ergänzt.
- Auftauen eine gefrorene Kryoröhrchen von Calu-3-Zellen schnell (<1 min) in einem 37 ° C Wasserbad.
- Übertragen der aufgetauten Zellen auf eine 50 ml sterile konische Röhre und 30 ml erwärmten EMEM-20% + S.
- Pelletieren der Zellen durch Zentrifugation für 5 min bei 1000-1200 × g,ohne Kühlung und mit geringem Steuerdruck Geschwindigkeit.
- Den Überstand umfüllen sanft und die Zellen in 5 ml erwärmter EMEM-20% + S durch vorsichtiges Auf-und Abpipettieren. Seed 2 bis 5 × 10 6 Zellen pro Vertiefung in einer 6-Well Gewebekulturplatte und bei 37 ° C, 7% CO 2 in Luft-Atmosphäre, bis die Zellen 75% - 80% konfluent. Überprüfen Sie täglich, bis zu 7 Tage erforderlich sein. Alle 3-4 Tage saugen das Medium aus den Zellen und ersetzen Sie es mit frischen EMEM-20% + S.
- Um Subkultur Zellen:
- Warm 0,05% Trypsin - 0,02% EDTA in einem 37 ° C warmen Wasserbad. Absaugen Mediums von den Zellen und wäscht die Zellen einmal mit 0,05% Trypsin erwärmte - 0,02% EDTA, um überschüssiges Medium und Serum zu entfernen. Entfernen Sie die Wasch-und 1 ml erwärmt Trypsin pro Well zu den Zellen.
- Bei 37 ° C und 7% CO 2 und unter einem Mikroskop Monitor alle 5 min, bis mindestens 75% der Zellen aus der Wanne (n) der Gewebekulturplatte abzulösen. Dies kannnehmen zwischen 5 und 30 min.
- Waschen der Zellen in EMEM-20% + S, um überschüssiges Trypsin zu entfernen. Übertragung der Zellen auf eine trypsinisierte 50 ml sterile konische Röhre. Mehrere Vertiefungen von Zellen aus einer 6-Well-Kulturplatte können in ein steriles 50 ml konischen Röhrchen gepoolt werden. 30 ml EMEM-20% + S und Pellet der Zellen durch Zentrifugation bei 1000-1200 xg, ohne Kühlung, und mit geringem Bremsgeschwindigkeit.
- Den Überstand umfüllen sanft und die Zellen in frischem EMEM-20% + S durch vorsichtiges Auf-und Abpipettieren. Mit Schritte 1.2.1 bis 1.2.3 oben, um Zellen trypsinieren weiterhin Subkultur Zellen in Zellkulturschalen wie in den Schritten 1.2.5 bis 1.2.7 beschrieben, wenn sie zwischen 75 sind - 80% konfluent.
- Subkultivierung von einem Well einer 6-Well-Platte bis zu einem T-25-cm 2-Kolben, in einem Endvolumen von 5 ml 20%-EMEM + S, Säen zwischen 0,5 bis 1 × 10 6 Zellen / Kolben.
- Mit 5 ml erwärmt Trypsin pro T-25 cm 2-Kolben, um Zellen, Subkultur lösenaus einem T-25-cm 2-Kolben bis zu einem T-75-cm 2-Kolben, in einem Endvolumen von 10 ml-20% EMEM + S, Säen von 1 bis 5 × 10 6 Zellen / Kolben.
- Mit 8 ml erwärmt Trypsin pro T-75 cm 2-Kolben, um Zellen, Subkultur von einem T-75 cm 2-Kolben lösen in 2 T-75 cm 2-Kolben. Für ein optimales Zellwachstum, nicht Subkultur Zellen in Kolben größer als T-75 cm 2 oder Subkultur in einem Verhältnis größer als 1 übergeordneten Kolben: 3 neue Flaschen.
- Sobald Zellen wurden subkultiviert, vollständig zu entfernen und zu ersetzen Medium alle 2 bis 3 Tage, bis sie 75-90% Konfluenz erreichen. Zellen können bis zu 3 Wochen zu 75-90% Konfluenz erreichen. Für eine optimale Erzeugung polarisierten Kulturen, Subkulturen Zellen, bevor sie wachsen über 90% Konfluenz als Monolayer.
- Weiterhin Subkultur Zellen, bis genügend Zellen auf Saatgut der gewünschten Anzahl von Einsätzen Transwell gewachsen sein. Jeder Transwell-Einsatz benötigt 2 × 10 5 Zellen. Für eine optimale Leistung Erzeugen polarisierten Kulturen, Zellen verwenden, die nicht mehr als 10 Subkulturen unterzogen wurden.
2. Wachsende Polarized Calu-3 Liquid-bedeckten Kulturen (LCC)
Sicherheitshinweise: Führen Sie alle in einer biologischen Sicherheitswerkbank mit sterilen Kultur Technik.
- Planen EMEM mit 10% FBS (EMEM-10%) und warm in einem Wasserbad auf 37 ° C.
- Bereiten Sie eine 24-Well-Transwell Platte für die Aussaat. Mit einer sterilen Pinzette bewegen Transwell Einsätze aus dem Inneren zum Äußeren Reihen der Platte ohne den Einsatz Membran. Zellen sollten nur in die Vertiefungen auf den äußeren Reihen der Platte subkultiviert werden. Um die Einführung der Luftblasen in die basolateralen Kompartimenten verhindern, fügen 600 ul EMEM-10% zu jedem durch Abwinkeln der Pipette gegen die Wand jedes Abteil und langsam freisetzenden das Medium in das Bohrloch.
- Nehmen Zellen aus T-75 cm 2 Gewebe. Subculture Flaschen mit warmen Trypsin, waschen und in 30 ml EMEM-20% + S pro alle 2 Flaschen des trypsinierten Zellen, wie in Schritt 1.2 beschrieben.
- Gründlich resuspendieren gewaschenen Zellen in 5 ml EMEM-10% durch vorsichtiges Auf-und Abpipettieren.
- Nachweis lebensfähiger und insgesamt Zellzahlen von der Trypanblau-Methode. Fahren Sie nur fort, wenn 80% - 90% lebensfähig sind.
- In einem 50 ml konischen Röhrchen sterile, verdünnte Zellen auf eine Konzentration von 2 × 10 6 lebensfähigen Zellen / ml mit 10% EMEM-.
- Hinzufügen von Zellen auf der apikalen Kammer jeder Transwell. Um Vertiefungen A1 und D1, die zellfreie Kontrollvertiefungen, dass Rohlinge ist, fügen Sie 100 ul EMEM-10% ohne Zellen sein wird. Zu jedem der verbleibenden Vertiefungen werden 100 ul resuspendierten Calu-3-Zellen, die Pipette vorsichtig Angelgewässer gegen die innere Führungskanal der Einsatzwand und langsam freisetzende die Zellen. Berühren Sie nicht die Pipette mit dem Einsatz Membran. Um eine homogene Suspension von Calu-3-Zellen erhalten, die leicht bewegen Zellsuspensionwährend dieser Seeder Schritt.
- Inkubieren Transwell Platte bei 37 ° C und 7% CO 2 in Luft-Atmosphäre. Legen Sie die Platte in einem Brutschrank, wo physische Störungen minimal sein wird. Um die Effizienz der Polarisation zu verbessern, nicht stapeln Platten auf der jeweils anderen.
- Um Kulturen zu halten, bis polarisiert und bereit, in den Experimenten zu verwenden, vollständig ersetzen Medium in Transwells, wie in den Schritten 2,10 bis 2,13 beschrieben. Medium sollte vollständig drei Tage nach sie in Transwells subkultiviert ersetzt werden, und dann auf einem alternierenden Zyklus zwischen dem vierten und dann dritten Tag nach der letzten Fütterung, bis die Zellen vollständig polarisiert sind.
- Warm EMEM-10% in einem Wasserbad auf 37 ° C.
- Vorsichtig absaugen Medium von Transwell-Einsätze. Mit einem Kapillarpipette an einer Vakuumfalle mit einem leichten Vakuum, oder mit einem Standard 1 ml Pipette Aspirat Mediums aus zellfreien Vertiefungen A1 und D1, dann von Vertiefungen ausgesät, zunächst Entfernen apikalen Mediums von allen Vertiefungen und then Entfernen basolateralen Medium aus allen Wells. Berühren Sie nicht einfügen Membranen während Absaugen Medium.
- Hinzufügen 200 ul EMEM-10% auf die apikale Kompartiment von zellfreien Vertiefungen A1 und D1, dann in die Vertiefungen ausgesät, Leiten des Mediums in die apikale Kompartiment mit der Seite des Einsatzes, um die Pipettenspitze zu führen. Fügen Sie nicht Mediums direkt auf Zellen, und berühren Sie nicht die Einlage Membran.
- Fügen Sie 600 ul EMEM-10% auf den basolateralen Kompartimenten. Um die Einführung der Luftblasen in die basolateralen Kompartimenten verhindern, fügen Mediums zu jedem durch Abwinkeln der Pipette gegen die Wand jedes Abteil und langsam freisetzenden das Medium in das Bohrloch.
3. Auswertung Resistance Entwicklung von Calu-3 LCC
Sicherheitshinweise: Führen Sie alle in einer biologischen Sicherheitswerkbank mit sterilen Kultur Technik.
- Bewerten transepithelialen elektrischen Widerstandes (TEER) von Calu-3 LCC 30 min nachMedium ändert; die Auswertung nach jedem Mediumwechsel durchgeführt werden können, falls gewünscht. Führen Sie Messungen unter sterilen Bedingungen. Beginnen Messungen mit der zellfreie Kontrollvertiefungen A1 und D1 (die Zuschnitte) an Baseline-Messungen zu erhalten, und weiterhin mit Messungen für jede Vertiefung.
- Unter sterilen Bedingungen übertragen die STX2 Elektrode auf eine 50 ml Zentrifugenröhrchen mit 70% Ethanol in sterilem Wasser und 15 min sterilisiert.
- Kalibrieren und testen Sie die voltohmmeter für die Verwendung gemäß den Anweisungen des Herstellers.
- Nehmen Sie die Elektrode aus dem Ethanol, an der Luft trocknen 5-10 sec, und spülen Sie die Elektrode mit sterilen EMEM-10%.
- Stellen Sie den Modus-Schalter des voltohmmeter, um den Widerstand Einstellung, und schalten Sie ON.
- Sanft die Elektrode in einer der drei Anschlüsse, die Zugriff zu erlauben in die basolaterale Kompartiment einer Transwell Kultur. Die Elektrodenspitze so dass der längere Vorsprung nur leicht berührt den Boden der äußeren Wanne und bleibt vertikal,und die kürzere Blei im Gewebekulturmedium der apikalen Kammer, ohne den Einsatz Membran.
- Drücken Sie "Measure R"-Taste, und warten Sie für das Lesen zu stabilisieren. Wiederholen für die anderen zwei Ports für jede Vertiefung und Aufzeichnen der Messungen von allen drei Anschlüssen, also insgesamt aus drei Messungen pro Vertiefung. Weiter, um den Widerstand für alle Vertiefungen der Zellen zu messen.
- Die Elektrode durch Tränken 5 bis 10 min in 70% Ethanol, Spülen in sterilem dH 2 O und Trocknen gründlich. In der Originalverpackung aufbewahren.
- Berechnen des Widerstands jedes Wells, unter Verwendung von Gleichung 1.
Ω Ist = Ω Probe - Ω blank, Gleichung 1
wo Ω Probe ist die durchschnittliche Messung von einem seeded gut und Ω blank ist die durchschnittliche Messung von der 2 Brunnen, A1 und D1, die Einsätze und mittlere, aber keine Zellen. - Berechnen Sie die Flächeneinheit Widerstand, mit Equation 2.
Ω tatsächlichen × effektiven Membranfläche = Ω × cm 2, Gleichung 2
wo die effektive Membranfläche beträgt 0,33 cm 2 für 24-Well-Transwell-Einsätze.
- Überprüfen, ob Polarisation ist durch Durchführen einer sekundären Assay vollständig, Messen Natriumfluorescein passive Diffusion zwischen den apikalen und basolateralen Kompartimenten, auf ein bis drei Transwell Kulturen. Die Vertiefungen für den Assay verwendet Natriumfluorescein ist unmittelbar nach Beendigung des Tests zu verwerfen.
- Planen nicht fluoreszierenden Puffer (118 mM NaCl; 4,75 mM KCl; 2,53 mM CaCl 2 · 2H 2 O; 2,44 mM MgSO4; 1,19 mM KH 2 PO 4, 25 mM NaHCO 3 in sterilem Wasser; Sterilfilter mit 0,45 um Filtrationsvorrichtung ). Bereiten Natriumfluorescein bei 1 mg / ml in nicht-fluoreszierenden Puffer, Sterilfilter, in Alufolie wickeln und bei 4 ° C, vor Licht geschützt. Warm, um Raum-temperaturre vor der Verwendung.
- Nach Abschluss Widerstandsmessungen, vorsichtig Mediums aus beiden basolateralen und apikale Kammern von einem bis drei einzelnen Transwell Kulturen.
- Spülen Transwell Kulturen. Sanft hinzuzufügen 600 ul sterilem Raumtemperatur Dulbeccos PBS (D-PBS) in die basolateralen Kompartimenten und 100 ul sterilem Raumtemperatur D-PBS zu den apikalen Kompartimenten.
- Entfernen Sie vorsichtig D-PBS aus Brunnen. Fügen Sie 600 ul sterilem nicht-fluoreszierenden Puffer zu den basolateralen Kompartimenten. Fügen Sie 100 ul sterilem 1 mg / ml Natrium-Fluorescein an die apikalen Fächern.
- Inkubieren der Platte bei 37 ° C für 1 Stunde. CO 2 ist während dieser Inkubationszeit erforderlich.
- Während der Inkubation, bereiten Sie einen Natriumfluorescein Standardkurve zwischen 20 pg / ml und 0 pg / ml, mit nicht-fluoreszierenden Puffer Natriumfluorescein verdünnen. Planen mindestens 8 verschiedenen Konzentrationen von Natriumfluorescein, die jeweils in einem Endvolumen von mindestens 600 ul. HaltenStandardkurve Verdünnungen von leichten bis zu seiner Absorption messen geschützt.
- Übertragen der nicht-fluoreszierenden Probe aus dem Puffer basolaterale Kompartiment jedes Tests zu einem separaten Transwell sauberes Röhrchen für die Analyse. Nehmen Sie den Test Transwells verwendet, um passive Natriumfluorescein Diffusion aus der Platte zu prüfen und zu verwerfen. Bringen Sie die Platte mit den restlichen Transwells in den Inkubator.
- Zeigen 100 ul jeder Standardlösung in dreifacher Ausfertigung in eine 96-Well-Flachboden-Platte.
- Bereiten Sie drei Verdünnungen von jedem basolateralen Probe (1:2, 1:20 und 1:50) in nicht-fluoreszierenden Puffer und 100 ul jeder unverdünnten Probe und jeder Verdünnung, in zweifacher Ausfertigung, in eine 96-Well-Flachbild- Bodenplatte.
- Maßnahme Probenabsorption auf einem ELISA-Plattenlesegerät bei 486 nm oder 490 nm beträgt.
- Bestimmung der Konzentration von Natrium-Fluorescein im basolaterale Kompartiment durch Vergleich der Absorption der Proben gegen die Absorptionswerte für die Natriumfluorescein strAndard Kurve.
4. Infizieren Polarized Calu-3 LCC mit Respiratory Virus
Sicherheitshinweise: Führen Sie alle in einer biologischen Sicherheitswerkbank mit sterilen Kultur-Technik, einer Sicherheitsstufe geeignet für das Virus verwendet wird.
- Verdünnte Virus in serumfreiem EMEM so daß gewünschte Inocula in 100 ul wäre.
- Waschen der Zellen in serumfreiem EMEM. Vorsichtig absaugen Medium aus allen Vertiefungen, die Beseitigung der apikalen Medium dann den basolateralen Medium. Mit einem Kapillarpipette an einer Vakuumfalle mit einem leichten Vakuum, oder mit einem Standard 1 ml Pipette Aspirat Mediums aus zellfreien Vertiefungen A1 und D1, dann von Vertiefungen ausgesät, das Entfernen des ersten apikalen Mediums von allen Vertiefungen, und dann Entfernen der basolateralen Medium aus allen Wells. Berühren Sie nicht einfügen Membranen während Absaugen Medium.
- Je 100 ul serumfreiem EMEM zum apikalen Abteil zellfreie Vertiefungen A1 und D1 und dann zu ter Vertiefungen ausgesät, Leiten Mediums in die apikale Kompartiment mit der Seite des Einsatzes, um die Pipettenspitze zu führen. Fügen Sie nicht Medium direkt auf Zellen, und berühren Sie nicht die Einlage Membran.
- Hinzufügen 600 ul serumfreiem EMEM der basolateralen Kompartimenten. Hinzufügen zu jedem Medium Transwell durch Abwinkeln der Pipette gegen die Wand der Kammer und das langsam freisetzende Mittel in das Bohrloch.
- Vorsichtig absaugen serum-freiem Medium aus Brunnen.
- Beginnend mit infizierten oder Mock-infizierte Brunnen, fügen Sie entsprechende Virus-Verdünnungen zur apikalen Kompartiment Transwells. Für nicht infizierten Vertiefungen werden 100 ul serumfreiem EMEM zum apikalen Kammer geeigneter Transwells zum Schein infiziert Vertiefungen werden 100 ul virusfreie Präparation in serumfreiem EMEM zum apikalen Kammer geeigneter Transwells verdünnt und für Virusinfektion, verdünnter Virus in serumfreiem EMEM und 100 ul der apikale Kammern geeigneter Transwells.
- Fügen Sie 600 ul serumfreiem EMEM allen basolateralen Kompartimenten.
- Bei 37 ° C und 7% CO 2 für 2 Stunden.
- Absaugen Medium aus Brunnen, zuerst von infizierten und Mock-infizierte Brunnen, dann von infizierten Brunnen. Entfernen apikalen Überstände erstens durch basolateralen Überstände gefolgt.
- Ersetzen Medium mit 200 ul EMEM-10% in den apikalen Fächern und 600 ul EMEM-10% in den basolateralen Kompartimenten.
Ergebnisse
Wenn sie als Flüssigkeit bedeckten Kulturen (LCC) in Transwell Kultursystemen gezüchtet, wie in Abbildung 1, Calu-3-Zellen polarisieren, Entwicklung deutliche apikalen und basolateralen Flächen dargestellt. Nach dem hier beschriebenen Verfahren, erreicht der transepithelialen elektrischen Widerstandes (TEER) von Calu-3 LCC ein Plateau bei oder über 1000 Ω x cm 2 innerhalb von 3 Wochen nach der Aussaat, von denen ein Beispiel in 2 gezeigt wird. Die engen Verbindungen zwischen polarisierten Zellen gebildet zu verhindern passive Äquilibrierung von kleinen Molekülen zwischen den apikalen und basolateralen Kompartimenten. Somit wird eine modifizierte Natriumfluorescein Äquilibrierung Assay verwendet werden, um Polarisation des Calu-3 LCC 15,17,18 bestätigen. Da der TEER von Calu-3 Zellmonoschichten in LCC zunimmt, nimmt die Menge von Fluorescein, die passiv äquilibriert in das basolaterale Kompartiment. Sobald der TEER beträgt 1.000 Ω x cm 2, wobei die Menge von Fluorescein, die in äquilibriertzur basolateralen Abteil ≤ 1%, wie in Abbildung 3 gezeigt, daher sind Calu-3 LCC als vollständig polarisiert ist, wenn der TEER ≥ 1000 Ω · cm 2. Der Gipfel TEER Messung von Calu-3 LCC kann von Experiment zu Experiment variieren. Allerdings, wenn TEER-Werte Plateau für einen bestimmten Experiment, kann ein vollständig polarisiert, nicht infizierten Calu-3 LCC für fünf stabilen bis 12 Wochen nach der Aussaat. Fehlen Resistenzentwicklung in Transwell-kultivierte Calu-3 kann von verschiedenen Faktoren, wie in Tabelle 1 dargelegt verursacht werden. Sobald der TEER von Calu-3 LCC Plateaus bei oder über 1000 Ω x cm 2, ist das Modell nun verwendet, um zu untersuchen Atemwegsepithelzellen Zellantworten auf Atemwegspathogene einschließlich Respiratory Syncytial Virus (RSV). Die Exposition gegenüber RSV führt zu einem raschen Rückgang im polarisierten Kultur Integrität im Vergleich zu einem Mock-Infektion von Zellen (Abbildung 4).
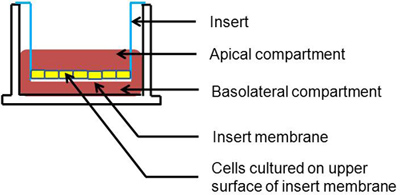
Abbildung 1. Querschnittsdarstellung der Transwell-kultivierten Zellen. Zellen werden auf der apikalen Oberfläche des Einsatzes Membran gewachsen.
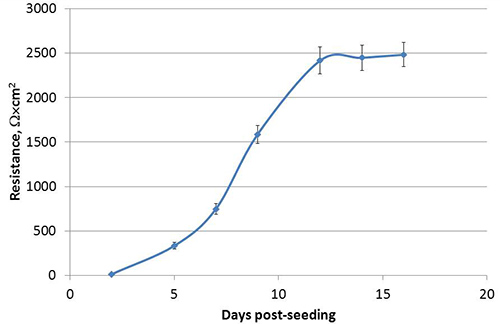
Abbildung 2. Entwicklung des transepithelialen elektrischen Widerstandes (TEER) und Polarisation Calu-3-Zellen nach dem Aussäen in Transwell-Einsätze. Zu jedem Zeitpunkt wird TEER als Median Ω x cm 2 ± SEM von 32 unabhängigen Vertiefungen aus einem repräsentativen Experiment.
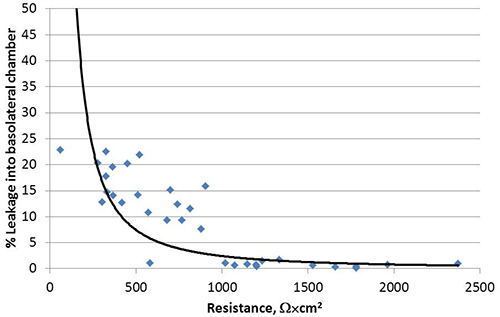
Abbildung 3. Passive Gleichge brierung von Natriumfluorescein in das basolaterale Kompartiment Calu-3 Zellmonoschichten gehemmt als Zellen polarisiert zu werden. kumulierten Daten aus vier unabhängigen Experimenten dargestellt. Jeder Datenpunkt stellt einen einzelnen Messung.
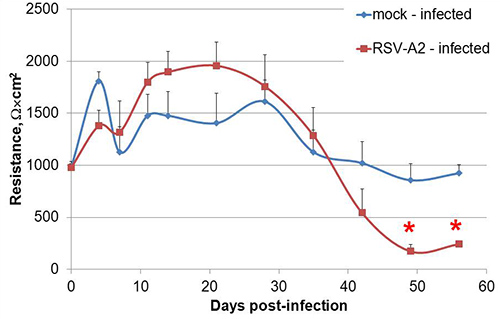
Abbildung 4. RSV-Infektion von polarisiertem Calu-3 LCC beschleunigt einen Rückgang der Monoschicht Integrität. Polarisierte Calu-3-Zellen wurden mit RSV-A2 mit einer MOI = 1 am Tag 0 infiziert und Polarität wurde für 8 Wochen nach der Infektion überwacht. Ein repräsentatives Experiment gezeigt. Die Daten sind als Median Widerstand 8 unabhängige Wells pro Infektion ± SEM pro Zeitpunkt vorgestellt. * P <0,05 zwischen Mock-und RSV-A2-infizierten Kulturen, wie durch den Student-t-Test ermittelt.
- Entfernen Sie alle Luftblasen in den Vertiefungen
- Verwenden Calu-3-Zellen, die aus gefrorenen Lager wurden weniger als 10 Mal subkultiviert
- Lassen Sie keine Calu-3-Zellen auf 100% Konfluenz in Monolayer Subkultur zu erreichen
- Überprüfen, ob die Zellen wachsen nicht auf den Kunststoff deutlich unterhalb des Einsatzes (was anzeigt, dass die Zellen durch die Poren des Einsatzes gewachsen)
- 2-3 Wochen nach der Aussaat für die vollständige Entwicklung von Resistenzen
- Überprüfen Sie die Zusammensetzung und Porengröße von Einsätzen verwendet werden, bei Bedarf ändern (empfohlen Polyester Einlage, 0,3 um Porengröße, keine Beschichtungen siehe Materialien für Details)
- Prüfen Sie die Qualität der Elektrode, Schleifen sanft angesammelt Proteine von der Spitze entfernen und ersetzen falls nötig
- Überprüfen Medium für bakterielles Wachstum
- Zusätzliche Zeit für die Polarisation zu entwickeln (manchmal dauern kann bis zu 4 Wochen)
- Verwenden Calu-3-Zellen, die aus gefrorenen Lager wurden weniger als 10 Mal subkultiviert
- Lassen Sie keine Calu-3-Zellen auf 100% Konfluenz in Monolayer Subkultur zu erreichen
- Durchweg ersetzen Medium in Transwell Kulturen, abwechselnd zwischen dem dritten und vierten Tag nach vorheriger Fütterung
- Kultur nur Zellen auf Einsätze, die in den äußeren Reihen von Platten gelegt werden
- Verwenden Sie eine andere Menge von Transwell-Einsätze
- Nicht stören oder stapeln Platten im Inkubator
- Nicht zu Vibrationen in der Biosicherheitswerkbank während Transwell plates gehandhabt werden
- Entfernen Sie alle Luftblasen in den Vertiefungen
- Bitte nicht stören die Zellschicht mit Pipettenspitzen beim Medienwechsel oder die Durchführung TEER Lesungen
- Verwenden Sie 200 ul Medium in der apikale Kompartiment, geringere Lautstärke kann zu instabilen TEER Messwerten führen
- Prüfen Sie die Qualität der Elektrode, Schleifen sanft angesammelt Proteine von der Spitze zu entfernen, und falls nötig ersetzen
Tabelle 1. Fehlersuche Probleme, die bei der Kultivierung Calu-3-Zellen in Transwells entstehen können. Mehrere Faktoren tragen zu Vollpolarisation von Calu-3-Zellen in flüssigem bedeckten Kulturen, die am ehesten von denen in dieser Tabelle markiert werden.
Diskussion
Beim Aufbau Calu-3 LCC in Transwell Einsätze können Zellen überhaupt nicht polarisieren, oder nicht vollständig polarisiert, wie durch eine definierte TEER ≥ 1000 Ω x cm 2 und ≤ 1% Natrium Fluoresceinfarbstoff Äquilibrierung zwischen den apikalen und basolateralen Kompartimenten. Zusätzlich kann Calu-3-Zellen in LCC vollständig polarisieren, aber TEER können inkonsistent zwischen Messungen. Obwohl Schwankungen TEER Messungen von Calu-3 LCC normalen von Tag zu Tag sind, werden einmal vollständig polarisiert, dramatische Schwankungen in TEER nicht zu erwarten, bis die Kultur natürlich mit dem Alter abnimmt, was kann so wenig wie 5 Wochen oder so lange wie 12 Wochen nach der Aussaat.
Die Fähigkeit von Calu-3 LCC zu polarisieren hängt teilweise wie Zellen subkultiviert werden beibehalten und vor Einsatz in der Transwell-System. Zellen, die über 90% Konfluenz als Monolayer während Subkultivierung geworden, die vor mehr als 10 mal aus gefrorenen Vorrat subkultiviert, oder die haben nichten mit frischem Medium in regelmäßigen Abständen zugeführt sind weniger wahrscheinlich, vollständig zu polarisieren, und beliebige Polarisation ist wahrscheinlich schnell sinken. Unvollständige oder völliges Fehlen der Polarisation kann auch auf eine Veränderung der Material-und Porengröße von Transwells für Calu-3 LCC verwendet zugeschrieben werden, und viel zu viel Variation in Transwells ähnlicher Zusammensetzung und die Porengröße kann auch Auswirkungen auf Polarisation. Größere Porengrößen ermöglichen Calu-3 durch die Transwell Membran in der basolateralen Kompartiment wachsen, Verhinderung der Kultur aus polarisieren. Ein Fehlen der Polarisation kann auch durch bakterielle Wachstum, angedeutet durch getrübte Kulturmedium, das anschließende Aufteilung der Tight Junctions zwischen Calu-3-Zellen führt.
Variable TEER Messungen von Calu-3 LCC kann durch mechanische Störungen der Calu-3 LCC Zellmonoschichten, die Einsätze oder die Platten selbst verursacht werden. Medium Änderungen und TEER-Messungen sollten ohne Pipettenspitzen oder elektro durchgeführt werdende führt die Berührung der Zellen. Während der Durchführung dieser Operationen ist darauf zu vermeiden Einführen von Luftblasen in den apikalen und basolateralen Kompartimenten, die die Fähigkeit des voltohmmeter um Widerstand detektieren stören wird. Die Fähigkeit des voltohmmeter Resistenz in einem Kulturmedium, das tatsächlich polarisierten detektieren kann auch durch Protein Anhaftungen an den Elektrodenleitungen begrenzt. Dieser Aufbau kann unter leichtem Schleifen entfernt werden, oder kann durch Ersetzen der Elektrode behoben werden.
Sobald Calu LCC-3 vollständig zu polarisieren und das nicht mehr TEER zunehmende sind Calu LCC-3 zur Verwendung als ein in vitro-Modell zur Charakterisierung Host Lungenepithelzellen Zellantworten auf Atemwegsinfektion bereit. Dieses System erlaubt eine bessere Charakterisierung der Erreger gerichtete Reaktion auf gegenüber Monoschicht kultivierten Zelllinien Lunge traditionell zur respiratorischen Erreger wie A549 und HEp-2-Zellen zu untersuchen, mit den zusätzlichen Vorteilen Calu-3 LCC being schneller zu entwickeln, leichter erhältlich und billiger zu erzeugen als primäre, polarisierten, differenzierten NHBE. Ähnlich NHBE, polarisiert Calu-3 zeigen, tight junction Bildung und produzieren Schleimstoffe. Doch im Gegensatz zu NHBE, nicht polarisierte Calu-3-Zellen nicht in Schichten von Basalzellen und Flimmerepithel cylindrischen Epithelzellen differenzieren, und nur wenige polarisierten Calu-3-Zellen zu entwickeln Zilien Fortsätze 19. So, obwohl nützlich für die Prüfung polarisierte Reaktionen der Atemwege Epithelzellen der Atemwege Beleidigung, sind polarisiert Calu-3 LCC nicht ein ideales Modell der Atemwege Entwicklung oder Umgestaltung in Reaktion auf Atemwege Beleidigung oder Verletzung zu untersuchen. Schleim Produktion von kultivierten Zellen in vitro kann Auswirkungen auf zellulärer Infektiosität sowie Freisetzung von infektiösen Viren und Virus-Ausbreitung in einem polarisierten Modell und einen direkten Vergleich der Schleimproduktion zwischen polarisierten Calu-3 LCC und polarisiert, differenzierte NHBE wurde nicht berichtet . A549 und HEp-2-Zellen are Kultur leichter als Calu-3-Zellen, jedoch im Gegensatz Calu-3 LCC, bilden sie keine polarisierten Kulturen, wenn auf Transwell Einsätze gewachsen, und sind somit nicht ideale Modelle zur Untersuchung in vitro die Reaktionen der polarisierte Epithelzellen der Atemwege Virusinfektion .
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken Elisabeth Blanchard für ihre technische Unterstützung danken. Die Erkenntnisse und Schlussfolgerungen in diesem Bericht sind die der Autoren und stellen nicht notwendigerweise die Ansichten der Centers for Disease Control and Prevention.
Materialien
| Name | Company | Catalog Number | Comments |
| REAGENZIEN | |||
| Calu-3 | ATCC | HTB-55 | |
| 0,05% Trypsin - 0,02% EDTA | Gibco / Invitrogen | 25300 | |
| Eagle Minimum Essential Medium (EMEM) | Gibco / Invitrogen | 07-00100DK | |
| Fötales Rinderserum (FBS) | HyClone | SH30070.03 | Hitze-Inaktivierung, 56 ° C, 30 Min. |
| Nicht-essentielle Aminosäuren 100X (10 mM) | Gibco / Invitrogen | 11140 | Lagerung bei 4 ° C im Dunkeln |
| L-Glutamin | Gibco / Invitrogen | 25030 | |
| HEPES | Gibco / Invitrogen | 15630 | |
| EMEM-10% FBS (EMEM-10%) | Supplement EMEM mit hitzeinaktiviertem FBS bis 10% Serum, steril-Filter | ||
| EMEM-20% FBS + Ergänzungen (EMEM-20% + S) | Supplement EMEM um Endkonzentrationen: hitzeinaktiviertes FBS, 20%; 1X Aminosäuren; 2 mM L-Glutamin, 10 mM HEPES; sterilen-Filter | ||
| 24-Well-Platten Transwell | Corning Costar | 3472 | 3 um Porengröße, Polyester |
| Trypanblau | Gibco / Invitrogen | 15250 | |
| Ethanol | Sigma | E7023 | Bereiten Sie sich 70% unter Verwendung von sterilen dH 2 O |
| Dulbeccos PBS (D-PBS) | Invitrogen | 14040 | |
| Nicht-fluoreszierenden Puffer | 118 mM NaCl;4,75 mM KCl; 2,53 mM CaCl 2 · H 2 O; 2,44 mM MgSO4; 1,19 mM KH 2 PO 4, 25 mM NaHCO 3 in sterilem Wasser; sterilen-Filter | ||
| Natriumfluorescein | Sigma | 6377 | 1 mg / ml in sterile nicht-fluoreszierenden Puffer; sterile-Filter, vor Licht schützen; bei 4 ° C bis zu 6 Monaten |
| EQUIPMENT | |||
| Voltohmmeter | World Precision Instruments | ||
| STX2 Elektrode | World Precision Instruments | ||
| ELISA-Reader | Für die Messung von A 486 oder A 490 |
Referenzen
- Zhu, Y., Chidekel, A., Shaffer, T. H. Cultured human airway epithelial cells (calu-3): a model of human respiratory function, structure, and inflammatory responses. Critical care research and practice. 2010, (2010).
- Mukherjee, M., Pritchard, D. I., Bosquillon, C. Evaluation of air-interfaced Calu-3 cell layers for investigation of inhaled drug interactions with organic cation transporters in vitro. International journal of pharmaceutics. 426, 7-14 (2012).
- Baginski, L., et al. Investigations into the fate of inhaled salmon calcitonin at the respiratory epithelial barrier. Pharmaceutical research. 29, 332-341 (2012).
- Vllasaliu, D., Alexander, C., Garnett, M., Eaton, M., Stolnik, S. Fc-mediated transport of nanoparticles across airway epithelial cell layers. Journal of controlled release : official journal of the Controlled Release Society. , (2011).
- Vinhas, R., et al. Pollen proteases compromise the airway epithelial barrier through degradation of transmembrane adhesion proteins and lung bioactive peptides. Allergy. 66, 1088-1098 (2011).
- Hein, S., Bur, M., Schaefer, U. F., Lehr, C. M. A new Pharmaceutical Aerosol Deposition Device on Cell Cultures (PADDOCC) to evaluate pulmonary drug absorption for metered dose dry powder formulations. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e. 77, 132-138 (2011).
- Huttunen, S., Toivanen, M., Arkko, S., Ruponen, M., Tikkanen-Kaukanen, C. Inhibition activity of wild berry juice fractions against Streptococcus pneumoniae binding to human bronchial cells. Phytotherapy research: PTR. 25, 122-127 (2011).
- Elm, C., Rohde, M., Vaerman, J. P., Chhatwal, G. S., Hammerschmidt, S. Characterization of the interaction of the pneumococcal surface protein SpsA with the human polymeric immunoglobulin receptor (hpIgR). The Indian journal of medical research. 119, 61-65 (2004).
- Sutherland, T. C., Quattroni, P., Exley, R. M., Tang, C. M. Transcellular passage of Neisseria meningitidis across a polarized respiratory epithelium. Infection and immunity. 78, 3832-3847 (2010).
- Grantham, M. L., et al. Palmitoylation of the influenza A virus M2 protein is not required for virus replication in vitro but contributes to virus virulence. Journal of. 83, 8655-8661 (2009).
- Saedisomeolia, A., Wood, L. G., Garg, M. L., Gibson, P. G., Wark, P. A. Lycopene enrichment of cultured airway epithelial cells decreases the inflammation induced by rhinovirus infection and lipopolysaccharide. The Journal of nutritional biochemistry. 20, 577-585 (2009).
- Yoshikawa, T., Hill, T., Li, K., Peters, C. J., Tseng, C. T. Severe acute respiratory syndrome (SARS) coronavirus-induced lung epithelial cytokines exacerbate SARS pathogenesis by modulating intrinsic functions of monocyte-derived macrophages and dendritic cells. Journal of virology. 83, 3039-3048 (2009).
- Yoshikawa, T., et al. Dynamic innate immune responses of human bronchial epithelial cells to severe acute respiratory syndrome-associated coronavirus infection. PloS one. 5, e8729 (2010).
- Hsu, A. C., et al. Critical role of constitutive type I interferon response in bronchial epithelial cell to influenza infection. PloS one. 7, e32947 (2012).
- Harcourt, J. L., Caidi, H., Anderson, L. J., Haynes, L. M. Evaluation of the Calu-3 cell line as a model of in vitro respiratory syncytial virus infection. Journal of virological methods. 174, 144-149 (2011).
- Zhang, L., Peeples, M. E., Boucher, R. C., Collins, P. L., Pickles, R. J. Respiratory syncytial virus infection of human airway epithelial cells is polarized, specific to ciliated cells, and without obvious cytopathology. Journal of virology. 76, 5654-5666 (2002).
- Geys, J., et al. In vitro study of the pulmonary translocation of nanoparticles: a preliminary study. Toxicology letters. 160, 218-226 (2006).
- Geys, J., Nemery, B., Hoet, P. H. Optimisation of culture conditions to develop an in vitro pulmonary permeability model. Toxicology in vitro : an international journal published in association with BIBRA. 21, 1215-1219 (2007).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical research. 23, 1482-1490 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten