Method Article
양극화 인간기도 액체 덮인 문화를 구축 호흡기 병원균에 대한 숙주 세포 응답을 공부하는 상피 Calu-3 전지
요약
이 보고서의 연구 결과와 결론은 저자의 이러한하며 반드시 질병 통제 예방 센터 (CDC)의 의견을 대표하지 않습니다.
초록
기도 상피 세포의 꼭대기과 basolateral 표면 생체 내 병원균에 노출되는 방향 응답을 보여줍니다. 따라서, 꼭대기과 basolateral 표면을 형성 극성 호흡기 병원균에 세포 반응을 검사를위한 체외 모델에 적합합니다. 하나의 모델은 일반적인 인간 기관지 상피 세포 (NHBE)를 구분하고 있습니다. 그러나,이 시스템은 분리 폐 조직 샘플, 전문성과 조직에서 배양 상피 세포, 그리고 공기 - 액체 인터페이스의 문화를 생성 할 시간이 필요합니다.
인간 기관지 암종에서 파생 Calu-3 세포는 호흡 모욕 1, 약리 화합물 2-6로 근위기도 상피 세포의 반응을 조사하고, 박테리아와 바이러스 병원균 7-9, 인플루엔자 바이러스, 리노 바이러스 등의에 대한 대안 모델 아르 그리고 중증 급성 호흡기 증후군 - 관련 coronavirus 10-14. 최근 we는 Calu-3 세포가 NHBE 15,16과 일치하는 방식으로 호흡 syncytial 바이러스 (RSV) 감염에 민감 것을 보여 주었다. 여기, 우리는 세부 사항의 성장과 배양 Calu-3 세포, LCC에 배양 된 세포를 유지의 기술적 세부 사항에 초점을 Calu-3 세포의 극성, 액체 덮인 문화 (LCC)의 설립, 우리는 제시 양극화 Calu-3 세포의 호흡 바이러스 감염을 수행하기위한 방법입니다.
지속적으로 양극화 Calu-3 LCC, Calu-3 세포를주의 깊게 Transwell 삽입의 배양하기 전에 subcultured해야합니다를 얻습니다.하려면 Calu-3 monolayer의 문화는, 90 %의 합류 아래에 남아 냉동 가공에서 이하 10 번 subcultured해야하며, 정기적으로 신선한 매체와 함께 제공해야합니다. 일단 Transwells에서 배양, Calu-3 LCC는주의해서 취급해야합니다. 불규칙한 미디어 변화와 세포 레이어 또는 플레이트의 기계적 또는 물리적 파괴에 부정적인에 대한 분극에 영향을 미칠몇 시간 또는 일. 양극화는 횡단 상피 전기 저항 (티에르)를 평가에 의해 모니터링되고 꼭대기과 basolateral 구획 17,18 사이의 나트륨 fluorescein의 수동 평균을 평가에 의해 검증된다. Ω × cm 2시 또는 1,000 이상되면 티에르 대지는 Calu-3 LCC는 호흡기 병원균에 세포 반응을 검사하는 데 사용 할 수 있습니다.
프로토콜
1. Transwell의 문화에서 사용하기 위해 배양 Calu-3 전지
안전 대책 : 무균 배양 기술을 사용하여 바이오 안전성 캐비닛의 모든 절차를 수행합니다.
- 냉동 창고에서 세포를 해동하려면 :
- 20% 열 inactivated 태아 소 혈청 (FBS), 0.1 MM 비 필수 아미노산, 2 MM L-글루타민, and10 밀리미터 HEPES의 pH를 7.4 (EMEM-20 % + S)를 포함 이글의 최소 필수 매체를 준비합니다. 37 살균 필터 준비 0.2 μm 기공 크기의 필터를 사용 매체 및 물 욕조에서 따뜻한 ° C. 현장기도 상피 환경에서 더 많은 반사로, 중간은 항생제 또는 antimycotics으로 보충되지 않습니다.
- 37 ° C의 물을 욕조에 빠르게 Calu-3 세포 (<1 분)의 냉동 cryovial을 해동.
- 50 ML 멸균 원뿔 튜브에 해동 세포를 전송하고 따뜻하게 EMEM-20 % + S.의 30 ML을 추가
- 1,000-1,200에서 5 분을위한 원심 분리하여 펠렛은 세포 × g,냉동하지 않고, 낮은 브레이크 속도.
- 부드럽게 표면에 뜨는을 가만히 따르다 부드럽게 아래로 pipetting과에 의해 데워 EMEM-20 % + S의 5 ML에있는 세포를 resuspend. 종자 2-5 × 10 37에서 6 잘 조직 배양 플레이트 및 배양에 잘 당 6 셀 ° C, 세포 75% 때까지 공기 분위기 속에서 7 % CO 2~80%의 합류. 매일 체크, 7까지 일이 필요할 수 있습니다. 모든 3~4일은 세포에서 미디어를 기음과 신선한 EMEM - 20 % + S.로 교체
- : 하위 문화의 셀에
- 따뜻한 0.05 % 트립신 - 37 ° C의 물을 욕조에 0.02 % EDTA (에틸렌 다이아 민 테트라 초산). 초과 매체와 혈청을 제거하는 0.02 % EDTA (에틸렌 다이아 민 테트라 초산) - 세포에서 미디어를 대기음, 그리고 따뜻하게 0.05 % 트립신으로 한 번 세포를 씻으십시오. 빨래를 제거하고 세포에 잘 당 따뜻하게 트립신의 1 ML를 추가합니다.
- 37 품다 ° C와 현미경으로 7 % CO 2와 모니터 세포의 75 % 이상이 조직 문화 판의 잘 (들)에서 분리 될 때까지 매 5 분.주세요 이 수도5 ~ 30 분을.
- 초과 트립신을 제거 EMEM-20 % + S에서 세포를 씻으십시오. 50 ML 멸균 원뿔 튜브에 trypsinized 세포를 전송합니다. 에서 6 - 잘 문화 판의 세포는 여러 우물은 한 50 ML 멸균 원뿔 튜브로 풀링 할 수 있습니다. 냉동하지 않고 1,000-1,200에서 원심 분리하여 EMEM-20 % + S와 펠렛 세포의 30 ML × g를 추가, 낮은 브레이크 속도로.
- 부드럽게 표면에 뜨는을 가만히 따르다 부드럽게 아래로 pipetting과에 신선한 EMEM-20 % + S에서 세포를 resuspend. 80 % 합류를 - 그들은 75 사이에있는 경우 1.2.7 단계 1.2.5에 설명 된대로 조직 문화 요리에 하위 문화 셀에 계속 세포를 trypsinize 위 1.2.3 단계 1.2.1을 사용합니다.
- 최대 6 잘 접시의 잘 하나에서 EMEM-20 % + S의 5 ML의 최종 볼륨 한 T-25cm 2 플라스크에 하위 문화는 0.5-1 × 10 6 세포 / 플라스크 사이에 퍼 뜨리고.
- 5 ML을 사용하면 셀, 하위 문화를 분리하기 위해 T-25cm 2 플라스크 당 트립신을 따뜻하게한 T-25cm 2 플라스크에서 최대 하나 EMEM-20 % + S의 10 ML의 최종 볼륨에서 T-75cm 2 플라스크, 퍼 뜨리고 5-1 사이 × 10 6 세포 / 병.
- 8 ML을 사용하면이 T-75cm 2 플라스크에 하나 T-75cm 2 플라스크에서 세포 하위 문화를 분리하기 위해 T-75cm 2 플라스크 당 트립신을 따뜻하게. 3 개의 새 플라스크 : 최적의 세포 성장, 세포 하위 문화 1 부모 병보다 더 큰 비율로 T-75cm 2 또는 하위 문화보다 큰 플라스크에하지 않습니다.
- 일단 세포가 subcultured되었으며, 완전히 제거하고 75~90%의 합류에 도달 할 때까지 모든 2-3일 매체를 교체하십시오. 셀 75~90%의 합류에 도달 할 최대 3 주까지 소요될 수 있습니다. 양극화 문화, 하위 문화 세포가 monolayer로 90 % 합류 넘어 성장하기 전에 최적의 세대를위한.
- 충분한 세포가 시드에 Transwell 삽입의 원하는 번호를 성장 할 때까지 하위 문화 세포로 진행합니다. 각 Transwell 삽입은 2 × 10 5 세포를 필요. 최적의 성능 양극화 문화를 창출를 들어, 10 개 이상 비주류를받은 세포를 사용합니다.
2. 성장 양극화 Calu-3 액체 덮인 문화 (LCC)
안전 대책 : 무균 배양 기술을 사용하여 바이오 안전성 캐비닛의 모든 절차를 수행합니다.
- 37 EMEM는 물 목욕에서 10 % FBS (EMEM-10 %)와 따뜻한을 포함하는 준비 ° C.
- 시딩을위한 24 잘 Transwell 판을 준비합니다. 멸균 포셉 사용하여 삽입 멤브레인을 손댈 필요없이 내부에서 플레이트의 외부 행에 Transwell 삽입 이동합니다. 셀은 접시의 외부 행에 우물로 subcultured해야합니다. basolateral 격실에 공기 거품의 도입을 방지하기 위해 각 구역의 벽에 피펫을 낚시 천천히 잘으로 매체를 방출하여 각 하나에 EMEM - 10 %의 600 μl를 추가합니다.
- T-75cm 두 조직의 세포를 분리합니다. Subculture의 플라스크는 따뜻하게 트립신을 사용하고 EMEM-20 % +과 같은 단계 1.2에 설명 된 trypsinized 세포의 매 2 플라스크 당 S의 30 ML에 씻는다.
- 철저하게 부드럽게 아래로 pipetting과에 의해 EMEM - 10 %의 5 ML에 세척 세포를 resuspend.
- trypan 블루 제외 방법으로 가능한 및 총 세포 수를 확인합니다. 경우에만 80 %를 진행 - 90 %가 가능한 수 있습니다.
- 50 ML 멸균 원뿔 튜브에서, 2의 농도 × EMEM-10 %를 10 6 가능한 셀 / ML로 세포를 희석.
- 각 Transwell의 꼭대기 칸에 셀을 추가합니다. , 공백은 세포없이 EMEM - 10 %의 100 μl를 추가하고 있습니다 셀 - 무료 제어 우물, 수 우물 A1과 D1에. 나머지 우물의 각으로, 부드럽게 삽입 벽의 내부 가이드 채널에 대한 피펫을 낚시하고 천천히 세포를 해제, resuspended Calu-3 세포의 100 μl를 추가합니다. 삽입 막에 피펫을 만지지 마십시오. Calu-3 세포의 균일 한 현탁액을 유지하기 위해 부드럽게 세포 현탁액을 선동이 심는 단계에서.
- 37 ° C 및 7퍼센트 공기 분위기에서 CO 2에서 길러 Transwell 판. 물리적 방해가 최소화 될 것입니다 인큐베이터에서 개최 판. 양극화의 효율성을 개선하기 위해, 서로의 위에 접시를 쌓아하지 않습니다.
- 양극화와 완전히 실험에 사용할 수는 다음과 2.13 단계 2.10에 설명 Transwells의 매체를 대체 할 때까지 문화를 유지한다. 세포가 완전히 양극화 때까지 매체는 완전히 이전 수유 후 네 번째 그리고 세 번째 날 사이에 교체주기에 그리고 삼일 Transwells에 subcultured 후에 교체, 그리고해야합니다.
- 따뜻한 EMEM-10 37 물 목욕의 %는 ° C.
- 부드럽게 Transwell 삽입에서 매체를 대기음. 부드러운 진공과 진공 트랩에 부착 된 모세관 피펫이나, 표준 1 ML 먼저 우물에서 꼭대기 매체를 제거 한 후 피펫, 세포가없는 우물 A1과 D1에서 대기음 매체 시드 우물에서, 그리고 t과암탉은 우물에서 basolateral 매체를 제거합니다. 미디어를 aspirating 동안 삽입 세포막을 만지지 마십시오.
- 피펫 팁을 안내 삽입물의 측면을 사용하여 꼭대기 칸에 매체를 지향 한 후 시드 우물에 이르기까지 셀 - 무료 우물 A1과 D1의 꼭대기 칸에 EMEM - 10 %의 200 μl를 추가합니다. 직접 세포에 미디어를 추가하지 않으며, 삽입 막에 손대지 마.
- basolateral 구획에 EMEM - 10 %의 600 μl를 추가합니다. basolateral 격실에 공기 거품의 도입을 방지하기 위해 각 구역의 벽에 피펫을 낚시 천천히 잘으로 매체를 방출하여 각 하나에 미디어를 추가 할 수 있습니다.
3. Calu-3 LCC의 저항 개발 평가
안전 대책 : 무균 배양 기술을 사용하여 바이오 안전성 캐비닛의 모든 절차를 수행합니다.
- 횡단 상피 전기 Calu-3 저항 (티에르) 후 LCC 30 분을 평가중간 변경, 원하는 경우 평가는 각 매체를 변경 한 후 수행 할 수 있습니다. 무균 조건 하에서 측정을 수행합니다. 기본 측정을 얻기 위해 셀 - 무료 제어 우물 A1과 D1 (공백)와 측정을 시작하고 각 잘에 대한 측정을 계속합니다.
- 무균 조건에서 멸균 물에 70 %의 에탄올을 포함하는 50 ML의 원심 분리기 튜브에 STX2 전극을 전송하고, 15 분 소독.
- 조정 및 제조업체의 지시에 따라 사용 voltohmmeter을 테스트합니다.
- 에탄올, 공기 건조 5-10 초에서 전극을 제거하고, 살균 EMEM-10 %를 전극을 씻어.
- 저항 설정으로 voltohmmeter의 모드 스위치를 설정하고 전원을 켜십시오.
- 부드럽게 한 Transwell 문화의 basolateral 구획에 액세스 할 수 있도록 3 포트 중 하나에 전극을 배치합니다. 장소 전극 그래서 더 이상 리드는 가볍게, 외부 우물의 바닥에 닿는 및 수직 유지그리고 짧은 리드가 삽입 막을 밟지 않고, 꼭대기 구역의 조직 문화 매체에 있습니다.
- "법안 R"버튼을 눌러, 그리고 안정화 할 수있는 읽기 기다립니다. 각도에 대한 다른 2 포트에 반복하고 세 포트에서 잘 당 3 측정 총 측정을 기록합니다. 세포의 우물에 대한 저항을 측정하고 있습니다.
- 70 %의 에탄올에 5-10 분 몸을 담글 수 살균 DH 2 O에 린스, 그리고 철저하게 건조하여 전극을 청소합니다. 원래 용기에 저장합니다.
- 수식 1을 사용, 각도의 저항을 계산합니다.
Ω 실제 = Ω 샘플 - Ω 빈, 수식 1
Ω 샘플은 시드 잘하고 Ω 빈의 평균 측정입니다 것은 삽입 및 매체를 포함하는 2 우물, A1과 D1의 평균 측정,, 그런데 세포입니다. - Equa를 사용하여 단위 면적 저항을 계산기 2.
Ω 실제 × 효과적인 막 면적은 = Ω × cm 2, 수식이
효과적인 막 면적은 24도 Transwell 삽입을위한 0.33 cm 2입니다.
- 그 양극화가에 1-3 Transwell 문화, 꼭대기과 basolateral 구획 사이에 수동 나트륨 fluorescein 확산을 측정, 보조 분석을 수행하여 완료 확인합니다. 나트륨 fluorescein 분석에 사용되는 우물은 즉시 분석 완료 후 폐기해야합니다.
- 4.75 MM KCl; 2.53 MM CaCl 2 0.2 H 2 O, 2.44 MM MgSO 4; 1.19 MM KH 2 PO 4; 25 MM 멸균 물에 NaHCO 3, 0.45 μm 여과 장치와 살균 필터 (118 MM NaCl 비 형광 버퍼를 준비 ). 네 빛으로부터 보호 ° C에서 비 형광 버퍼 살균 필터, 알루미늄 호일의 랩, 그리고 상점에서 1 MG / ML에서 나트륨 fluorescein을 준비합니다. 객실 temperatu에 따뜻한사용하기 전에 다시.
- 저항 측정을 완료 한 후, 조심스럽게 1-3 개인 Transwell 문화의 basolateral과 혀끝의 구획 모두에서 매체를 제거합니다.
- Transwell 문화를 씻어. 부드럽게 혀끝의 격실에 basolateral 격실 및 100 μl 룸 온도 살균 D-PBS로 600 μl 룸 온도가 멸균 Dulbecco의 PBS (D-PBS)을 추가합니다.
- 부드럽게 우물에서 D-PBS를 제거합니다. basolateral 구획에 600 μl 멸균 비 형광 버퍼를 추가합니다. 혀끝의 구획에 100 μl 멸균 한 MG / ML 나트륨 fluorescein을 추가합니다.
- 1 시간에 37 ° C에서 판을 품다. CO 2이 부화하는 동안 필요하지 않습니다.
- 부화하는 동안, 나트륨 fluorescein을 희석 비 형광 버퍼를 사용하여, 20 μg / ML과 0 μg / ML 사이에 이르기까지 나트륨 fluorescein 표준 곡선을 준비합니다. 최소 600 μl의 최종 볼륨에 나트륨 fluorescein의 적어도 8 개의 다른 농도, 각을 준비합니다. 유지표준 곡선 dilutions는 흡광도를 측정 할 준비가 될 때까지 빛으로부터 보호되고 있습니다.
- 각 테스트 Transwell의 basolateral 구획에서 분석을위한 별도의 깨끗한 튜브에 비 형광 버퍼 샘플을 전송합니다. 접시에서 수동 나트륨 fluorescein 보급을 검토하고 삭제하는 데 사용되는 테스트 Transwells를 제거합니다. 보육에 남아있는 Transwells으로 판을 반환합니다.
- 96 - 웰 평면 바닥 판에 세중의에서 각 표준 용액 100 μl를 추가합니다.
- 비 형광 버퍼에 각 basolateral 샘플의 세 dilutions (1시 2분, 1시 20분 및 1시 50분)를 준비하고,에 중복으로 각 undiluted 샘플의 각 희석 100 μl를 추가 96 - 웰 평면 바닥 판.
- 486 나노 미터 또는 490 nm의에서 엘리사 플레이트 리더에서 측정 샘플 흡광도.
- fluorescein 성에게 나트륨의 흡광도 값에 대한 샘플의 흡광도를 비교하여 basolateral 구획의 나트륨 fluorescein의 농도를 결정andard 곡선.
4. 호흡기 바이러스에 극성 Calu-3 LCC를 감염
안전 대책 : 바이러스가 사용되는 적합한 바이오 안전성 수준의 무균 문화 기술을 사용하여 바이오 안전성 캐비닛의 모든 절차를 수행합니다.
- 원하는 inocula 100 μl에있을 것입니다 수 있도록 혈청 무료 EMEM에서 바이러스를 희석.
- 혈청 무료 EMEM에 세포를 씻으십시오. 부드럽게 한 다음 basolateral 매체 꼭대기 매체를 제거, 모든 우물에서 매체를 대기음. 부드러운 진공과 진공 트랩에 부착 된 모세관 피펫이나, 표준 1 ML 피펫, 세포가없는 우물 A1과 D1에서 대기음 매체와 후 시드 우물에서 먼저 우물에서 꼭대기 매체를 제거하고 제거 모든 우물에서 basolateral 매체입니다. 미디어를 aspirating 동안 삽입 세포막을 만지지 마십시오.
- t 그 다음에 셀 - 무료 우물 A1과 D1의 꼭대기 칸에 혈청이없는 EMEM 100 μl를 추가하고그는 시드 우물은 피펫 팁을 안내하는 삽입물의 측면을 사용하여 꼭대기 칸에 매체를 지향. 직접 세포에 미디어를 추가하지 않으며, 삽입 막에 손대지 마.
- basolateral 구획에 혈청이없는 EMEM 600 μl를 추가합니다. 구획의 벽 피펫을 낚시 천천히 잘으로 매체를 방출하여 각 Transwell에 미디어를 추가 할 수 있습니다.
- 부드럽게 우물에서 혈청 무료 매체를 대기음.
- 감염되지 않은 또는 모의에 감염된 우물부터, Transwells의 꼭대기 칸에 적절한 바이러스 dilutions을 추가합니다. 감염되지 않은 우물를 들어, 모의에 감염된 우물에 대한 적절한 Transwells의 꼭대기 칸에 혈청이없는 EMEM 100 μl를 추가 할 적절한 Transwells의 꼭대기 칸에 혈청이없는 EMEM에 희석 바이러스 무료 준비의 100 μl를 추가하고,에 바이러스 감염은 혈청 무료 EMEM에서 바이러스를 희석하고 적절한 Transwells의 꼭대기 격실에 100 μl를 추가합니다.
- 모든 basolateral 구획에 혈청이없는 EMEM 600 μl를 추가합니다.
- 37 품다 ° C, 2 시간에 7퍼센트 CO 2.
- 그리고 감염된 우물에서, 첫 감염되지 않은 및 모의에 감염된 우물에서 우물에서 매체를 대기음. basolateral supernatants 다음 첫번째 꼭대기 supernatants를 제거합니다.
- 꼭대기 격실과 basolateral 구획에 EMEM - 10 %의 600 μl에 EMEM - 10 %의 200 μl와 매체를 교체하십시오.
결과
그림 1, 독특한 꼭대기과 basolateral 표면을 개발 극성 Calu-3 세포에 도시 된 바와 같이, Transwell 문화 시스템에서 액체 덮인 문화 (LCC)로 성장합니다. 방법을 따라하면 여기에 설명 Calu-3 LCC의 횡단 상피 전기 저항 (티에르)는 시딩 후 3 주 이내에 Ω × cm 2시 또는 1,000 위 고원, 그림 2에 표시되어있는 예를 전달할 수 있습니다. 양극화 세포 사이에 형성 꼭 접속점은 꼭대기과 basolateral 구획 사이의 작은 분자의 수동적 인 평균을 방지. 따라서, 수정 나트륨 fluorescein의 평균 분석은 Calu-3 LCC 15,17,18의 편광을 확인하는 데 사용됩니다. LCC 증가에 Calu-3 세포 monolayers의 티에르으로 수동적으로 basolateral 구획에 equilibrates fluorescein의 양이 줄어 듭니다. 티에르 1,000 Ω × cm 2에 equilibrates fluorescein의 양되면basolateral 구획으로 그림 3에 표시된 ≤ 1%가되며 따라서 Calu-3 LCC는 티에르가 ≥ 1,000 Ω × cm 2 때 완전히 양극화로 간주됩니다. Calu-3 LCC의 최대 티에르 측정 실험에서 실험 다를 수 있습니다. 그러나, 주어진 실험 한 번 티에르 값 고원, 완비 된 양극화, 감염되지 않은 Calu-3 LCC는 12주 후 시딩을 통해 5 안정적으로 할 수 있습니다. Transwell - 교양 Calu-3에 저항 개발 부재는 표 1에서 설명한대로 여러 가지 요인에 의해 발생 될 수 있습니다. Ω × cm 2시 또는 1,000 위 Calu-3 LCC의 대지 티에르이 모델이 검사하는 데 사용 할 준비가되면 호흡 syncytial 바이러스 (RSV) 등의 호흡기 병원균에기도 상피 세포 응답. 셀의 모의 감염 (그림 4)에 비해 양극화 문화 무결성에서 더 급격하게 나 빠지고 RSV 결과 노출.
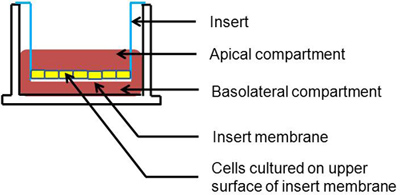
1 그림. Transwell - 배양 세포의 단면 표현입니다. 셀 삽입 막의 꼭대기 표면에 성장하고 있습니다.
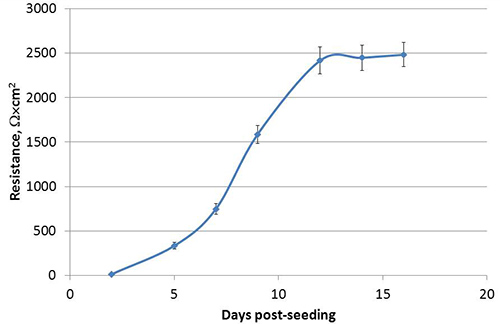
그림 2. 횡단 상피 전기 저항 (티에르)와 Transwell 삽입에 심는 후 Calu-3 세포의 분극의 개발. 각 시점에서이 티에르는 중간 Ω X cm 2로 표시되는 하나 대표 실험에서 32km 독립적 인 우물의 ± SEM.
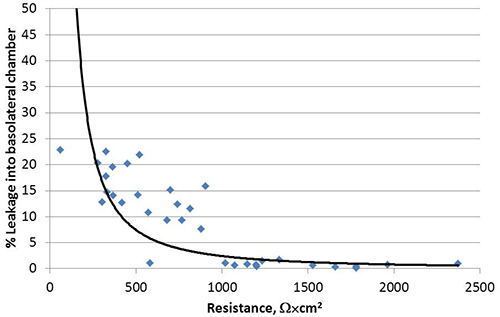
그림 3. 수동 equili 세포가 양극화 될 때 Calu-3 세포 monolayers의 basolateral 구획에 나트륨 fluorescein의 bration이 저해되어 있습니다. 네 독립적 인 실험의 누적 데이터가 제공됩니다. 각 데이터 포인트에는 개별 측정을 나타냅니다.
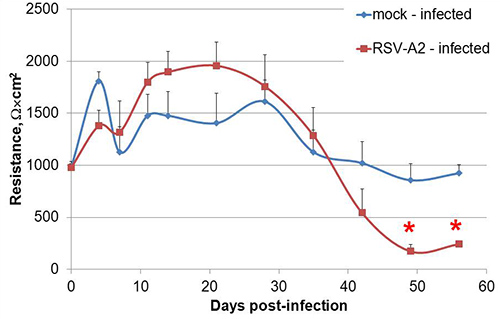
4 그림. 양극화 Calu-3 LCC의 RSV 감염은 monolayer 무결성의 감소를 가속화. 양극화 Calu-3 세포는 하루에 0에 나 역시 = 1에서 RSV-A2에 감염되었고, 극성이 팔주 후 감염 감시했다. 한 대표 실험 표시됩니다. 데이터는 감염 당 8 독립적 인 우물 ± SEM 시점마다의 평균 저항으로 표시됩니다. * P와 같은 학생의 t-테스트에 의해 결정 모형과 RSV-A2-감염된 문화, 사이 <0.05.
- 우물에서 기포를 제거
- 냉동 가공에서보다 10 배 subcultured 된 Calu-3 세포를 사용하여
- Calu-3 세포 monolayer의 하위 문화에 100 % 합류에 도달하는 것을 허용하지 않습니다
- 세포 (세포 삽입물의 구멍을 통해 성장하고 있다는 것을 의미)도 삽입 아래의 플라스틱 성장되지 않은 확인
- 전체 저항 개발까지 2-3 주가 포스트 심는 허용
- 변경, 사용 삽입의 조성과 기공 크기를 확인 필요한 경우 (권장 폴리 에스터 삽입, 0.3 μm 기공 크기, 아니 코팅, 자세한 내용은 자료를 참조)
- 끝에서 축적 된 단백질을 제거 부드럽게 샌딩하고 필요한 경우 교체, 전극의 품질을 확인
- 박테리아 성장을위한 매체를 확인
- 개발 편광은 (가끔 최대 4 주가 소요될 수 있습니다)에 대한 추가 시간을 허용
- 냉동 가공에서보다 10 배 subcultured 된 Calu-3 세포를 사용하여
- Calu-3 세포 monolayer의 하위 문화에 100 % 합류에 도달하는 것을 허용하지 않습니다
- 지속적으로 이전 수유 후 다음 세 번째와 네 번째 일 사이에 교체 Transwell 문화에 매체를 대체
- 플레이트의 외부 행에 배치되어 삽입에만 문화 전지
- Transwell 삽입의 다른 많이 사용
- 중단 또는 보육에 접시를 쌓아하지 마십시오
- 바이오 캐비닛에 진동을 발생하지 않지만 Transwell 오십시오에스가 처리되고있다
- 우물에서 기포를 제거
- 미디어를 변경하거나 티에르의 판독을 수행하는 피펫 팁과 세포 레이어를 방해하지 마십시오
- 꼭대기 칸에 200 μl 매체를 사용하여, 낮은 볼륨이 불안정 티에르의 판독 될 수 있습니다
- , 전극의 품질을 확인 끝에서 축적 된 단백질을 제거 부드럽게 샌딩하고 필요한 경우 교체
Transwells의 경우 배양 Calu-3 세포를 발생할 수 있습니다 표 1. 문제 해결 문제. 여러 요인이 액체 덮인 문화,이 표에 강조 표시되어있는의 가능성이 가장 높은에 Calu-3 세포의 전체 분극에 기여합니다.
토론
Transwell 삽입에 Calu-3 LCC를 설립 할 때, 세포는 전혀 극성을하지 못하거나, 완전히 극성을하지 않을 수 있습니다, 같은 티에르에 의해 정의 ≥ 1,000 Ω × cm (2) 및 꼭대기과 basolateral 구획 사이 ≤ 1 %의 나트륨 fluorescein 염료 평균. 또한, LCC의 Calu-3 세포가 완전히 극성 수도 있지만, 티에르는 측정 사이의 일관성이 될 수 있습니다. Calu-3 LCC의 티에르 측정의 변동이 날마다 정상적인 있지만 문화가 자연스럽게 최소 5와 주만큼 오래 12주 할 수있는 나이가 거부 될 때까지 티에르에 한 번 완전히 양극화, 극적인 그네가 예상되지 않습니다 시딩 후.
극성을 할 수 Calu-3 LCC의 능력 세포가 유지하고 Transwell 시스템에서 사용하기 전에 subcultured하는 방법에 부분에 따라 달라집니다. subculturing 동안 monolayer로 90 % 합류 이상 성장해 왔습니다 셀, 냉동 가공에서 이상 10 배 subcultured 된, 또는하지 않은 그정기적으로 신선한 매체와 함께 제공되는 전용 완전히 극성을 할 가능성이 줄어들 수 있으며, 모든 양극화가 급격히 감소 할 가능성이 있습니다. 양극화의 불완전하거나 총 부족은 또한 재료와 Calu-3 LCC에 사용 Transwells의 기공 크기의 변화로 표시 될 수 있습니다, 및 유사한 구성과 기공 크기의 Transwells에 많은 - 투 - 많은 변화도 양극화에 영향을 미칠 수 있습니다. 큰 기공 크기는 Calu-3 편광의 문화를 방지 basolateral 격실에 Transwell 막을 통해 성장하도록 허용 할 수 있습니다. 양극화의 부재는 세균 성장으로 인해 수 있습니다, Calu-3 세포 사이의 긴밀한 접합의 후속 분해로 연결 clouded 문화 매체에 의해 지적했다.
Calu-3 LCC의 가변 티에르 측정은 Calu-3 LCC 세포 monolayers, 삽입, 또는 플레이트 자신의 기계적 중단으로 인해 발생할 수 있습니다. 매체 변화와 티에르 측정 피펫 팁이나 전기없이 수행해야드의 셀을 터치 이끌고 있습니다. 이 작업을 수행하는 동안주의 저항을 감지 할 수있는 voltohmmeter의 능력을 방해 할 꼭대기과 basolateral 구획로 기포를 도입하지 않도록주의해야한다. 실제로 극성 인 문화에 저항을 감지 할 수있는 voltohmmeter의 능력은 또한 전극 리드에 단백질 축적에 의해 제한 될 수 있습니다. 이 빌드 - 업이 부드러운 샌딩으로 제거 할 수 있습니다, 또는 전극을 대체하여 수정 될 수 있습니다.
일단 Calu-3 LCC가 완전히 극성과 티에르가 더 이상 증가하지 않습니다, Calu-3 LCC는 호흡기 감염에 호스트 폐 상피 세포의 반응을 특성화를위한 체외 모델에서와 같은 사용하기 위해 준비가되어 있습니다. 이 시스템은 Calu-3 LCC 베이의 추가 장점과 함께 전통적으로 이러한 A549과 형 간염-2 세포와 같은 호흡기 병원균을 연구하는 데 사용 monolayer - 교양 폐 세포 라인에 비해 병원균에 방향 응답 더 나은 특성을 허용개발 NG 더 빠른, 더 쉽게 얻을 수 있으며, 기본, 양극화, 차별화 된 NHBE보다 생성 할 수 적은 비용으로. NHBE와 마찬가지로, 양극화 Calu-3 단단히 연결 형성을 설명하고, mucins을 생산합니다. 그러나, NHBE 달리 극성 Calu-3 세포는 기저 세포와 솜털이있는 주상 상피 세포의 레이어로 구분하지 않으며, 몇 극성 Calu-3 세포 섬모가 부족해 같은 예측에게 19를 개발합니다. 호흡기 모욕에기도 상피 세포의 극성 반응을 조사하는 데 유용하지만 따라서, 양극화 Calu-3 LCC는 호흡기 모욕이나 부상에 대한 응답으로기도 개발이나 리모델링을 검토 할 수있는 이상적인 모델이 아닙니다. 체외에서 배양 세포의 점액 생산은 세포 감염뿐만 아니라 편광 모델의 전염성 바이러스 및 바이러스 확산의 출시, 그리고 양극화 Calu-3 LCC와 양극화, 차별화 된 NHBE가보고되지 않은 사이의 점액 생산의 직접 비교에 영향을 미칠 수 있습니다 . A549과 간염-2 세포Calu-3 세포보다 문화에 쉽게 다시 그러나, Transwell 삽입에 커서 Calu-3 LCC는 달리, 그들은 양극화 문화를 형성하지 않습니다, 따라서 적합하지 모델은 호흡기 바이러스 감염에 체외에서 양극화 상피 세포의 반응을 조사를위한 .
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
저자는 그녀의 기술 지원 엘리자베스 알리슨에게 감사하고 싶습니다. 이 보고서의 연구 결과와 결론은 저자의 이러한하며 반드시 질병 통제 예방 센터 (CDC)의 의견을 대표하지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | |||
| Calu-3 | ATCC | HTB-55 | |
| 0.05 % 트립신 - 0.02 % EDTA (에틸렌 다이아 민 테트라 초산) | Gibco / Invitrogen | 25,300 | |
| 이글의 최소 필수 매체 (EMEM) | Gibco / Invitrogen | 07-00100DK | |
| 태아 소 혈청 (FBS) | HyClone | SH30070.03 | 열 비활성화, 56 ° C, 30 분 |
| 100X 비 필수 아미노산 (10 ㎜) | Gibco / Invitrogen | 11,140 | 어둠 속에서 4 ° C에서 저장 |
| L-글루타민 | Gibco / Invitrogen | 25,030 | |
| HEPES | Gibco / Invitrogen | 15,630 | |
| EMEM - 10% FBS (EMEM-10 %) | 무균 필터, 혈청 10 % 열 inactivated FBS와 EMEM을 보완 | ||
| EMEM - 20% FBS + 보충 (EMEM-20 % + S) | , 1X 아미노산, 2 밀리미터 L-글루타민, 10 밀리미터 HEPES, 살균 필터 열 inactivated FBS, 20 % 최종 농도에 EMEM을 보완 | ||
| 24 잘 Transwell 판 | 코닝 Costar | 3472 | 3 μm의 기공 크기, 폴리 에스테르 |
| Trypan 파랑 | Gibco / Invitrogen | 15,250 | |
| 에탄올 | 시그마 | E7023 | 멸균 DH 2 O를 사용하여 70 %를 준비 |
| Dulbecco의 PBS (D-PBS) | Invitrogen | 14,040 | |
| 비 형광 버퍼 | 118 MM NaCl,4.75 MM KCl, 2.53 MM CaCl 2 × H 2 O, 2.44 MM MgSO 4; 1.19 MM KH 2 PO 4; 멸균 물에 25 MM NaHCO 3, 무균 필터 | ||
| 나트륨 fluorescein | 시그마 | 6377 | 무균 비 형광 버퍼 1 MG / ML, 살균 필터, 빛으로부터 보호, 4에서 매장 ° C까지 6 개월 |
| 장비 | |||
| Voltohmmeter | 세계 정밀 계측기 | ||
| STX2 전극 | 세계 정밀 계측기 | ||
| 엘리사 플레이트 리더 | 486 또는 490를 측정 할 수 |
참고문헌
- Zhu, Y., Chidekel, A., Shaffer, T. H. Cultured human airway epithelial cells (calu-3): a model of human respiratory function, structure, and inflammatory responses. Critical care research and practice. 2010, (2010).
- Mukherjee, M., Pritchard, D. I., Bosquillon, C. Evaluation of air-interfaced Calu-3 cell layers for investigation of inhaled drug interactions with organic cation transporters in vitro. International journal of pharmaceutics. 426, 7-14 (2012).
- Baginski, L., et al. Investigations into the fate of inhaled salmon calcitonin at the respiratory epithelial barrier. Pharmaceutical research. 29, 332-341 (2012).
- Vllasaliu, D., Alexander, C., Garnett, M., Eaton, M., Stolnik, S. Fc-mediated transport of nanoparticles across airway epithelial cell layers. Journal of controlled release : official journal of the Controlled Release Society. , (2011).
- Vinhas, R., et al. Pollen proteases compromise the airway epithelial barrier through degradation of transmembrane adhesion proteins and lung bioactive peptides. Allergy. 66, 1088-1098 (2011).
- Hein, S., Bur, M., Schaefer, U. F., Lehr, C. M. A new Pharmaceutical Aerosol Deposition Device on Cell Cultures (PADDOCC) to evaluate pulmonary drug absorption for metered dose dry powder formulations. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e. 77, 132-138 (2011).
- Huttunen, S., Toivanen, M., Arkko, S., Ruponen, M., Tikkanen-Kaukanen, C. Inhibition activity of wild berry juice fractions against Streptococcus pneumoniae binding to human bronchial cells. Phytotherapy research: PTR. 25, 122-127 (2011).
- Elm, C., Rohde, M., Vaerman, J. P., Chhatwal, G. S., Hammerschmidt, S. Characterization of the interaction of the pneumococcal surface protein SpsA with the human polymeric immunoglobulin receptor (hpIgR). The Indian journal of medical research. 119, 61-65 (2004).
- Sutherland, T. C., Quattroni, P., Exley, R. M., Tang, C. M. Transcellular passage of Neisseria meningitidis across a polarized respiratory epithelium. Infection and immunity. 78, 3832-3847 (2010).
- Grantham, M. L., et al. Palmitoylation of the influenza A virus M2 protein is not required for virus replication in vitro but contributes to virus virulence. Journal of. 83, 8655-8661 (2009).
- Saedisomeolia, A., Wood, L. G., Garg, M. L., Gibson, P. G., Wark, P. A. Lycopene enrichment of cultured airway epithelial cells decreases the inflammation induced by rhinovirus infection and lipopolysaccharide. The Journal of nutritional biochemistry. 20, 577-585 (2009).
- Yoshikawa, T., Hill, T., Li, K., Peters, C. J., Tseng, C. T. Severe acute respiratory syndrome (SARS) coronavirus-induced lung epithelial cytokines exacerbate SARS pathogenesis by modulating intrinsic functions of monocyte-derived macrophages and dendritic cells. Journal of virology. 83, 3039-3048 (2009).
- Yoshikawa, T., et al. Dynamic innate immune responses of human bronchial epithelial cells to severe acute respiratory syndrome-associated coronavirus infection. PloS one. 5, e8729 (2010).
- Hsu, A. C., et al. Critical role of constitutive type I interferon response in bronchial epithelial cell to influenza infection. PloS one. 7, e32947 (2012).
- Harcourt, J. L., Caidi, H., Anderson, L. J., Haynes, L. M. Evaluation of the Calu-3 cell line as a model of in vitro respiratory syncytial virus infection. Journal of virological methods. 174, 144-149 (2011).
- Zhang, L., Peeples, M. E., Boucher, R. C., Collins, P. L., Pickles, R. J. Respiratory syncytial virus infection of human airway epithelial cells is polarized, specific to ciliated cells, and without obvious cytopathology. Journal of virology. 76, 5654-5666 (2002).
- Geys, J., et al. In vitro study of the pulmonary translocation of nanoparticles: a preliminary study. Toxicology letters. 160, 218-226 (2006).
- Geys, J., Nemery, B., Hoet, P. H. Optimisation of culture conditions to develop an in vitro pulmonary permeability model. Toxicology in vitro : an international journal published in association with BIBRA. 21, 1215-1219 (2007).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical research. 23, 1482-1490 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유