Method Article
L'établissement d'une culture liquide recouvert de Airway humaines épithéliales polarisées cellules Calu-3 pour étudier la réponse cellulaire aux agents pathogènes respiratoires hôte
Dans cet article
Résumé
Les constatations et conclusions présentées dans ce rapport sont celles des auteurs et ne reflètent pas nécessairement les vues des Centers for Disease Control and Prevention.
Résumé
Les surfaces apicales et basolatérale des cellules épithéliales des voies aériennes démontrer réponses directionnelles à l'exposition pathogène in vivo. Ainsi, idéal dans des modèles in vitro pour examiner les réponses cellulaires à des agents pathogènes respiratoires polarisent, formant des surfaces apical et basolatéral. Un tel modèle se différencie normales cellules épithéliales bronchiques humaines (NHBE). Cependant, ce système nécessite des échantillons de tissus pulmonaires, l'expertise isoler et cultiver des cellules épithéliales du tissu, et le temps pour générer une culture de l'interface air-liquide.
Calu-3 cellules, dérivées d'un adénocarcinome bronchique humain, sont un modèle alternatif pour l'examen de la réponse des cellules des voies respiratoires proximales épithéliales respiratoires insulte 1, composés pharmacologiques 2-6, et 7-9 bactérienne et des agents pathogènes viraux, y compris les virus de la grippe, rhinovirus et le syndrome respiratoire aigu sévère - le coronavirus associé au 10-14. Récemment, we démontré que Calu-3 cellules sont sensibles au virus respiratoire syncytial (VRS) d'une manière compatible avec NHBE 15,16. Ici, nous détaillons la mise en place d'un polarisée, liquide recouvert de culture (LCC) des cellules Calu-3, en se concentrant sur les détails techniques de culture et de la culture de cellules Calu-3, le maintien des cellules qui ont été cultivées dans LCC, et nous présentons le procédé pour effectuer infection par le virus respiratoire polarisés cellules Calu-3.
Pour obtenir systématiquement polarisée Calu-3 LCC, les cellules Calu-3 doit être soigneusement repiquées avant la culture dans les inserts Transwell. Calu-3 cultures monocouches devrait rester inférieur à 90% de confluence, doivent être repiquées moins de 10 fois en stock congelé, et doit être régulièrement alimenté par du milieu frais. Une fois cultivées dans Transwells, Calu-3 LCC doivent être manipulés avec soin. Irréguliers changements de supports et de la perturbation mécanique ou physique des couches de cellules ou de plaques de polarisation pour avoir un impact négatifplusieurs heures ou jours. Polarisation est contrôlée par l'évaluation de trans-épithéliale résistance électrique (TEER) et est contrôlée par l'évaluation de l'équilibrage passif de la fluorescéine de sodium entre les compartiments basolatéral et apical 17,18. Une fois les plateaux TEER égale ou supérieure à 1000 Ω x cm 2, Calu-3 LCC sont prêts à utiliser pour examiner les réponses cellulaires à des agents pathogènes respiratoires.
Protocole
1. La culture de cellules Calu-3 pour une utilisation dans les cultures Transwell
Mesures de sécurité: Effectuez toutes les procédures dans une enceinte de sécurité biologique en utilisant une technique de culture stérile.
- Pour décongeler des cellules de congélation:
- Préparer Eagle milieu essentiel minimum contenant 20% de sérum de sérum fœtal bovin (FBS), 0,1 mM non-acides aminés essentiels, 2 mM de L-glutamine, et 10 mM HEPES pH 7,4 (EMEM-20% + S). -Filtre stérile au milieu préparé à l'aide d'un 0,2 um de taille de pore du filtre, et au chaud dans un bain-marie à 37 ° C. Pour être plus représentatif de l'épithélium des voies aériennes dans l'environnement in situ, moyen n'est pas supplémenté avec des antibiotiques ou antifongiques.
- Décongeler un tube cryogénique congelé des cellules Calu-3 rapidement (<1 min) dans un bain d'eau à 37 ° C.
- Transférer les cellules décongelées dans un tube conique de 50 ml stérile et ajouter 30 ml d'EMEM chauffée-20% + S.
- Granules des cellules par centrifugation pendant 5 min à 1000-1200 xg,sans réfrigération, et avec une vitesse de frein est bas.
- Décanter le surnageant et remettre en suspension délicatement les cellules dans 5 ml de EMEM chauffée-20% + S en pipetant doucement de haut en bas. Graine 2 à 5 × 10 6 cellules par puits dans une plaque à 6 puits de culture de tissu et incuber à 37 ° C, CO 7% 2 dans l'atmosphère de l'air jusqu'à ce que les cellules sont 75% - 80% de confluence. Vérifiez tous les jours, jusqu'à 7 jours peut être nécessaire. Tous les 3-4 jours aspirer le fluide à partir des cellules et le remplacer avec des produits frais EMEM-20% + S.
- Pour les cellules sous-culture:
- Chaud trypsine 0,05% - 0,02% d'EDTA dans un bain à 37 ° C. Aspirer le fluide à partir des cellules, et laver les cellules une fois avec de la trypsine 0,05% chaud - 0,02% d'EDTA pour éliminer l'excès et milieu sérique. Retirez le lavage et ajouter 1 ml de trypsine réchauffé par puits pour les cellules.
- Incuber à 37 ° C et 7% de CO 2 et de contrôle au microscope toutes les 5 min jusqu'à ce qu'au moins 75% des cellules détacher du puits (s) de la plaque de culture tissulaire. Cela peutprendre entre 5 et 30 min.
- Laver les cellules dans du EMEM-20% + S pour éliminer la trypsine excès. Transférer les cellules trypsinisées à un tube conique de 50 ml stérile. Plusieurs puits de cellules d'une plaque de culture à 6 puits peuvent être regroupés en un seul tube conique de 50 ml stérile. Ajouter 30 ml de EMEM-20% + S et sédimenter les cellules par centrifugation à 1000-1200 xg, sans réfrigération, et avec une vitesse de frein est bas.
- Décanter le surnageant et remettre en suspension délicatement les cellules en eau douce EMEM-20% + S en pipetant doucement de haut en bas. En utilisant les étapes 1.2.1 1.2.3 ci-dessus par le biais de trypsiniser cellules, les cellules continuent de sous-culture dans des boîtes de culture de tissus comme décrit dans les étapes 1.2.5 1.2.7 travers quand ils sont entre 75 - 80% de confluence.
- Subculture d'un puits d'une plaque à 6 puits jusqu'à un T-flacon de 25 cm2 dans un volume final de 5 ml de EMEM-20% + S, l'ensemencement de 0,5 à 1 × 10 6 cellules / flacon.
- Avec 5 ml de trypsine réchauffé par T-flacon de 25 cm2 pour détacher les cellules, sous-cultured'un T-25 cm 2 jusqu'à une fiole T-75 cm 2 ballon dans un volume final de 10 ml de milieu EMEM-20% + S, entre l'ensemencement de 1 à 5 x 10 6 cellules / flacon.
- Utilisation 8 ml réchauffé par la trypsine T-flacon de 75 cm2 pour détacher les cellules, d'une sous-culture T-75 cm 2 en 2 flacon T-75 cm 2 flacons. Pour une croissance optimale des cellules, les cellules ne sont pas sous-culture dans des flacons de plus de T-75 cm 2 ou sous-culture à un ratio supérieur à 1 flacon parent: 3 nouveaux flacons.
- Une fois que les cellules ont été repiquées, supprimer complètement et remplacer milieu tous les 2 à 3 jours jusqu'à ce qu'ils atteignent la confluence 75-90%. Les cellules peuvent prendre jusqu'à 3 semaines pour atteindre 75-90% de confluence. Pour la génération optimale des cultures de cellules polarisées, subculture, avant qu'ils cultivent au-delà de 90% de confluence en monocouche.
- Continuer jusqu'à ce que la sous-culture de cellules suffisamment de cellules se sont développées pour ensemencer le nombre désiré d'inserts Transwell. Chaque insert Transwell exige 2 × 10 5 cellules. Pour des performances optimales générer cultures polarisés, utiliser des cellules qui ont subi pas plus de 10 sous-cultures.
2. Croissance Polarized Calu-3 Liquide couvertes de cultures (LCC)
Mesures de sécurité: Effectuez toutes les procédures dans une enceinte de sécurité biologique en utilisant une technique de culture stérile.
- Préparer EMEM contenant 10% de FBS (EMEM-10%) et au chaud dans un bain-marie à 37 ° C.
- Préparer une plaque de 24 puits Transwell pour l'ensemencement. En utilisant une pince stérile, déplacer inserts Transwell de l'intérieur aux lignes extérieures de la plaque sans toucher la membrane insert. Les cellules ne doivent être repiquées dans des puits sur les lignes extérieures de la plaque. Pour éviter l'introduction de bulles d'air dans les compartiments basolatéral, ajouter 600 ul de milieu EMEM-10% à chacun en inclinant la pipette contre la paroi de chaque compartiment et relâchant lentement le support dans le puits.
- Détacher les cellules de T-75 cm 2 de tissu. Par voie sousflacons lture l'aide de trypsine réchauffé, et laver dans 30 ml de EMEM-20% + S pour tous les 2 flacons de cellules trypsinisées, tel que décrit à l'étape 1.2.
- Bien remettre en suspension les cellules lavées dans 5 ml de EMEM-10% en pipetant doucement de haut en bas.
- Déterminez nombre de cellules viables totales par la méthode d'exclusion au bleu trypan. Effectuez cette opération uniquement si 80% - 90% sont viables.
- 50 ml dans un tube conique stérile, diluer les cellules à une concentration de 2 x 10 6 cellules viables / ml avec EMEM-10%.
- Ajouter à cellules du compartiment apical de chaque Transwell. Pour les puits A1 et D1, qui seront des puits de contrôle acellulaires, qui est, flans, ajouter 100 ul de MEM-10% sans cellules. Pour chacun des puits restants, ajouter 100 ul d'extrait cellules Calu-3, pêche à la ligne doucement la pipette contre le canal de guidage intérieur de la paroi d'insertion et libérant lentement les cellules. Ne touchez pas la pipette sur la membrane d'insertion. Afin de maintenir une suspension homogène de cellules Calu-3, agiter doucement la suspension cellulaireau cours de cette étape d'ensemencement.
- Incuber Transwell plaque à 37 ° C et 7% de CO 2 dans l'atmosphère de l'air. Placer la plaque dans un incubateur où les perturbations physiques seront minimes. Pour améliorer l'efficacité de polarisation, ne pas empiler les plaques les unes sur les autres.
- Pour maintenir les cultures jusqu'à polarisée et prête à l'emploi dans les expériences, remplacer complètement milieu dans Transwells, comme décrit dans les étapes 2,10 à 2.13 ci-dessous. Milieu doit être entièrement remplacé trois jours après avoir été repiquées dans Transwells, puis sur un cycle alterné entre le quatrième et troisième après l'alimentation précédente, jusqu'à ce que les cellules sont complètement polarisées.
- Chaud EMEM-10% dans un bain d'eau à 37 ° C.
- Aspirer moyenne des inserts Transwell. Avec une pipette capillaire relié à un piège à vide avec un léger vide, ou à une norme de pipette de 1 ml, moyenne aspiration de puits sans cellules A1 et D1, puis ensemencé à partir des puits, enlever premier milieu apical de tous les puits, et tpoule élimination du milieu basolatéral de tous les puits. Ne pas toucher les membranes d'insertion tout en aspirant à moyen terme.
- Ajouter 200 ul de milieu EMEM-10% au compartiment apical de la cellule sans puits A1 et D1, puis ensemencés dans les puits, diriger le milieu dans le compartiment apical avec le côté de l'insert pour guider la pointe de la pipette. Ne pas ajouter de support directement sur les cellules, et ne pas toucher la membrane d'insertion.
- Ajouter 600 ul de milieu EMEM-10% dans les compartiments basolatéral. Pour éviter l'introduction de bulles d'air dans les compartiments basolatéral, ajouter à chaque support d'une pêche à la ligne par la pipette contre la paroi de chaque compartiment et le moyen de libération lente dans le puits.
3. Développement de la résistance de l'évaluation Calu-3 LCC
Mesures de sécurité: Effectuez toutes les procédures dans une enceinte de sécurité biologique en utilisant une technique de culture stérile.
- Évaluer trans-épithélial résistance électrique (TEER) de Calu-3 LCC 30 minutes aprèschangements de milieu, l'évaluation peut être effectuée après chaque changement de milieu si vous le souhaitez. Effectuer des mesures dans des conditions stériles. Commencez avec des mesures de contrôle acellulaire puits A1 et D1 (les blancs) pour obtenir des mesures de référence, et continuer avec les mesures pour chaque puits.
- Dans des conditions stériles, transférer l'électrode STX2 un tube à centrifuger de 50 ml contenant 70% d'éthanol dans de l'eau stérile, et stériliser 15 minutes.
- Calibrer et tester l'voltohmmeter pour une utilisation selon les instructions du fabricant.
- Retirer l'électrode de l'éthanol, de l'air sec 5-10 sec et rincer l'électrode avec stérile EMEM-10%.
- Réglez le commutateur de mode de la voltohmmeter au réglage de la résistance, et mettez sous tension.
- Placer doucement l'électrode dans l'un des orifices 3 qui permettent d'accéder dans le compartiment basolatéral de la culture une Transwell. Placer l'électrode de telle sorte que la tête légèrement plus seulement touche le fond du puits extérieur et reste vertical,et la plus courte est de plomb dans le milieu de culture de tissu du compartiment apical, sans toucher la membrane insert.
- Appuyez sur "Mesure R", et attendre que la lecture se stabilise. Répéter pour les 2 autres ports pour chaque puits et enregistrer les mesures de tous les trois ports, pour un total de trois mesures par puits. Continuer à mesurer la résistance de tous les puits de cellules.
- Nettoyer l'électrode par trempage 5-10 min dans de l'éthanol à 70%, rinçage à l'O stérile dH 2, et sécher soigneusement. Stocker dans le récipient d'origine.
- Calculer la résistance de chacun des puits, en utilisant l'équation 1.
Ω = Ω réelle échantillon - Ω vide, l'équation 1
où l'échantillon Ω est la mesure moyenne d'un puits épépiné et Ω vierge est la mesure moyenne de la 2 puits, A1 et D1, contenant des inserts et des moyens, mais pas de cellules. - Calculer la résistance unité de surface, à l'aide Equation 2.
Ω × réelle surface de membrane efficace = Ω × cm 2, l'équation 2
où la surface de membrane efficace est de 0,33 cm 2 pour les inserts Transwell de 24 puits.
- Vérifiez que la polarisation est complète en effectuant un essai secondaire, la mesure de la diffusion passive de fluorescéine de sodium entre les compartiments apical et basolatéral, sur une à trois cultures Transwell. Les puits utilisés pour le dosage de fluorescéine de sodium doit être jetée immédiatement après la fin de l'essai.
- Préparer non fluorescent tampon (118 mM NaCl; 4,75 mM de KCl; 2,53 mM de CaCl 2 .2 H 2 O; 2,44 mM MgSO 4, 1,19 mM de KH 2 PO 4; 25 mM NaHCO 3 dans de l'eau stérile; filtre stérile de 0,45 um dispositif de filtration ). Préparer la fluorescéine de sodium à 1 mg / ml dans un tampon non fluorescent, filtre stérile, envelopper dans du papier aluminium, et conserver à 4 ° C, à l'abri de la lumière. Réchauffer à la salle de temre avant de l'utiliser.
- Après avoir terminé les mesures de résistance, retirez soigneusement moyen de deux compartiments basolatéral et apical de un à trois cultures Transwell individuels.
- Rincer cultures Transwell. Ajouter délicatement 600 ul de PBS à température ambiante stérile Dulbecco (D-PBS) pour les compartiments basolatéral et 100 pi température ambiante stériles D-PBS dans les compartiments apical.
- Retirez délicatement D-PBS dans les puits. Ajouter 600 ul stérile non fluorescent tampon dans les compartiments basolatéral. Ajouter 100 ul stérile 1 fluorescéine sodique mg / ml dans les compartiments apicales.
- Incuber la plaque à 37 ° C pendant 1 heure. CO 2 n'est pas nécessaire pendant cette incubation.
- Pendant l'incubation, préparer un sel de sodium de fluorescéine courbe standard comprise entre 20 pg / ml et 0 pg / ml, en utilisant non fluorescent tampon pour diluer la fluorescéine de sodium. Préparer au moins 8 différentes concentrations de fluorescéine de sodium, chacun dans un volume final de 600 pl au moins. Garderdilutions courbe standard abri de la lumière jusqu'au moment de mesurer l'absorbance.
- Transférer le tampon d'échantillon non fluorescent du compartiment basolatéral de chaque Transwell test pour un tube séparé propre à l'analyse. Retirer le test Transwells utilisée pour examiner la diffusion passive de fluorescéine de sodium de la plaque et le jeter. Retour à la plaque Transwells restantes à l'incubateur.
- Placer 100 pl de chaque solution étalon en triple dans un plat à 96 puits à fond plat.
- Préparer trois dilutions de chaque échantillon basolatérale (1:2, 1:20 et 1:50) dans un tampon non fluorescent, et ajouter 100 ul de chaque échantillon non dilué et de chaque dilution, en double exemplaire, dans un plat à 96 puits- plaque de fond.
- Absorbance de l'échantillon de mesure sur un lecteur de plaque ELISA à 486 nm ou 490 nm.
- Déterminer la concentration de fluorescéine de sodium dans le compartiment basolatéral en comparant l'absorbance des échantillons à l'encontre des valeurs d'absorbance pour la fluorescéine sodique ercourbe Andard.
4. Infectant Polarized Calu-3 LCC avec le virus respiratoire
Mesures de sécurité: Effectuez toutes les procédures dans une enceinte de sécurité biologique en utilisant une technique de culture stérile, à un niveau de biosécurité appropriées pour le virus utilisé.
- Diluer virus dans le sérum sans MEM afin que inoculum désiré serait dans 100 pi.
- Laver les cellules dans le sérum sans MEM. Aspirer moyenne de tous les puits, enlever le milieu apical puis le milieu basolatéral. Avec une pipette capillaire relié à un piège à vide avec un léger vide, ou à une norme de pipette de 1 ml, moyenne aspiration de puits sans cellules A1 et D1, puis ensemencé à partir de puits, d'une part l'élimination du milieu apical de tous les puits, puis l'élimination du milieu basolatéral de tous les puits. Ne pas toucher les membranes d'insertion tout en aspirant à moyen terme.
- Ajouter 100 ul de sérum EMEM au compartiment apical de la cellule sans puits A1 et D1, puis à til ensemencée puits, de la direction moyenne dans le compartiment apical avec le côté de l'insert pour guider la pointe de la pipette. Ne pas ajouter de support directement sur les cellules, et ne pas toucher la membrane d'insertion.
- Ajouter 600 ul de sérum EMEM aux compartiments basolatéral. Ajouter à chaque milieu Transwell en inclinant la pipette contre la paroi du compartiment à libération lente et le milieu dans le puits.
- Aspirer un milieu sans sérum à partir de puits.
- A partir de puits non infectées ou infectées maquette, ajouter dilutions de virus appropriées pour le compartiment apical de Transwells. Pour les puits non infectés, ajouter 100 ul de sérum sans MEM dans le compartiment apical de Transwells appropriées, par pseudo-infectées puits, ajouter 100 ul de virus sans préparation dilué dans du sérum sans MEM dans le compartiment apical de Transwells appropriées, et pour infection par le virus, diluer le virus dans le sérum sans MEM et ajouter 100 ul dans les compartiments apical de Transwells appropriées.
- Ajouter 600 ul de sérum EMEM à tous les compartiments basolatéral.
- Incuber à 37 ° C et 7% de CO 2 pendant 2 heures.
- Aspirer moyen de puits, d'abord à partir de puits non infectés et infectés par simulation, puis à partir de puits infectés. Retirer surnageants apicaux d'abord, puis les surnageants basolatéral.
- Remplacer moyenne avec 200 pl de milieu EMEM-10% dans les compartiments apical et 600 ul de milieu EMEM-10% dans les compartiments basolatéral.
Résultats
Lorsqu'il est cultivé comme liquide recouvertes de cultures (CLC) dans les systèmes de culture Transwell, comme illustré à la figure 1, les cellules Calu-3, polarisent développement distincts surfaces apical et basolatéral. Suivant la méthode décrite ici, la résistance électrique trans-épithéliale (TEER) de Calu-3 LCC atteint un plateau ou supérieure à 1000 Ω × cm 2 dans les 3 semaines après le semis, dont un exemple est illustré à la figure 2. Les jonctions serrées formées entre cellules polarisées empêcher l'équilibrage passif de petites molécules entre les compartiments apical et basolatéral. Ainsi, un test de la fluorescéine de sodium modifié l'équilibre est utilisée pour confirmer la polarisation de Calu-3 LCC 15.17.18. Que la TEER de monocouches de cellules Calu-3 augmente dans LCC, la quantité de fluorescéine qui s'équilibre passivement dans le compartiment basolatéral diminue. Une fois la TEER est 1.000 Ω x cm 2, la quantité de fluorescéine qui s'équilibre endans le compartiment basolatéral est ≤ 1%, comme le montre la figure 3, par conséquent, Calu-3 LCC sont considérés comme complètement polarisée lorsque la TEER est ≥ 1000 Ω x cm 2. La mesure de TEER pic de Calu-3 LCC peut varier d'une expérience à l'. Cependant, une fois les valeurs TEER plateau pour une expérience donnée, un complètement polarisée, non infecté Calu-3 LCC peut être stable pendant 5 à 12 semaines après l'ensemencement. Absence de développement d'une résistance dans Transwell-culture Calu-3 peut être causée par plusieurs facteurs tels que décrits dans le tableau 1. Lorsque le TEER de Calu-3 plateaux LCC ou au-dessus de 1000 × Ω cm 2, le modèle est prêt à être utilisé pour examiner réponses des voies aériennes de cellules épithéliales respiratoires à des agents pathogènes, notamment les virus respiratoire syncytial (VRS). L'exposition à des résultats RSV dans une baisse plus rapide de la culture de l'intégrité polarisée par rapport à une maquette de l'infection des cellules (figure 4).
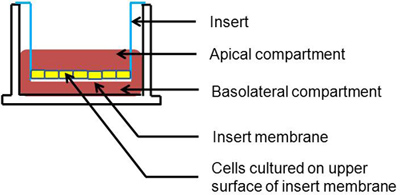
Figure 1. Les cellules section représentation des Transwell-cultures de cellules. Sont cultivées sur la surface apicale de la membrane d'insertion.
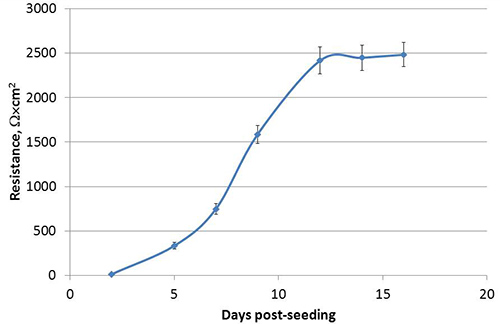
Figure 2. Développement des réseaux trans-épithélial résistance électrique (TEER) et la polarisation des cellules Calu-3 après le semis dans des inserts Transwell. A chaque point dans le temps, TEER est présentée comme médiane cm x 2 Ω ± SEM de 32 puits indépendants issus d'une expérience représentative.
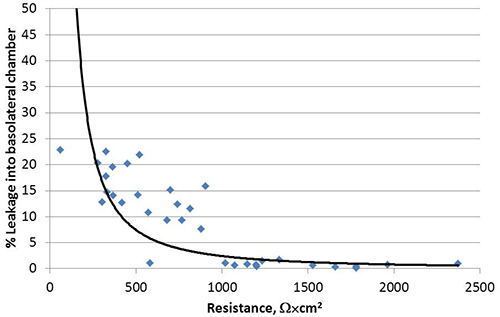
Figure 3. Passif equilibre bration de la fluorescéine de sodium dans le compartiment basolatéral des monocouches de cellules Calu-3 est inhibée que les cellules se polariser. données cumulées de quatre expériences indépendantes sont présentés. Chaque point représente une mesure individuelle.
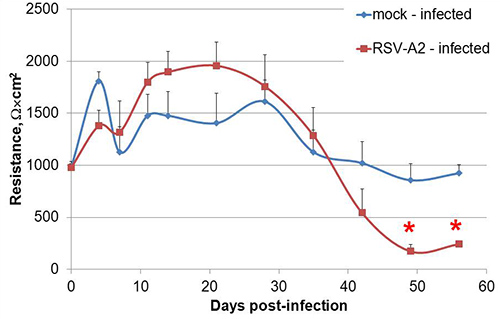
Figure 4. Infection par le VRS de polarisation Calu-3 LCC accélère une baisse intégrité de la monocouche. Polarized Calu-3 cellules ont été infectées avec RSV-A2 à une MOI = 1 au jour 0 et la polarité a été suivie pendant 8 semaines après l'infection. Une expérience représentative est présentée. Les données sont présentées comme la résistance médiane de 8 puits indépendants par l'infection ± SEM par point de temps. * P <0,05 entre les cultures maquette et RSV-A2-infectés, tels que déterminés par t de Student-test.
- Retirer les bulles d'air dans les puits
- Utilisez Calu-3 cellules qui ont été repiquées en stock congelé moins de 10 fois
- Ne laissez pas les cellules Calu-3 pour atteindre 100% de confluence dans la sous-culture monocouche
- Vérifier que les cellules ne poussent pas sur le plastique bien en dessous de la garniture (ce qui indique que les cellules peuvent avoir poussé à travers les pores de l'insert)
- Permettez 2-3 semaines après l'ensemencement pour le développement résistance complète
- Vérifiez la composition et la taille des pores d'inserts utilisés, changer si nécessaire (insert polyester recommandé, 0,3 um taille des pores, pas de revêtements, matériaux pour voir les détails)
- Vérifier la qualité de l'électrode, le ponçage doucement pour éliminer les protéines accumulées à partir de la pointe, et le remplacement, si nécessaire
- Vérifiez milieu pour la croissance bactérienne
- Prévoyez un délai supplémentaire pour la polarisation de se développer (peut parfois prendre jusqu'à 4 semaines)
- Utilisez Calu-3 cellules qui ont été repiquées en stock congelé moins de 10 fois
- Ne laissez pas les cellules Calu-3 pour atteindre 100% de confluence dans la sous-culture monocouche
- Constamment remplacer les moyennes dans les cultures Transwell, alternant entre le troisième jour, puis la quatrième place après l'alimentation précédente
- Seules des cellules en culture sur des inserts qui sont placés dans les rangées extérieures des plaques
- Utilisez un lot différent d'inserts Transwell
- Ne pas perturber ou empiler des plaques dans l'incubateur
- Ne pas provoquer des vibrations dans l'armoire de biosécurité en Transwell platees sont traitées
- Retirer les bulles d'air dans les puits
- Ne pas déranger la couche de cellules avec des pointes de pipette lors du changement de média ou d'effectuer des lectures TEER
- Utiliser 200 pl de milieu dans le compartiment apical; baisse du volume peut entraîner des lectures instables TEER
- Vérifiez la qualité de l'électrode, le ponçage en douceur pour éliminer les protéines accumulées à partir de la pointe, et remplacer si nécessaire
Tableau 1. Identifier des problèmes qui peuvent survenir lorsque la culture de cellules Calu-3 dans Transwells. De multiples facteurs contribuent à la polarisation complète de cellules Calu-3 dans le liquide recouvertes de cultures, les plus susceptibles de laquelle sont mis en évidence dans ce tableau.
Discussion
Lors de l'établissement Calu-3 dans des inserts Transwell LCC, les cellules ne peuvent pas du tout polariser, ou peuvent ne pas être totalement polariser, telle que définie par un TEER ≥ 1000 Ω x cm 2 et ≤ 1% de sodium de fluorescéine colorant équilibrage entre les compartiments basolatéral et apical. En outre, les cellules Calu-3 dans LCC peut polariser entièrement, mais TEER peuvent être incompatibles entre les mesures. Bien que les fluctuations dans les mesures de TEER de cellules Calu-3 LCC sont normales au jour le jour, une fois complètement polarisées, balançoires dramatiques dans TEER sont pas attendus avant la culture diminue naturellement avec l'âge, ce qui peut être aussi peu que 5 semaines ou aussi longtemps que 12 semaines après le semis.
La capacité des cellules Calu-3 LCC à polariser dépend en partie de la façon dont les cellules sont maintenues et repiqués avant de l'utiliser dans le système Transwell. Les cellules qui se sont développées au-delà de 90% de confluence en monocouche pendant le repiquage, qui ont été repiquées plus de 10 fois en stock congelé, ou qui n'ont pas êtrefr fourni avec un milieu frais sur une base régulière sont moins susceptibles de polariser entièrement, et toute polarisation est susceptible de diminuer rapidement. Manque incomplète ou totale de la polarisation peut également être attribuée à la variation dans le matériau et la taille des pores de Transwells utilisés pour Calu-3 LCC, et beaucoup à beaucoup de variation dans Transwells de composition similaire et la taille des pores peut également affecter la polarisation. Tailles de pores plus grands peuvent permettre Calu-3 à grandir à travers la membrane Transwell dans le compartiment basolatéral, ce qui empêche la culture de polarisation. Une absence de polarisation peut également être due à la croissance bactérienne, indiqué par un milieu de culture nébuleuse, ce qui conduit à la dégradation ultérieure des jonctions serrées entre les cellules Calu-3.
Mesures de TEER variables de Calu-3 LCC peuvent être causées par des perturbations mécaniques des monocouches de cellules Calu-3 LCC, les inserts ou les plaques elles-mêmes. Changements de milieu et des mesures de TEER devraient être exécutées sans pointes de pipettes ou électroconduit de toucher les cellules. Lors de l'exécution de ces opérations, des précautions doivent être prises pour éviter l'introduction de bulles d'air dans les compartiments apical et basolatéral, qui vont perturber la capacité du voltohmmeter pour détecter la résistance. La capacité de la voltohmmeter pour détecter la résistance dans une culture qui est en réalité polarisée peut également limitée par l'accumulation de protéines sur les fils d'électrodes. Cette accumulation peut être enlevé avec ponçage léger, ou peut être corrigé par le remplacement de l'électrode.
Une fois Calu-3 LCC complètement polariser et la TEER n'augmente plus, Calu-3 LCC sont prêts à être utilisés comme un modèle in vitro pour caractériser les réponses d'accueil de cellules épithéliales pulmonaires aux infections respiratoires. Ce système permet une meilleure caractérisation des réponses directionnelles à des agents pathogènes par rapport à une monocouche de culture des lignées de cellules pulmonaires traditionnellement utilisées pour étudier les pathogènes respiratoires, comme l'A549 et cellules HEp-2, avec les avantages supplémentaires de Calu-3 bei LCCng plus rapide à développer, plus facile à obtenir, et moins cher à produire que l'enseignement primaire, polarisé, NHBE différenciée. Semblable à NHBE, polarisée Calu-3 montrent la formation des jonctions serrées, et de produire des mucines. Cependant, contrairement à NHBE, polarisés Calu-3 cellules ne se différencient pas en couches de cellules basales et les cellules épithéliales ciliées, et quelques polarisés Calu-3 cellules se développent cils projections semblables 19. Ainsi, bien utile pour examiner les réponses des cellules polarisées épithéliales des voies aériennes respiratoires à l'insulte, polarisée Calu-3 LCC ne sont pas un modèle idéal pour étudier le développement des voies aériennes ou de rénovation en réponse à une agression respiratoires ou des blessures. La production de mucus par les cellules en culture in vitro peut avoir un impact infectivité cellulaire, ainsi que la libération de virus infectieux et la propagation du virus dans un modèle polarisé, et une comparaison directe de la production de mucus entre polarisée Calu-3 LCC et polarisée, NHBE différencié n'a pas été signalée . A549 et cellules HEp-2 d'unesont plus faciles à la culture de cellules Calu-3, mais, contrairement à Calu-3 LCC, ils ne forment pas cultures polarisées lorsqu'elles sont cultivées sur des inserts Transwell, et sont des modèles idéaux donc pas d'examiner in vitro les réponses des cellules épithéliales polarisées à l'infection par le virus respiratoire .
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier Elisabeth Blanchard pour son assistance technique. Les constatations et conclusions présentées dans ce rapport sont celles des auteurs et ne reflètent pas nécessairement les vues des Centers for Disease Control and Prevention.
matériels
| Name | Company | Catalog Number | Comments |
| REACTIFS | |||
| Calu-3 | ATCC | HTB-55 | |
| 0,05% de trypsine - EDTA à 0,02% | Gibco / Invitrogen | 25300 | |
| Eagle milieu essentiel minimum (MEM) | Gibco / Invitrogen | 07-00100DK | |
| Sérum fœtal bovin (FBS) | HyClone | SH30070.03 | Chaleur inactiver, 56 ° C, 30 min |
| Non-acides aminés essentiels 100X (10 mM) | Gibco / Invitrogen | 11140 | Conserver à 4 ° C dans l'obscurité |
| L-glutamine | Gibco / Invitrogen | 25030 | |
| HEPES | Gibco / Invitrogen | 15630 | |
| FBS EMEM-10% (EMEM-10%) | Supplément EMEM avec la chaleur de FBS inactivé à 10% de sérum stérile filtre | ||
| EMEM-20% de FBS + suppléments (EMEM-20% + S) | Supplément EMEM à des concentrations finales: inactivé par la chaleur FBS, 20%; 1X acides aminés; 2 mM de L-glutamine; HEPES 10 mM, stérile filtre | ||
| Plaques à 24 puits Transwell | Corning Costar | 3472 | 3 taille des pores um, polyester |
| Bleu trypan | Gibco / Invitrogen | 15250 | |
| L'éthanol | Sigma | E7023 | Préparez-vous à 70% en utilisant stérile dH 2 O |
| PBS de Dulbecco (D-PBS) | Invitrogen | 14040 | |
| Non fluorescent tampon | 118 mM NaCl;4,75 mM de KCl; 2,53 mM de CaCl 2 x H 2 O; 2,44 mM MgSO 4, 1,19 mM de KH 2 PO 4; 25 mM NaHCO 3 dans de l'eau stérile; stérile-filtre | ||
| Fluorescéine de sodium | Sigma | 6377 | 1 mg / ml dans des conditions stériles non fluorescent tampon; stérile filtre, protéger de la lumière, conserver à 4 ° C à 6 mois |
| ÉQUIPEMENT | |||
| Voltohmmeter | World Precision Instruments | ||
| STX2 électrode | World Precision Instruments | ||
| Lecteur de plaque ELISA | Capable de mesurer A 486 ou A 490 |
Références
- Zhu, Y., Chidekel, A., Shaffer, T. H. Cultured human airway epithelial cells (calu-3): a model of human respiratory function, structure, and inflammatory responses. Critical care research and practice. 2010, (2010).
- Mukherjee, M., Pritchard, D. I., Bosquillon, C. Evaluation of air-interfaced Calu-3 cell layers for investigation of inhaled drug interactions with organic cation transporters in vitro. International journal of pharmaceutics. 426, 7-14 (2012).
- Baginski, L., et al. Investigations into the fate of inhaled salmon calcitonin at the respiratory epithelial barrier. Pharmaceutical research. 29, 332-341 (2012).
- Vllasaliu, D., Alexander, C., Garnett, M., Eaton, M., Stolnik, S. Fc-mediated transport of nanoparticles across airway epithelial cell layers. Journal of controlled release : official journal of the Controlled Release Society. , (2011).
- Vinhas, R., et al. Pollen proteases compromise the airway epithelial barrier through degradation of transmembrane adhesion proteins and lung bioactive peptides. Allergy. 66, 1088-1098 (2011).
- Hein, S., Bur, M., Schaefer, U. F., Lehr, C. M. A new Pharmaceutical Aerosol Deposition Device on Cell Cultures (PADDOCC) to evaluate pulmonary drug absorption for metered dose dry powder formulations. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e. 77, 132-138 (2011).
- Huttunen, S., Toivanen, M., Arkko, S., Ruponen, M., Tikkanen-Kaukanen, C. Inhibition activity of wild berry juice fractions against Streptococcus pneumoniae binding to human bronchial cells. Phytotherapy research: PTR. 25, 122-127 (2011).
- Elm, C., Rohde, M., Vaerman, J. P., Chhatwal, G. S., Hammerschmidt, S. Characterization of the interaction of the pneumococcal surface protein SpsA with the human polymeric immunoglobulin receptor (hpIgR). The Indian journal of medical research. 119, 61-65 (2004).
- Sutherland, T. C., Quattroni, P., Exley, R. M., Tang, C. M. Transcellular passage of Neisseria meningitidis across a polarized respiratory epithelium. Infection and immunity. 78, 3832-3847 (2010).
- Grantham, M. L., et al. Palmitoylation of the influenza A virus M2 protein is not required for virus replication in vitro but contributes to virus virulence. Journal of. 83, 8655-8661 (2009).
- Saedisomeolia, A., Wood, L. G., Garg, M. L., Gibson, P. G., Wark, P. A. Lycopene enrichment of cultured airway epithelial cells decreases the inflammation induced by rhinovirus infection and lipopolysaccharide. The Journal of nutritional biochemistry. 20, 577-585 (2009).
- Yoshikawa, T., Hill, T., Li, K., Peters, C. J., Tseng, C. T. Severe acute respiratory syndrome (SARS) coronavirus-induced lung epithelial cytokines exacerbate SARS pathogenesis by modulating intrinsic functions of monocyte-derived macrophages and dendritic cells. Journal of virology. 83, 3039-3048 (2009).
- Yoshikawa, T., et al. Dynamic innate immune responses of human bronchial epithelial cells to severe acute respiratory syndrome-associated coronavirus infection. PloS one. 5, e8729 (2010).
- Hsu, A. C., et al. Critical role of constitutive type I interferon response in bronchial epithelial cell to influenza infection. PloS one. 7, e32947 (2012).
- Harcourt, J. L., Caidi, H., Anderson, L. J., Haynes, L. M. Evaluation of the Calu-3 cell line as a model of in vitro respiratory syncytial virus infection. Journal of virological methods. 174, 144-149 (2011).
- Zhang, L., Peeples, M. E., Boucher, R. C., Collins, P. L., Pickles, R. J. Respiratory syncytial virus infection of human airway epithelial cells is polarized, specific to ciliated cells, and without obvious cytopathology. Journal of virology. 76, 5654-5666 (2002).
- Geys, J., et al. In vitro study of the pulmonary translocation of nanoparticles: a preliminary study. Toxicology letters. 160, 218-226 (2006).
- Geys, J., Nemery, B., Hoet, P. H. Optimisation of culture conditions to develop an in vitro pulmonary permeability model. Toxicology in vitro : an international journal published in association with BIBRA. 21, 1215-1219 (2007).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical research. 23, 1482-1490 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon