このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単一細胞付着性細胞培養のタイムラプス蛍光顕微鏡による蛋白質分解率の定量化
要約
このプロトコルでは、蛋白質半減単一接着細胞、パルスのラベリングとスナップ タグ融合タンパク質の蛍光タイムラプス イメージングを使用してを決定する方法について説明します。
要約
タンパク質合成の動的な状態で、劣化と半減を様々 な状況下で調整できます。しかし、最もよく使われるアプローチ タンパク質の半減期を判断するには、いずれかにタンパク質合成阻害剤の使用を必要とするまたは分離細胞から人口平均に限定。このプロトコルでは、測定蛋白質半減単一接着細胞、内スナップ タグ融合タンパク質を蛍光タイムラプス顕微鏡と組み合わせて使用する方法について説明します。スナップ タグに融合した興味のすべての蛋白質は、benzylguanine 誘導体に蛍光、結合は細胞透過性色素による共有結合することができます、残留色素のウォッシュ アウト後の分類された蛋白質の人口の崩壊を監視できます。その後細胞を追跡および曲線当てはめによる単一細胞における蛋白質分解率の決定を可能にする履歴セルごとに指数関数的減衰曲線の時間の結果の統合の蛍光強度の定量化。このメソッドは、他の方法で評価することはできません簡単に培養細胞の人口の半分の生活の不均一性の推定値を提供します。ここで紹介した方法は、スナップ タグに融合した興味の蛋白質を表現する培養された付着性のセルの任意の型に適用されます。ここで E カドヘリン被覆細胞培養皿上に成長したマウス胚性幹 (ES) 細胞を使用してどのように単一電池の劣化によりタンパク質の半減の広い範囲で料金を定めることができるを示します。
概要
細胞蛋白質が合成と分解率の各蛋白質の生理学的規制の対象は特定されている広範な売り上げ高を受けることが知られています。従来、蛋白質分解率は測定された放射性パルス追跡分析など、一括方法またはタンパク質合成阻害剤シクロヘキシミド1などを含むされています。最近では、地球規模2タンパク質代謝回転を定量化する安定同位体標識質量分析法との組み合わせで細胞培養 (SILAC) のアミノ酸と定めております。これらのメソッドは、人口の平均によって制限され、細胞間の変動についての情報が失われるため。さらに、細胞集団間で非同期タンパク質分解の一時的な変更を識別できません。
また、タンパク質の半減は、蛍光ベースのアプローチは、多くの場合単一セルの解像度を提供することの利点があるによって決定することができます。たとえば、活性型緑色蛍光タンパク質 (paGFP) は、初期の哺乳類の胚3Oct4 半減期を決定するため使用されています。細胞内タンパク質崩壊を監視する別の方法は、蛍光タイムラプス イメージングとの組み合わせでスナップ タグの使用です。スナップ タグは変異 DNA 修復酵素 O6- alkylguanine DNA-alkyltransferase (AGT) 特に (BG) 誘導体、分子プローブ4,5,に結合することができます benzylguanine と反応して、バージョン6。 したがって、任意のスナップ タグ融合タンパク質が不可逆的蛍光、細胞透過性色素をラベルすることができます。パルスが残留色素の流失が続くスナップ タグに融合した興味の蛋白質の分類の分類された蛋白質の人口の低下を監視され、そのタンパク質の半減期を求めることができます。スナップ タグは正常にパルス追跡は蛋白質の分類に使用されている、タンパク質を決定するため半減付着細胞文化とin vivo5,7,8,9。一般的に使用されるカバー スナップ タグ基板の大規模な様々 な蛍光スペクトル、市販、特定のアプリケーションに対して最適な染料の選択を有効にします。したがって、スナップイン タグは、他の蛍光融合タンパク質や色素と組み合わせてマルチカラー イメージングを使用もできます。細胞不透過性色素は、細胞膜透過性の色素が細胞内と膜結合タンパク質のモニタリングに適用、つなが膜蛋白質の分類に適しています。さらに、これらのプローブのいくつかはほとんどない基底の蛍光を展示し、スナップ タグ10へのバインド時に強力な蛍光信号を発光のみで開始。
このプロトコルでは、スナップ タグを使用して単一セルの興味の異なった蛋白質の分解速度を測定する方法について説明します。ここでは、E-カドヘリンの培養マウス胚性幹 (ES) 細胞に本手法を適用が、付着性の培養されたセルの任意の型を使用する可能であるべきです。示すパルス標識蛍光タイムラプス イメージング続いてスナップ タグ融合タンパク質の興味の様々 な蛋白質の 1 つのセルの半減を決定することができます半減の細胞間の可変性の見積もりを提供します、培養細胞の人口。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注: この研究で E14 ES 細胞ラインが使用されました。しかし、このプロトコルは、他のスナップ タグ内因性のタンパク質のタグ付けまたは過剰発現による融合した興味の蛋白質を表現するマウス ES 細胞ラインには直接適用。結果のセクションで示した例では、ドキシサイクリン誘導スナップ タグ融合細胞は使用された (次の蛋白質に融合したスナップ タグ: Nanog、Oct4、Srsf11、または蛍光タンパク質 mOrange2 と sfGFP の制御下に置く、ドキシサイクリン誘導型プロモーター。詳細については、11の参照ドキシサイクリン誘導スナップ タグ融合細胞の生成に使用されるプラスミド)。ドキシサイクリン誘導システムは、それのタイミングおよび興味の蛋白質の表現の強さを厳しく制御することができ便利なすることができます。C 末端がスナップ タグの位置決めをお勧め、N 末端を変更するアミノ酸配列はターゲット蛋白質 (N 末端規則12) の半減期を変更する可能性が高い。
1. E-カドヘリン コーティングと細胞の播種
- スナップ タグ4に融合した興味の蛋白質を表現する ES 細胞ラインを生成します。
- コート 100 mm 細胞培養皿 4 ml の 0.1% ゼラチン (リン酸緩衝生理食塩水 (PBS) Ca2 +/Mg2 +なしで希釈) 1 h. のためのゼラチンを削除させてすぐに 1 h. の使用のための乾燥や最大 2 ヶ月間コーティング料理を保存します。
- ES 細胞培養培地 (グラスゴー最小値必要な媒体、10 %es 細胞修飾ウシ胎児血清 2 mM ピルビン酸ナトリウム、1% 非本質的なアミノ酸、1% ペニシリン/ストレプトマイシン、2 mM 100 μ M 2-L-グルタミンを添加した興味の細胞ラインを育てるメルカプトエタノール、白血病抑制因子 (LIF) 3 μ M CHIR99021 0.8 μ m PD184352) ゼラチン コーティング料理皿あたり 10-20 美緒セルの合流点に到達するまで 2 日間の CO2を 37 ° C、5% に。
注: ここでは、LIF は HEK 293 t 細胞、培養上清のコレクションが続くし、フィルタ リングのトランスフェクションによって製作されました。LIF の各バッチはその潜在的な多能性を維持するためにテストされたが、濃度が定められなかった。ただし、組換え LIF は市販されても、マウス ES 細胞培養の一般的に使用される濃度は 1000 単位/ml13。 - コートの 96 ウェル プレートに適したイメージング遺伝子組換えマウスの 30 μ L と E-カドヘリン Fc キメラ蛋白質 (E-cad-Fc)/ウェル (5 ng/μ L、Ca2 +/Mg2 +で PBS で希釈しました。ストック濃度 100 ng/μ L、-80 ° C で保存を使用)。E-cad-Fc は非常に壊れやすいので広範なピペッティングを避けてください。1.5 h の 37 ° C で孵化させなさい。
注: 顕微鏡によって他の形式を使用する場合があります。 - 電子 cad Fc を吸引、Ca2 +/Mg2 +で 100 μ L の PBS で 1 回洗浄し、予め温めておいた ES 細胞培養液 100 μ L を追加します。
- 5 ml の PBS の Ca2 +/Mg2 +なし興味のセルを洗浄します。吸引し、0.25% トリプシン-EDTA の 2 mL を追加します。37 ° C で 4 分間インキュベートします。ES 細胞培養培地 4 mL を追加、再懸濁します、1000 x g で 4 分間吸引上澄みでスピンダウンし、新鮮な ES 細胞培養培地 2 mL にペレットを再懸濁します。
注: Ca2 +/Mg2 +なし PBS は trypsinization の前に細胞を洗浄するため細胞接着に必要な Ca2 +イオンを除去するために使用ください。対照的に、E-cad-Fc 希釈とコーティング (手順 1.4)、PBS を使用して、Ca2 +/Mg2 +E-cad-Fc に ES 細胞の接着からコーティングされた料理は Ca2 +-依存14。 - 再懸濁細胞 1:10 ES 細胞培養培地とカウント、カウント商工会議所 (商工深さ 0.1 mm のロード 10 μ L) を使用しての 1 つの mL で希釈します。
- 種 30,000 セル/cm2 E cad Fc では、イメージング プレートをコーティングしました。ES 細胞培養培地で最大 200 μ L/ウェルを埋めます。ドキシサイクリン誘導性細胞の誘導ドキシサイクリンの適切な投与量と (線量と事前に誘導のタイミングを最適化します。ここで使用される細胞がドキシサイクリンで治療 500 ng/mL イメージングの前に 24 h)。37 ° C、5% CO2で孵化させなさい、パルス ラベリングと細胞播種後 24 h の画像に進みます。
2. パルス スナップ タグのラベルを付ける
メモ: タンパク質崩壊実験は適切なスナップインの色素の濃度を使用することが重要です。濃度は、コマ撮りの初めに明るい信号を生成するために十分に高くする必要があります、蛍光性は時間とともに減少します。しかし、あまりにも高い染料濃度を使用して残留色素媒体またはセルを洗濯後も残されて可能性があります。自由な染料その後減衰曲線を歪曲映画のコースを新しく作り出されたスナップ タグ分子をバインドしました。観測された蛍光シグナルは染料、セルラインを使用する、対応するタンパク質の発現レベルのプロパティによって異なります。したがって、製造元が生きているセルイメージ投射の推奨希釈から始まって、異なる希釈率をテストすることによって色素の濃度を最適化することが重要です。本研究では, 遠赤色蛍光基板使用しています。12 の最適濃度 nM ドキシサイクリン誘導発現細胞決定されました。
- 予め温めておいた ES 細胞培地の濃度を適当にスナップの色素を薄くしなさい。以前 96 ウェル プレートに播種された細胞からメディアを取り除きます、ピペットを使用し、50 μ L/ウェル スナップ色素希釈を追加します。37 ° C で 30 分間インキュベートします。
- ピペットと色素の希釈を吸引、(せずに Ca2 +/Mg2 +) に予め温めておいた PBS の 200 μ L で 3 x を洗ってください。ES 細胞培養液 200 μ L を追加し、37 ° C で 15 分間インキュベート
- さらに 2 回前の洗浄手順を繰り返します。
メモ: 広範な洗浄は、非連結の色素を除去するために重要です。PBS で繰り返し洗浄のステップは、15 分孵化イメージングの実験を開始する前にスナップ-タグ融合タンパク質の堅牢なラベリングを確保するのに対し、中で残留細胞外の染料を削除します。しかし、穏やかなピペッティングして洗浄手順を実行、E-cad-Fc に播種された細胞は簡単に切り離す傾向があるので、自動吸引器を使用しないでください。 - 画像中の 200 μ L を追加します。1% ペニシリン/ストレプトマイシン、2 mM L-グルタミン、100 μ M 2-メルカプトエタノール、LIF、3 μ M 1% 非本質的なアミノ酸、2 mM ピルビン酸ナトリウム 10 %es 細胞修飾ウシ胎児血清 (補足蛍光バック グラウンドを減らす、フェノールレッドの自由な媒体を使用するにはCHIR99021 と 0.8 μ M PD184352)。
3. 微速度顕微鏡観察
- CO2温度制御ができ、ライブ イメージングに適した顕微鏡を使用します。37 ° C、5% CO2温度設定使用し、1-2 h の平衡に許可する前に。
- 顕微鏡にプレートを置き、撮影に適した場所を見つけます。セルの均等に分散、しかし余りに密、これは解析を促進するとスポットを選択します。分析に必要なセルの数を選択したスポットの数を調整します。本研究では細胞あたり 3-5 点を記録しました。
- 目的を選択します。20 × 対物は ES 細胞のサイズに適しています。
- 記録される蛍光チャンネルのイルミネーションの設定を選択します。レーザーの出力と興味の細胞からの蛍光信号の強度に応じて露出を調整します。それは、映画のコース上の減少がレーザー光毒性と退色を最小限にするために 30% 以上を避けるために強い最初の信号を取得することを確認します。本研究では、632/22 の励起フィルターの nm (波長/帯域通過)、679/34 の排出フィルター nm (波長/帯域通過)、レーザー出力の 10% と露出時間が 100 ms に使用されました。
- イメージングの間隔とタイムラプスの実験の期間を選択します。予想される半減期 2-20 h が付いている蛋白質、15 分の時間間隔に 12-24 時間の集録時間を選択します。短い寿命の蛋白質、それに応じて時間間隔および長寿命の蛋白質の増加のための取得時間を減らします。
- イメージングを開始します。
4. 画像処理と解析
- Tiff 形式でスタックとして取得した画像を収集します。さらに処理と解析、フィジー ソフトウェア15を使用します。顕微鏡のソフトウェアでスタックとして時間経過データを収集しない場合、は、ソフトウェアでタイムラプスの実験のすべてのフレームを開きます (いずれかのファイルをクリックして |開く.またはドラッグ アンド ドロップ ツールバーに対応するファイル)画像をクリックして |スタック|画像をスタックします。
- スタック内のすべての画像から背景を削除するのに減算バック グラウンド関数を使用します。これを行うには、[プロセス] をクリックして |背景を減算します。ポップアップ ウィンドウでローリングの球の半径を選択します。イメージ セルのサイズは、少なくとも半径を使用します。背景差分をスタック内のすべてのセルに適用する選択はいプロセスのスタック?ポップアップ ウィンドウ。
- 興味のセルを選択し、ツールバーを使用してそれのまわりの利益 (率 ROI) の領域を描画します。核の信号最初ツールバーの対応するタブをクリックして、クリックして関心の核に調整それのまわりの楕円楕円形選択範囲を使用します。細胞質信号または非常に密集した地域密接にセル アウトラインに従うようにするフリーハンドの選択を使用します。背景のあまりにも大きな領域を含むを避けるため、にもかかわらず、すべてのバック グラウンド ピクセル (ステップ 4.8 4.9) その後減算により正確にセル アウトラインに従う必要はありません。
- 分析をクリックして関心領域を ROI マネージャーに追加 |ツール |ROI マネージャー |追加、またはキーボードのTを押すことによって。
- 履歴ウィンドウにタブを移動することによってまたは shift キーを押すことで次のフレームに進む + < キーボードの前のアクションを繰り返します。次の映画のコースを通して興味のセル、フレームごとの ROI を ROI マネージャーに追加します。最終的な ROI の詳細] をクリックして履歴の各セルの設定を保存 |保存. で ROI マネージャー。
注: 両方の娘細胞を個別に追跡、細胞の分裂後、バック グラウンド減算後の積分強度を合計 (4.6 4.9 の手順を参照) 細胞分裂時にタンパク質の希釈を考慮します。両方の娘細胞の ROI 設定を保存します。 - 映画を通して興味のセルを追跡、測定、平均強度と Roi の領域の値を取得するをクリックします。電子スプレッドシート プログラムに得られた値をコピーし、各時点の生セルの強度を次のように計算。

場所意味するc平均強度と領域C対応する ROI の領域。 - ローカルの背景を見積もるには、各時間フレームのための興味のセルの近くに投資収益率を追加します。任意細胞蛍光信号を含めないようにします。セルのサイズは、ほぼ円形の投資収益率を使用して、移動または場合は隣接セル干渉する場合など、必要に応じてそれを縮小します。背景の投資収益率を得るために設定 ROI 設定携帯電話前述を進み強度値をワークシートにコピーします。
- セルの統合された強度のバック グラウンド補正値を得るためには、まず各時点のバック グラウンドの強度を計算します。

バック グラウンド信号とC領域の平均強度BGを意味するが、セルを取り囲む ROI の領域です。両方の領域は、同じサイズを持っている場合を除き、投資収益率、背景色の部分を使用しないでください。 - 時期ごとのセルの最終的なバック グラウンド減算統合された強度を計算します。

- 単一のセルの減衰曲線を正規化するには、最初の時間点の輝度値によって各時点の強度の値を分割します。
注: 曲線のあてはめ (4.11 のステップを参照) 実行できます各単一セルまたは人口平均。国交正常化は、細胞間の異なる蛍光強度からバイアスを避けるために、母集団の平均を計算する場合に必要です。国交正常化では、各セルが最終的な減衰曲線を同じ重さで寄与しているように。また、国交正常化は、(図 3 a-3 Cを参照)、絶対蛍光強度とは関係なく単一細胞崩壊を視覚化するのに役立ちますすることができます。ただし、場合にのみ単一セルの半減が決定され、データは平均化されません、正規化ステップは省略できます、曲線のあてはめは raw データで直接実行できます。 - タンパク質の半減期の推定曲線のフィッティング ツールを使用します。この研究では、既定では MATLAB のユーザー インターフェイスの [アプリケーション] セクションにある MATLAB ツールボックス 3.4.1 カーブフィッティングは使用されました。蛍光強度をインポートし、MATLAB に電子スプレッドシートデータのインポートタブをクリックしてから時刻値カーブフィッティング ツールボックスを開き、 X データとY の時間ポイントと蛍光減衰データを選択データでフィット カーブ選択カスタム式] タブ] タブし、指数関数的減衰の式を入力します。
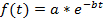
f(t)は与えられた時点での蛍光強度が、初期強度とb減衰率。フィット オプション] タブ、両方aとbの下限の 0 を選択します。Aとbの推定値は、[結果] ウィンドウに表示されます。半減期を次のように計算します。
Access restricted. Please log in or start a trial to view this content.
結果
記述のプロトコルは、スナップ タグに融合蛋白質の半減期で細胞間の可変性の見積もりを提供します。イメージング プレートのコーティング用組換え E-カドヘリン - fc 使用できますそれ以外の植民地に自生する ES 細胞の単一セルの解像度。単一のセルは、映画 (図 1 a) のコースを通して個別に追跡できます。
各単一セルの蛋白質の半減期を決定す...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
最も重要なステップ、残留非連結色素が残っていないか確認培地でも細胞としてそれ以外の場合は、洗浄後それを可能性がありますにバインド新しくスナップ タグを使用して蛋白質の腐敗を監視する、生産実験とそこの間に後でスナップ タグ分子イービ減衰曲線を危険にさらします。これは慎重に記載されている洗濯のすべての手順を実行することによって達成される 1 つの手です。その?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
微速度顕微鏡観察実験で、生体分子スクリーニング施設 (BSF)、スイス連邦工科大学に行った。ありがとう Marc Delachaux (視聴覚サービス、スイス連邦工科大学)、ビデオ撮影と映画の編集します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| ES cell line expressing a SNAP-tag fusion protein of interest | - | - | |
| Falcon 100 mm TC-Treated Cell Culture Dish | Corning | 353003 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate | Corning | 353219 | |
| Neubauer-improved counting chamber, 0.1 mm | Marienfeld-superior | 640030 | |
| CO2 Incubator | Panasonic | MCO-170AICUV-PE | |
| Centrifuge 5804 R | Eppendorf | 5804000528 | |
| InCell Analyzer 2200 Cell Imaging System | GE Healthcare Life Sciences | 29027886 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Glasgow Minimum Essential Medium | Sigma-Aldrich | G5154 | |
| Fetal Bovine Serum, embyonic stem cell-qualified | ThermoFisher | 16141-079 | |
| Sodium pyruvate solution | Sigma-Aldrich | 113-24-6 | |
| Minimum Essential Medium Non-Essential Amino Acids | ThermoFisher | 11140-035 | |
| Penicillin-Streptomycin | BioConcept | 4-01F00H | |
| L-Glutamine 200mM | ThermoFisher | 25030-024 | |
| 2-Mercaptoethanol | Sigma-Aldrich | 63689-25ML-F | |
| Leukemia Inhibitory factor | - | - | Produced in the lab by transient transfection of HEK-293T cells, followed by collection and filtering of the supernatant. |
| CHIR99021 (GSK-3 Inhibitor XVI) | Merck Millipore | 361559 | |
| PD 0325901 | Sigma-Aldrich | 391210-10-9 | |
| Gelatin from bovine skin | Sigma-Aldrich | 9000-70-8 | |
| Dulbecco's PBS 10x concentrated | BioConcept | 3-05K00-I | |
| Dulbecco's PBS Without Ca++/Mg++ | BioConcept | 3-05F29-I | |
| Trypsin-EDTA-Solution 0.25% | Sigma-Aldrich | T4049 | |
| Recombinant Mouse E-Cadherin Fc Chimera protein | R&D systems | 748-EC-050 | |
| Doxycycline hyclate | Sigma-Aldrich | D9891 | |
| SNAP-Cell 647-SiR | New England BioLabs | S9102S | |
| FluoroBrite DMEM | ThermoFisher | A18967-01 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| FIJI | - | - | Open-source image analysis software |
| MATLAB R2014a | Mathworks | - | |
| Microsoft Excel | Microsoft | - |
参考文献
- Zhou, P. Determining Protein Half-Lives. Signal Transduct Protoc. , 67-77 (2004).
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Plachta, N., Bollenbach, T., Pease, S., Fraser, S. E., Pantazis, P. Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nature Cell Biol. 13 (2), 117-123 (2011).
- Keppler, A., Gendreizig, S., Gronemeyer, T., Pick, H., Vogel, H., Johnsson, K. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nature Biotechnol. 21 (1), 86-89 (2002).
- Keppler, A., Pick, H., Arrivoli, C., Vogel, H., Johnsson, K. Labeling of fusion proteins with synthetic fluorophores in live cells. Proc Nat Acad Sci U S A. 101 (27), 9955-9959 (2004).
- Gronemeyer, T., Chidley, C., Juillerat, A., Heinis, C., Johnsson, K. Directed evolution of O6-alkylguanine-DNA alkyltransferase for applications in protein labeling. Protein Eng Design Select. 19 (7), 309-316 (2006).
- Jansen, L. E. T., Black, B. E., Foltz, D. R., Cleveland, D. W. Propagation of centromeric chromatin requires exit from mitosis. J Cell Biol. 176 (6), 795-805 (2007).
- Bojkowska, K., et al. Measuring In Vivo Protein Half-Life. Chem Biol. 18 (6), 805-815 (2011).
- Mandic, A., Strebinger, D., Regali, C., Phillips, N. E., Suter, D. M. A novel method for quantitative measurements of gene expression in single living cells. Methods. 120, 65-75 (2017).
- Komatsu, T., et al. Real-Time Measurements of Protein Dynamics Using Fluorescence Activation-Coupled Protein Labeling Method. J Am Chem Soc. 133 (17), 6745(2011).
- Deluz, C., et al. A role for mitotic bookmarking of SOX2 in pluripotency and differentiation. Genes Dev. 30 (22), 2538-2550 (2016).
- Varshavsky, A. The N-end rule pathway and regulation by proteolysis. Protein Sci. 20 (8), 1298-1345 (2011).
- Tamm, C., Pijuan Galitó, S., Annerén, C. A Comparative Study of Protocols for Mouse Embryonic Stem Cell Culturing. PLoS ONE. 8 (12), e81156(2013).
- Nagaoka, M., et al. E-Cadherin-Coated Plates Maintain Pluripotent ES Cells without Colony Formation. PLoS ONE. 1 (1), e15(2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Meth. 9 (7), 676-682 (2012).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotech. 34 (7), 703-706 (2016).
- Blanchoud, S., Nicolas, D., Zoller, B., Tidin, O., Naef, F. CAST: An automated segmentation and tracking tool for the analysis of transcriptional kinetics from single-cell time-lapse recordings. Methods. 85, 3-11 (2015).
- Peng, T., et al. A BaSiC tool for background and shading correction of optical microscopy images. Nature Comm. 8, (2017).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nature Methods. 12 (5), 404-406 (2015).
- Chae, H. D., Lee, M. R., Broxmeyer, H. E. 5-Aminoimidazole-4-carboxyamide Ribonucleoside Induces G1/S Arrest and Nanog Downregulation via p53 and Enhances Erythroid Differentiation. Stem Cells. 30 (2), 140-149 (2012).
- Lin, Y., et al. Reciprocal Regulation of Akt and Oct4 Promotes the Self-Renewal and Survival of Embryonal Carcinoma Cells. Mol Cell. 48 (4), 627-640 (2012).
- Wei, F., Scholer, H. R., Atchison, M. L. Sumoylation of Oct4 Enhances Its Stability, DNA Binding, and Transactivation. J Biol Chem. 282 (29), 21551-21560 (2007).
- Gautier, A., et al. An Engineered Protein Tag for Multiprotein Labeling in Living Cells. Chem Biol. 15 (2), 128-136 (2008).
- Los, G. V., et al. HaloTag: A Novel Protein Labeling Technology for Cell Imaging and Protein Analysis. ACS Chem Biol. 3 (6), 373-382 (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved