Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Unicellulaire Quantification du taux de dégradation des protéines par microscopie de Fluorescence Time-lapse en Culture cellulaire adhérente
Dans cet article
Résumé
Ce protocole décrit une méthode pour déterminer la protéine demi-vies dans cellules adhérentes de vie unique, en utilisant des impulsions d’étiquetage et de Time-lapse imagerie de fluorescence des protéines de fusion SNAP-tag.
Résumé
Les protéines sont dans un état dynamique de synthèse et de dégradation et leur demi-vie peuvent être ajustée dans diverses circonstances. Cependant, les plus courantes des approches pour déterminer la demi-vie de la protéine sont soit limité aux moyennes de la population de cellules lysées ou exiger l’utilisation des inhibiteurs de la synthèse protéique. Ce protocole décrit une méthode pour mesurer la protéine demi-vies dans cellules adhérentes de vie unique, en utilisant des protéines de fusion SNAP-tag en combinaison avec la microscopie en fluorescence Time-lapse. Toute protéine d’intérêt fusionné à un SNAP-tag peut être liée par covalence par un colorant fluorescent, cellule perméables qui est couplé à un dérivé de benzylguanine, et la décroissance de la population de protéines marquées peut être surveillée après le lavage du colorant résiduel. Subséquente cellule de suivi et quantification de l’intensité de fluorescence intégrée sur les résultats de temps dans une courbe de décroissance exponentielle pour chaque cellule de chenilles, permettant de déterminer le taux de dégradation des protéines dans des cellules individuelles par ajustement de courbe. Cette méthode fournit une estimation de l’hétérogénéité des demi-vies dans une population de cellules cultivées, ce qui ne peut facilement être évalué par d’autres méthodes. L’approche présentée ici s’applique à n’importe quel type de cellules adhérentes exprimant une protéine d’intérêt fusionné à un SNAP-tag. Ici nous utilisons des cellules souches embryonnaires (ES) de souris cultivées sur des plaques de culture cellulaire E-cadhérine-enduit pour illustrer comment unique cellule dégradation des taux de protéines avec un large éventail de demi-vie peuvent être déterminés.
Introduction
Il est bien connu que les protéines cellulaires subissent une vaste chiffre d’affaires, avec des taux de synthèse et de dégradation étant spécifique à chaque protéine et sous réserve de la régulation physiologique. Traditionnellement, les taux de dégradation des protéines ont été mesurées à l’aide de méthodes en bloc, telles que l’analyse de pouls radioactifs de chase, ou impliquant des inhibiteurs de la synthèse protéique par exemple cycloheximide1. Plus récemment, les isotopes stables d’étiquetage avec des acides aminés dans la culture de cellules (SILAC) en combinaison avec la spectrométrie de masse a été créé pour quantifier le renouvellement des protéines sur une échelle mondiale2. Toutefois, ces méthodes sont limités par une moyenne de population, et informations sur la variabilité de la cellule-cellule sont donc perdues. En outre, des modifications passagères dans la dégradation des protéines qui sont unsynchronized dans l’ensemble de la population cellulaire ne peuvent être identifiées.
Alternativement, protéine demi-vies aussi peuvent être déterminées que par les approches axées sur la fluorescence, qui ont souvent l’avantage de fournir la résolution de cellule unique. Par exemple, une protéine fluorescente verte photoactivatable (paGFP) a servi à déterminer Oct4 Half-Life dans le début de l’embryon de mammifère3. Une autre méthode pour surveiller la décomposition des protéines dans les cellules vivantes est l’utilisation d’une balise de SNAP en combinaison avec Time-lapse imagerie de fluorescence. Le SNAP-tag est une version mutante de l’ADN réparation enzymatique O6- alkylguanine DNA-alkyltransférase (l’AGT) qui réagit spécifiquement avec benzylguanine dérivés (BG), qui peuvent être couplés à traceurs moléculaires4,5, 6. par conséquent, toute protéine de fusion SNAP-tag peut être irréversiblement marqué avec un colorant fluorescent, de perméabilité cellulaire. Impulsion d’étiquetage d’une protéine d’intérêt fusionné à la SNAP-tag, suivi du lavage du colorant résiduel, permet de surveiller la dégradation de la population de protéines marquées et, donc, pour déterminer la demi-vie de la protéine. SNAP-tags ont été utilisées avec succès pour pulse-chase marquage des protéines et pour la détermination des protéines demi-vies dans adhérentes cellule culture et in vivo5,7,8,9. Une grande variété de substrats SNAP-tag couvrant couramment utilisée les spectres fluorescents sont disponibles dans le commerce, ce qui permet la sélection de la teinture optimale pour chaque application spécifique. Ainsi, SNAP-tags utilisable aussi pour l’imagerie multicolor en combinaison avec d’autres protéines de fusion fluorescent ou colorants. Cellule-imperméable colorants conviennent pour le marquage des protéines membranaires-attaché, que perméable à la cellule colorants sont applicables pour la surveillance des protéines intracellulaires et membrane-bondissent. En outre, certaines de ces sondes ne présentent presque aucune fluorescence basale et seulement commencent à émettre un signal fluorescent fort lors de la liaison à un SNAP-tag10.
Ce protocole décrit comment mesurer le taux de dégradation des différentes protéines d’intérêt dans des cellules individuelles à l’aide d’un SNAP-tag. Ici, nous appliquons cette méthode aux cellules souches embryonnaires (ES) de souris cultivées sur la E-cadhérine, mais il devrait être possible de l’utiliser avec n’importe quel type de cellules cultivées adhérentes. Nous montrons que l’impulsion marquage des protéines de fusion de SNAP-tag suivies de Time-lapse imagerie de fluorescence permet de déterminer les demi-vies monocellulaire de diverses protéines d’intérêt et fournit une estimation de la variabilité de la cellule-cellule des demi-vies dans un population des cellules cultivées.
Protocole
Remarque : Dans cette étude, la lignée de cellules E14 ES a été utilisée. Toutefois, ce protocole est directement applicable à n’importe quel autre ES lignée cellulaire de souris exprimant une protéine d’intérêt fusionné à un SNAP-tag, soit par la protéine endogène de marquage à l’aide de surexpression. Pour les exemples présentés dans la section résultats, doxycycline-inducible SNAP-tag fusion des lignées de cellules ont été utilisées (SNAP-tag fusionnés aux protéines suivantes : Nanog, Oct4, Srsf11, ou pour les protéines fluorescentes mOrange2 et sfGFP et de mettre sous le contrôle d’un promoteur inductible doxycycline. Voir11 pour plus amples renseignements sur les plasmides utilisés pour la génération des lignées cellulaires fusion inductibles par doxycycline SNAP-tag). Le système inductible par la doxycycline peut être particulièrement utile, car elle permet de contrôler étroitement le calendrier et l’intensité de l’expression de la protéine d’intérêt. C-terminal de positionnement de la SNAP-tag est recommandé, comme changer le N-terminal, séquence d’acides aminés est plus susceptible d’altérer la demi-vie de la protéine cible (N-end règle12).
1. E-cadhérine revêtement et ensemencement de la cellule
- Générer une lignée de cellules ES exprimant une protéine d’intérêt fusionné à la SNAP-tag4.
- Manteau 100 mm cellule Pétri avec 4 mL de 0,1 % de gélatine (dilué dans une solution saline tamponnée au phosphate (PBS) sans Ca2 +/Mg2 +) pendant 1 h. supprimer la gélatine et laisse sécher pendant 1 h. utilisation immédiatement ou stocker les plats revêtus pour jusqu'à 2 mois.
- Croissance de la lignée cellulaire d’intérêt dans le milieu de culture de cellules ES (Glasgow Minimum indispensable milieu, additionné de 10 % ES qualifié cellulaire sérum de veau fœtal, pyruvate de sodium 2 mM, 1 % des acides aminés non essentiels, la pénicilline/streptomycine de 1 %, 2 mM de L-glutamine, 100 µM 2- mercaptoéthanol, facteur inhibiteur de leucémie (LIF), 3 µM CHIR99021 et 0,8 µM PD184352) enduit de gélatine plats à 37 ° C et 5 % de CO2 pendant 2 jours jusqu'à arriver à une confluence de 10-20 Mio cellules par plat.
Remarque : Ici, FRV a été produit par transfection transitoire des cellules 293 t HEK, suivie d’une collection surnageante et filtrage. Chaque lot de FRV a été testé pour sa capacité à maintenir la pluripotence, mais les concentrations n’ont pas été déterminées. Cependant, FRV recombinante est également disponible dans le commerce et la concentration utilisée couramment pour culture de cellules de souris ES est de 1000 unités/mL13. - Recouvrir une plaque de 96 puits d’imagerie avec 30 µL de souris recombinante de protéine chimère de E-cadhérine Fc (E-cad-Fc) / puits (5 ng/µL, dilué dans du PBS avec Ca2 +/Mg2 +. Utiliser des concentrations stocks de 100 ng/µL, stockées à-80 ° C). Éviter une vaste pipetage, E-cad-Fc étant très fragile. Incuber à 37 ° C pendant 1,5 h.
Remarque : Selon le microscope, autres formats pourraient être utilisés. - Aspirer le E-cad-Fc, laver une fois avec 100 µL de PBS avec Ca2 +/Mg2 +et ajouter 100 µL de préchauffé ES milieu de culture cellulaire.
- Laver les cellules d’intérêt avec 5 mL de PBS sans Ca2 +/Mg2 +. Aspirer et ajouter 2 mL d’EDTA-trypsine 0,25 %. Incuber pendant 4 min à 37 ° C. Ajouter 4 mL de milieu de culture de cellules ES, resuspendre et tournez en bas à 1000 x g pendant 4 min. aspirer le surnageant et Resuspendre le culot dans 2 mL de milieu de culture de cellule ES frais.
Remarque : PBS sans Ca2 +/Mg2 + devrait servir pour laver les cellules avant de trypsinisation afin d’éliminer les ions Ca2 + , ce qui sont exigées pour l’adhésion cellulaire. En revanche, pour une utilisation E-cad-Fc dilution et revêtement (étape 1.4), PBS avec Ca2 +/Mg2 +, depuis l’adhésion des cellules ES E-cad-FC plats revêtus est Ca2 +-dépendante14. - Diluer les cellules resuspendues 01:10 dans 1 mL de milieu de culture cellulaire ES et comte, à l’aide d’une chambre de comptage (charge 10 µL pour une chambre de 0,1 mm de profondeur).
- Graine de 30 000 cellules/cm2 dans la E-cad-CF enduit plaque d’imagerie. Remplir jusqu'à 200 µL / puits d’ES milieu de culture cellulaire. Pour les lignées cellulaires doxycycline-inductible, induire une dose appropriée de la doxycycline (optimiser la dose et le moment de l’induction à l’avance. Les lignées cellulaires utilisées ici ont été traitées avec la doxycycline de ng/mL 500 24h avant l’imagerie). Incuber à 37 ° C et 5 % de CO2 et aller de l’avant avec l’impulsion d’étiquetage et d’imagerie 24h après l’ensemencement de la cellule.
2. impulsion de marquage de la SNAP-tag
Remarque : Pour des expériences de décomposition de protéine, il est crucial d’utiliser une concentration de colorant SNAP adéquate. La concentration doit être suffisamment élevée pour donner un signal clair au début de la Time-lapse, puisque la fluorescence diminuerait au fil du temps. Cependant, en utilisant des concentrations de teintes trop élevé peut provoquer colorant résiduel étant laissé dans le milieu ou dans les cellules même après lavage. Le colorant libre pourrait ensuite lier aux molécules de SNAP-tag nouvellement produites au cours du film, qui va fausser la courbe de décroissance. Le signal de fluorescence observée dépend des propriétés de la teinture, la lignée cellulaire utilisée, ainsi que le niveau d’expression de la protéine correspondante. Par conséquent, il est essentiel d’optimiser la concentration de colorant en testant différentes dilutions, à partir de la dilution suggérée pour l’imagerie de cellules vivantes par le fabricant. Pour cette étude, un substrat fluorescent rouge sombre a été utilisé. Une concentration optimale de 12 nM a été déterminé pour les lignées cellulaires de surexpression inductibles par doxycycline.
- Diluer le colorant de clin d’oeil à la concentration appropriée dans préchauffé ES milieu de culture cellulaire. Utiliser une pipette pour retirer délicatement le support des cellules déjà ensemencées dans la plaque à 96 puits et ajouter 50 µL de colorant dilué de SNAP / puits. Incuber 30 min à 37 ° C.
- Aspirer le colorant dilué avec une pipette et laver 3 x avec 200 µL de PBS préchauffé (sans Ca2 +/Mg2 +). Ajouter 200 µL de milieu de culture cellulaire ES et incuber pendant 15 min à 37 ° C.
- Répétez les étapes précédentes de laver deux fois plus.
Remarque : Un lavage est important afin d’enlever n’importe quel colorant non lié. Les étapes de lavages répétés avec PBS enlever le colorant extracellulaire résiduel dans le milieu, considérant que l’incubation de 15 min à ce robuste marquage des protéines SNAP-tag fusion avant de commencer l’expérimentation d’imagerie. Cependant, effectuez les opérations de lavage en pipettant également, doux et ne pas utiliser un aspirateur automatique, comme les cellules ensemencées sur E-cad-Fc ont tendance à se détacher facilement. - Ajouter 200 µL de milieu d’imagerie. Pour réduire le fond de la fluorescence, utilisez un milieu sans rouge de phénol (additionné de pyruvate de sodium 2 mM, 1 % des acides aminés non essentiels, 1 % pénicilline/streptomycine, 2 mM de L-glutamine, 100 µM 2-mercaptoéthanol, FRV, 3 µM, 10 % ES qualifié cellulaire sérum de veau fœtal CHIR99021 et 0,8 µM PD184352).
3. Time-lapse microscopie
- Utiliser un microscope adapté pour l’imagerie live, permettant à température contrôlée et CO2. Réglez la température à 37 ° C et le CO2 à 5 % avant de les utiliser puis laisser se pour équilibrer pendant 1 à 2 h.
- Placer la plaque dans le microscope et trouver des points appropriés pour l’imagerie. Sélectionnez les lieux où les cellules sont répartis uniformément, mais pas trop dense, comme ce qui facilitera l’analyse. Ajuster le nombre de spots sélectionnés au nombre de cellules nécessaires à l’analyse. Dans cette étude, 3-5 places par lignée cellulaire ont été enregistrés.
- Sélectionner l’objectif. Un objectif 20 X est adaptée à la taille des cellules ES.
- Sélectionnez les paramètres d’éclairage pour l’ou les canaux fluorescent à enregistrer. Ajuster la puissance du laser et l’exposition selon l’intensité du signal de fluorescence des cellules d’intérêt. Assurez-vous d’obtenir un fort signal initial, puisqu’il va diminuer au cours du film, mais éviter les puissances supérieures à 30 % afin de minimiser la phototoxicité et photoblanchiment. Pour cette étude, un filtre d’excitation de 632/22 nm (longueur d’onde/passe-bande), filtre d’émission de 679/34 nm (longueur d’onde/bandpass), puissance de laser de 10 % et l’exposition de temps de 100 ms ont été utilisés.
- Sélectionnez l’imagerie intervalles et la durée de l’expérience en Time-lapse. Pour les protéines ayant attendu une demi-vie de 2 à 20 h, choisissez le délais d’acquisition de 12 à 24 heures avec des intervalles de temps de 15 min. Pour les protéines de poissons, réduire les intervalles et les délais d’acquisition, pour une augmentation des protéines en conséquence.
- Commencer d’imagerie.
4. traitement et analyse d’images
- Recueillir les images acquises comme une pile au format tiff. Pour la poursuite du traitement et d’analyse, utilisez le logiciel de Fidji15. Si les données time-lapse ne sont pas collectées comme une pile par le logiciel de microscope, ouvrir tous les cadres de l’expérience en Time-lapse dans le logiciel (soit en cliquant sur fichier | Ouvrir... ou glisser et déposer les fichiers correspondants à la barre d’outils), puis cliquez sur Image | Piles | Images à empiler.
- Utilisez la fonction de fond de soustraction pour supprimer l’arrière-plan de toutes les images dans la pile. Pour ce faire, cliquez sur processus | Soustraire le fond. Sélectionnez le rayon roulement de boule dans la fenêtre pop-up. Utilisez un rayon qui est au moins la taille des cellules imagés. Pour appliquer la soustraction de l’arrière-plan à toutes les cellules dans la pile, sélectionnez Oui dans le pile de processus ? fenêtre pop-up.
- Sélectionnez une cellule d’intérêt et tracez une zone d’intérêt (ROI) autour de lui à l’aide de la barre d’outils. Pour les signaux nucléaires, utilisez la sélection ovale en première en cliquant sur l’onglet correspondant dans la barre d’outils et puis en cliquant sur le noyau d’intérêt et en ajustant l’ovale autour d’elle. Pour les zones très denses ou de signaux cytoplasmiques utiliser la sélection à main levée pour pouvoir suivre de près les contours de la cellule. Évitez d’inclure des trop grandes régions d’origine, même s’il n’est pas nécessaire de suivre les contours de la cellule précisément en raison de la soustraction ultérieure de tous les pixels d’arrière-plan (étape 4.8-4.9).
- Ajouter la région d’intérêt au gestionnaire du ROI en cliquant sur Analyze | Outils | Gestionnaire de ROI | Ajouter, ou en appuyant sur T sur le clavier.
- Passez à la section suivante, en déplaçant l’onglet dans la fenêtre pile ou en appuyant sur MAJ + < sur le clavier, puis répétez les actions précédentes. Suivez la cellule d’intérêt tout au long du film et le retour sur investissement de chaque image s’ajoute le gestionnaire de ROI. Sauver le ROI final définie pour chaque cellule de chenilles en cliquant plus | Enregistrer... dans le gestionnaire de ROI.
Remarque : Après des divisions cellulaires, suivre les deux cellules filles séparément et leurs intensités intégrées en résumé après soustraction du fond (voir étapes 4.6 à 4.9) pour tenir compte de la dilution de protéine pendant la division cellulaire. Enregistrer les jeux de retour sur investissement pour les deux cellules filles. - Une fois que la cellule d’intérêt est suivie tout au long du film, cliquez sur mesure, pour obtenir les valeurs de l’intensité moyenne et de la zone de la ROIs. Copiez les valeurs obtenues dans un programme de tableur électronique et calculer l’intensité brute intégrée de la cellule pour chaque point de temps comme suit :

où signifiecest l’intensité moyenne etzoneCla zone du ROI correspondante. - Pour estimer le contexte local, ajouter un ROI proche de la cellule d’intérêt pour chaque laps de temps. Évitez d’inclure n’importe quel signal de fluorescence cellulaire. Utilisez un retour sur investissement circulaire qui est à peu près la taille d’une cellule et déplacer ou réduire en conséquence si nécessaire, par exemple , si les cellules voisines s’immiscer. Procédez comme décrit précédemment avec le cellulaire ROI afin d’obtenir un fond ROI définie et copier les valeurs d’intensité mesurée dans la feuille de calcul.
- Pour obtenir une valeur de référence-corrigée pour l’intensité intégrée de la cellule, en premier lieu calculer l’intensité intégrée de l’arrière-plan pour chaque point de temps :

où signifieBG est l’intensité moyenne du signal de fond et la zoneC est la zone du ROI encerclant la cellule. N’utilisez pas la zone de l’arrière-plan du ROI, à moins que les deux zones ont la même taille. - Calculer l’intensité intégrée finale soustraite à l’arrière-plan de la cellule pour chaque point dans le temps :

- Pour normaliser les courbes de décroissance unicellulaire, divisez la valeur de l’intensité de chaque instant de la valeur de l’intensité du premier temps-point.
Remarque : L’ajustement de la courbe (voir étape 4.11) peut être effectuée soit sur chaque cellule unique ou sur la moyenne de la population. Une normalisation est nécessaire si une moyenne de population de base est calculée afin d’éviter les biais d’intensités de fluorescence différente entre les cellules. La normalisation assure ainsi que chaque cellule contribue avec le même poids à la courbe de décroissance final. En outre, la normalisation peut être utile de visualiser les désintégrations de cellule unique indépendamment de leurs intensités de fluorescence absolue (voir Figures 3 a-3C). Toutefois, si seules les unicellulaires demi-vies sont déterminées et les données ne sont pas en moyenne, l’étape de normalisation peut-être être omise et l’ajustement de la courbe peut être directement effectuée sur les données brutes. - Pour l’estimation de la demi-vie de la protéine, utilisez un outil d’ajustement de courbe. Dans cette étude, la courbe MATLAB toolbox 3.4.1 a été utilisée, qui se trouve par défaut dans la section Apps de l’interface utilisateur MATLAB. Importer l’intensité de la fluorescence et les valeurs de temps de la feuille de calcul électronique en MATLAB en cliquant sur l’onglet Importer des données ouvrir la boîte à outils courbe et sélectionnez les points dans le temps et les données de désintégration de fluorescence dans les données X et Y données onglet choisir Custom équation dans l’ajustement de courbe onglet et entrez l’équation pour une décroissance exponentielle :
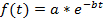
où f (t) est l’intensité de fluorescence à un moment donné, une l’intensité initiale et b la décroissance. Dans les Options d’ajustement... onglet, sélectionnez 0 pour la limite inférieure d’un et b. Les valeurs estimées pour a et b apparaît alors dans la fenêtre de résultats. Calculer la demi-vie comme suit :
Résultats
Le protocole décrit fournit une estimation de la variabilité de la cellule-cellule dans Half-Life pour une protéine donnée fusionné à un SNAP-tag. L’utilisation de E-cadhérine-Fc recombinante pour le revêtement de la plaque d’imagerie permettant la résolution unicellulaire dans les cellules ES, qui, autrement, se développer dans les colonies. Cellules individuelles peuvent être suivis séparément tout au long du film ( Figure 1 a).
Afin de détermi...
Discussion
L’étape plus cruciale lorsque vous utilisez un SNAP-tag pour surveiller la décomposition des protéines, c’est pour s’assurer qu’aucun colorant résiduel non lié n’est laissé dans le milieu ou dans les cellules après lavage, sinon il pourrait lier à nouveau produit des molécules plus tard au cours de l’expérience et le ther SNAP-tag Eby compromis la courbe de décroissance. Il s’agit d’une part, obtenue en exécutant avec soin toutes les étapes de lavage décrite. En revanche, la concentration de...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Time-lapse microscopie expériences furent réalisées à Biomolecular Screening Facility (BSF), EPFL. Nous remercions Marc Delachaux (Service Audiovisuel, EPFL) pour la vidéographie et le montage du film.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| ES cell line expressing a SNAP-tag fusion protein of interest | - | - | |
| Falcon 100 mm TC-Treated Cell Culture Dish | Corning | 353003 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate | Corning | 353219 | |
| Neubauer-improved counting chamber, 0.1 mm | Marienfeld-superior | 640030 | |
| CO2 Incubator | Panasonic | MCO-170AICUV-PE | |
| Centrifuge 5804 R | Eppendorf | 5804000528 | |
| InCell Analyzer 2200 Cell Imaging System | GE Healthcare Life Sciences | 29027886 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Glasgow Minimum Essential Medium | Sigma-Aldrich | G5154 | |
| Fetal Bovine Serum, embyonic stem cell-qualified | ThermoFisher | 16141-079 | |
| Sodium pyruvate solution | Sigma-Aldrich | 113-24-6 | |
| Minimum Essential Medium Non-Essential Amino Acids | ThermoFisher | 11140-035 | |
| Penicillin-Streptomycin | BioConcept | 4-01F00H | |
| L-Glutamine 200mM | ThermoFisher | 25030-024 | |
| 2-Mercaptoethanol | Sigma-Aldrich | 63689-25ML-F | |
| Leukemia Inhibitory factor | - | - | Produced in the lab by transient transfection of HEK-293T cells, followed by collection and filtering of the supernatant. |
| CHIR99021 (GSK-3 Inhibitor XVI) | Merck Millipore | 361559 | |
| PD 0325901 | Sigma-Aldrich | 391210-10-9 | |
| Gelatin from bovine skin | Sigma-Aldrich | 9000-70-8 | |
| Dulbecco's PBS 10x concentrated | BioConcept | 3-05K00-I | |
| Dulbecco's PBS Without Ca++/Mg++ | BioConcept | 3-05F29-I | |
| Trypsin-EDTA-Solution 0.25% | Sigma-Aldrich | T4049 | |
| Recombinant Mouse E-Cadherin Fc Chimera protein | R&D systems | 748-EC-050 | |
| Doxycycline hyclate | Sigma-Aldrich | D9891 | |
| SNAP-Cell 647-SiR | New England BioLabs | S9102S | |
| FluoroBrite DMEM | ThermoFisher | A18967-01 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| FIJI | - | - | Open-source image analysis software |
| MATLAB R2014a | Mathworks | - | |
| Microsoft Excel | Microsoft | - |
Références
- Zhou, P. Determining Protein Half-Lives. Signal Transduct Protoc. , 67-77 (2004).
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Plachta, N., Bollenbach, T., Pease, S., Fraser, S. E., Pantazis, P. Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nature Cell Biol. 13 (2), 117-123 (2011).
- Keppler, A., Gendreizig, S., Gronemeyer, T., Pick, H., Vogel, H., Johnsson, K. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nature Biotechnol. 21 (1), 86-89 (2002).
- Keppler, A., Pick, H., Arrivoli, C., Vogel, H., Johnsson, K. Labeling of fusion proteins with synthetic fluorophores in live cells. Proc Nat Acad Sci U S A. 101 (27), 9955-9959 (2004).
- Gronemeyer, T., Chidley, C., Juillerat, A., Heinis, C., Johnsson, K. Directed evolution of O6-alkylguanine-DNA alkyltransferase for applications in protein labeling. Protein Eng Design Select. 19 (7), 309-316 (2006).
- Jansen, L. E. T., Black, B. E., Foltz, D. R., Cleveland, D. W. Propagation of centromeric chromatin requires exit from mitosis. J Cell Biol. 176 (6), 795-805 (2007).
- Bojkowska, K., et al. Measuring In Vivo Protein Half-Life. Chem Biol. 18 (6), 805-815 (2011).
- Mandic, A., Strebinger, D., Regali, C., Phillips, N. E., Suter, D. M. A novel method for quantitative measurements of gene expression in single living cells. Methods. 120, 65-75 (2017).
- Komatsu, T., et al. Real-Time Measurements of Protein Dynamics Using Fluorescence Activation-Coupled Protein Labeling Method. J Am Chem Soc. 133 (17), 6745 (2011).
- Deluz, C., et al. A role for mitotic bookmarking of SOX2 in pluripotency and differentiation. Genes Dev. 30 (22), 2538-2550 (2016).
- Varshavsky, A. The N-end rule pathway and regulation by proteolysis. Protein Sci. 20 (8), 1298-1345 (2011).
- Tamm, C., Pijuan Galitó, S., Annerén, C. A Comparative Study of Protocols for Mouse Embryonic Stem Cell Culturing. PLoS ONE. 8 (12), e81156 (2013).
- Nagaoka, M., et al. E-Cadherin-Coated Plates Maintain Pluripotent ES Cells without Colony Formation. PLoS ONE. 1 (1), e15 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Meth. 9 (7), 676-682 (2012).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotech. 34 (7), 703-706 (2016).
- Blanchoud, S., Nicolas, D., Zoller, B., Tidin, O., Naef, F. CAST: An automated segmentation and tracking tool for the analysis of transcriptional kinetics from single-cell time-lapse recordings. Methods. 85, 3-11 (2015).
- Peng, T., et al. A BaSiC tool for background and shading correction of optical microscopy images. Nature Comm. 8, (2017).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nature Methods. 12 (5), 404-406 (2015).
- Chae, H. D., Lee, M. R., Broxmeyer, H. E. 5-Aminoimidazole-4-carboxyamide Ribonucleoside Induces G1/S Arrest and Nanog Downregulation via p53 and Enhances Erythroid Differentiation. Stem Cells. 30 (2), 140-149 (2012).
- Lin, Y., et al. Reciprocal Regulation of Akt and Oct4 Promotes the Self-Renewal and Survival of Embryonal Carcinoma Cells. Mol Cell. 48 (4), 627-640 (2012).
- Wei, F., Scholer, H. R., Atchison, M. L. Sumoylation of Oct4 Enhances Its Stability, DNA Binding, and Transactivation. J Biol Chem. 282 (29), 21551-21560 (2007).
- Gautier, A., et al. An Engineered Protein Tag for Multiprotein Labeling in Living Cells. Chem Biol. 15 (2), 128-136 (2008).
- Los, G. V., et al. HaloTag: A Novel Protein Labeling Technology for Cell Imaging and Protein Analysis. ACS Chem Biol. 3 (6), 373-382 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon